Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de la Sociedad Entomológica Argentina
versión impresa ISSN 0373-5680versión On-line ISSN 1851-7471
Rev. Soc. Entomol. Argent. v.65 n.3-4 Mendoza ago./dic. 2006
Producción masiva y simultánea de machos de Ceratitis capitata (Diptera: Tephritidae) y parasitoides Dichasmimorpha longicaudata (Hymenoptera: Braconidae)
Massive and simultaneous production of Ceratitis capitata (Diptera: Tephritidae) males and Diachasmimorpha longicaudata (Hymenoptera: Braconidae) parasitoids
López, Silvia N.*, Mariana Viscarret, Silvia Lanzavecchia, Silvina Goenaga y Jorge L. Cladera
Instituto de Genética «Ewald Favret», CICVyA, CNIA, INTA, C.C. 25. 1712 Castelar, Buenos Aires, Argentina; e-mail: snlopez@cnia.inta.gov.ar
* Dirección actual: Instituto de Microbiología y Zoología Agrícola, CICVyA, CNIA, INTA Castelar
ABSTRACT. In the genetic sexing strain «Cast191», the females of Ceratitis capitata are homozygous for the mutation slow , slowing down their rate of development, and the males are heterozygous, having a normal rate of development. This feature made Cast191 capable of producing sterile males, on one hand, and parasitoids that are reared on the remaining larvae, on the other. The objective of the present work was to do this two thing simultaneously and at a larger scale than previously. Besides, in an attempt to improve malefemale separation under this conditions, a pulse of 15ºC was applied to first stage larva during 1 or 2 days; these larvae were later held either at 20ºC or, at 25ºC until pupation, both groups of pupae being then kept at 25ºC . The best separation between male and female, achieved rearing larvae at 20ºC without any pulse of 15ºC , was then used to evaluate the quality of the parasitoids Diachasmimorpha longicaudata reared on the larvae remaining after male separation. These larvae were exposed to the parasitoid under standard conditions. The rate of parasitism obtained was similar to the one found when parasitoids are exposed to wild strain, and the F1 sex rate was even more biased toward females. The potential use at larger scale of the Cast191 strain of C. capitata for producing sterile males and D. longicaudata parasitoids is discussed.
KEY WORDS. Ceratitis capitata. Genetic sexing strains. Sterile insect technique. Parasitoids.
RESUMEN. En la línea de sexado genético «Cast191» las hembras de Ceratitis capitata son homocigotas para el gen slow , lo que reduce su velocidad de desarrollo; los machos son heterocigotas y muestran una velocidad de desarrollo normal. Esta característica permitió producir, con Cast191, machos estériles por un lado, y parasitoides criados sobre las larvas remanentes por el otro. Nuestro objetivo con este trabajo fue producir ambos insumos simultáneamente y a una escala mayor que hasta ahora. Además, bajo estas condiciones, y en un intento por aumentar la separación entre sexos, se aplicó a las larvas del primer estadío un pulso de 15º C, durante 1 ó 2 días, luego del cual se las mantuvo a 20º C ó 25º C, hasta que entraron al estado de pupa, luego se mantuvo todo el material a 25º C. La mejor separación de sexos, lograda con el tratamiento a 20º C sin pulso de frío, se usó para comparar la calidad del parasitoide Diachasmimorpha longicaudata, criado sobre las larvas obtenidas tras la separación de los machos, con aquellos criados sobre la línea salvaje. Para ello, este tratamiento de separación fue aplicado en la cría de la mosca, y el material remanente de dieta con larvas fue expuesto al parasitoide. La tasa de parasitismo obtenida fue semejante a la hallada sobre la línea salvaje, y la tasa sexual de la F 1 del parasitoide presentó un sesgo hacia las hembras aún mayor. Se discute la factibilidad de utilizar la línea Cast191 de C. Capitata, para la producción a mayor escala de machos de mosca y para la cría masiva del parasitoide D. longicaudata.
PALABRAS CLAVE. Ceratitis capitata. Línea de sexado genético. Técnica del insecto estéril. Parasitoides.
INTRODUCCIÓN
Ceratitis capitata (Wiedemann), vulgarmente llamada «mosca del Mediterráneo», es una de las dos especies de tefrítidos de importancia económica y cuarentenaria en la Argentina (Maddison & Bartlett, 1989). Diferentes métodos de control han sido utilizados hasta el presente para combatir las moscas de los frutos, entre los que se destaca la técnica del insecto estéril (TIE), método cuya eficiencia aumenta significativamente cuando se liberan sólo machos estériles (McInnis et al , 1994).
Existen líneas de sexado genético desarrolladas para C. Capitata, donde las hembras pueden ser diferenciadas y separadas de los machos por algún carácter morfológico y/o biológico (Robinson et al. , 1999). En este sentido, en el Instituto de Genética ¨Ewald A. Favret¨ (IGEAF) del Instituto Nacional de Tecnología Agropecuaria (INTA) se ha desarrollado la línea Cast191 portadora de una mutación de color de ojos que tiene efectos pleiotrópicos sobre el tiempo de desarrollo de las larvas (gen sw del cromosoma 2), y de una traslocación entre el cromosoma 2 y el cromosoma Y. En esta línea, los machos son heterocigotas para el gen sw (Y/ sw +) y las hembras son homocigotas ( sw / sw ). Este gen se expresa en homocigosis, lo que provoca una tasa de desarrollo de larvas de hembras retardada respecto de las de macho (Cladera, 1995, 1997). Esta diferenciación temprana permite separar las hembras de los machos y disminuir costos, ya que sólo las larvas que desarrollarán en machos son irradiadas (como pupa), y liberados cuando son adultos (Manso & Lifschitz, 1992; Cladera, 1995; Pizarro et al , 1997). El comportamiento de apareo de los machos estériles de esta línea con las hembras de la naturaleza, ha demostrado gran eficiencia en jaulas de campo (Cladera et al ., 2002).
La liberación de machos estériles tiene un efecto directo sobre la tasa de natalidad de la mosca de la fruta, disminuyendo la progenie (Carpenter, 1981). Sin embargo, aquellas hembras que hayan sido fecundadas por machos salvajes, darán una progenie capaz de desarrollarse dentro de los frutos, lo que escapa al control de la TIE hasta la edad adulta. Es en este marco donde se propone el uso de otras estrategias de control complementarias a la TIE , como el control biológico mediante el uso de enemigos naturales parasitoides (Knipling, 1998).
Los parasitoides de C. capitata y otras especies de ¨moscas de la fruta¨, han sido utilizados con éxito en estrategias de control biológico clásico e inundativo en otros lugares del mundo (Clausen, 1976; Wong et al , 1991; Sivinski et al , 1996). Entre estos enemigos naturales se destaca Diachasmimorpha longicaudata (Ashmead), parasitoide de estadios larvales de Bactrocera spp. principalmente. Esta especie se caracteriza por ser de fácil cría en laboratorio, por poseer un amplio rango de huéspedes y por haber sido utilizada con éxito en numerosas introducciones para el control de tefrítidos en general (Cancino Díaz & Yoc, 1993; Wong & Ramadan, 1987).
Debido a que en la línea Cast191 de la mosca de la fruta C. capitata, la separación de sexos es no destructiva, podría utilizarse con el doble propósito de producir machos estériles y parasitoides criados sobre las larvas remanentes. Es de esperar que este doble uso, sea más eficiente si la diferencia en el tiempo de desarrollo entre machos y hembras, observada en esta línea, se hace máxima. En este sentido, existen antecedentes sobre estudios que procuraron hallar las condiciones de temperatura que hicieran más pronunciada esta diferencia (Pizarro et al ., 1997; Viscarret et al ., 2002). En particular, Viscarret et al . (2002) obtuvieron una satisfactoria separación de sexos. Las condiciones de este ensayo fueron disímiles a las de la cría rutinaria, tanto por el uso de materiales y procedimientos diferentes (dosis de siembra menor, uso de bandejas más pequeñas), como por el estricto control de las condiciones ambientales al utilizar cámaras climatizadas.
Por otra parte, recientemente han sido evaluados los parámetros poblacionales de D. longicaudata desarrollado sobre la línea sexante (Viscarret et al. 2006). Sin embargo, nunca se evaluó el uso de esta línea para la cría del parasitoide, tras el proceso de separación de sexos obtenida en una cría productiva.
Los objetivos de este trabajo fueron ensayar algunas combinaciones de temperaturas con el fin de lograr un aumento en la separación de sexos en la línea Cast191 de C. capitata bajo condiciones estándares de cría productiva, estudiando su rendimiento en producción, y luego sobre las larvas obtenidas tras la separación de los machos de la mosca, criar D. longicaudata, comparando su calidad con la de los parasitoides obtenidos en una cría normal sobre moscas de la línea salvaje.
MATERIAL Y MÉTODOS
Experimento 1: Separación de sexos de Ceratitis capitata línea Cast191
El material biológico utilizado en este experimento provino de la cría de C. capitata línea de sexado genético Cast191, que se realiza en el Insectario de Cría Masiva del Laboratorio de Insectos del Instituto de Genética «Ewald A. Favret» (IGEAF) INTA Castelar.
Se sembraron huevos de mosca (de menos de 24 h de puestos) sobre dieta artificial para larvas (Terán, 1977), en 24 bandejas plásticas estándares de cría (28 x 35 cm ). La dosis de siembra fue de 2 ml de huevos/kg de dieta, dosis de rutina empleada en el IGEAF para la cría del parasitoide D. longicaudata . Luego de 2 días a 25 ± 2º C, HR: 66 ± 20 % y fotoperíodo: 14L:10O, cuatro bandejas (réplicas) fueron asignadas a cada una de las combinaciones de los siguientes tratamientos:
• aplicación de un pulso de 15 ± 1º C durante 0, 1 ó 2 días. Se realizó en una cámara Sanyo con una HR: 77 ± 10% y fotoperíodo: 14L-10O.
• exposición a una temperatura de 2 0±2 º C (HR: 58-84%, fotoperíodo: 8L-16O) ó 25 ± 2º C (HR: 44-90%, fotoperíodo: 14L-10O) con posterioridad al pulso de 15º C y hasta la entrada en el estado de pupa. Estas temperaturas fueron aplicadas en sendas salas de cría del Insectario de Cría Masiva.
Una vez iniciada la entrada en el estado de pupa, en un sustrato de vermiculita, todas las bandejas fueron mantenidas a 25 ± 2º C, HR: 44-89% y fotoperíodo: 14L-10O. Cada día, durante una semana, las pupas fueron separadas e individualizadas por tratamiento y réplica. Una vez emergidos, los adultos fueron contados y separados por sexo.
Para cada bandeja (unidad experimental) se registró la cantidad total de moscas emergidas, y se calculó el porcentaje de hembras emergidas para cada tratamiento. Asimismo, se buscó el día de formación de pupas que tuvieran un porcentaje de hembras = 5% (calculado este porcentaje respecto del total de pupas de machos y hembras formadas hasta ese día). El porcentaje acumulado de pupas de machos para esa fecha, fue denominado porcentaje acumulado de pupas de la población de machos con menos de 5% de pupas de hembras.
Las posibles diferencias entre los tratamientos en el porcentaje de hembras emergidas, y el porcentaje acumulado de pupas de la población de machos con menos de 5% de pupas de hembras, fueron analizadas mediante un ANOVA (Statsoft Inc., 2000). Las medias fueron separadas mediante la Prueba de Tukey.
Dado que los datos de cantidad total de adultos emergidos, no cumplieron con los supuestos de normalidad y homocedacea, esta variable fue analizada por una prueba de Kruskal-Wallis, aplicada a las combinaciones de los niveles de los dos factores estudiados (Statsoft Inc., 2000).
Experimento 2: Cría de Dichasmimorpha longicaudata sobre larvas remanentes
Los individuos del parasitoide D. longicaudata, utilizados en el presente estudio, provinieron de la cría experimental que se realiza en el Laboratorio de Insectos, Instituto de Genética E. Favret, INTA Castelar. La cepa del parasitoide utilizada aquí, DL (+) , es criada sobre una línea salvaje de C. capitata .
Sobre la base de los resultados obtenidos en el ensayo previo, se aplicó el mejor tratamiento de separación de sexos a 4 bandejas estándares de cría (réplicas), sembradas con huevos de mosca de la línea Cast191 (de menos de 24 hs. de ovipuestos).
Transcurridos 14 días se procedió a la separación de las pupas en cada bandeja. Del material remanente de dieta con larvas, se separó una muestra (tres porciones de 1 cm. de diámetro tomadas de tres posiciones equidistantes a lo largo de una diagonal de la bandeja) con el objeto de determinar los estadios larvales presentes. Con el resto del material de cada bandeja se armaron 3 unidades de oviposición con larvas (caja de Petri de 3 cm . de diámetro, cubierta con voile), y se expusieron individualmente a frascos del parasitoide durante 6 hs. (c/u con alrededor de 10-15 hembras con experiencia previa de oviposición y 7-10 machos por frasco) de la línea DL (+) de D. longicaudata.
Una vez terminada la exposición, cada una de estas unidades se colocaron en dieta fresca y con sustrato para las pupas, a 25 ± 2º C y 40-80% HR. Para cada réplica se registraron: 1) número y sexo de moscas emergidas, 2) número y sexo de parasitoides emergidos, y 3) número de pupas de las que no emergió ningún individuo.
Se estimaron las variables parasitismo (número de parasitoides*100/(número de parasitoides + número de moscas emergidas)), tasa sexual de la F 1 (número de hembras parasitoides/número de machos parasitoides), y mortalidad total (número de pupas no emergidas*100/(número de parasitoides+número de moscas emergidas+número de pupas no emergidas)).
RESULTADOS
Experimento 1: Separación de sexos de Ceratitis capitata línea Cast191
No se observaron diferencias en la cantidad de adultos emergidos entre los distintos tratamientos (estadístico de KruskalWallis = 6,46; P = 0,26) (Tabla I). El intervalo de supervivencia estimada de huevo a adulto fue de 0,14 a 0,20; cálculo realizado considerando que en 1 ml de huevos hay aproximadamente 24.000 huevos.
Un pulso de menor temperatura al inicio del desarrollo larval, no afectó la proporción de hembras emergidas, pero ésta fue significativamente mayor cuando las larvas se desarrollaron a 25º C, que cuando lo hicieron a 20º C (F tiempo pulso de frío = 0,032; GL = 2,18; P = 0,99; F temperatura = 87,75; GL = 1,18; P = 0,000; F interacción = 0,50; GL = 2,18; P = 0,61) (Fig. 1).

Tabla I. Número de adultos emergidos y supervivencia huevo-adulto (media ± error estándar). Medias seguidas por la misma letra no difieren significativamente (Prueba de Kruskal-Wallis, P>0.05).
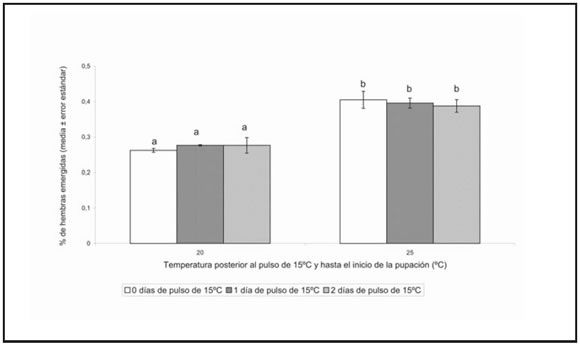
Fig. 1. Porcentaje de hembras emergidas. Medias seguidas por la misma letra no difieren significativamente (ANOVA; P>0,05)
Para el análisis de la separación de larvas de distinto sexo, que se hizo a través del porcentaje acumulado de pupas de la población de machos con menos de un 5% de pupas de hembras, los tratamientos sometidos a una temperatura posterior al pulso de frío de 25º C fueron descartados, ya que las hembras representaban más del 5% del material separado desde el primer día de formación de pupas. Para los tratamientos a 20º C, con un α =0,05, no se alcanzaron diferencias significativas en el porcentaje de machos separados entre los distintos tiempos de aplicación del pulso de 15º C (ANOVA de un factor, F= 3,35; GL= 1,9; P= 0,08), aunque con un α =0.10, fue mayor el porcentaje acumulado de machos cuando no hubo pulso de 15º C, respecto del tratamiento en el que se aplicó 2 días el pulso de frío (Prueba de Tukey) (Figura 2). El tratamiento sin pulso de frío puede considerarse el mejor tratamiento en términos de separación de sexos, ya que presentó el mayor porcentaje acumulado de pupas de la población de machos con menos del 5% de hembras (54,71%), aunque no difirió significativamente de aquel en el que se aplicó 15º C durante 1 día (Figura 2). Esta máxima separación se alcanzó a los 14,25 ± 0,25 días después de la siembra de los huevos. Los adultos comenzaron a emerger entre los 9,75 ± 0,22 días después de la separación, con una producción de machos de 3.707,50 ± 653,54 por bandeja de cría.
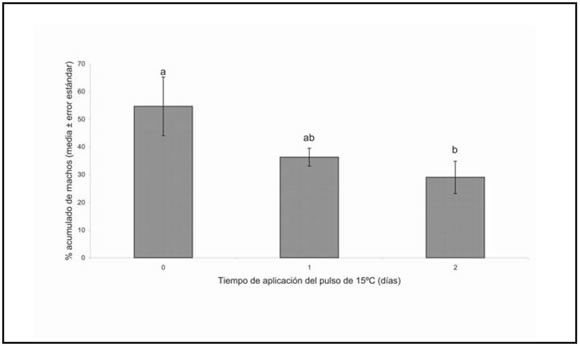
Fig. 2. Porcentaje acumulado de pupas de la población de machos con menos de 5% de hembras. Medias seguidas por la misma letra no difieren significativamente (ANOVA, P>0,10)
Experimento 2: Cría de Dichasmimorpha longicaudata sobre larvas remanentes
Diachasmimorpha longicaudata, pudo reproducirse sobre las larvas de C. capitata línea Cast191, tras el procedimiento de separación. Las larvas de moscas remanentes en la bandejas sometidas al tratamiento de separación (20º C a lo largo del desarrollo larval) que fueron expuestas al parasitoide, pertenecían en su gran mayoría al 3 er estadio (99,75 ± 0,25 %), correspondiendo el resto al 2º estadio larval.
Se registró un 26,7 5 ± 2,08 % de parasitismo en tanto que la tasa sexual de la descendencia del parasitoide criado sobre esta línea, mostró una alta proporción de hembras (1,60 ± 0,36 hembras/(hembras + machos)). Finalmente, la mortalidad total registrada en las bandejas de la línea sexante, que englobó la mortalidad de las pupas parasitadas y no parasitadas, fue de 38,44 ± 3,24 % (Tabla II).

Tabla II. Parasitismo, tasa sexual de la F 1 y mortalidad total de Diachasmimorpha longicaudata, criado sobre las líneas Cast191 y salvaje de Ceratitits capitata (media ± error estándar).
DISCUSIÓN
El presente trabajo ha aportado información original sobre la separación de sexos en la línea sexante y la producción de parasitoides sobre ésta, bajo condiciones de cría rutinaria. Fueron probados diferentes tratamientos térmicos, con la intención de mejorar la separación de sexos bajo dichas condiciones estándares de cría, se descartó la necesidad de un pulso de menor temperatura (15º C) en el inicio del estado larval. Luego de separar los machos, se crió D. longicaudata sobre las larvas de las moscas remanentes. Además, se evaluaron los dos parámetros de calidad utilizados rutinariamente en la cría de este parasitoide, porcentaje de parasitismo y tasa sexual, y se determinó que eran superiores a los obtenidos en la cría mantenida bajo condiciones semejantes, pero sobre la línea silvestre de mosca.
El rendimiento en la producción de moscas de la línea sexante de C. capitata, medido a través de la supervivencia de huevo a adulto, fue similar para todos los tratamientos aplicados. El intento por lograr una adecuada separación de sexos, en una cría rutinaria de la línea Cast191 de C. Capitata, sin mermas importantes en el rendimiento de la producción de moscas puede considerarse por tanto, exitoso. En este sentido, cabe recordar que en las líneas de sexado genético, la supervivencia esperable máxima es el 50% de una línea salvaje, debido a la presencia de zigotos no viables producidos por segregación adyacente durante la meiosis (Robinson et al ., 1999). Esta supervivencia (0,14-0,20), fue en nuestro caso inferior a la hallada por Viscarret et al . (2002) (0,29-0,37). Esta merma se explica probablemente por la menor dosis de siembra usada por esos autores (1 ml de huevos/kg de dieta). La supervivencia registrada en la cría del Insectario de Cría Masiva del IGEAF,INTA Castelar, es de alrededor de 0,30; con una dosis media de siembra de 0,73 ml. de huevos/kg de dieta (López, datos no publicados). Concluimos por lo tanto, que el tratamiento térmico no fue el factor determinante en la baja supervivencia registrada en este estudio. El objetivo de utilizar las condiciones de cría masiva para encontrar un tratamiento térmico que permitiera mayor separación de sexos, incluían usar una dosis de siembra de 2 ml. de huevos por kilogramo de dieta. A priori, no había razón para considerar inadecuada esta dosis, sin embargo, los resultados obtenidos plantean la necesidad de utilizar una densidad de siembra menor en futuros ensayos.
La cantidad de moscas adultas emergidas fue semejante para todos los tratamientos, pero la proporción de hembras emergidas fue mayor cuando las larvas se desarrollaron a una mayor temperatura (independientemente de la presencia de un pulso de frío extra en el inicio del desarrollo larval), esto indica un efecto negativo de la baja temperatura sobre la viabilidad de las hembras. Este efecto negativo podría estar relacionado con el desarrollo más lento de las larvas de hembras a menor temperatura, lo que las expone a competencia por el alimento, con larvas de machos de mayor tamaño y al deterioro progresivo de la dieta (Manso et al ., 2006).
En el presente trabajo, manteniendo las larvas a 20º C, pudo obtenerse una mejor separación entre las poblaciones de machos y hembras, que criándolas a 25º C, sin la necesidad de aplicar un pulso de menor temperatura en el primer estadio larval. Sin embargo, los niveles de separación de sexos fueron bajos en comparación con los de Viscarret et al . (2002), a 21º C. Podría atribuirse a la alta dosis de siembra practicada en este ensayo. El consumo de la dieta por las larvas de machos de mayor tamaño, así como el inevitable deterioro de la dieta con el transcurso de los días y en especial la pérdida de humedad (Manso et al ., 2006), habrían provocado la mortalidad de una parte de la población de hembras, sobreviviendo aquellas hembras que tuvieron un desarrollo más rápido, lo que resultó en la superposición en el tiempo de desarollo de ambas poblaciones (machos y hembras). Se concluye que el mejor nivel de separación de sexos, se obtiene con 20 grados continuos, y que este nivel es adecuado teniendo en cuenta un posible doble uso de esta línea de mosca; sin embargo la alta mortalidad larval, probablemente producto de la dosis de siembra, sugiere la necesidad de utilizar en el futuro una menor dosis de siembra de huevos, también para mejorar la separación entre sexos.
El material de larvas de mosca remanente, en las bandejas de cría tras el procedimiento de separación, en su mayoría fue del 3 er estadio, lo que resultó en un sustrato adecuado para la cría del parasitoide D. longicaudata . (1)
El parasitismo por D. longicaudata hallado sobre la línea sexante fue mayor al registrado en la cría del IGEAF, INTA Castelar, aunque menor al hallado por Cancino Díaz & Yoc (1993) y Ovruski et al . (2003); en todos los casos usando como sustrato de cría una línea salvaje de C. capitata . Tampoco se alcanzaron aquí, en el experimento 2, los valores de Viscarret et al. (2006), pero nótese que la metodología empleada en ambos trabajos fue muy diferente. En la publicación mencionada, los individuos se mantenían en parejas aisladas bajo condiciones ambientales estrictas, en cámaras climatizadas. En el presente trabajo se evaluaron características del parasitoide bajo condiciones de cría en jaulas con cientos de parejas, en salas de cría con condiciones ambientales que variaban dentro de intervalos mayores, e individuos bajo frecuente manipulación. De hecho, en el último párrafo del trabajo de Viscarret et al . (2006) se sugiere estudiar la biología del parasitoide en condiciones de cría, propuesta concretada en el presente estudio.
La tasa sexual de la descendencia del parasitoide criado sobre esta línea, mostró una proporción de hembras superior a la registrada en la cría rutinaria del IGEAF, INTA Castelar (Tabla II), aunque semejante a la hallada por Ovruski et al. (2003) sobre la línea salvaje. Este sesgo hacia las hembras puede explicarse por el estadio y el tamaño de las larvas ofrecidas. (2)
La mortalidad total registrada, posterior al evento del parasitismo, en las bandejas de la línea sexante, fue algo superior a la de la línea salvaje (Tabla II). El superparasitismo, el manipuleo de los puparios debido al método de exposición de las larvas, y ciertas acciones físicas de los parasitoides hacia el huésped, como la introducción del ovipositor en la larva sin deposición de huevos en su interior, se han reconocido como causas de baja viabilidad de los puparios (Ovruski et al . 2003). En el presente trabajo, deberíamos agregar la mortalidad provocada por la manipulación que la línea recibe en el procedimiento de separación de sexos. Esta manipulación resulta inevitable e inherente al uso de esta línea, con el doble propósito de producir machos de moscas y criar parasitoides.
En vista de la mortalidad de larvas y del parasitismo obtenido podrían plantearse dudas acerca de la conveniencia (costo / beneficio), de utilizar esta línea con doble propósito. Respecto de lo primero, ya se dijo que cualquier línea sexante, conlleva una pérdida de individuos debido a la generación de zigotos letales (Robinson et al, 1999), es decir, esto no es un «defecto» o «mayor costo» inherente a esta línea. Respecto al aparente bajo porcentaje de parasitismo, al menos en comparación con Ovruski et al (2003) y Cancino Díaz & Yoc (1993), nuestros valores sobre la línea sexante no son muy diferentes de los obtenidos sobre la línea silvestre. Es decir que bajo las mismas condiciones de cría, obtenemos parasitismo semejante y esto es independiente de la línea de la mosca sobre la cual se críe el parasitoide. Es probable que factores inherentes al manejo (ambientales, manipuleo, etc.) y no a la línea, sean los responsables del porcentaje de parasitismo obtenido. Respecto de los costos, la cría de una sola cepa de moscas, en términos tanto de personal o insumos como de consumo de dieta por parte de las larvas, puede resultar en importantes ahorros comparado con el manejo de dos cepas: una para la producción de macho estéril de la mosca y otra para la cría del parasitoide, siempre y cuando la integración de TIE y el CB sean una opción de control para las moscas de la fruta. Se puede discutir la puesta a punto, o la mejora en el manejo de la línea que proponemos pero, claramente, es factible disminuir con ella los costos en la bio-fábrica.
(1) El estadio larval ofrecido al parasitoide para su reproducción, es un aspecto relevante ya que puede afectar la descendencia (número y sexo) del enemigo natural criado artificialmente (Cancino Díaz & Yoc, 1993). En este sentido diversos autores han comprobado que los mejores resultados en la producción de parasitoides del género Diachasmimorpha, sobre líneas salvajes de huéspedes tefrítidos, se logra sobre larvas del 3 er estadio (Cancino Díaz, 1998; Ovruski et al ., 2003; Viscarret et al ., 2006).
(2)Existen numerosos antecedentes acerca de la influencia que ejercen sobre la proporción sexual, factores tales como el estadio larval, la edad y el tamaño del huésped. Messing & Ramadan (2000), observaron que Diachasmimorpha krausii (Fullaway) deja un alto porcentaje de hembras al parasitar larvas del 3 er estadio intermedio de Bactrocera latifrons (Hendel), y larvas del 3 er estadio temprano de C. capitata . Idéntico resultado halló Wong (1993) para D. tryoni y D. Longicaudata, criados sobre larvas del 3 er estadio tardío de Dacus dorsalis Hendel y C. capitata respectivamente. Respecto del tamaño del huésped, Messing & Ramadan (2000) hallaron para D. krausii una descendencia sesgada hacia las hembras cuando el parasitoide fue criado sobre B. latifrons (larvas más grandes), que sobre C. capitata (larvas más pequeñas). Esta tendencia de dejar descendencia femenina en larvas de mosca de mayor tamaño también ha sido observada para D. longicaudata (huéspedes: Anastrepha ludens (Loew) y B. dorsalis ) y otros parasitoides de la subfamilia Opiinae (Cancino Díaz & Yoc, 1993; Messing et al ., 1993).
AGRADECIMIENTOS
Este trabajo contó con el apoyo de un subsidio (PICTO Nº 12909) de la Agencia Nacional de Promoción Científica Tecnológica (FONCyT).
BIBLIOGRAFÍA CITADA
1. CANCINO DÍAZ, J. L. 1998. Procedimientos y fundamentos de la cría masiva de Diachasmimorpha longicaudata (Ashmead) parasitoides de moscas de la fruta. En : Memorias del XII Curso Internacional sobre Moscas de la Fruta , SAGAR-CONASAG-DGSV, Metapa de Domínguez, Chiapas, México, pp. 407-416. [ Links ]
2. CANCINO DÍAZ, J. L. & M. O. YOC. 1993. Methods proposed to apply quality control in the mass rearing of Diachasmimorpha longicaudata . En : Nicoli, G., M. Benuzzi & N. C. Leppla (eds.), Quality control of mass reared arthropods , IOBC-Rimini, Italia, pp. 37-47. [ Links ]
3. CARPENTER, S. R. 1981. Effect of control measures on pest populations subject to regulation by parasites and pathogens. J. Theor. Biol . 92: 181-184. [ Links ]
4. CLADERA, J. L. 1995. Self-Sexing Strain of Ceratitis capitata (Diptera:Tephritidae) Based on a Gene that Affects the rate of Development. Ann. Entomol. Soc. Am . 88: 353-356. [ Links ]
5. CLADERA, J. L. 1997. Genetics markers, translocation and sexing genes on chromosome 2 of Ceratitis capitata . En : Proceedings of the Final Research Coordination Meeting, Clearwater, Florida, 11- 13 June 1994. Organized by the Joint FAO/ IAEA Division of Nuclear Techniques in Food and Agriculture [ Links ]
6. CLADERA, J. L., VERA, M. T., CALCAGNO, G., VILARDI, J. C. & D. O. MCINNIS. 2002. Mating competitiveness of Cast- 191, a promising genetic sexing strain of the Mediterranean Fruit Fly (Diptera: Tephritidae). Ann. Entomol. Soc. Am. 95(1): 133-138. [ Links ]
7. CLAUSEN, C. P. 1976. Introduced parasites and predators of arthropod pests and weeds: a world review . Agriculture Handbook Nº 480. Agricultural Research Service, USDA. Clausen J. P. (ed.). [ Links ]
8. KNIPLING, E. F. 1998. Sterile insect and parasite augmentation techniques: unexploited solutions for many insect pest problems. Fla. Entomol . 81 (1): 134-160 [ Links ]
9. MADDISON, P. A. & B. J. BARTLETT. 1989. A contribution towards the zoogeography of the Tephritidae. En : Helle, W., Robinson, A. S. & G. Hooper (eds.), World Crops Pests, Fruit Flies: their biology, natural enemies and control . Vol. 3A, pp. 27-35. Elsevier Science Publishers B. V., Amsterdam, Holanda. [ Links ]
10. MANSO, F. C. & E. LIFSCHITZ. 1992. Nueva metodología genética para el mejoramiento de la eficiencia de la Técnica del Macho Estéril en el control de la mosca del Mediterráneo Ceratitis capitata . Cienc. Invest . 44 (4): 225-228. [ Links ]
11. MANSO, F. C., PIZARRO, J. M. & J. L. CLADERA. 2006. Relación entre tiempo de desarrollo larvario y fecundidad de la hembra en Ceratitis capitata (Diptera: Tephritidae. Rev. Soc. Entomol. Argent . 65 (1-2): 43-54. [ Links ]
12. MESSING, R. H., KLUNGNESS, L. M., PURCELL, M. F. & T. T. WONG. 1993. Quality control parameters reared opiinae parasitoids used in augmentative biological control of tephritid fruit flies in Hawaii. Biol. Control . 3: 140-147. [ Links ]
13. MESSING, R. H. & M. M. RAMADAN. 2000. Host range and reproductive output of Diachasmimorpha krausii (Hymenoptera: Braconidae) a parasitoid of the tephritid fruit flies newly imported to Hawaii. En : Tan, K. H. (ed.), Area-Wide control of the fruit flies and other insect pests , Penerbit University Sains Malaysia, Penang, Malasia, pp. 713- 718. [ Links ]
14. MCINNIS, D. O., TAM, S., GRACE, C. & D. MYYASHIDA. 1994. Population suppression and sterility rates induced by variable sex ratio, sterile insect releases of Ceratitis capitata in Hawaii. Ann. Entomol Soc. Am . 87: 231-240. [ Links ]
15. OVRUSKI, S. M., COLIN, C., SORIA, A., OROÑO, L.E. & P. SCHLISERMAN. 2003. Introducción y producción en laboratorio de Diachasmimorpha tryoni y Diachasmimorpha longicaudata (Hymenoptera: Braconidae) para el control biológico de Caratitis capitata (Diptera: Tephritidae) en la Argentina. Rev. Soc . Entomol. Argent . 62 (3-4): 49-59. [ Links ]
16. PIZARRO, J. M., MANSO, F. C. & J. L. CLADERA. 1997. New allele at a locus affecting developmental time in mediterranean fruit fly (Diptera: Tephritidae) and its potential use in genetic sexing at the egg stage. Ann. Entomol. Soc. Am . 90 (2): 220-222. [ Links ]
17. ROBINSON, A. S., FRANZ, G. & K. FISHER. 1999. Genetic sexing strain in the medfly, Ceratitis capitata : development, mass rearing and field testing. Trends Entomol. 1: 81-104. [ Links ]
18. SIVINSKI, J. M., CALKINS, C. O., BARANOWSKI, R., HARRIS, D., BRAMBILA, J., DÍAZ, J., BURNS, R. E., HOLLER, T. & G. DODSON. 1996. Suppression of a Caribbean frui fly Anastrepha suspensa (Loew) (Diptera: Tephritidae) population through augmented releases of the parasitoid Diachasmimorpha longicaudata (Ashmead) (Hymenoptera: Braconidae). Biol. Control 6: 177-185. [ Links ]
19. STATSOFT, INC. 2000. Statistica for Windows. Tulsa OX, Estados Unidos. [ Links ]
20. TERÁN, H. R. 1977. Comportamiento alimentario y su correlación a la reproducción en hembras de Ceratitis capitata (Wied.) (Diptera, Trypetidae). Revista Agronómica N. O. A. 14: 17-34 [ Links ]
21. VISCARRET, M. M., STOLAR, C. E. & J. L. CLADERA. 2002. Male-female separation with a genetic sexing strain of Medfly, Ceratitis capitata , based on the gene sw (slow). En : Proceedings of 6 th International Fruit Fly Symposium, Stellenbosch, Sudáfrica, pp. 445-448. [ Links ]
22. VISCARRET, M. M., La ROSSA , R., SEGURA, D. F., OVRUSKI, S. M. & J. L. CLADERA. 2006. Evaluation of the parasitoid Dichasmimorpha longicaudata (Ashmead) (Hymenoptera: Braconidae) reared on a genetic sexing strain of Ceratitis capitata (Wied.) (Diptera: Tephritidae). Biol. Control 36: 147-153. [ Links ]
23. WONG, T. T. Y. 1993. Mass-rearing of larval fruit fly parasitoids in Hawai. En : Aluja M. & P. Liedo (eds.), Fruit flies: Biology and Management , Springer-Verlag, New York, Inc. Estados Unidos, pp. 257-260. [ Links ]
24. WONG, T. T. Y. & M. M. RAMADAN. 1987. Parasitization of the Mediterranean and Oriental fruit flies (Diptera: Tephritidae) in the Kula area of Maui, Hawaii. J. Econ. Entomol. 80 (1): 77-80. [ Links ]
25. WONG, T. T. Y., M. M. RAMADAN, D. O. MCINNIS, N. MOCHIZUKI, J. A. NISHIMOTO & J. C. HERR. 1991. Augmentative releases of Diachasmimorpha tryoni (Hymenoptera: Braconidae) to suppress a Mediterranean fruit fly population in Kula Maui, Hawaii. Biol. Control . 1: 2-7. [ Links ]
Recibido: 13-I-2006
Aceptado : 30-X-2006














