Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de la Sociedad Entomológica Argentina
Print version ISSN 0373-5680On-line version ISSN 1851-7471
Rev. Soc. Entomol. Argent. vol.65 no.3-4 Mendoza Aug./Dec. 2006
Susceptibilidad a endosulfan y monitoreo de resistencia en poblaciones de Piezodorus guildinii (Insecta, Heteroptera: Pentatomidae), en cultivos de soja de Argentina
Susceptibility to endosulphan and resistance monitoring in «green stinkbug» populations, Piezodorus guildinii (Insecta, Heteroptera: Pentatomidae), in soya crops in Argentina
Stadler Teodoro1 , Micaela Buteler2 y Adriana A. Ferrero3
1Laboratorio de Investigaciones y Servicios Ambientales Mendoza (LISAMEN CRICYT- CONICET), CC 131, (5500) Mendoza, Argentina; e-mail: lpe@lab.cricyt.edu.ar
2Department of Land Resources and Environmental Sciences, Montana State University, Bozeman, MT 59717, USA.
3Universidad Nacional del Sur, (8000) Bahia Blanca, prov. Buenos Aires, Argentina.
ABSTRACT. The susceptibility status to endosulphan of different populations of P. guildinii (Westwood) that affect soybean crops in the Argentinean provinces of Santiago del Estero, Chaco and Santa Fe was determined. Also, to detect possible changes in P. guildinii response to the insecticide, resistance was monitored in a population of P. guildinii from Santiago del Estero from 2002 to 2005. Insects were collected from soybean fields in five localities, Oliveros, Reconquista, San Justo, Bandera and Coronel Du Graty. Topical bioassays were conducted in the laboratory, in the framework of standard World Health Organization test methods. The status of the susceptibility of the P. guildinii populations was: DL95 = 0,680μg/μL [0,489- 1,338] to 2,277μg/μL [1,526-5,418]. The results obtained suggest that the populations studied, which are geographically distant, show differences in their tolerance to endosulphan (detoxifying capabilities) that could be related to environmental factors and linked to any toxicocinetic or toxicodynamic processes. P. guildini populations studied show a trend towards increased tolerance to endosulphan from southern Santa Fe (Oliveros) to northern populations from Bandera (Chaco) that is probably related to environmental factors characteristic of each region. The population of P. guildinii monitored from 2002 to 2005 did not show an increase in tolerance to endosulphan with time. Population and environmental factors are both responsible for the temporal and spatial variations of susceptibility of a population to a biocide, making it hard to distinguish between phenotypic plasticity and susceptibility changes with a genetic basis. The soybean growing area in Argentina occupies a region with a huge range of climatic conditions and flora. In such a varied environment, phenotypic plasticity expressed by different P. guildinii should not be omitted, and should be differentiated from changes in susceptibility caused by genetic differences. Understanding the underlying mechanisms responsible for changes in susceptibility to pesticides, will allow us to distinguish between the effects of phenotypic plasticity and genetic changes and in turn this will aid in the selection of the appropriate measures for insect pest control. The susceptibility data on endosulphan obtained in this study will be useful for insecticide resistance monitoring and control failure diagnosis.
KEY WORDS. Piezodorus guildinii . Soya. Insecticide resistance. Endosulphan. Phenotypic plasticity.
RESUMEN. Se determinó la susceptibilidad a endosulfan en diferentes poblaciones de P. guildinii (Westwood), que afectan los cultivos de soja en las provincias argentinas de Santiago del Estero, Chaco y Santa Fe. Se estableció su estatus de susceptibilidad actual para todas las poblaciones estudiadas, y se monitoreó la resistencia a endosulfan en una población de P. guildinii , de Santiago del Estero desde 2002 a 2005, para detectar los cambios en la respuesta al insecticida, con la finalidad de alertar acerca de posibles fallas de control. Los insectos fueron colectados en plantaciones de soja en las localidades de Oliveros, Reconquista, San Justo, Bandera y Coronel Du Graty. Los bioensayos se desarrollaron en laboratorio por el método del tópico, en el marco de los protocolos de la Organización Mundial de la Salud. El estatus de susceptibilidad actual a endosulfan, en las poblaciones de P. guildinii estudiadas fue de: DL95 = 0,680μg/μL [0,489-1,338] a 2,277μg/μL [1,526-5,418]. De los resultados de los bioensayos se desprende que las poblaciones estudiadas, muy distantes geográficamente unas de otras, muestran algunas diferencias en su tolerancia a endosulfan (capacidad de detoxificación), exhibiendo, además, un incremento gradual de la misma desde la zona sur de Sta. Fe (Oliveros) hacia el norte (Bandera - Chaco), que probablemente se relaciona con los factores ambientales propios de cada región, y se pueden deber también a procesos toxicodínámicos o toxicocinéticos. La población de P. guildinii de Coronel Du Graty (Santiago del Estero) monitoreada desde 2002 a 2005, no mostró un incremento de tolerancia al endosulfan a lo largo del tiempo, que sugiera la presencia de fenómenos de resistencia. Factores poblacionales y ambientales son corresponsables de las variaciones temporales y espaciales de la susceptibilidad de una población a un biocida, esto hace que los límites entre la plasticidad fenotípica y las diferencias en la susceptibilidad a xenobióticos con base genética, resulten difusos. Dentro del área de cultivo de la soja en la Argentina , que abarca regiones con importantes diferencias climáticas y florísticas, la plasticidad fenotípica que muestran diferentes poblaciones de P. guildinii , no debe ser omitida, distinguiendo los cambios de susceptibilidad a insecticidas relacionados con la plasticidad, de aquellos de origen genético. Comprender los mecanismos responsables de cambios en la susceptibilidad a xenobióticos, permitirá discernir entre los efectos de la plasticidad fenotípica y de los cambios genéticos, esto llevará a seleccionar las medidas adecuadas para el control de poblaciones de insectos plaga. La información acerca del estatus actual de susceptibilidad a endosulfan, obtenida a través del presente estudio, resultará de utilidad para el monitoreo de resistencia así como para el diagnóstico de fallas en el control de esta plaga.
PALABRAS CLAVE. Piezodorus guildinii . Soja. Resistencia. Endosulfan. Plasticidad fenotípica.
INTRODUCCIÓN
La fauna subtropical incluye un importante reservorio de especies colonizadoras potenciales de la soja [ Glycine max (Fabaceae)], que rápidamente se han adaptado a este cultivo introducido (Kogan, 1981). Nezara viridula (L.) fue el pentatómido dominante durante la etapa de expansión de la soja en Sudamérica (Vincentini & Jiménez, 1977), hasta que Piezodorus guildinii (Westwood) asumió ese rol, producto de su capacidad de adaptación al medio y de su estrategia para invadir y establecerse en el cultivo (Panizzi, 1980). Entre las características que le han permitido a P. guildinii colonizar exitosamente la soja, se destacan su ciclo anual multivoltino con 3 o más generaciones, su alta tasa reproductiva y su capacidad de invadir la soja durante la etapa vegetativa, al inicio de floración (Cividanes & Parra, 1994).
Del «complejo de chinches de la soja» de la Argentina [ Nezara viridula , Piezodorus guildinii , Edessa meditabunda (Fabricius) y Dichelops furcatus (Fabricius )], P. guildinii es la especie que causa daños más severos al cultivo. El número de semillas dañadas por planta, es mayor para esta especie (18,5%) en comparación con los daños provocados por otras especies del complejo de chinches (entre 3,4% y 3,6%). Desde el punto de vista cualitativo, el ataque de P. guildinii está asociado con el retardo en la maduración (Boethel et al ., 2000) y afecta la calidad de la semilla, más que al rendimiento del cultivo (Corrêa-Ferreira & de Azevedo, 2002).
El principal factor de riesgo de resistencia a insecticidas, es la presencia de individuos naturalmente resistentes a un principio activo, en asociación con el incremento en la frecuencia de uso de esa sustancia. Las variables que aceleran o retardan la aparición del fenómeno de la resistencia, son los mecanismos bioquímicos no específicos para el sitio de acción -inducción enzimática, por ejemplo-, así como las prácticas culturales y el patrón de uso de insecticidas, que afectan la dinámica de la resistencia (Annon, 2005). La resistencia es un fenómeno recurrente en cultivos de alto valor económico, afectados por plagas que requieren tratamientos químicos intensivos. Por ejemplo, la respuesta de algunas poblaciones de N. viridula de Florida (EEUU), a esta constante presión con un único principio activo (endosulfan), fue la aparición del fenómeno de resistencia (Leibee & Capinera, 1995). En la Argentina , el cultivo de la soja ha sufrido un incremento exponencial durante las pasadas dos décadas, hasta alcanzar 15.171 millones de hectáreas en la temporada 2005- 06 (SAGyPA, 2006) [Fig. 1]; paralelamente se ha extendido el empleo del endosulfan a más de 3,5 millones de hectáreas (CASAFE, 2006). Este escenario de riesgo potencial de resistencia a endosulfan, en poblaciones de P. guildinii , se ve agravado por el uso continuo del endosulfan, desde hace más de dos décadas, para el control del «complejo de chinches».

Figura 1. Área sembrada con soja ( Glycine max (Fabaceae)] en la Republica Argentina , temporada 2005-06. (SAGYPA,2006).
La susceptibilidad a insecticidas, así como los fenómenos de resistencia están asociados a factores genéticos y ambientales (Mascarenhas et al .,1998; Moulton et al ., 2000; Shelton et al . 2000; Zhao et al .2002; Ahmad et al. 2003; Domínguez-Gil & McPheron, 2000; Huang et al ., 2004; Miyo et al ., 2000), principalmente a aquellos que afectan los mecanismos de detoxificación en los herbívoros, como los componentes químicos de los vegetales, que alteran la respuesta a los xenobóticos a través de la inducción de mecanismos de detoxificación (Berry et al ., 1980; Yu et al ., 1979; Koch et al .,1999; Ndakidemi & Dakora, 2003). Los mecanismos de detoxificación específicos, que permiten a los insectos fitófagos interactuar con los aleloquímicos de sus hospederas, frecuentemente resultan ser los mismos caminos metabólicos involucrados en los fenómenos de resistencia (Ahmad et al ., 1986).
Del mismo modo que la diversidad en la dieta (alternancia de hospederas) de una especie de insecto es relevante para su capacidad de detoxificación, las diferencias intraespecíficas de una hospedera (diferencias varietales, condiciones ambientales, épocas del año, etc.) afectan su capacidad de respuesta ante un xenobiótico (Mattson & Haack, 1987; Brattsten, 1988). Por ejemplo, Robertson et al ., (1990) demostraron que no hay diferencias significativas entre la respuesta de una cepa resistente a azinfos metil de Epiphyas postvittana (Walker) (Lepidoptera: Tortricidae), que se alimenta de Rubus occidentalis (Rosaceae), y otra susceptible que se alimenta de dieta artificial; mientras que las larvas de la cepa susceptible que se alimentan de dieta artificial, resultaron significativamente más tolerantes al insecticida en comparación con las susceptibles que se alimentan de R. occidentales. Estos y otros ejemplos de la literatura, demuestran que ciertas diferencias en la susceptibilidad a insecticidas, en diferentes poblaciones de una misma especie, no siempre se deben a factores genéticos (Mullin & Croft, 1983; Lindroth, 1989; Yu et al ., 1979; Berry et al ., 1980; Hinks & Suprr, 1989).
Sobre la base de estos antecedentes, se consideró necesario establecer criterios confiables para la toma de decisiones acerca de la alternancia de pesticidas, o para adaptar las estrategias de control a diferentes situaciones o tácticas de manejo. Para ello, se evaluó la susceptibilidad de P. guildinii a endosulfán en diferentes zonas del área sojera de Argentina. Asimismo, se monitorearon las poblaciones de P. guildinii de la localidad de Du Graty, durante tres campañas sojeras, para detectar fenómenos de resistencia en presencia de posibles cambios en la eficacia del endosulfan en ese período.
MATERIAL Y MÉTODOS
Los estudios sobre susceptibilidad y el monitoreo de resistencia a endosulfan de P. guildinii, comenzaron en el mes de octubre de 2002 en tres localidades de Santa Fe, una del sur de Santiago del Estero y otra del sur del Chaco (San Justo, Oliveros, Reconquista, Bandera y Coronel Du Graty respectivamente) (Fig. 2). Se estudiaron las diferentes poblaciones de P. guildinii , para determinar el estatus de susceptibilidad actual a endosulfan. Por otra parte, se monitorearon poblaciones de P. guildinii de Du Graty (Chaco) durante tres campañas sojeras consecutivas (2002-03, 2003-04 y 2004-05), para identificar posibles fenómenos de resistencia a endosulfan (Tabla I).
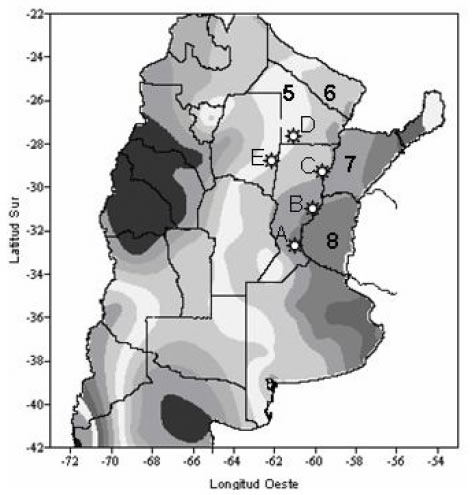
Figura 2. Sitios de muestreo en Santa Fe, Santiago del Estero y Chaco : A.- Oliveros; B.- San Justo; C.- Reconquista; D.- Bandera; E.- Coronel Du Graty y Balance hídrico, tercera década de julio de 2005: 5.- Comienzo de sequía; 6.- regular; 7.- Bueno; 8.- Optimo; (Fuente: Servicio Meteorológico Nacional Argentino).

Tabla I. P. guildinii : Información sobre el material biológico utilizado en los bioensayos con endosulfan.
Material biológico
Los insectos adultos fueron colectados en las plantaciones de soja en tres momentos diferentes del desarrollo del cultivo, en coincidencia con los picos poblacionales de la plaga (Cividanes & Parra, 1994), e identificados a través de observaciones periódicas.
La captura de los insectos, así como su transporte al laboratorio fue realizado de acuerdo con procedimientos operativos normalizados, que fueron aplicados durante los tres años de monitoreo y que se detallan a continuación. La colección de insectos se realizó en áreas en las que, por lo menos 25 días antes del muestreo, no hubo aplicación de insecticidas. Teniendo en cuenta que las principales especies del «complejo de chinches», presentan una distribución agregada (patchy distribution) -especialmente los estadios pre-imaginales-, la colección se realizó en diversos sectores del área de muestreo y al azar, para conformar una muestra que fuese representativa de esa región.
La colección de insectos se realizó mediante un paño horizontal de 80 cm de largo por 50 cm de ancho. El transporte del material se realizó dentro de cajas de telgopor de 60cmx40cmx30cm, acondicionadas con material vegetal para evitar la deshidratación, y en las que se colocaron no más de 500 individuos. Las cajas fueron equipadas con un datalogger marca HOBO H08, para el registro de humedad relativa y temperatura durante el transporte. En todos los casos, el tiempo máximo para transporte del material desde el sitio de muestreo hasta el lugar de ensayos, fue de 30 horas, la temperatura máxima dentro de las cajas no superó los 35º C y la HR % se mantuvo por sobre el 75%.
En el laboratorio, antes de cada bioensayo, los insectos fueron pesados y se descartaron aquellos que diferían en más del 10% del valor del peso promedio del lote [49,0 mg ( ± 8,4)]. Para los bioensayos se utilizaron únicamente insectos en buenas condiciones generales (WHO, 1976).
Desarrollo de los ensayos
Insecticida utilizado: Endosulfan técnico, LOTE AAPC 20333 provisto por Bayer S.A.
Solvente utilizado: Acetona Mallinckrodt (ChromAR-HPLC, KY, USA).
Preparación de las soluciones del insecticida: se prepararon soluciones madre de 10 mg/ml de endosulfan en acetona, y a partir de éstas, series de diluciones de 0,05; 0,1; 0,2; 0,3; 0,5; 0,7 y 1,0 mg/ml, en viales de vidrio Boro-Silicato. Las soluciones fueron conservadas a 4º C ( ± 1º C) durante no más de 48hs.
Determinación de la susceptibilidad a endosulfan en bioensayos por contacto
Se realizaron bioensayos de aplicación tópica en el marco del protocolo WHO (1976). Las soluciones acetónicas de endosulfan fueron aplicadas en el tercio posterior ventral del abdomen de los insectos, bajo microscopio estereoscópico, empleando un dispensador automático Hamilton No PB-600-1, con jeringa de 50 µL . Se aplicó un volumen de 1 µL por individuo, bajo anestesia con CO2 neutralizado con carbonato de calcio. Los insectos tratados y los respectivos controles fueron mantenidos en unidades de ensayo de diez individuos, en potes plásticos de 250 cm³ de capacidad, con agua «ad livitum» a 26 +/- 1º C y 75% de HR durante 24 horas.
Previo a la evaluación de la susceptibilidad a endosulfan, se realizó un «screening» para determinar los intervalos de las concentraciones a utilizar en los bioensayos. Para el screening se utilizaron cuatro concentraciones (0,05; 0,30; 0,70 y 1,00 mg/ml) y dos repeticiones con seis insectos por concentración. Cada serie de bioensayos se realizó con insectos provenientes del mismo muestreo. Los bioensayos se realizaron con diez insectos por concentración, con siete concentraciones (0,05; 0,10; 0,20; 0,30; 0,50; 0,70 y 1,00 mg/ml), y cinco repeticiones independientes y simultáneas por concentración.
Análisis de los datos
Los datos de dosis-mortalidad, para cada uno de los bioensayos con endosulfan, fueron corregidos por el método de Abbot (1925) para la mortalidad en los controles. Los datos dosis-mortalidad corregidos, fueron analizados mediante SAS-PROC PROBIT (SAS Institute, 1999) para determinar la dosis de endosulfan que provoca el 50% (DL50 ) y 95% (DL95 ) de mortalidad, y los correspondientes intervalos de confianza (IC95%) para cada localidad. Las diferencias significativas (α = 0,05) entre poblaciones de diferente origen geográfico y campañas, fueron evaluadas mediante el método de Robertson & Preisler (1992). El método calcula un índice a través de la comparación de los valores de las dosis letales (DL). Los componentes utilizados para el cálculo de los índices, y sus intervalos de confianza son: ordenada al origen, pendiente y los tres valores estimados de matriz de covarianza.
RESULTADOS
Susceptibilidad de Piezodorus guildinii a endosulfan
Los valores de la DL95 para endosulfan, calculados para las poblaciones de las diferentes localidades, fluctúan entre 0,680 µg/µL y 2,277 µg/µL , siendo la población de Bandera 3,3 veces más tolerante que la de Oliveros, que resultó la más susceptible de las cuatro estudiadas. No se observaron diferencias estadísticamente significativas en la susceptibilidad a endosulfan, entre las poblaciones del norte de la región estudiada en 2002-2003 (Reconquista, Bandera, San Justo y Coronel Du Graty). En cambio, se hallaron diferencias estadísticamente significativas (P< 0,05) entre las poblaciones del norte y la de Oliveros (Tabla II). Los valores de DL50 muestran buena correspondencia entre localidades, mientras que los valores de la DL95 muestran mayor dispersión, así como el valor de la pendiente (m) varía considerablemente entre localidades (Tabla II). El cociente entre la máxima y la mínima DL95 es 3,3; mientras que el cociente entre la máxima y la mínima DL50 es 2,5.

TABLA II. Resultados de los ensayos de susceptibilidad a endosulfan en las diferentes poblaciones de P. guildinii , colectadas en Reconquista, San Justo, Oliveros, Du Graty y Bandera, en los muestreos realizados durante la campaña 2002-2003. DL50 = dosis letal media; DL95 = dosis letal 95%; IC = intervalo de confianza; m = pendiente; x² = Chi cuadrado de heterogeneidad; gl = grados de libertad; EE = error estándar; a.- Valores seguidos de la misma letra en una misma columna no son significativamente diferentes según Robertson & Preisler (1992); b.- Ningún valor de chi-cuadrado resulto significativo (P > 0,05, g.l. = 7).
Las poblaciones de P. guildini muestran un incremento gradual en la tolerancia al endosulfan o gradiente de toxicidad (Tabla II, quinta columna), entre las localidades desde la zona sur de Santa Fe (Oliveros), hacia el norte (Coronel Du Graty y Bandera).
Monitoreo de resistencia a endosulfan de Piezodorus guildinii de Coronel Du Graty
Los valores de la DL95 para endosulfan, calculados para las poblaciones de Coronel Du Graty en las campañas 2002-03, 2003- 04 y 2004-05, fluctúan entre 1,019 µg/µL y 1,704 µg/µL.
No se observaron diferencias significativas en las DL50 de las poblaciones estudiadas de 2002 a 2005, aunque sí se observaron diferencias estadísticamente significativas (P< 0,05) entre las DL95 a través el método de Robertson y Preisler (1992) [Tabla III].

TABLA III. Resultados de los ensayos de susceptibilidad a endosulfan de P. guildinii colectados en Du Graty durante las campañas 2002-2003, 2003-2004 y 2004-2005. DL50 = dosis letal media; DL95 = dosis letal 95%; IC = intervalo de confianza; m = pendiente; X² = Chi cuadrado de heterogeneidad; gl = grados de libertad; EE = error estándar; a.- Valores seguidos de la misma letra en una misma columna no son significativamente diferentes según Robertson & Preisler (1992); b.- Ningún valor de chi-cuadrado resulto significativo (P > 0,05, g.l. = 7).
Los valores de DL50 muestran buena correspondencia, mientras que los valores de la DL95, muestran mayor dispersión para las diferentes campañas, y los valores de la pendiente (m) varían considerablemente (Tabla III). Asimismo, el cociente entre la máxima y la mínima DL95 es 1,3; y el cociente entre la máxima y la mínima DL50 es 1,2. En este caso, tratándose de la misma localidad y probablemente de la misma población, la dispersión de los valores es menor que la observada entre las distintas poblaciones de P. guilidinii, provenientes de las diferentes localidades estudiadas en 2002-2003. Además, el monitoreo de los cambios en la susceptibilidad a endosulfan en la población de P. guildinii de Du Graty desde 2002 a 2005, no mostró un patrón de incremento a lo largo del tiempo que evidencie fenómenos de resistencia en esa área.
DISCUSIÓN
Al eliminar todas aquellas diferencias en la susceptibilidad a insecticidas que puedan manifestarse a través de genes de resistencia, Godfrey & Fuson (2001) demostraron categóricamente que los cambios en la respuesta de un insecto a diferentes xenobióticos, provienen de diferencias interespecíficas e intraespecíficas de las plantas hospederas. En estos estudios, en los que la variabilidad genética se encontraba controlada a través del empleo de cepas monoclonales para los bioensayos, los autores demuestran definitivamente el alto nivel de relevancia que posee la plasticidad fenotípica de la especie sobre su susceptibilidad a insecticidas. Este hallazgo confirma los resultados de otros trabajos afines con diferentes taxones (no monoclonales) como lepidópteros, áfidos, coleópteros y dípteros [ Spodoptera exigua (Hübner) (Mascarenhas et al .,1998; Moulton et al ., 2000), Plutella xylostella (L.) (Shelton et al . 2000; Zhao et al .2002), Helicoverpa armigera (Hübner) (Ahmad et al . 2003) Platynota idaeusalis (Walker) (Domínguez-Gil & McPheron, 2000), Drosophila melanogaster Meigen (Miyo et al., 2000) y Tribolium castaneum (Herbst) (Huang et al ., 2004)].
Sobre la base de estos antecedentes, las ligeras diferencias en la susceptibilidad a endosulfan, observadas en las poblaciones de P. guilidinii de Du Graty entre 2002 y 2005 (Tabla III) pueden interpretarse como un efecto ambiental, ya que a pesar del uso continuo del insecticida en esta área, no hay evidencias sobre cambios relevantes de la susceptibilidad a lo largo de las tres campañas sojeras (2002-2005). Estas ligeras diferencias en la susceptibilidad a endosulfan, podrían estar asociadas a diferencias fisiológicas intraespecíficas de la hospedera, ligadas a factores ambientales. La soja acumula metabolitos tóxicos al final del ciclo, como metanol e isoflavonas, así como la genisteina (Koch et al .,1999; Ndakidemi & Dakora, 2003), y sus títulos en el fruto están sujetos a variables tales como la temperatura y disponibilidad de agua (Mattson & Haack, 1987). La presencia de estos metabolitos en la soja tienen influencia directa sobre la actividad detoxificante de P. guildinii, y eventualmente sobre su susceptibilidad a endosulfan.
Por otra parte, el gradual incremento de la tolerancia al endosulfan observado en diferentes poblaciones de P. guildini , desde la zona sur de Santa Fe (Oliveros) hacia el norte (Du Graty y Bandera) [Tabla II, columna 5], indica divergencias fisiológicas entre las poblaciones tanto de la hospedera como del insecto, asociadas principalmente a factores ambientales como el clima y la composición florística de la región de procedencia (Fig. 2).
Además de los aleloquímicos que afectan la actividad detoxificante en una población, también es necesario considerar como factores externos todas aquellas variables, que provocan cambios en la dinámica poblacional de la plaga («factor poblacional»), y que afectan la frecuencia génica de la población entre dos ciclos de cultivo. Miyo et al . (2000) estudiaron las variaciones intraespecificas de la actividad detoxificante en poblaciones de D. melanogaster , colectadas en diferentes regiones geográficas. Estos autores encontraron, que las diferencias en la susceptibilidad a insecticidas en esta especie se hallan asociadas a amplios rangos de variación genética, ligada a factores exógenos como la temperatura. El patrón de distribución de la población de D. melanogaster estudiada por Miyo et al (2000) resultó unimodal, de manera que, cuando la población cae por debajo de su capacidad de carga, la tasa intrínseca de incremento (r) de cada genotipo, determina la composición genética de la población de la temporada siguiente a través de una selección, que responde a una estrategia de desarrollo de tipo «r». Del mismo modo, dentro de grandes extensiones de monocultivos de soja en la Argentina, las poblaciones de P. guildinii están sometidas a procesos de expansión y contracción desde la floración a la cosecha de la soja, dentro de dos ciclos de cultivo anuales (Fig. 1); en los que la plaga difícilmente alcanza una estructura poblacional estable, así como sucede con D. melanogaster (Miyo & Charlesworth, 2004).
De aquí se desprende, que la selección de un determinado genotipo en diferentes poblaciones de P. guildinii, al inicio de cada ciclo de cultivo, es otro elemento relevante de la variación ambiental («factor poblacional»), además de la variabilidad inter e intraespecífica de las hospederas y del historial del uso de pesticidas en una determinada región. El «factor poblacional» y los factores ambientales son corresponsables de las variaciones temporales y espaciales de la susceptibilidad de una población a un biocida, así como las coadaptaciones y la coevolución entre herbívoros y sus hospederas, moldean mosaicos espaciales y temporales de variación genética (Scriber, 2002) que hacen más difusos los límites entre la plasticidad fenotípica y las diferencias en la susceptibilidad a xenobióticos con base genética.
Estos antecedentes también ponen en evidencia la utilidad de los datos toxicológicos que se obtienen a partir de insectos capturados a campo, y alertan sobre la necesidad de analizar con suma cautela la información toxicológica que proviene de ensayos con organismos criados sobre dieta artificial, cuyos resultados pueden conducir a conclusiones erróneas. Por ejemplo, los estudios realizados por Robertson et al. (1990), demuestran que las larvas susceptibles a azinfos-metil, criadas sobre dieta artificial, resultaron significativamente más tolerantes al insecticida que las susceptibles criadas sobre sus hospederas. Sin lugar a dudas, la dieta artificial es una excelente herramienta para la experimentación toxicológica en laboratorio; sin embargo, el alimento artificial actúa como factor de presión de selección, y la respuesta del insecto a un xenobiótico deja de ser la esperable en condiciones naturales (Godfrey & Fuson, 2001).
Determinar con precisión la línea de base de la susceptibilidad o estatus de susceptibilidad actual a endosulfan en poblaciones de P. guildinii , es el primer paso para implementar un seguimiento metódico de la eficacia de este producto, a lo largo de las sucesivas campañas de producción. La información toxicológica, que surge de estos ensayos, también puede ser aplicada a programas de monitoreo de resistencia a endosulfan basados en la técnica de la dosis discriminante (WHO, 1976), utilizando el doble de la DL95 (Zerba et al ., 2001). Esta herramienta permitirá a los especialistas en manejo de plagas, interpretar acertadamente los casos de fallas de control en el campo, detectar casos incipientes de resistencia e implementar a tiempo las acciones de mitigación necesarias. Sin embargo, dentro del área de cultivo de la soja en la Argentina , que abarca regiones con importantes diferencias climáticas y florísticas, la plasticidad fenotípica que muestran las diferentes poblaciones de P. guildinii no debe ser omitida, y se deben distinguir los cambios de susceptibilidad a insecticidas relacionados con la plasticidad, de aquellos de origen genético.
AGRADECIMIENTOS
Agradecemos a Damián Correa y a Marcelina Bavio por su colaboración en el desarrollo de los bioensayos. Al Ing. Agr. Ramiro Oviedo Bustos de Bayer CropScience (Argentina), por la asistencia logística para la provisión del material biológico.
BIBLIOGRAFÍA CITADA
1. ABBOTT, W. S. 1925. A method for computing the effectiveness of an insecticide. Journal of Economic Entomology 18: 265 –267. [ Links ]
2. AHMAD, S., L. B. BRATTSTEN, C. A. MULLIN & S. J. YU. 1986. Enzymes involved in the metabolism of plant allelochemicals. En : L. B. Brattsten & S. Ahmad (eds.), Molecular Aspects of Insect-Plant Associations . Plenum Press, New York, pp. 73-151. [ Links ]
3. AHMAD, M., M. I. ARIF, & Z. AHMAD. 2003. Susceptibility of Helicoverpa armigera (Lepidoptera: Noctuidae) to new chemistries in Pakistan. Crop Protection . 22 :539-544 [ Links ]
4. ANNON, 2005. Mode of Action Classification v4.2.1 Insecticide Resistance Action Committee IRAC, 12pp. [ Links ]
5. BERRY, R. E., S. J. YU & L. C. TERRIERE. 1980. Influence of host plants on insecticide metabolism and management of variegated cutworm. Journal of Economic Entomology 73: 771-774. [ Links ]
6. BOETHEL, D. J., J. S. RUSSIN, A. T. WIER, M. B. LAYTON, J. S. MINK & M. L. BOYD. 2000. Delayed maturity associated with Southern green stink bug (Heteroptera: Pentatomidae) injury at various soybean phenological stages. Journal of Economic Entomology 93(3): 707-712 [ Links ]
7. BRATTSTEN, L. B. 1988. Potential role of plant allelochemicals in the development of insecticide resistance. En : Barbosa, P. & D. K. Letourneau (eds.), Novel Aspects of Insect-Plant Interactions . John Wiley & Sons, New York, pp. 313-348. [ Links ]
8. CASAFE. 2006. http://www.casafe.org/sobrelaindustria.htm [ Links ]
9. CIVIDANES, F. J. & J. PARRA. 1994. Zoneamento ecológico de Nezara viridula (L), Piezodorus guildinii (West.) e Euschistus heros (Fabr.) (Heteroptera: Pentatomidae) em quatro estados productores de soja do Brasil. Anais da Sociedade Entomológica do Brasil 23 (1): 219-226. [ Links ]
10. CORRÊA-FERREIRA, B.S. & J. AZEVEDO.2002. Soybean seed damage by different species of stink bugs. Agriculture and Forest Entomology 4:145-150 [ Links ]
11. DOMÍNGUEZ-GIL, O. E. & B. A. McPHERON. 2000. Effect of diet on detoxification enzyme activity of Platynota idaeusalis (Walker) (Lepidoptera:Tortricidae) larvae strains. Revista Facultad de Agronomia (LUZ) 17: 119-138 [ Links ]
12. GODFREY, L.G. & K. J. FUSON. 2001. Environmental and Host Plant Effects on Insecticide Susceptibility of the Cotton Aphid (Homoptera: Aphididae). The Journal of Cotton Science 5:22-29 [ Links ]
13. HINKS, C. F. & D. T. SPURR. 1989. Effect of food plants on the susceptibility of the migratory grasshopper (Orthoptera: Acrididae) to deltamethrin and dimethoate. Journal of Economic Entomology 82: 721-726. [ Links ]
14. HUANG, F., B. SUBRAMANYAM & M. D. TOEWS. 2004. Susceptibility of laboratory and field strains of four stored-product insect species to spinosad. Journal of Economic Entomology 97(6): 2154-2159 [ Links ]
15. KOCH J.L., M. HORBOWICZ & R.L. OBENDORF. 1999. Methanol, pectin and pectinesterase changes during soybean seed maturation. Seed Science Research 9(4): 311-320 16. KOGAN, M. 1981. Dynamics of insect adaptations to soybean: Impact of integrated pest management. Environmental Entomology 10: 363-371 [ Links ] [ Links ]
17. LEIBEE, G. L. & J. L. CAPINERA. 1995. Pesticide resistance in Florida insects, limits management options. Florida Entomologist 78(3): 386-399 [ Links ]
18. LINDROTH, R. L., 1989. Chemical ecology of the luna moth, effects of host plant on dexotification enzyme activity. Journal of Chemical Ecology 15: 2019-2029. [ Links ]
19. MASCARENHAS, V. J., J. B. GRAVES, B. R. LEONARDS & E. BURRIS. 1998. Susceptibility of field population of beet armyworm (Lepidoptera: Noctuidae) to commercial and experimental insecticides. Journal of Economic Entomology 91: 827-833. [ Links ]
20. MATTSON, W. J. & R. A. HAACK. 1987. The Role of Drought in outbreaks of Plant-eating Insects. BioScience 37 (2): 110-118. [ Links ]
21. MIYO, T & B. CHARLESWORTH. 2004. Density-independent population projection trajectories of chromosome-substituted lines resistant and susceptible to organophosphate insecticides in Drosophila melanogaster . BMC Genet 5: 31-40. [ Links ]
22. MIYO, T., S. AKAI & Y. OGUMA. 2000. Seasonal fluctuation in susceptibility to insecticides within natural populations of Drosophila melanogaster : empirical observations of fitness costs of insecticide resistance. Genes Genetic Syst ems 75: 97-104 [ Links ]
23. MOULTON, J. K., D. A. PEPPER & T. J. DENNEHY. 2000. Beet armyworm Spodoptera exigua resistance to spinosad. Pestest Management Science 56: 842-848. [ Links ]
24. MULLIN, C. A. & B. A. CROFT. 1983. Hostrelated alterations of detoxification enzymes in Tetranychus urticae (Acari: Tetranychidae). Environmental Entomology 12(4): 1278-1282. [ Links ]
25. NDAKIDEMI, P. A. & DAKORA, F. D. 2003. Legume seed flavonoids and nitrogenous metabolites as signals and protectants in early seedling development. Functional Plant Biology 30(7): 729-745 [ Links ]
26. PANIZZI, A.R. 1980. Dynamics of phytophagous pentatomids associated with soybean in Brazil. Proceedings World Soybean Conference III, Boulder, Colorado, pp. 674-680. [ Links ]
27. ROBERTSON, J. L., K. F. ARMSTRONG, D. M. SUCKLING, AND H. K. PREISLER. 1990. Effects of host plants on the toxicity of azinphosmethyl to susceptible and resistant light brown apple moth (Lepidoptera: Tortricidae). Journal of Economic Entomology 83: 2124-2129. [ Links ]
28. ROBERTSON, J. L. & H. K. PREISLER, 1992. Pesticide Bioassays with Arthropods. Boca Raton, FL, CRC Press. [ Links ]
29. SAGYPA. 2006. http://www.sagpya.mecon.gov.ar/new/0-0/agricultura/index.php [ Links ]
30. SAGYPA. 2006. http://www.sagpya.mecon.gov.ar/new /00/agricultura/otros /estimaciones/infsoja.php ; http://www.sagpya.mecon.gov.ar/new/0 0/prensa/monsanto2.php. [ Links ]
31. SAS Institute. 1999. SAS/STAT user's guide, vers 8. SAS Institute, Cary, NC. [ Links ]
32. SCRIBER J. M., 2002. Evolution of insect-plant relationships: chemical constraints, coadaptation, and concordance of insect/ plant traits. Entomologia Experimentalis et Applicata 104 (1): 217-235. [ Links ]
33. SHELTON, A. M., F. V. SANCES, J. HAWLEY, J. D. TANG, M. BOUNE, D. JUNGERS, H. L. COLLINS, & J. FARIAS. 2000. Assessment of insecticide resistance after the outbreak of diamondback moth (Lepidoptera: Plutellidae) in California in1997. Journal of Economic Entomology 93: 931-936. [ Links ]
34. VINCENTINI, R. & H. A. JIMENEZ. 1977. El vaneo de los frutos de soja. Paraná, Estación Experimental Regional Agropecuaria Serie Técnica 47: 1-30 [ Links ]
35. WHO. 1976. World Health Organization Expert Committee on Insecticide Resistance of Vectors and Reservoirs of Diseases to Pesticides. Criteria and meaning of tests for determining the susceptibility or resistance, unpublished document, annex of 585 WHO technical report series, WHO/ VBC/ 81.6, 4 pp. [ Links ]
36. YU, S. J., R. E. BERRY & L. C. TERRIERE. 1979. Host plant stimulation of detoxifying enzymes in a phytophagous insect. Pesticide Biochemistry and Physiology 12: 280-284. [ Links ]
37. ZERBA, M. I., D. MARTÍNEZ, & T. STADLER, 2001. Nuevo método de diagnóstico a campo de resistencia a insecticidas para el picudo del algodonero ( Anthonomus grandis )- New field method for insecticide resistance diagnosis in cotton boll weevil populations. Proceedings of the workshop «Cotton in the southern cone - Integrated pest management of the cotton boll weevil in Argentina, Brazil and Paraguay». Final international workshop, 26th –28th June 2001, Fortaleza-Brazil. PART I: 238-245. [ Links ]
38. ZHAO, J. Z., Y. X. LI, H. L. COLLINS, L. GUSUKUMA-MINUTO, R.F.L. MAU, G. D. THOMPSON & A. M. SHELTON. 2002. Monitoring and characterization of diamondback moth (Lepidoptera: Plutellidae) resistance to spinosad. Journal of Economic Entomology 95:430-436. [ Links ]
Recibido: 1-IX-2006
Aceptado: 9-XI-2006














