Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de la Sociedad Entomológica Argentina
versión impresa ISSN 0373-5680versión On-line ISSN 1851-7471
Rev. Soc. Entomol. Argent. v.67 n.1-2 Mendoza ene./jun. 2008
Diversidad taxonómica y denso-actividad de solífugos (Arachnida: Solifugae) asociados a un ecosistema desértico costero del centro norte de Chile
Taxonomic diversity and density-activity of solpugids (Arachnida: Solifugae) in a coastal desert ecosystem in the northern centre of Chile
Valdivia, Daniel E.*, Jaime Pizarro-Araya*, Jorge Cepeda-Pizarro* y Andrés A. Ojanguren-Affilastro**
*Laboratorio de Entomología Ecológica, Departamento de Biología, Facultad de Ciencias, Universidad de La Serena, Casilla 599, La Serena, Chile; e-mail: daelvhu@gmail.com
**División Aracnología, Museo Argentino de Ciencias Naturales Bernardino Rivadavia, Av. Ángel Gallardo 470, 1405 DJR Buenos Aires, Argentina
RESUMEN. En Chile, el orden Solifugae está representado por 14 especies agrupadas en 10 géneros, distribuidos en las tres familias descritas en Sudamérica: Ammotrechidae, Mummuciidae y Daesiidae. En el presente trabajo se documenta la composición genérica y/o específica de solífugos asociados a un ecosistema desértico costero del centro norte de Chile, y se muestran las variaciones de su denso-actividad. El estudio se realizó en el sector costero de Punta de Choros (29°21'S, 71°10'O; 17 msnm), durante los meses de junio, agosto, octubre y noviembre de 2005. Entre los 249 ejemplares capturados, se reconoció la presencia de tres familias, cuatro géneros y cinco especies. Éstas fueron Procleobis sp., Sedna pirata Muma (Ammotrechidae), Mummucia sp., Mummucia variegata (Gervais) (Mummuciidae) y Ammotrechelis goetschi Roewer (Daesiidae). La mayor denso-actividad de solífugos se registró en los meses de octubre, 5 especies (ca 30 % del total capturado); y noviembre, 3 especies (ca 41 % del total capturado). Mientras que algunas especies se mostraron activas durante todo el período de estudio (e.g., Ammotrechelis goetschi), otras presentaron actividad parcial. Por ejemplo, Mummucia variegata manifestó actividad entre agosto y noviembre; Sedna pirata entre octubre y noviembre y tanto Procleobis sp. como Mummucia sp. estuvieron activas sólo en octubre. La diversidad y la denso-actividad de Solifugae estarían determinadas por factores biológicos y ecológicos.
PALABRAS CLAVE. Solifugae; Artrópodos epígeos; Denso-actividad; Desierto costero; Chile.
ABSTRACT. In Chile the order Solifugae is represented by 14 species arranged in 10 genera distributed among the three families described for South America: Ammotrechidae, Mummuciidae and Daesiidae. The present work documents the taxonomic composition of solpugids in a desert coastal ecosystem of the northern centre of Chile and describes variation in their density-activity. The study was carried out in the coastal sector of Punta de Choros (29°21'S, 71°10'W; 17 masl) during June, August, October and November 2005. The 249 captured specimens represented three families, four genera, and five species. These were Procleobis sp. and Sedna pirata Muma (Ammotrechidae), Mummucia sp. and Mummucia variegata (Gervais) (Mummuciidae), and Ammotrechelis goetschi Roewer (Daesiidae). The highest levels of solpugid density-activity occurred in October (ca 30 % of the total captured) and November (ca 41 % of the total captured). Five species were captured in October and three, in November. While some species were active throughout the study (e.g., Ammotrechelis goetschi), others showed occasional activity. For example, Mummucia variegata showed activity between August and November, Sedna pirata between October and November, and Procleobis sp. and Mummucia sp. only in October. The diversity and density-activity may be determined by biological and ecological factors.
KEY WORDS. Solifugae; Epigeic arthropods; Density-activity; Coastal desert; Chile.
INTRODUCCIÓN
El conocimiento actual de la diversidad de Arachnida, considera al orden Solifugae como un taxón meso-diverso, constituido por 12 familias, 140 géneros y 1.087 especies (Harvey, 2002). Los solífugos son depredadores de artrópodos con exoesqueletos blandos (Muma, 1966a; Maury, 1998; Brookhart & Brantley, 2000). Presentan hábitos tanto diurnos como nocturnos (Muma, 1974; Maury, 1998) con una actividad estacional marcada, la cual puede ser univoltina o bivoltina (Punzo, 1998, 2000). Antecedentes bionómicos para la familia Eremobatidae, reconocen cuatro estadios: huevo, postembrionario, ninfa y adulto; este último de corta duración (Muma, 1966b). Estas hembras realizan hasta seis oviposturas, depositando grupos de ~10 huevos en superficies arenosas o en profundidades que varían entre 10 a 20 cm. (Punzo, 1998).
La distribución de estos arácnidos se asocia preferentemente con ambientes áridos y semiáridos del mundo, como han sido descritos para Arizona y Texas, EE.UU. (Muma, 1966b); Etiopia y Somalia, África (Delle Cave & Simonetta, 1971); Monte, Argentina (Flores et al., 2004) y Nuevo México, EE.UU. (Muma, 1979; Brookhart & Brantley, 2000). En Chile, dichos ambientes se encuentran en el desierto costero transicional (DCT, 25-32° S) que se caracteriza por el predominio de dunas costeras (Paskoff & Manríquez, 2004; Castro & Brignardello, 2005) y por la presencia de una biota particular, en términos de riqueza específica, endemismos y de distribución geográfica restringida (Rundel et al., 1991). El conocimiento de la biodiversidad del DCT se restringe principalmente a la vegetación (Armesto et al., 1993), los vertebrados (Meserve et al., 1995; Marquet et al., 1998; Rau et al., 1998; Holmgren et al., 2001; Palma et al., 2005) y los artrópodos (Pizarro- Araya & Jerez, 2004; Cepeda-Pizarro et al., 2005a, 2005b; Agusto et al., 2006).
En el DCT, el conocimiento de Arachnida se limita a los órdenes Scorpiones (Mattoni, 2002; Ojanguren-Affilastro, 2002, 2003, 2004, 2005; Ochoa, 2005; Mattoni & Acosta, 2006; Agusto et al., 2006; Ojanguren- Affilastro et al., 2007) y Acari (Covarrubias et al., 1964, 1976; Cepeda-Pizarro, 1989; Cepeda-Pizarro et al., 1992a, 1992b, 1996). Sin embargo, existen pocos antecedentes para Pseudoscorpiones (Vitali di Castri, 1965, 1969a, 1969b), Palpigradi (Condé, 1974), Araneae (Zapfe, 1961) y Opiliones (Maury, 1987a) y son casi inexistentes para Solifugae. Sólo Cepeda-Pizarro et al. (2005a) entregan antecedentes ecológicos con respecto a solífugos presentes en el DCT. En tanto, para el territorio nacional, el estudio de Solifugae se caracteriza por aportes taxonómicos (Mello-Leitão, 1936, 1937, 1942; Kraus, 1966; Muma, 1971; Cekalovic, 1975, 1976; Maury, 1980, 1985, 1987b). De acuerdo con éstos, en Chile a la fecha, se registran 14 especies de solífugos pertenecientes a las familias Daesiidae, Ammotrechidae y Mummuciidae.
En Chile, Ammotrechidae agrupa los géneros Sedna Muma, Chileotreca Maury, Procleobis Kraepelin, Pseudocleobis Pocock y Ammotrecha Banks (Mello-Leitão, 1942; Kraus, 1966; Muma, 1971; Cekalovic, 1975; Maury, 1987b); Mummuciidae a Uspallata Mello-Leitão, Mummucina Roewer y Mummucia Simon (Maury, 1984, 1987b) y Daesiidae agrupa los géneros Ammotrechelis Roewer y Syndaesia Maury (Maury, 1980, 1985, 1987b).
Los objetivos del presente trabajo son: 1) documentar a nivel específico la composición taxonómica del orden Solifugae, asociados a un hábitat desértico costero del centro norte de Chile y 2) determinar las variaciones espaciotemporales de su abundancia relativa, definida aquí como «denso-actividad», la cual está determinada por el efecto que tienen algunas variables atmosféricas sobre su actividad y por la presencia de barreras que limitan su libre desplazamiento (Luff, 1975; Niemelä et al., 1992; Southwood, 1994; de los Santos et al., 2000; Cepeda-Pizarro et al., 2005a, 2005b).
MATERIAL Y MÉTODOS
Sitio de estudio. El estudio se realizó en el sector costero de Punta de Choros (29°21'S, 71°10'O) frente a la Reserva Nacional Pingüino de Humboldt, en la comuna de La Higuera, ~114 Km al Norte de La Serena. El área corresponde a una zona desértica costera. El clima es de tendencia mediterránea (di Castri & Hajek, 1976) con presencia de neblina, la temperatura es relativamente baja y una amplitud térmica diaria y anual pequeña debido a la influencia del mar (Armesto et al., 1993). Las precipitaciones son escasas e irregulares, se concentran en invierno (de mayo a agosto) con 29 días de lluvia como promedio y no superan los 90 mm anuales; hay años secos con menos de 25 mm como promedio y años húmedos con más de 175 mm, en ciclos irregulares y aparentemente relacionados con la oscilación meridional del Pacífico Sur (Novoa & Villaseca, 1989). Las características geomorfológicas y biofísicas del área de estudio se encuentran en Castro & Brignardello (2005) y la descripción florística en Armesto et al. (1993).
Metodología y diseño del muestreo de solífugos. Los datos de la composición taxonómica y las variaciones de la densoactividad de la fauna de solífugos, se obtuvieron por medio del uso de trampas de intercepción instaladas en cuatro hábitats pedológicos contrastantes definidos como EC (estepa costera, 29º15'12''S; 71º26'59''O, 17 msnm), DC (duna costera, 29º16'31''S; 71º23'51''O, 18 msnm), HC (humedal costero, 29º18'18''S; 71º21'50''O, 2 msnm) y ECI (estepa costera interior, 29º19'48''S; 71º19'46''O, 23 msnm) (Fig. 1). En cada uno de los hábitats se instalaron dos parcelas de 4 x 5 metros, cada una con 20 trampas de intercepción a intervalos regulares de un metro. Cada trampa estuvo constituida por 2 vasos plásticos dispuestos uno sobre el otro, el vaso interno (7,4 cm de diámetro x 10,2 cm de alto) fue llenado hasta dos tercios de su capacidad con una mezcla de formalina (10%) y agua con detergente doméstico, en una proporción de 3:7 respectivamente. Las trampas operaron durante tres días en los meses de junio, agosto, octubre y noviembre del año 2005.
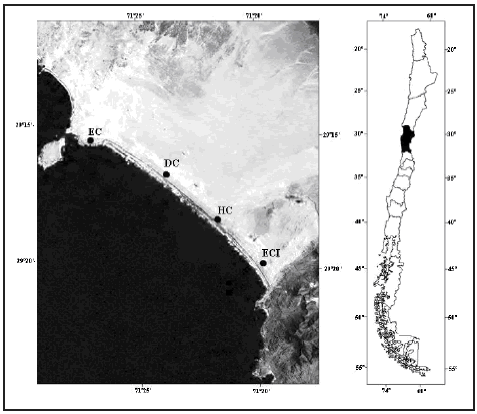
Fig.1. Ubicación geográfica de los cuatro hábitats de estudio: estepa costera (EC: 29º15'12'' S; 71º26'59'' O, 17 msnm), duna costera (DC: 29º16'31'' S; 71º23'51'' O, 18 msnm), humedal costero (HC: 29º18'18'' S; 71º21'50'' O, 2 msnm) y estepa costera interior (ECI: 29º19'48'' S; 71º19'46'' O, 23 msnm), en el desierto costero transicional de Chile.
El material capturado fue retirado, limpiado y conservado en alcohol (80%) hasta el momento de su procesamiento; el material recolectado está depositado en la colección del Laboratorio de Entomología Ecológica de la Universidad de La Serena (LEULS). Para la determinación taxonómica se siguió lo propuesto por Mello-Leitão (1938), Muma (1971), Maury (1977, 1984, 1987b) y El-Hennawy (1990).
RESULTADOS
Diversidad taxonómica del ensamble de Solifugae. Se colectaron 249 individuos, pertenecientes a las familias Daesiidae, Ammotrechidae y Mummuciidae. En total se registraron la presencia de cinco especies: Procleobis sp., Sedna pirata Muma (Ammotrechidae), Mummucia variegata (Gervais) y Mummucia sp. (Mummuciidae) y Ammotrechelis goetschi Roewer (Daesiidae).
En los hábitats esteparios se registró la mayor diversidad específica, en EC se capturaron las cinco especies mientras que en ECI se capturaron cuatro especies, excepto Mummucia sp. En HC se registraron las especies Ammotrechelis goetschi, Mummucia variegata y Mummucia sp. En DC se encontró el menor número de especies, con Ammotrechelis goetschi y Mummucia variegata (Tabla I, Fig. 2).
Tabla I. Relaciones temporales de la solífugofauna presente en cuatro hábitats pedológicos de Punta de Choros (Región de Coquimbo, Chile).
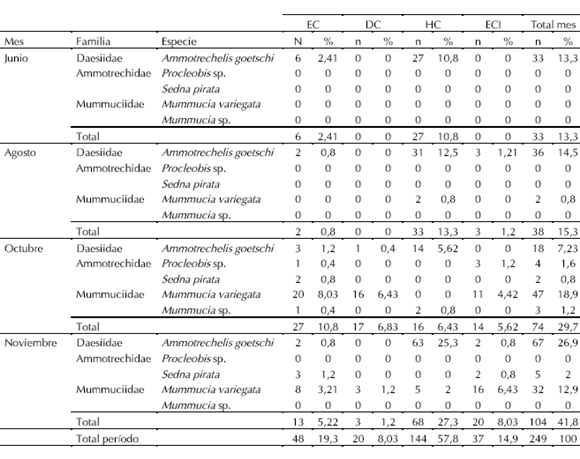

Fig. 2. Distribución espacial de la solífugofauna presente en Punta de Choros (Región de Coquimbo, Chile). El símbolo «+» indica la presencia de la especie.
Denso-actividad del ensamble de Solifugae. Las especies más abundantes fueron Ammotrechelis goetschi y Mummucia variegata, con el 61,85% y 32,53% del total respectivamente. Siendo Mummucia sp. (1,20%), Sedna pirata (2,81%) y Procleobis sp. (1,61%) las especies menos abundantes (Tabla I, Fig.2).
Ammotrechelis goetschi fue la única especie que mostró actividad en los cuatro meses de muestreo, presentó una mayor abundancia en el mes de noviembre (26,91%), mientras que Mummucia variegata tuvo actividad entre agosto a noviembre, pero octubre fue el mes de mayor abundancia (18,88%). Por su parte, Sedna pirata mostró actividad en los meses de octubre y noviembre, siendo este último mes el de mayor abundancia (2,01%); tanto Procleobis sp. como Mummucia sp. se encontraron activas solamente en el mes de octubre, con un aporte del 1,61% y 1,2% respectivamente (Tabla I, Fig. 3). El hábitat en que se registró la mayor abundancia fue el HC con 57,8%, seguido por EC y ECI con 19,3% y 14,9 respectivamente, DC fue el hábitat que presentó la menor abundancia con 8,03% (Tabla I).
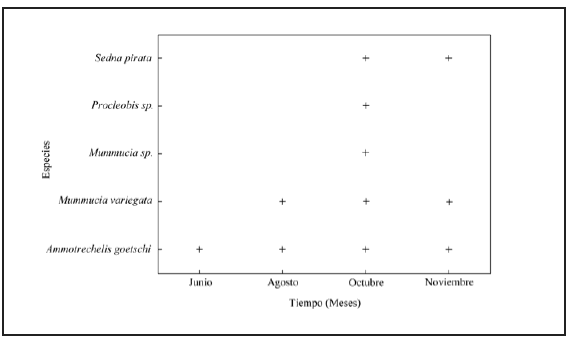
Fig. 3. Fluctuación temporal de la solífugofauna presente en Punta de Choros (Región de Coquimbo, Chile). El símbolo «+» indica la presencia de la especie.
Antecedentes de capturas de artrópodos epígeos en los cuatro hábitats, en los mismos periodos de muestreo (J. Pizarro-Araya, datos no publicados), permiten establecer que Solifugae presentó una marcada diferencia en la fluctuación temporal, con respecto a los restantes artrópodos. Estos últimos presentaron una mayor abundancia en agosto (ca 60%), en cambio Solifugae presentó una mayor cantidad en los meses de octubre (ca 30%), y noviembre (ca 41%) (Tabla I, Fig. 4).

Fig. 4. Comparación de la denso-actividad entre Solifugae y Arthropoda presentes en Punta de Choros (Solifugae no está considerada en Arthropoda).
DISCUSIÓN
Estructura taxonómica del ensamble de Solifugae. La solífugofauna del área de Punta de Choros, estuvo constituida por cinco especies agrupadas en cuatro géneros y tres familias, representando ca 35% de la diversidad total del orden descrito para Chile. Por su parte, el DCT conforma, en términos biogeográficos, una barrera que ha permitido el desarrollo de una biota única en términos de diversidad y endemismo (Rau et al., 1998; Jerez, 2000; Pizarro-Araya & Jerez, 2004; Cepeda-Pizarro et al., 2005a, 2005b) en donde, para tres de las 14 especies de solífugos presentes en Chile, su rango de distribución se encuentra en el DCT; en tanto para seis especies el DCT es parte importante de su rango de distribución (D. Valdivia, datos no publicados), esto posiblemente se debe a la asociación entre el ensamble de artrópodos y las condiciones que ofrece el DCT ya sea en términos de la diversidad en la estructura vegetal y/o por la condiciones edáficas (Cepeda-Pizarro et al., 2005b).
Según Muma (1971) y Maury (1987b), junto con capturas realizadas por uno de nosotros (DEV), el rango distribucional de Ammotrechelis goetschi se registra para el DCT mientras que Sedna pirata extiende su rango distribucional hasta el sector costero de Punta de Choros, antes sólo conocido para el sector Playa Pirata, Quinteros (Región de Valparaíso, Chile); por su parte Mummucia variegata presenta un amplio rango distribucional que se extiende desde el extremo sur de Perú y Bolivia hasta Chile Central.
Por otro lado, Mummucia sp. presentó caracteres de diagnóstico similares a Mummucia patagonica, para la cual el registro en el país corresponde a Rincón Negro en Última Esperanza (Región de Magallanes y La Antártica, Chile). En tanto, para Procleobis sp. aconteció lo mismo con respecto a Procleobis patagonicus Holmerg. Maury (1977) realiza una descripción exhaustiva de P. patagonicus, indicando la posición sistemática y aclarando la relación de dicha entidad con otros géneros; en un posterior trabajo (1987b) entrega la sinonimia con Gaucha atacama Roewer y señala una escasa probabilidad de que P. patagonicus se encuentre en el desierto de Atacama. Por lo anterior, consideramos necesario dejar estos taxones a nivel genérico hasta un posterior análisis.
Distribución de las abundancias relativas del ensamble de Solifugae. Las especies más representativas, en términos de abundancia relativa, correspondieron a Ammotrechelis goetschi y Mummucia variegata, la menos representativa fue Mummucia sp. Los hábitats más favorables para la profusión de solífugos fueron HC y EC. Ammotrechelis goetschi y Mummucia variegata se capturaron en los cuatro hábitats, mientras que Sedna pirata y Procleobis sp. se encontraron en los hábitats esteparios; por su parte Mummucia sp. se capturó en EC y HC.
Ha sido ampliamente documentado, para especies de solífugos norteamericanas, que la presencia de estos arácnidos en una determinada área, depende de factores biológicos como hábitos de excavación, hábito alimentario, factores de aislamiento reproductivo y cópula (Muma, 1966a, 1966b, 1966c, 1966d, 1966e, 1974). Muma (1966e), Martins et al. (2004) y Rocha & Carvalho (2006) señalan la relación entre el tipo de sustrato pedológico (de tipo arenoso) y la micro-distribución de la especie, en donde el sustrato arenoso favorece el desarrollo de factores biológicos como la excavación, cópula e hibernación. Dichos antecedentes concuerdan con lo encontrado en el presente trabajo, siendo el sustrato arenoso el predominante en los cuatro hábitats del área de estudio (Castro & Brignardello, 2005).
Las variaciones en la denso-actividad encontrada en el ensamble de solífugos de Punta Choros fueron similares a lo documentado por Muma (1979, 1980) y Brookhart & Brantley (2000) para el desierto de Nuevo México, Flores et al. (2004) para el desierto del Monte, Martins et al. (2004) para Brasil Cerrado y por Cepeda-Pizarro et al. (2005a) para el DCT. Estas variaciones tienen relación con los meses de menor pluviometría, para el área de estudio se concentra entre los meses de septiembre a abril, además de las peculiaridades fisiológicas del sistema (Polis & McCormick, 1986).
Una adecuada interpretación de las variaciones en abundancia de la solífugofauna depende de una clara comprensión de la dinámica vegetal del sistema (Crawford, 1988; Rogers et al., 1988; Rau et al., 1998; Spotorno et al., 1998; Brookhart & Brentley, 2000) y la relación que presentan en la formación de microhábitat. Xavier & Rocha (2001) describen la relación de un mumucido con la estructura vegetal de Opuntia inamoena, por su parte Martins et al. (2004) y Rocha & Carvalho (2006) señalan la relación positiva entre la abundancia y diversidad vegetal con la abundancia de solífugos. Cuantificaciones realizadas en el área de estudio con respecto a la estructura (vegetacional), muestran una relación similar con los antecedentes arriba señalados y presenta el mismo fenómeno en el comportamiento de solífugos. Dado que el HC presenta la mayor abundancia vegetal, seguido por EC, ECI y DC, esta asociación dependería de la abundancia e interacción entre la presa y el componente vegetal; lo que determinaría la competencia y depredación entre solífugos, arañas y escorpiones (Polis & McCormick, 1986; Flores et al., 2004; Martins et al., 2004), que pueden estar establecidas por el comportamiento tanto diurno como nocturno de los competidores y depredadores (Xavier & Rocha, 2001).
Lo necesario para futuros trabajos es conocer la diversidad de Solifugae, tanto en el desierto costero transicional como para el resto del país, establecer la dinámica de las poblaciones de solífugos, que indiquen cómo se comporta en el ensamble de solífugos con una determinada composición vegetal, su ciclo de vida y la interacción de depredadorpresa.
AGRADECIMIENTOS
Agradecemos a Francisco López (Departamento de Biología, Universidad de La Serena, Chile) por la asistencia en gráficos y a David López Aspe (Centro de Estudios Avanzados en Zonas Áridas (CEAZA), La Serena, Chile) por la asistencia en SIG. A Hisham El-Hennawy (Cairo University, Egypt), Mark S. Harvey (Departament of Terrestrial Invertebrates, Western Australian Museum, Australia) y Mark E. Eberle (Department of Biological Sciences Fort Hays State University, Kansas, USA) por el envío de material bibliográfico. Extendemos nuestros agradecimientos a David Wise (Department of Biological Sciences and Institute for Environmental Science and Policy, University of Illinois at Chicago, USA) y Lincoln Rocha (Instituto Butantan, São Paulo, Brazil) por los valiosos comentarios y sugerencias realizadas al manuscrito. Agradecemos también a los integrantes del proyecto para el estudio en sistemática de solífugos NSF, BSI, Grants 0640219 y 0640245 (del que los autores son colaboradores externos), por su apoyo y por el envío de material bibliográfico. Trabajo financiado por los proyectos FPA-04-007- 2005 (CONAMA, Región de Coquimbo, Chile) y DIULS-PF07101 de la Universidad de La Serena, Chile (JPA).
BIBLIOGRAFÍA CITADA
1. AGUSTO, P., C. I. MATTONI, J. PIZARRO-ARAYA, J. CEPEDA-PIZARRO & F. LÓPEZ-CORTÉS. 2006. Comunidades de escorpiones (Arachnida: Scorpiones) del desierto costero transicional de Chile. Revista Chilena de Historia Natural 79: 407-421.
2. ARMESTO, J. J., P. E. VIDIELLA & J. R. GUTIÉRREZ. 1993. Plant strategies in the Chilean coastal desert. Revista Chilena de Historia Natural 66: 271-282.
3. BROOKHART, J. O. & S. L. BRANTLEY. 2000. Solpugids (Arachnida) of The Sevilleta National Wildlife Refuge, New Mexico. Southwestern Naturalist 45: 443-449.
4. CASTRO, C. & L. BRIGNARDELLO. 2005. Geomorfología aplicada a la ordenación territorial de litorales arenosos. Orientaciones para la protección, usos y aprovechamiento sustentables del sector de Los Choros, Comuna de la Higuera, IV Región. Revista de Geografía Norte Grande (Chile) 33: 33-58.
5. CEKALOVIC, T. 1975. Catálogo sistemático de los Solifugae de Chile (Arachnida). Boletín de la Sociedad de Biología de Concepción (Chile) XLIX: 131-137.
6. CEKALOVIC, T. 1976. Catálogo de los Arachnida: Scorpiones, Pseudoescorpiones, Opiliones, Acari, Araneae y Solifugae de la XII Región de Chile, Magallanes, Incluyendo la Antártica Chilena. Gayana (Chile) 37: 1-108.
7. CEPEDA-PIZARRO, J. 1989. The relationships between abiotic factors and the abundance patterns of soil microarthropods on a desert watershed. Pedobiologia 33: 76-86.
8. CEPEDA-PIZARRO, J. G., J. R. GUTIÉRREZ, L. VALDERRAMA & H. VÁSQUEZ. 1996. Phenology of the edaphic microarthropods in a Chilean coastal desert site and their response to water and nutrient amendments in the soil. Pedobiologia 40: 352-363.
9. CEPEDA-PIZARRO, J. G., M. A. ROJAS, M. B. MALDONADO, J. VILCHES & N. PEREIRA. 1992a. Effect of season, substrate quality, litter quality and soil conditions on edaphic microarthropods in a coastal desert site of north-central Chile. Revista Chilena de Historia Natural 65: 65-74.
10. CEPEDA-PIZARRO, J. G., M. A. ROJAS, M. B. MALDONADO, J. VILCHES & N. PEREIRA. 1992b. A litter-bag study of mite densities (Actinedida and Oribatida) in Atriplex litter and soil of a desert site in northern Chile. Journal of Arid Environments 23: 177- 188.
11. CEPEDA-PIZARRO, J., J. PIZARRO-ARAYA & H. VÁSQUEZ. 2005a. Composición y abundancia de artrópodos epígeos del Parque Nacional Llanos de Challe: impactos del ENOS de 1997 y efectos del hábitat pedológico. Revista Chilena de Historia Natural 78: 635-650.
12. CEPEDA-PIZARRO, J., J. PIZARRO-ARAYA & H. VÁSQUEZ. 2005b. Variación de la abundancia de Arthropoda en un transecto latitudinal del desierto costero transicional de Chile, con énfasis en los tenebriónidos epígeos. Revista Chilena de Historia Natural 78: 651- 663.
13. CONDÉ, B. 1974. Nouveaux Palpigrades du museum de Geneve. Revue suisse de Zoologie 84: 665-674.
14. COVARRUBIAS, R., I. RUBIO & F. DI CASTRI. 1964. Observaciones ecológico-cuantitativas sobre la fauna edáfica de zonas semi-áridas del Norte Chico de Chile. Boletín de Producción Animal Serie A: 1-109.
15. COVARRUBIAS, R., I. RUBIO & F. DI CASTRI. 1976. Densidad edáfica en comunidades naturales e intervenidas del Norte Chico de Chile. Investigaciones Zoológicas Chilenas 14: 15-23.
16. CRAWFORD, C. S. 1988. Surface-active arthropods in a desert landscape: influences of microclimate, vegetation, and soil surface on assemblage structure. Pedobiologia 32: 373-385.
17. DE LOS SANTOS, A., E. J. ALONSO, E. HERNÁNDEZ & A. M. PÉREZ. 2000. Adaptive trends of darkling beetles (Col. Tenebrionidae) on environmental gradients on the island of Tenerife (Canary Islands). Journal of Arid Environments 45: 85-98.
18. DELLE CAVE, L. & A. M. SIMONETTA. 1971. A tentative revision of the Daesiidae (Arachnida, Solifugae) from Ethiopia and Somalia. Monitore Zoologico Italiano, n.s., Supplemento 4: 37-77.
19. DI CASTRI, F. & E. R. HAJEK. 1976. Bioclimatología de Chile. Imprenta-Editorial de la Universidad Católica de Chile. Santiago. 129 pp.
20. EL-HENNAWY, H. K. 1990. Key to solpugid families (Arachnida: Solpugida). Serket 2: 20-27.
21. FLORES, G. E., S. J. LAGOS & S. ROIG-JUÑENT. 2004. Artrópodos epígeos que viven bajo la copa del algarrobo (Prosopis flexuosa) en la Reserva Telteca (Mendoza, Argentina). Multequina 13: 71-90.
22. HARVEY, M. S. 2002. The Neglected cousins: What do we know about the Smaller Arachnid Orders? Journal of Arachnology 30: 357-372.
23. HOLMGREN, M., M. SCHEFFER, E. EZCURRA, J. R. GUTIÉRREZ & G. M. J. MOHREN. 2001. El Niño effects on the dynamics of terrestrial ecosystems. Trends in Ecology and Evolution 16: 89-94.
24. JEREZ, V. 2000. Diversidad y patrones de distribución geográfica de insectos coleópteros en ecosistemas desérticos de la región de Antofagasta, Chile. Revista Chilena de Historia Natural 73: 79-92.
25. KRAUS, O. 1966. Solifugen aus Chile. Senckenbergiana Biologica 47: 181-184.
26. LUFF, M. L. 1975. Some features influencing the efficiency of pitfall traps. Oecologia 19: 345-357.
27. MARQUET, P. A., F. BOZINOVIC, G. A. BRADSHAW, C. CORNELIUS, H. GONZÁLEZ, J. R. GUTIÉRREZ, E. HAJEK, J. A. LAGOS, F. LÓPEZ-CORTÉS, L. NÚÑEZ, E. F. ROSELLO, C. SANTORO, H. SAMANIEGO, V. G. STANDEN, J. C. TORRES-MURA & F. M. JAKSIC. 1998. Los ecosistemas del desierto de Atacama y área andina adyacente en el norte de Chile. Revista Chilena de Historia Natural 71: 593-617.
28. MARTINS, E. G., V. BONATO, G. MACHADO, R. PINTODA- ROCHA & L. S. ROCHA. 2004. Description and ecology of a new species of sun spider (Arachnida: Solifugae) from the Brazilian Cerrado. Journal of Natural History 38: 2361-2375.
29. MATTONI, C. I. 2002. Bothriurus picunche sp. nov., a new scorpion from Chile (Bothriuridae). Studies on Neotropical Fauna and Environment 37: 169-174.
30. MATTONI C. I. & L. E. ACOSTA. 2006. Systematics and distribution of three Bothriurus species (Scorpiones, Bothriuridae) from central and northern Chile. Studies on Neotropical Fauna and Environment 41: 235-250.
31. MAURY, E. A. 1977. Notas sobre la sistemática y distribución geográfica de Procleobis patagonicus (Holmberg, 1876) (Solifugae, Ammotrechidae, Saronominae). Physis, Sección C 36: 283-293.
32. MAURY, E. A. 1980. Presencia de la familia Daesiidae en América del Sur con la descripción de un nuevo género (Solifugae). Journal of Arachnology 8: 59-67.
33. MAURY, E. A. 1984. Las familias de solífugos americanos y su distribución geográfica (Arachnida, Solifugae). Physis, Sección C 42: 73-80.
34. MAURY, E. A. 1985. Nota sobre los géneros Namibesia y Syndaesia (Solifugae, Daesiidae). Aracnología 4: 1- 6.
35. MAURY, E. A. 1987a. Triaenonochidae Sudamericanos. II. El género Diasia Sörensen, 1902 (Opiliones, Laniatores). Physis, Sección C 45: 74-84.
36. MAURY, E. A. 1987b. Consideraciones sobre algunos solífugos de Chile (Solifugae: Ammotrechidae, Daesiidae). Revista de la Sociedad Entomológica Argentina 44: 419-432.
37. MAURY, E. A. 1998. Solifugae. En: J. J. Morrone y S. Coscarón (eds.), Biodiversidad de Artrópodos Argentinos. Una perspectiva biotaxonómica, Ediciones Sur, La Plata, Argentina, pp. 560-568.
38. MELLO-LEITÃO, C. de. 1936. Étude sur les Arachnides de Papudo et Constitución (Chili), Recueillis par le Prof. Dr. Carlos E. Porter. Revista Chilena de Historia Natural 40: 112-129.
39. MELLO-LEITÃO, C. de. 1937. Notes sur quelques solifugues de L'Amérique du Sud. Anais da Academia Brasileira de Ciências 9: 83-87.
40. MELLO-LEITÃO, C. de. 1938. Solífugos de Argentina. Anales del Museo Argentino de Ciencias Naturales Bernardino Rivadavia 40: 1-32.
41. MELLO-LEITÃO, C. de. 1942. Novos solifugos do Chile e do Mexico. Anais da Academia Brasileira de Ciências 14: 305-313.
42. MESERVE, P. L., J. A. YUNGER, J. R. GUTIÉRREZ, L. C. CONTRERAS, W. B. MILSTEAD, B. K. LANG, K. L. CRAMER, S. HERRERA, V. O. LAGOS, S. I. SILVA, E. L. TABILO, M. A. TORREALBA & F. M. JAKSIC. 1995. Heterogeneous responses of small mammals to an El Niño (ENSO) event in nor-central semiarid Chile and the importance of ecological scale. Journal of Mammalogy 76: 580-595.
43. MUMA, M. H. 1966a. Egg deposition and incubation for Eremobates durangonus with notes on the eggs of other species of Eremobatidae (Arachnida: Solpugida). Florida Entomologist 49: 23-31.
44. MUMA, M. H. 1966b. Mating behavior in the solpugid genus Eremobates Banks. Animal Behaviour 14: 346- 350.
45. MUMA, M. H. 1966c. Feeding behaviour of North American Solpugida (Arachnida). Florida Entomologist 49: 199-216.
46. MUMA, M. H. 1966d. The life cycle of Eremobates durangonus (Arachnida: Solpugida). Florida Entomologist 49: 233-242.
47. MUMA, M. H. 1966e. Burrowing habits of North American Solpugida (Arachnida). Psyche 73: 251-260.
48. MUMA, M. H. 1971. The solpugids (Arachnida, Solpugida) of Chile, with descriptions of a new family, new genera, and new species. American Museum Novitates 2476: 1-23.
49. MUMA, M. H. 1974. Maturity and reproductive isolation of common solpugids in North American deserts. Journal of Arachnology 2: 5-10.
50. MUMA, M. H. 1979. Arid-grassland solpugid population variations in Southwestern New Mexico. Florida Entomologist 62: 320-328.
51. MUMA, M. H. 1980. Solpugid (Arachnida) populations in a Creosotebush vs. a mixes plant association. Southwestern Naturalist 2: 129-136.
52. NIEMELÄ, J., J. R. SPENCE & D. H. SPENCE. 1992. Habitat associations and seasonal activity of ground-beetles (Coleoptera, Carabidae) in central Alberta. Canadian Entomology 124: 521-540.
53. NOVOA, R. & S. VILLASECA. 1989. (eds.) Mapa agroclimático de Chile. Instituto de Investigaciones Agropecuarias, Santiago 126 pp.
54. OCHOA, J. A. 2005. Patrones de distribución de escorpiones de la región andina en el sur peruano. Revista Peruana de Biología 12: 49-68.
55. OJANGUREN-AFFILASTRO, A. A. 2002. Nuevos aportes al conocimiento del género Brachistosternus en Chile, con la descripción de dos nuevas especies (Scorpiones, Bothriuridae). Boletín de la Sociedad de Biología de Concepción (Chile) 73: 37-46.
56. OJANGUREN-AFFILASTRO, A. A. 2003. Un nuevo Orobothriurus (Scorpiones, Bothriuridae) de la región de Atacama, Chile. Revista Ibérica de Aracnología 7: 117-122.
57. OJANGUREN-AFFILASTRO, A. A. 2004. Un nuevo Brachistosternus Pocock, 1893 del norte de Chile (Scorpiones, Bothriuridae). Revista Ibérica de Aracnología 10: 69-74.
58. OJANGUREN-AFFILASTRO, A. A. 2005. Notes on the genus Brachistosternus (Scorpiones, Bothriuridae) in Chile, with the description of two new species. Journal of Arachnology 33: 175-192.
59. OJANGUREN-AFFILASTRO, A. A., C. I. MATTONI & L. PRENDINI. 2007. The genus Brachistosternus (Scorpiones: Bothriuridae) in Chile, with descriptions of two new species. American Museum Novitates 3564: 1-44.
60. PALMA, R. E., P. A. MARQUET & D. BORIC-BARGETTO. 2005. Inter and intraspecific phylogeography of small mammals in the Atacama desert and adjacent areas of northern Chile. Journal of Biogeography 32: 1931- 1941.
61. PASKOFF, R. & H. MANRÍQUEZ. 2004. Las dunas de las costas de Chile. Ediciones Instituto Geográfico Militar. Santiago, Chile. 112 pp.
62. PIZARRO-ARAYA, J. & V. JEREZ. 2004. Distribución geográfica del género Gyriosomus Guérin-Méneville, 1834 (Coleoptera: Tenebrionidae): una aproximación biogeográfica. Revista Chilena de Historia Natural 77: 491-500.
63. POLIS, G. A. & S. J. McCORMICK. 1986. Scorpions, spiders and solpugids: predation and competition among distantly related taxa. Oecologia 71: 111-116.
64. PUNZO, F. 1998. The biology of camel-spiders (Arachnida, Solifugae). Kluwer Academic Publishers, Norwell, Massachussets, 301 pp.
65. PUNZO, F. 2000. Desert arthropods: life history variations. Springer, Heidelberg, 308 pp.
66. RAU, J. R., C. ZULETA, A. GANTZ, F. SAIZ, A. CORTES, L. YATES, A. E. SPOTORNO & E. COUVE. 1998. Biodiversidad de artrópodos y vertebrados terrestres del norte grande de Chile. Revista Chilena de Historia Natural 71: 527-554.
67. ROCHA, L. S. & M. C. CARVALHO. 2006. Description and ecology of a new solifuge from Brazilian amazonia (Arachnida, Solifugae, Mummuciidae). Journal of Arachnology 34: 163-169.
68. ROGERS, L. E., N. E. WOODLEY, J. K. SHELDON & P. A. BEEDLOW. 1988. Diets of darkling beetles (Coleoptera: Tenebrionidae) within a shrub-steppe ecosystem. Annals of the Entomological Society of America 81: 782-791.
69. RUNDEL, P. W., M. O. DILLION, B. PALMA, H. A. MOONEY, S. L. GULMON & J. R. EHLERINGER. 1991. The phytogeography and ecology of the coastal Atacama and Peruvian deserts. Aliso 13: 1-49.
70. SOUTHWOOD, T. R. E. 1994. Ecological methods: with particular refence to the study of insect populations. Chapman & Hall, London, United Kingdom.
71. SPOTORNO, A. E., C. ZULETA, A. GANTZ, F. SÁIZ, J. RAU, M. ROSENMANN, A. CORTES, G. RUIZ, L. YATES, E. COUVE & J. C. MARIN. 1998. Sistemática y adaptación de mamíferos, aves e insectos fitófagos de la Región de Antofagasta, Chile. Revista Chilena de Historia Natural 71: 501-526.
72. VITALI DI CASTRI, V. 1965. Cheiridium danconai n. sp. (Pseudoscorpionida) con consideraciones sobre su desarrollo postembrionario. Investigaciones Zoológicas Chilenas 12: 67-92.
73. VITALI DI CASTRI, V. 1969a. Tercera nota sobre los Cheridiidae de Chile (Pseudoscorpionida) con descripción de Apocheiridium (Chiliocheiridium) serenense n. subgen. n. sp. Boletín de la Sociedad de Biología de Concepción (Chile) 41: 265-280.
74. VITALI DI CASTRI, V. 1969b. Remarques sur la Familie des Menthidae (Arachnida, Pseudoscorpionida) a propos de la presence au Chili d´une nouvelle espece, Oligomenthus chilensis. Bulletin du Muséum National d'Histoire Naturelle, Paris 41: 498-506.
75. XAVIER, E. & L. S. ROCHA. 2001. Autoecology and description of Mummucia mauryi (Solifugae, Mummuciidae), a new solifuge from Brazilian semiarid caatinga. Journal of Aracnology 29: 127-134.
76. ZAPFE, H. 1961. Biogeografía de las arañas en Chile. Investigaciones Zoológicas Chilenas 7: 133-136. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Recibido: 17-03-2007;
Aceptado: 12-07-2007














