Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de la Sociedad Entomológica Argentina
versión impresa ISSN 0373-5680versión On-line ISSN 1851-7471
Rev. Soc. Entomol. Argent. v.68 n.1-2 Mendoza ene./jun. 2009
Método de diagnóstico para el monitoreo de resistencia a insecticidas en poblaciones de "picudo del algodonero", Anthonomus grandis (Coleoptera: Curculionidae)
A diagnostic test for insecticide resistance monitoring in "cotton boll weevil" Anthonomus grandis (Coleoptera: Curculionidae) populations
Stadler, Teodoro
Laboratorio de Toxicología Ambiental, Instituto de Medicina y Biología Experimental de Cuyo (IMBECU), Centro Regional de Investigaciones Científcas y Tecnológicas (CRICYT -CONICET), CC. 131, M5500 IRA, Mendoza, Argentina; e-mail: lpe@mendoza-conicet.gov.ar
RESUMEN. El control de las poblaciones de Anthonomus grandis Boheman, por debajo de su umbral de daño económico durante el ciclo del cultivo del algodón, se realiza en forma efectiva hasta el momento, a través de insecticidas de síntesis. La presión selectiva de las aplicaciones extensivas e intensivas de insecticidas hace imperativa la detección temprana de focos de resistencia a los mismos, en función de un correcto manejo del fenómeno. Se desarrolló un método de diagnóstico de resistencia para A. grandis a partir de la técnica "vial test", que fue adaptada en forma de "kit" para el monitoreo rápido y sencillo de los focos de resistencia en el campo. La toxicidad (CL99), para calcular la concentración discriminante (CD) del insecticida y la preparación del "kit", se obtiene a partir de bioensayos de laboratorio con una cepa normal susceptible de A. grandis. Se determinó la vida media de los insecticidas dentro de los viales por CIPAC MT 46, para establecer una fecha de vencimiento del "kit". La CD y el método en su conjunto fueron validados a través de ensayos a campo. El "kit", usado en el monitoreo de resistencia en el campo, fue especialmente diseñado para ser utilizado en las condiciones geográficas, económicas y socio-culturales presentes en la región algodonera argentina. La implementación de esta técnica permitirá conseguir la información necesaria, y así obtener una apropiada alternancia de insecticidas. Como consecuencia, se prevé una reducción de impacto ambiental de las prácticas agronómicas en el control de plagas en algodón.
PALABRAS CLAVE. Monitoreo de resistencia; Picudo del algodonero; Manejo integrado de plagas.
ABSTRACT. The in-season control of the cotton boll weevil Anthonomus grandis Boheman is done by insecticide application, which so far is the only effective way to reduce boll weevil populations to levels below economic significance. The extensive and intensive control actions with insecticides cause selective pressure on pest populations. Thus, to achieve an accurate insecticide resistance management of boll weevil, the assessment of changes in the susceptibility to chemicals of A. grandis populations is required. A field method for insecticide resistance diagnosis in cotton boll weevil was developed which is based on the principle of the "vial-test". The method was adapted to a kit that provides a fast, simple and reliable tool that allows a direct pre-assessment of early insecticide resistance outbreaks in A. grandis field populations. The toxicity (LC99) data to calculate the discriminating concentration of the insecticide to be used for the preparation of the kit was assessed by laboratory toxicity screening on normal susceptible adult A. grandis. To establish the expiration date for the kit, the half-life of the pesticide inside the vials was assessed by CIPAC MT 46. The DC for the two pesticides as well as the whole method was validated in field trials. The insecticide resistance field test kit was shown as a valuable tool to be used directly at the local geographical, economical and socio-cultural circumstances of the Argentine cotton growing area. Early resistance diagnosis on cotton boll weevil populations allows proper pesticide alternation, leading to a subsequent lower environmental impact of agronomic practices for the control of insect pests in cotton.
KEY WORDS. Pesticide resistance monitoring; Cotton boll weevil; Integrated Pest Management.
Recibido: 11-03-2009;
Aceptado: 14-05-2009
Las poblaciones de Anthonomus grandis Boheman son deficientemente controladas a través de sus enemigos naturales, de modo que el control químico es, por el momento, la herramienta más efectiva contra esta plaga (Stadler & McKibben, 1997; Stadler, 1996). Sin embargo, diferentes autores han señalado que la aplicación intensiva y extensiva de insecticidas, en la lucha contra A. grandis en EEUU, provocó un rápido desarrollo de resistencia, que fue relevada tempranamente en ese país (Roussel & Clower, 1957; Graves et al., 1967).
Para identificar las causas de los fenómenos de resistencia, se requiere el estudio de los mecanismos bioquímicos que la confieren, así como del grado de selección de los mismos. En cambio, para determinar los cambios en la susceptibilidad a un principio activo, basta con someter un grupo representativo de una población de la plaga a bioensayos toxicológicos (Robertson & Preisler, 1992). Sobre la base de esta información, los factores operacionales tales como tipo de insecticida, dosis y modo de aplicación, pueden seleccionarse para conformar una estrategia que permita retrasar el desarrollo de la resistencia, y prolongar la vida útil de los insecticidas en uso. Por estos motivos, el monitoreo de resistencia a insecticidas es una eficaz herramienta para detectar a tiempo la aparición de focos donde se presenta este fenómeno, evitando el fracaso de las medidas de control y los inconvenientes asociados (Frisbie et al., 1989).
El objetivo del presente trabajo es describir en forma detallada una nueva tecnología para el diagnóstico en el campo, de los focos de resistencia a insecticidas en poblaciones de A. grandis (Stadler et al., 2008) para que la misma pueda ser transcrita y aplicada por investigadores y extensionistas, en función de optimizar la eficiencia de las campañas de control de esta plaga tan destructiva. Esta nueva tecnología puede ser aplicada en el campo y en el marco de las condiciones geográficas, económicas y socio-culturales de la región algodonera argentina. El "kit" de monitoreo de resistencia representa un avance en las prácticas de control de la plaga, ya que permite optimizar las estrategias de manejo, a través de la alternancia de productos y la reducción del impacto ambiental como consecuencia del uso racional de agroquímicos.
Fundamento del método de diagnóstico de resistencia
El método se basa en la "técnica del vial" (Kanga & Plapp, 1992), que consiste en exponer los insectos adultos recolectados en el campo a una concentración discriminante (CD) del insecticida a evaluar y aplicada en las paredes internas de viales de vidrio boro-silicato (Fig. 1; Stadler et al., 2008). La concentración discriminante se calcula a partir del valor de la concentración letal 99 [CD se define como el doble de la CL99 (Robertson & Preisler, 1992)]. Finalmente, el diagnóstico de la resistencia se realiza a partir del porcentaje de mortalidad de los insectos expuestos al insecticida.
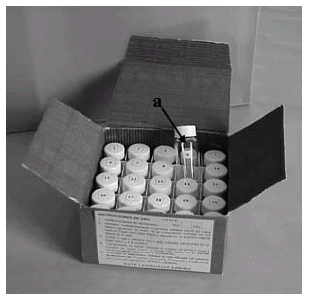
Fig. 1. "Kit" para el diagnóstico en el campo de la resistencia a insecticidas. a, viales de vidrio borosilicato (Stadler et al., 2008).
Materiales para el desarrollo del método de diagnóstico de resistencia a insecticidas
Trampa para la recolección de insectos adultos: La trampa Scout modificada (Fig. 2 [Stadler et al., 2008]) se utiliza para capturar el número de insectos suficiente para el ensayo (≥ 100) y asegurar su supervivencia por, al menos, 24 horas hasta su incorporación al "kit". Las modificaciones introducidas en la trampa Scout comprenden la incorporación de un recipiente de polietileno de 9 cm de alto por 8 cm de diámetro (Fig. 2 a) que contiene la feromona, y un aro de esponja sintética embebida en agua (Fig. 2 b) para evitar la deshidratación de los insectos.

Fig. 2. Trampa Scout modificada para la captura de Anthonomus grandis. a, recipiente de polietileno; b, esponja (Stadler et al., 2008).
Dispositivo para la impregnación de viales con insecticida: Este dispositivo fue diseñado para revestir las paredes internas de viales de vidrio boro-silicato, de 20ml de capacidad, con una película uniforme del insecticida (Fig. 3; Stadler et al., 2008). Consta de un marco metálico y cinco rodillos torneados que forman canales (Fig. 3 a), donde se depositan 16 viales (Fig. 3 b). Los rodillos giran siete vueltas por minuto y son movidos sincrónicamente por un motor eléctrico con reductor de velocidad. A ambos lados de los rodillos, se encuentran dos niveles que permiten asegurar la horizontalidad del sistema (Fig. 3 c) y garantizar así, la uniformidad de la película de insecticida que se deposita sobre las paredes internas de los viales. El dispositivo sobre el cual rotan los viales (Fig. 3) opera dentro de una estufa (Fig. 4a), donde se acelera el proceso de evaporación del solvente de la solución insecticida que está en los viales, mientras se impregnan uniformemente las paredes internas de los mismos. La estufa consiste en un cubo con paredes de acrílico transparente (Fig. 4 b) y un sistema de calefacción, que permite mantener la temperatura a 30 ± 2ºC durante el proceso de secado. La circulación del aire dentro de la estufa es continua y forzada a través de un sistema de ventilación (Fig. 3 d, c).

Fig. 3. Detalle de los rodillos del dispositivo para la impregnación de los viales con el insecticida. a, canal para ubicar el vial; b, vial ; c, nivel para asegurar la posición de los rodillos (Stadler et al., 2008).

Fig. 4. Equipo para impregnación de los viales impregnados que componen el "kit". a, dispositivo para la impregnación de los viales; b, estufa; c, salida de vapores del solvente; d, entrada de aire caliente (30°C); e, termostato; f, sensor del termostato (Stadler et al., 2008).
Kit para el diagnóstico de resistencia a insecticidas: La función del "kit" de diagnóstico es exponer los insectos al insecticida, para el cual se desean monitorear los cambios en la susceptibilidad. El "kit" de diagnóstico (Fig. 1) consiste en una caja de cartón corrugado (14,5 x 14,5 x 8,5 cm) con tapa y divisiones internas, tiene 25 viales de vidrio boro-silicato con cierre hermético, 20 de ellos contienen la concentración discriminante del insecticida [pseudo-réplicas] y los cinco restantes son testigos. Los valores de toxicidad (CL99), para calcular la concentración discriminante (CD) de insecticidas para la preparación del "kit", se obtienen a partir de bioensayos de laboratorio por el método del film (contacto tarsal) dentro de los mismos viales.
A los lados de la caja del "kit" se encuentran las instrucciones para su uso (Tabla I), las recomendaciones y advertencias (Tabla II) y un modelo, a modo de ejemplo, para realizar el diagnóstico del ensayo (Tabla III; Stadler et al., 2008).
Tabla I. Instrucciones. Información que se encuentra en uno de los lados de la caja del "kit" de monitoreo (Stadler et al., 2008).

Tabla II. Recomendaciones y advertencias. Información que se encuentra en uno de los lados de la caja del "kit" de monitoreo (Stadler et al., 2008).

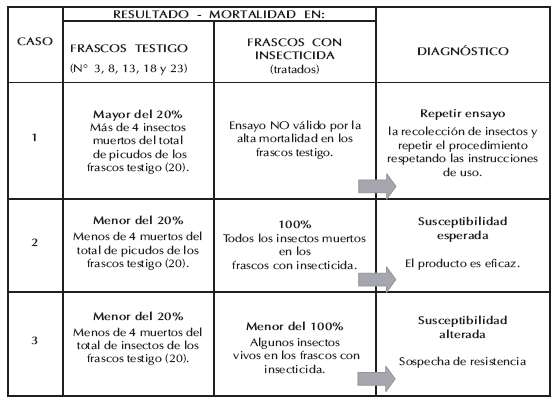
Tabla III. Guía para realizar el diagnóstico de resistencia con los tres resultados posibles del monitoreo. Información que se encuentra en uno de los lados de la caja del "kit" de monitoreo (Stadler et al., 2008).
Planilla de datos y resultados que acompañan al kit: La planilla que acompaña al "kit" consiste en un formulario con casilleros, en la que se volcará la información complementaria y los resultados del ensayo (número de insectos vivos y muertos) a las 24 horas de iniciado el mismo (Tabla 4; Stadler et al., 2008).
Tabla IV. Planilla con información complementaria y resultados del monitoreo. (1) cálculo del porcentaje de mortalidad en los frascos control; (2) cálculo del porcentaje de mortalidad en los frascos tratados (Stadler et al., 2008).

Preparación de los viales para el armado del kit
1.- Establecer el tipo de insecticida a utilizar para el control de A. grandis, sobre la base de estudios previos de eficacia (Stadler & McKibben, 1997; Mulrooney, 2002) en el marco del programa de manejo de plagas establecido para cada región.
2.- Determinar la CL99 por el método del film, dentro de viales de vidrio boro-silicato de 20mL para el insecticida seleccionado (ver punto 1), sobre la base de una muestra representativa de insectos provenientes de diferentes localidades de la zona a monitorear (Zerba et al, 1999, 2001).
3.- Calcular la CD (Robertson & Preisler, 1992).
4.- Enjuagar 3 veces los 25 viales de vidrio boro-silicato de 20mL, con 5mL de acetona y dejar evaporar completamente. Rotular con números los viales y tapas respectivas.
5.- Preparar una solución del insecticida, utilizando un solvente adecuado (éter, acetona, etc.) en una concentración tal, que cada 0,3mL de la solución contenga la dosis discriminante calculada (ver punto 3; Zerba et al, 1999, 2001). Ejemplo: Si la dosis discriminante para la cipermetrina es de 58,2 µg/vial, deben prepararse 10mL de una solución que contenga 1,94 mg de insecticida.
6.- Colocar 20 viales limpios y secos (ver punto 4) sobre el dispositivo para impregnación (Fig. 3) y colocar dentro de cada uno, 0,3mL de la solución insecticida (ver punto 5) previamente preparada. Ejemplo: 58,2 µg de cipermetrina en 0,3mL de solución/vial [viales tratados].
7.- Completar el proceso de secado y formación de la película de insecticida en la estufa (Fig. 4).
8.- Colocar 5 viales limpios y secos sobre el dispositivo para impregnación y colocar dentro de cada uno, 0,3mL del solvente [viales control].
9.- Completar el proceso de secado en la estufa (Fig. 4).
10.- Colocar los 25 viales en la caja del "kit (Fig. 1), cerrar y conservar en lugar fresco y al abrigo de la luz.
Procedimiento para el monitoreo de resistencia
I.- Colocar trampas Scout modificadas en la zona a muestrear, en número suficiente para obtener muestras representativas. En función de la extensión del área a registra y del número de muestras disponibles es posible utilizar varios "kit" para la distintas zonas en una región. En caso de disponer de un número relevante de trampas, pero de pocos insectos en cada una, pueden agruparse los insectos en un pool y extraerlos al azar para completar los frascos.
II.- Luego de un período de captura de 24 hs recoger las trampas y colocar los insecto dentro de los viales de un "kit", de acuerd al criterio expuesto (ver punto I). De lo insectos capturados, se introduce u mínimo de 4 a un máximo de 10 insecto por vial (según disponibilidad) hast completar los 25 viales que componen e "kit" (Fig. 1).
III.- Colocar el "kit" en un sitio resguardado al abrigo de la luz.
IV.- Evaluar mortalidad luego de 24 horas de exposición, anotar los valores en la planilla "ad hoc" (Tabla IV) y completar la misma con la información complementaria.
V.- Realizar el diagnóstico en base al ejemplo (Tabla III). Cuando la mortalidad en los frascos tratados resulta menor del 100%, es recomendable repetir el test antes de alternar el insecticida.
VI.- Incorporar la información contenida en la planilla (Tabla IV) a un sistema de información geográfica (Ravelo et al., 2001).
Validación del kit de monitoreo de resistencia a insecticidas para A. grandis
Para establecer la fecha de caducidad del "kit", Zerba et al. (1999, 2001) determinaron la vida media de los insecticidas dentro de los viales sobre la base de CIPAC MT 46 y del análisis por cromatografía de gases; se fija la fecha de vencimiento del "kit" a los doce meses de la fecha de preparación. Las CD para malatión y cipermetrina, así como el empleo del "kit" y el método de monitoreo en su conjunto, fueron validados por Zerba et al. (1999, 2001) a través de ensayos en los campos experimentales del Instituto Agronómico Paraná-IAPAR (Londrina-Brasil), en el Centro Nacional de Pesquisa de Recursos Genéticos y Biotecnología EMBRAPA - CENARGEN (Brasilia-Brasil) y en el Instituto Agronómico Nacional-IAN del Ministerio de Agricultura y Ganadería (Caacupé-Paraguay).
Consideraciones finales
Los insecticidas son una pieza clave en los programas de manejo integrado de plagas (MIP). Sin embargo, a partir del auge de los insecticidas órgano-clorados en los años '40, un promedio de una clase de insecticida cada diez años se ha perdido, a causa del fenómeno de resistencia. Por este motivo, un componente principal del MIP es el manejo de la resistencia a insecticidas (MRI), cuya función es prevenir el desarrollo de la misma a métodos específicos de control de plagas, tales como los productos fitosanitarios.
El método de diagnóstico de resistencia en el campo, que se describe en este trabajo, puede ser inmediatamente incorporado en un programa de control de A. grandis, ya que es compatible con las prácticas de MIP en el cultivo del algodón. Los resultados obtenidos, a las 24 horas de aplicado este método, permiten diagnosticar "in situ" y sin necesidad de estudios bioquímicos de laboratorio, posibles focos de resistencia y, de ser necesario, identificar un insecticida alternativo y proponer la técnica de control apropiada.
Incorporando las modificaciones pertinentes a nivel de muestreo, tipo de sustancia y CD, el uso de este método de diagnóstico puede hacerse extensivo al monitoreo de resistencia a insecticidas químicos y/o biológicos, en poblaciones de diferentes especies de insectos plaga de la agricultura, así como también de parásitos y vectores de enfermedades humanas y animales. El "kit" es aplicable en todos aquellos casos en los que la detección temprana de la resistencia a insecticidas resulte una alternativa viable para evitar fracasos en campañas de control de plagas y representa, además, una contribución significativa a la reducción de los riesgos derivados del uso de pesticidas para el hombre y el ambiente.
AGRADECIMIENTOS
El autor agradece a la Lic. María Inés Zerba y a la Ing. Agr. Dolores Martínez Gines por su intensa y profesional participación en el proceso de validación y optimización de este importante desarrollo tecnológico para el control de una plaga clave, que pone en riesgo la economía de la región algodonera argentina. Agradezco también la colaboración del Instituto Agronómico Paraná-IAPAR (Londrina-Brasil), del Centro Nacional de Pesquisa de Recursos Genéticos y Biotecnología (EMBRAPA-CENARGEN, Brasilia-Brasil) y del Instituto Agronómico Nacional-IAN del Ministerio de Agricultura y Ganadería (Caacupé-Paraguay) por poner a disposición de este proyecto sus instalaciones y campos experimentales. Este trabajo fue financiado por el Common Fund for Commodities a través del "Project on Integrated Pest Management of the Cotton Boll Weevil in Argentina, Brazil and Paraguay CFC/ICAC/04".
BIBLIOGRAFÍA CITADA
1. CIPAC. 1995. MT 46 Accelerated storage procedure. En: Dobrat, W. & A. Martijn (eds.) CIPAC Handbook Physio-chemical Methods for Technical Formulated Pesticides: 148-152. [ Links ]
2. FRISBIE, R. E., K. EL ZIK, & L.T. WILSON. 1989. Integrated Pest Management systems and cotton production. Wiley, New York, 437 pp. [ Links ]
3. GRAVES, J. B., J. S. ROUSSEL, J. GIBBENS & D. PATTON. 1967. Laboratory Studies on the Development of Resistance and Cross-Resistance in the Boll Weevil. J. Econ. Entomol. 60: 47-50. [ Links ]
4. KANGA, L. H. B. & F. W. PLAPP Jr. 1992. Development of a glass vial technique for monitoring resistance to organophosphate and carbamate insecticides in the tobacco budworm and the boll weevil. En: Proc. Beltwide Cotton Prod. and Res. Conf., National Cotton Council, Memphis, TN, pp 731-734. [ Links ]
5. MULROONEY, J. E. 2002. Efficacy of fipronil aerially applied in oil adjuvants and drift retardants against boll weevils, Anthonomus grandis Boheman (Coleoptera:Curculionidae) Southw. Entomologist 27(2): 201-208. [ Links ]
6. ROBERTSON, J. L. & H. K. PREISLER. 1992. Pesticide Bioassays with Arthropods. CRC Press. Boca Raton, FL, 127pp. [ Links ]
7. RAVELO, A. C., M. GRILLI & J. A. SANTA. 2001. Monitoreo del picudo del algodonero mediante utilización de información satelital y terrestre. En: Proceedings of the Cotton in the Southern Cone - Project on Integrated Pest Management of the Cotton Boll Weevil in Argentina, Brazil and Paraguay CFC/ICAC/04, PART 1, 26-28 Fortaleza, Brazil, pp. 215-224. [ Links ]
8. ROUSSEL, J. S. & D. F. CLOWER. 1957. Resistance to Chlorinated Hydrocarbon Insecticides in the Boll Weevil. J. Econ. Entomol. 50: 462-468. [ Links ]
9. STADLER, T. 1996. Susceptibilidad a Insecticidas y Fenómenos de Resistencia a Insecticidas en Poblaciones de Anthonomus grandis. En: Proceedings Integrated Pest Management of the Cotton Boll Weevil in Argentina, Brazil and Paraguay, Londrina-Brasil, pp. 153-162. [ Links ]
10. STADLER, T. & G. H. McKIBBEN. 1997. Dose-mortality response of the cotton boll weevil Anthonomus grandis Boheman, 1843 (Coleoptera: Curculionidae) to selected insecticides. Arthropod Management Tests 22: 416. [ Links ]
11. STADLER, T. & M. BUTELER. 2007. Migration and dispersal of Anthonomus grandis (Coleoptera: Curculionidae) in South America. Rev. Soc. Entomol. Argent. 66 (3-4): 205-217. [ Links ]
12. STADLER, T., M. I. ZERBA & D. MARTÍNEZ GINES. 2008. Método para el diagnóstico a campo de resistencia a insecticidas químicos y biológicos en poblaciones de insectos plaga de la agricultura y parásitos o vectores de enfermedades humanas y animales. Patente de INVENCIÓN, MOSP: P19990106270/1999; INPI. Res N° AR025279B1/2008; Titular CONICET. [ Links ]
13. ZERBA, M. I., D. MARTÍNEZ GINES & T. STADLER. 1999. Development of a protocol for pesticide resistance monitoring on Anthonomus grandis". En: Proceedings of the Cotton in the Southern Cone - Project on Integrated Pest Management of the Cotton Boll Weevil in Argentina, Brazil and Paraguay CFC/ICAC/04, PART 1, 26-28 Fortaleza, Brazil, 2001, pp. 159-163. [ Links ]
14. ZERBA, M. I., D. MARTÍNEZ GINES & T. STADLER. 2001. Nuevo método de diagnóstico a campo de resistencia a insecticidas para el picudo del algodonero (Anthonomus grandis). En: Proceedings of the Cotton in the Southern Cone - Project on Integrated Pest Management of the Cotton Boll Weevil in Argentina, Brazil and Paraguay CFC/ICAC/04, PART 1, 26-28 Fortaleza, Brazil, pp. 249-256. [ Links ]














