Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de la Sociedad Entomológica Argentina
versión On-line ISSN 1851-7471
Rev. Soc. Entomol. Argent. vol.69 no.1-2 Mendoza ene./jun. 2010
TRABAJOS CIENTÍFICOS
Biología de Eretmocerus mundus (Hymenoptera: Aphelinidae), parasitoide del complejo Bemisia tabaci (Homoptera: Aleyrodidae), en condiciones de laboratorio
Biology of Eretmocerus mundus (Hymenoptera: Aphelinidae), parasitoid of Bemisia tabaci complex (Homoptera: Aleyrodidae) under laboratory conditions
Chacón Castro, Yerlin y Silvia N. López
Insectario de Investigaciones para Lucha Biológica, Instituto de Microbiología y Zoología Agrícola (IMYZA), Instituto Nacional de Tecnología Agropecuaria (INTA). C.C.25 (1712) Castelar, Buenos Aires, Argentina; e-mail: snlopez@cnia.inta.gov.ar
ABSTRACT: The estimation of biological attributes of natural enemies prior to its use in the field is an important tool in a biological control program. The objective of the present paper was to evaluate the main biological parameters of Eretmocerus mundus Mercet, a parasitoid of Bemisia tabaci (Gennadius), under controlled laboratory conditions. Parasitoid survival, female longevity, fecundity, sex rate, intrinsic rate of natural increase (rm), net reproductive rate (Ro) and generational time (T) were studied using life tables, with pepper (Capsicum annuum L.) and tomato (Solanum lycopersicum L.) as host plants. Results obtained on pepper and tomato, respectively, were: pupal survival: 86.86 ± 1.94 and 83,45 ± 2,13%; female longevity: 18,19 ± 1,61 and 17,00 ± 0,92 days; sex rate: 0,34 ± 0,06 and 0,47 ± 0,05 female/(male + female); lx50: 21 and 18 days; rm: 0,226 ± 0,061 and 0,228 ± 0,057 parasitized nymphs/female/day; Ro: 189,71 ± 24,25 and 154,65 ± 17,58 parasitized nymphs/female; T: 25,88 ± 0,42 and 24,03 ± 0,34 days. Results lead to a better understanding of the local population of this parasitoid and its potential role as a biological control agent of B. tabaci.
KEY WORDS: Eretmocerus mundus; Bemisia tabaci; Capsicum annuum; Solanum lycopersicum; Biological control.
RESUMEN: La estimación de los atributos biológicos de un enemigo natural, previa a su empleo en el campo, constituye un aspecto de importancia en todo proyecto de control biológico. El objetivo de este trabajo fue evaluar los principales parámetros biológicos de Eretmocerus mundus Mercet, parasitoide de Bemisia tabaci (Gennadius), bajo condiciones de laboratorio.La emergencia del adulto, longevidad y fecundidad de la hembra, proporción sexual de la descendencia, tasa intrínseca de crecimiento poblacional (rm), tasa neta de reproducción (Ro) y tiempo generacional (T); se estimaron mediante la técnica de tabla de vida y fecundidad, utilizando el pimiento (Capsicum annuum L.) y el tomate (Solanum lycopersicum L.) como plantas hospederas. Los resultados obtenidos en pimiento y tomate fueron respectivamente: supervivencia pupal: 86.86 ± 1.94 y 83,45 ± 2,13%; longevidad de la hembra: 18,19 ± 1,61 y 17,00 ± 0,92 días; proporción sexual: 0,34 ± 0,06 y 0,47 ± 0,05 hembras/(machos + hembras); lx50: 21 y 18 días; rm: 0,226 ± 0,061 y 0,228 ± 0,057 ninfas parasitadas/hembra/día; Ro: 189,71 ± 24,25 y 154,65 ± 17,58 ninfas parasitadas/hembra; T: 25,88 ± 0,42 y 24,03 ± 0,34 días. Los resultados obtenidos son una contribución al conocimiento de la población local del parasitoide y su posible papel como agente de control biológico de B. tabaci.
PALABRAS CLAVE: Eretmocerus mundus; Bemisia tabaci; Capsicum annuum; Solanum lycopersicum; Control biológico.
Recibido: 23-XII-2009;
Aceptado: 17-III-2010
INTRODUCCIÓN
El complejo de biotipos Bemisia tabaci (Gennadius) es una plaga que afecta la mayoría de los cultivos hortícolas de muchas regiones productoras del mundo (Evans, 2008). Este insecto provoca daños directos mediante la succión de savia e indirectos a través de la excreción del exceso de hidratos de carbono, donde se desarrollan hongos que producen fumagina, causante de la disminución de la capacidad fotosintética de la planta afectada (Byrne et al., 1990). Además, es un importante vector de enfermedades virales (Cohen, 1990; Brown & Bird, 1992; Torres et al., 1996). Esta mosca blanca es un insecto polífago con más de 500 plantas hospederas, entre los que se incluyen cultivos anuales, ornamentales, industriales, frutales y malezas (Byrne et al., 1990; Brown et al., 1995; Evans, 2008). En la Argentina, esta especie ha sido hallada en diversas zonas de producción atacando cultivos de soja, algodón y tabaco. Desde el 2001, se ha convertido en una de las principales plagas de cultivos hortícolas en todo el país; se destaca la presencia del biotipo B, el cual es capaz de producir severos daños económicos por transmisión de virosis (Truol et al., 2005).
Si bien históricamente el control de B. tabaci se ha basado en el uso de agroquímicos, en los últimos años, en muchos países se han desarrollado programas de control biológico mediante el uso de algunas especies del género Eretmocerus Haldeman (Rose & Zolnerowich, 2003). Las especies conocidas de este género son parasitoides primarios solitarios de ninfas de las moscas blancas. La mayoría son arrenotocos, aunque se han registrado algunas especies telitocas. Las hembras colocan sus huevos debajo de la ninfa de la mosca blanca, preferentemente del segundo y tercer estadio temprano, y es la larva de primer estadio del parasitoide la que penetra en el huésped, los dos siguientes estadios larvales se desarrollan endoparasíticamente. El parasitoide completa el desarrollo pupal en el interior de la ninfa momificada, caracterizada por adquirir un color naranja en este período. El adulto emerge a través de un orificio circular hecho en el dorso del huésped. Además de parasitoides, los adultos también son predadores al alimentarse directamente de los fluidos internos de las ninfas ("host-feeding" (Gerling, 1990)).
Entre todos los parasitoides del género Eretmocerus utilizados para el control de B. tabaci, se destaca E. mundus Mercet, especie de origen mediterráneo que aparece en forma espontánea y abundante, parasitando esta plaga en los cultivos hortícolas de esa región europea. De hecho, a partir de 2002 este parasitoide comenzó a ser comercializado en todo el mundo para el control de esta plaga (Stansly et al., 2005a). La biología y efectividad de este parasitoide en cultivos hortícolas tales como tomate (Solanum lycopersicum L., Solanaceae), pimiento (Capsicum annuum L., Solanaceae), y judía (Phaseolus vulgaris L. Fabaceae) han sido principalmente estudiadas sobre el biotipo "Q" de B. tabaci, por ser éste el biotipo predominante en los países mediterráneos (Stansly et al., 2004, 2005a, 2005b; Tellez et al., 2003; Urbaneja et al., 2007). Los estudios realizados sobre el biotipo B de B. tabaci se han llevado a cabo sobre otros cultivos, se destacan poinsettia (Euphorbia pulcherrima Willd, Euphorbiaceae) y melón (Cucumis melo L., Cucurbitaceae) (De Barro et al., 2000; Goolsby et al., 1998; Heinz y Parrella, 1998; Hoelmer, 2007).
En Argentina, E. mundus ha sido registrado atacando en forma natural el complejo Bemisia tabaci en pimiento, tomate y melón en el noreste, oeste y centro del país lo que indicaría que esta especie está presente en una extensa área (López & Evans, 2008).
Dado que las características biológicas de un parasitoide pueden variar dependiendo de la población, la especie y biotipo del insecto huésped, la planta hospedera y las condiciones ambientales (Goolsby et al., 1998; Hoelmer, 2007; Liu, 2007), el objetivo del presente trabajo fue evaluar los atributos biológicos básicos de E. mundus sobre el biotipo B de B. tabaci en pimiento y tomate.
MATERIAL Y MÉTODOS
Los individuos de B. tabaci y E. mundus utilizados provinieron de las crías del Insectario de Investigaciones para Lucha Biológica, IMYZA, INTA Castelar. La cría de B. tabaci se inició a partir de adultos recolectados en cultivos de pimiento en el partido de La Plata, provincia de Buenos Aires, en el 2005. La población de mosca blanca se mantiene sobre plantas de tabaco (Nicotiana tabacum L., Solanaceae) y pimiento en una cámara de cría a 22-30ºC, HR: 50-100% y luz natural. La cría de E. mundus fue iniciada a partir de ninfas de B. tabaci parasitadas, provenientes de Bella Vista, provincia de Corrientes, en el año 2005. La población del parasitoide se mantiene a través de la provisión de plantas de tabaco y pimiento con ninfas de B. tabaci, en una cámara de cría a 22-30ºC, HR: 50-100% y luz natural.
En todos los estudios realizados, los parasitoides fueron expuestos a su huésped (ninfas de B. tabaci) mediante el uso de una "jaulita-clip". Ésta consistió en un pequeño cilindro de plástico transparente (4 cm de diámetro y 4 cm de altura) con la base de "voile". La exposición se realizó confinando el/los parasitoides en el interior de la jaulita, la que a su vez fue fijada al envés de la superficie foliar en donde se encontraban las ninfas mediante un clip de aluminio (Muñiz & Nombela, 2001). La caracterización biológica del parasitoide se hizo utilizando pimiento y tomate como plantas hospederas, ya que son las más afectadas por esta plaga en Argentina.
Tiempo de desarrollo y supervivencia pupal
Una pareja de E. mundus (menos de 24 h de emergencia) fue aislada en una jaulita-clip y expuesta a una hoja de una planta hospedera (pimiento o tomate) que contenía más de 30 ninfas de B. tabaci de segundo y tercer estadio. Se utilizaron 5 parejas (réplicas) para cada hospedera. La exposición se realizó en una cámara climatizada Conviron E7 a 25 ± 1ºC, HR: 40-60% y un fotoperíodo de 16:8 (L:O). Luego de 24 h de exposición, los parasitoides fueron removidos y las hojas con las ninfas fueron mantenidas bajo las condiciones mencionadas hasta la emergencia de los parasitoides de la generación filial. Se registraron el número de ninfas de B. tabaci parasitadas por cada hembra y el tiempo transcurrido de huevo a prepupa (última etapa de la larva de tercer estadio, reconocible porque la ninfa parasitada se torna naranja) y de prepupa a adulto. Además, se estimó la supervivencia de la pupa, calculada como el número de adultos emergidos respecto del número de ninfas parasitadas inicialmente en cada hoja.
Longevidad, supervivencia y fecundidad de las hembra de Eretmocerus mundus. Proporción sexual de la F1
Una pareja de E. mundus de menos de 24 horas de edad fue aislada en una jaulita-clip yexpuesta a una hoja de las planta hospedera (pimiento o tomate) que contenía más de 30 ninfas de B. tabaci de segundo y tercer estadio ninfal. Se utilizaron 16 parejas (réplicas) para cada hospedera. Durante toda la vida de la hembra y cada 24 h, cada pareja fue expuesta a una nueva cohorte de ninfas. Aquellos machos que murieron antes del tercer día de vida fueron reemplazados por otro. La exposición se realizó en una cámara climatizada Conviron E7 a 25 ± 1ºC, HR: 40-60% y un fotoperíodo de 16:8 (L:O). Las plantas con las cohortes de moscas blancas expuestas a los parasitoides fueron colocadas en una cámara a 26 ± 1ºC, 40-50% de humedad relativa y luz natural. Diariamente y para cada hembra del parasitoide,se registraron el número de ninfas parasitadas y el sexo de la progenie.
Para la construcción de la tabla de vida y fecundidad de E. mundus, se consignaron la edad de la hembra en días (x) y la proporción de hembras sobrevivientes a la edad x (lx). Se utilizó como lx de los estados inmaduros la supervivencia pupal, estimada en el punto anterior.
La fecundidad específica por edades de los adultos (mx) se expresó como el número promedio de ninfas parasitadas/hembra/día. Se calculó, además, la proporción sexual de la progenie, que corresponde al número de hembras/(hembras+machos) de la descendencia de cada hembra de edad x.
Parámetros poblacionales
A partir de las variables lx y mx calculadas en el punto anterior, se estimaron los siguientes parámetros poblacionales: tasa neta de reproducción (R0), tiempo generacional (T) y tasa intrínseca de crecimiento natural (rm). Para el cálculo de estos parámetros se utilizó el programa TABLAVI (La Rossa & Kahn, 2003).
Análisis estadístico
Se realizó un análisis de varianza (ANOVA) de dos factores, para determinar posibles diferencias en el tiempo de desarrollo entre plantas hospederas y sexo del parasitoide. El efecto de la hospedera sobre la supervivencia de los estados inmaduros y la longevidad de la hembra adulta fue analizado mediante una Prueba de Kruskal-Wallis, por no cumplir los datos con los supuestos de normalidad y homocedacia. Para la comparación de las curvas de supervivencia de la población de hembras entre hospederas, se utilizó la prueba F de Cox. Las posibles diferencias en la fecundidad media acumulada y los parámetros poblacionales entre plantas hospederas fueron analizadas mediante un ANOVA de un factor. Todos los análisis estadísticos se hicieron utilizando el programa STATISTICA (Statsoft, 2000) y se consideró un nivel de significancia de α = 0,05.
RESULTADOS
Tiempo de desarrollo y supervivencia pupal
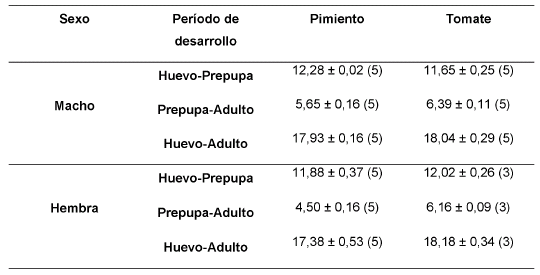
No se encontraron diferencias significativas en el tiempo de desarrollo de huevo a adulto de E. mundus entre las plantas hospederas (gl = 1,14; F = 1,44; P = 0,25), ni entre machos y hembras (gl = 1,14; F = 0,30; P = 0,59) (Tabla I). La interacción entre planta hospedera y sexo fue no significativa (gl = 1,14; F = 0,84; P = 0,38). El tiempo de desarrollo promedio fue de 17,38 y 18,18 días para las hembras y de 17,93 y 18,04 días para los machos en pimiento y tomate, respectivamente; la mayor parte de dicho tiempo (alrededor de 12 días) correspondió al desarrollo de huevo a prepupa (Tabla I).
Tabla I Tiempo de desarrollo (días) de Eretmocerus mundus sobre Bemisia tabaci en pimiento y tomate a 25,6 ± 1ºC [promedio ± error estándar (número de réplicas)].
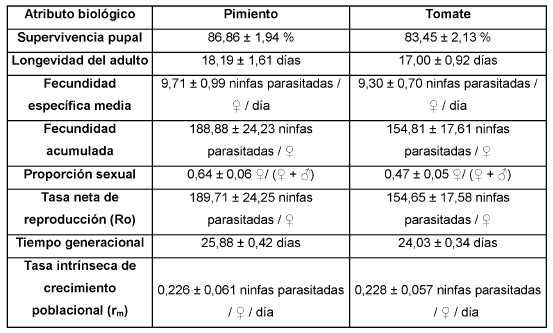
La supervivencia pupal fue semejante en ambas hospederas (estadístico de Kruslal-Wallis = 0,07, P = 0,79) (Tabla II).
Tabla II Atributos biológicos de Eretmocerus mundus sobre Bemisia tabaci en pimiento y tomate (media ± error estándar).
Longevidad, supervivencia y fecundidad de la hembra de E. mundus. Proporción sexual de la F1. Parámetros poblacionales
No se hallaron diferencias significativas en la longevidad de las hembras entre hospederas (estadístico de Kruskal-Wallis = 2,65; P = 0,10.) (Tabla II).
La población de hembras de E. mundus presentó una mayor supervivencia sobre el pimiento, en comparación con el tomate (prueba de Cox´s F, gl = 32; F = 2,27; P = 0,02). El 50% de las hembras (lx50) sobrevivió hasta el día 21 en pimiento y hasta el día 18 en tomate (Figura 1).
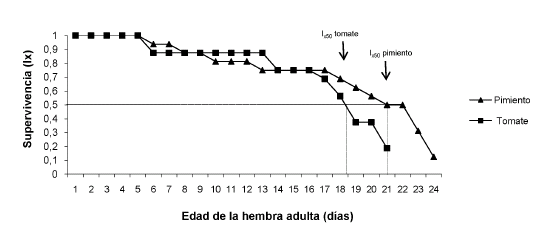
Figura 1 Curvas de supervivencia de Eretmocerus mundus sobre Bemisia tabaci en pimiento y tomate.
Para ambas hospederas no se registró periodo de preoviposición, se observó parasitismo hasta el último día de vida (Figura 2). En el pimiento, el nivel de parasitismo se mantuvo regular durante los primeros dos tercios de vida de la hembra adulta, con un máximo el día 14 (16,33 ninfas parasitadas/hembra) y comenzó a decaer a partir del día 15. En el tomate, se observó un mayor parasitismo en los primeros 8 días de la vida adulta de la hembra, para luego disminuir hasta el día 21 (Figura 2).
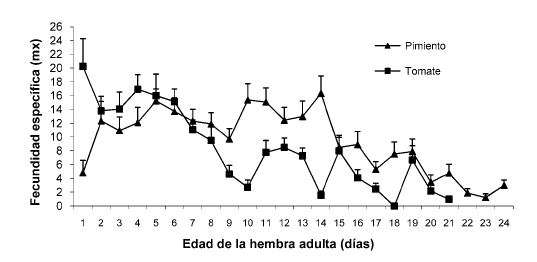
Figura 2 Fecundidad específica de Eretmocerus mundus sobre Bemisia tabaci en pimiento y tomate (media + error estándar).
No se observaron diferencias significativas entre hospederas en la fecundidad media acumulada de E. mundus (gl = 1,30; F = 1,34; P = 0,26) (Tabla II).
La proporción promedio de hembras en la descendencia de E. mundus fue de 0,34 ± 0,06 y de 0,47 ± 0,05 hembras/(hembras+machos) en pimiento y en tomate, respectivamente. Sobre el pimiento la generación filial estuvo compuesta por una mayor cantidad de machos que de hembras, a lo largo de toda la vida de la hembra progenitora. Sobre el tomate la descendencia fue en su mayoría femenina durante los primeros 9 días de vida de la hembra adulta, con una proporción de hembras menor a 0,5 para el resto del período reproductivo (Figura 3).
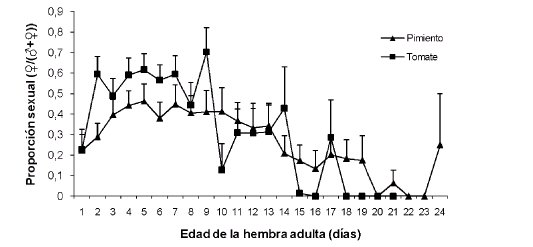
Figura 3 Proporción sexual (hembras / (hembras + machos)) de Eretmocerus mundus sobre Bemisia tabaci en pimiento y tomate (media + error estándar).
No se observaron diferencias significativas en los parámetros poblacionales del parasitoide entre hospederas (gl = 1,30; F = 1,37; P = 0,25 para Ro; gl = 1,30; F = 0,70; P = 0,41 para T; gl = 1,30; F = 0,11; P = 0,74 para rm) (Tabla II).
DISCUSIÓN
En general no se observaron diferencias en la biología de E. mundus sobre el pimiento y el tomate. La comparación de los resultados hallados en este trabajo con los reportados en la bibliografía es dificultosa, debido a que los distintos autores realizaron la evaluación biológica de este género trabajando con diferentes especies del parasitoide y sobre distintos biotipos de B. tabaci, plantas hospedera y condiciones ambientales. Asimismo, existe disparidad de criterios sobre la manera de estimar determinados parámetros biológicos (por ej. la supervivencia preimaginal y la fecundidad). Por este motivo, limitaremos nuestro análisis a la comparación dentro del sistema E. mundus - B. tabaci (Tabla III).
Tabla III Parámetros biológicos de Eretmocerus mundus sobre Bemisia tabaci registrados por otros autores bajo condiciones de laboratorio.
El tiempo de desarrollo promedio de los estados inmaduros en ambos cultivos fue similar (17-18 días) a los reportados en otros estudios realizados sobre diversas hospederas, bajo condiciones de temperatura similares, con excepción de algunos autores que registraron desarrollos más breves (Jones & Greenberg, 1998; Ardeh, inéd.) o más prolongados (Gameel, 1969; Foltyn & Gerling, 1985) que los hallados en este trabajo (Tabla III). La supervivencia del período prepupa-adulto se encontró dentro de los valores hallados por otros autores para la supervivencia preimaginal, tales como Manzarolini et al. (1997): 78,30%, Gerling & Fried (2000): 84% y Greenberg et al. (2002): 84,90%. Cabe destacar que el resultado aquí obtenido representa una aproximación (sobreestimación) de la supervivencia de los estados inmaduros, ya que sólo se consideró el lapso prepupa-adulto, y no así el estado de huevo ni los primeros dos estadios larvales.
Las hembras vivieron, en promedio, alrededor de 17-18 días en tomate y pimiento, valores que resultaron superiores a lo hallado por otros autores con excepción de Gameel (1969), que registró una longevidad promedio de 34,58 días (Tabla III). El 50% de la población de hembras adultas de E. mundus sobrevivió hasta el día 18 en tomate y hasta el día 21 en pimiento, se observaron diferencias significativas entre ambas plantas. Esto podría deberse a la presencia de tricomas en los foliolos del tomate que constituyen un obstáculo para el desplazamiento de los parasitoides. De esta manera, es probable que las hembras deban invertir más energía para movilizarse en el tomate, acelerando su consumo metabólico y su muerte. Por el contrario, esto no ocurriría sobre pimiento, cuyos folíolos son glabros. Este fenómeno también ha sido reportado por otros autores (Headrick et al., 1996; McAuslane & Nguyen, 1996; Qiu et al., 2005; Liu, 2007). No obstante esta diferencia, la población en estudio sobrevivió varios días sobre ambas plantas hospederas, con la mitad de la población de hembras viva durante casi tres semanas. También, se observó en ambas especies hospederas que a partir del día 6 es cuando se inicia la muerte de las hembras de la población de E. mundus. Si bien este resultado fue obtenido bajo condiciones controladas de laboratorio y su extrapolación a condiciones de campo es limitada, permite esperar una alta supervivencia de los parasitoides durante los primeros días posteriores a su liberación en el campo para el control de la mosca blanca.
Respecto de la fecundidad, las hembras de E. mundus no presentaron periodo de preoviposición en ninguna de las dos hospederas. Sobre pimiento, la hembra del parasitoide mostró una actividad de parasitismo variable pero continua hasta su muerte, dejando el 50% y el 90% de su descendencia en los días 10 y 18 de vida, respectivamente. Sobre tomate, la fecundidad fue mayor durante los primeros días de vida de la hembra adulta, con un pico el primer día que luego decae hasta el último día de vida, con lo que la hembra dejó su descendencia antes, comparado con el pimiento (el 50% y el 90% en los días 6 y 15, respectivamente). En términos generales, este patrón coincide con el obtenido por Urbaneja et al. (2007) sobre estas mismas plantas hospederas. El análisis conjunto de la curva de supervivencia y fecundidad permite observar que el día en que murió el 50% de las hembras, ya se había alcanzado un 95% del total de ninfas que fueron parasitadas en pimiento y un 94% en tomate.
La fecundidad diaria estimada (9-10 ninfas parasitadas/hembra/día) fue semejante o inferior a la registrada por otros autores sobre diversas hospederas (Tabla III). En general, aquellos autores que evaluaron la fecundidad a través del número de huevos hallaron valores mayores, lo cual es esperable ya que de esta manera no se está contemplando la mortalidad preimaginal como al medir el número de ninfas parasitadas. Por su parte, los valores de fecundidad acumulada registrados en este trabajo, fueron superiores a los obtenidos por otros autores y, si bien las diferencias no fueron significativas, se encontró la misma tendencia hallada por Urbaneja et al. (2007), con mayores valores de fecundidad total en pimiento que en tomate, producto de una mayor supervivencia de la población de hembras sobre la primera hospedera (Tabla III).
Eretmocerus mundus dejó una descendencia mayoritariamente masculina en ambas hospederas a lo largo de toda su vida, resultado contrario al que hallaron Ardeh (inéd.), Tawfik et al. (1979) y Sharaf & Batta (1985) a 25ºC sobre diversas plantas (Tabla III). Sin embargo, pudo observarse que la edad de la hembra en el momento de la oviposición tuvo influencia sobre la proporción sexual de la descendencia cuando se reprodujo sobre tomate, ya que su descendencia fue mayoritariamente femenina entre los 2 y 9 días de vida de la hembra adulta, con una proporción de hembras menor a 0,5 para el resto del período reproductivo. Por el contrario, sobre pimiento la generación filial siempre mostró una mayor proporción de machos que de hembras a lo largo de toda la vida de la hembra progenitora. Para ambas plantas hospederas, se observó que la proporción de hembras en la segunda mitad de la vida adulta fue aún menor que en la primera mitad. Esto es esperable ya que los machos de las parejas expuestas murieron antes que las hembras, lo que determinó que en los últimos días de vida la hembra no haya sido fecundada. Al agotarse el esperma disponible, las hembras sólo dejaron descendencia haploide (machos). Gerling & Fried (2000) también observaron cambios en el promedio de sexos de la progenie de E. mundus basado en la edad de oviposición de la hembra adulta.
El impacto que los parámetros biológicos puedan tener desde el punto de vista del control biológico va a depender del tipo de uso que se haga del parasitoide. Si éste es introducido en el sistema a través de liberaciones inundativas, el principal objetivo será generar una alta mortalidad en la población plaga a través del impacto de las hembras liberadas, en cuyo caso, es importante la cantidad de ninfas que parasiten, independientemente del sexo de su descendencia. Si en cambio, se realizan liberaciones inoculativas estacionales, además del objetivo mencionado se querrá lograr una mortalidad a mediano plazo a través del parasitismo llevado adelante por la descendencia de los individuos liberados, mortalidad generada exclusivamente por la progenie femenina. En este aspecto influirán, además de la fecundidad y la proporción sexual, el tiempo de desarrollo, la supervivencia preimaginal y del adulto, etc. Sobre la base de los resultados obtenidos, E. mundus tendría el mismo impacto sobre la población plaga en ambas hospederas respecto del primer objetivo. Por el contrario, si se considera el segundo aspecto, esto es, la acción de los descendientes de los individuos liberados, E. mundus tendría un potencial mayor en tomate respecto del pimiento ya que en esta hospedera el parasitoide presenta una mayor concentración de su energía reproductiva en los primeros días de vida cuando su descendencia es principalmente femenina. Dado que estos resultados fueron obtenidos bajo condiciones de laboratorio, es fundamental su validación bajo condiciones de invernáculo.
Respecto de los parámetros poblacionales, la tasa neta de reproducción de la población en estudio fue superior a la registrada por Urbaneja et al. (2007). Esta superioridad mostrada puede ser causada por la alta longevidad de las hembras en estudio, en comparación con la población parasitoide estudiada sobre el biotipo Q de Bemisia tabaci, esto evidencia una ventaja de la población local. El tiempo que transcurre entre dos generaciones sucesivas en tomate fue levemente inferior que en pimiento, sin embargo, esta diferencia no fue significativa, lo cual difiere con lo reportado por Urbaneja et al. (2007), quienes sí observaron diferencias significativas entre estas dos hospederas. Además, el tiempo generacional mostrado por la población en estudio fue superior al reportado por Ardeh (inéd.) en tomate y poinsettia (Tabla III). La tasa intrínseca de crecimiento natural (rm) obtenida no mostró diferencia significativa entre las plantas hospederas. Este resultado es similar al obtenido por Urbaneja et al. (2007), pero superior a la rm obtenida por Qiu et al. (2007) para Eretmocerus sp. nr. Furuhashii a 26ºC (0,149). Además, se encuentra entre los valores obtenidos por Ardeh (inéd. (Tabla III)).
Messenger (1964) propuso utilizar la tasa intrínseca de incremento poblacional (rm) como un índice que, al combinar las tasas de desarrollo, reproducción y supervivencia, permite estimar la efectividad potencial de un enemigo natural para controlar a su plaga. De este modo, comparado con el del insecto huésped, el valor de rm registrado en este estudio para E. mundus sobre ambas hospederas fue superior a las tasas obtenidas para B. tabaci biotipo B por Enkegaard (1993) sobre poinsettia (Euphorbia pulcherrima Willd) y Powell & Bellows (1992) sobre algodón y zapallito. Esto indicaría un alto potencial de control de la población en estudio. Vale recordar aquí, que E. mundus no sólo mata a su huésped al reproducirse, sino también al alimentarse de él (host-feeding), aspecto no evaluado en este trabajo. Esta causa de mortalidad adicional actúa aumentando la eficiencia del parasitoide para controlar a la plaga y es un factor para ser estudiado en futuras investigaciones.
En la Argentina, B. tabaci constituye una importante plaga de diversas hortalizas, no obstante lo cual son escasos los estudios realizados para determinar aspectos tales como su dinámica poblacional, daño producido y rol de sus enemigos naturales en cada uno de los cultivos atacados. En los cinturones hortícolas de Corrientes y La Plata, esta especie de mosca blanca inicia sus infestaciones en primavera tanto en tomate como en pimiento, aunque muestra preferencia por esta última hospedera (Cáceres et al., 2004; Polack et al., 2005). En cultivos con un manejo racional de productos químicos, Cáceres et al. (2005) registraron la presencia espontánea de distintos predadores y parasitoides asociados a B. tabaci, destacándose E. mundus a lo largo de varias temporadas. Sin embargo, sus niveles de parasitismo llegaron a ser elevados cuando los niveles poblacionales de la mosca blanca fueron altos hacia el verano y otoño, es decir, en un estado avanzado del ciclo del cultivo. En este contexto y sobre la base de los atributos biológicos evaluados en este trabajo, la acción controladora espontánea del parasitoide podría reforzarse introduciéndolo en el sistema al aparecer los primeros adultos de moscas blancas en la primavera, con buenas perspectivas tanto en pimiento como en tomate. La estrategia de uso del enemigo natural (modo, número, dosis y frecuencia de introducciones) dependerá de diversos aspectos (densidad de la plaga, estado fenológico del cultivo, condiciones ambientales, etc.) y su determinación deberá abordarse a través de futuros ensayos en condiciones de invernáculo.
AGRADECIMIENTOS
A la Comisión de Incentivos del Ministerio de Ciencia y Tecnología, al Consejo Nacional para Investigaciones Científicas y Tecnológicas y a la Vicerrectoría de Vida Estudiantil y Servicios Académicos del Instituto Tecnológico de Costa Rica por su ayuda financiera para que Yerlin Chacón Castro pudiera realizar esta investigación en el IMYZA, INTA Castelar, como trabajo final de graduación (Ingeniería en Biotecnología, Instituto Tecnológico de Costa Rica). A la Ing. Andrea Andorno, Lic. Carmen Hernández y Dra. Mariana Viscarret por la lectura del manuscrito.
BIBLIOGRAFÍA CITADA
1. ARDEH, M. J. Inéd. Whitefly control potential of Eretmocerus parasitoids with different reproductive modes. Thesis, Wageningen University, The Netherlands, 2004, 104 pp. [ Links ]
2. BROWN, J. & J. BIRD. 1992. Whitefly transmitted geminiviruses and associated disorders in the Americas and the Caribbean basin. Plant Dis.76: 200-225. [ Links ]
3. BROWN, J., D. FROHLICH & R. ROSELL. 1995. The sweetpotato or silverleaf whiteflies: biotypes of Bemisia tabaci or a species complex. Annu. Rev. Entomol. 40: 511-534. [ Links ]
4. BYRNE, D., T. BELLOWS & M. PARRELLA. 1990. Whiteflies in agricultural systems. En: Gerling, D. (ed.), Whiteflies: their bionomics, pest status and management. Intercept, Andover UK, pp. 227-261. [ Links ]
5. CÁCERES, S. 2004. Moscas blancas del complejo Bemisia tabaci en cultivos hortícolas de Corrientes. Estrategias de manejo. En: Mosca blanca Bemisia tabaci. Jornada de Actualización. La Plata, Buenos Aires, 2004, pp. 9-13. [ Links ]
6. CÁCERES S., V. S. MIÑO & M. R. A. AGUIRRE. 2005. A cuatro años de la explosión de mosca blanca Bemisia Tabaci en pimiento y tomate de Corrientes. En: Actas y Trab. De la XVI Reunión de Comunicaciones Científicas y Técnicas, Corrientes, 2005, CD Sanidad Vegetal 021. [ Links ]
7. COHEN, S. 1990. Epidemiology of whitefly-transmitted viruses. En: Gerling, D. (ed.), Whiteflies: their bionomics, pest status and management. Intercept, Andover UK, pp. 211-225. [ Links ]
8. DE BARRO, P. J., P. HART & R. MORTON. 2000. The biology of two Eretmocerus spp. (Haldeman) and three Encarsia spp. Forster and their potential as biological control agents of Bemisia tabaci biotype B in Australia. Entomol. Exp. Appl. 94: 93-102. [ Links ]
9. ENKEGAARD, D. 1993. The poinsettia strain of the cotton whitefly, Bemisia tabaci (Homoptera: Aleyrodidae), biological and demographic parameters on poinsettia (Euphorbia pulcherrima) in relation to temperature. Bull. Entomol Res. 83: 535-546. [ Links ]
10. EVANS, G. A. 2008. The whiteflies (Hemiptera: Aleyrodidae) of the world and their host plants and natural enemies. http://www.sel.barc.usda.gov:591/1WF/World-Whitefly-Catalog.pdf, 23/09/08. [ Links ]
11. FOLTYN, S. & D. GERLING. 1985. The parasitoids of the aleyrodid Bemisia tabaci in Israel: development, host preference and discrimination of the aphelinid wasp Eretmocerus mundus. Entomol. Exp. Appl. 38: 255-260. [ Links ]
12. GAMEEL, O. I. 1969. Studies on whitefly parasites Encarsia lutea Masi and Eretmocerus mundus Mercet. Hymenoptera Aphelinidae. Rev. Zool. Bot. Afr. LXXIX (1-2): 65-77. [ Links ]
13. GERLING, D. 1990. Natural Enemies of whiteflies: Predators and Parasitoids. En: Gerling, D. (ed.), Whiteflies: their bionomics, pest status and management. Intercept, Andover UK, pp. 147-186. [ Links ]
14. GERLING, D. & R. FRIED. 2000. Biological Studies with Eretmocerus mundus Mercet (Hym.: Aphelinidae) in Israel. OILB/SROP Bull. 23: 117-123. [ Links ]
15. GOOLSBY, J. A., M. A. CIOMPERLIK, B. C. LAGSPI, JR., J. C. LEGASPI & L. E. WENDEL. 1998. Laboratory and field evaluation of exotic parasitoids of Bemisia tabaci (Gennadius) (Biotype "B") (Homoptera: Aleyrodidae) in the Lower Rio Grande Valley of Texas. Biol. Control. 12: 127-135. [ Links ]
16. GREENBERG, S. M., W. A. JONES & T. X. LIU. 2002. Interactions among two species of Eretmocerus mundus Mercet ((Hymenoptera: Aphelinidae), two species of whiteflies (Homoptera: Aleyrodidae), and tomatoe. Environ. Entomol. 31: 397-402. [ Links ]
17. HEADRICK, D. H., T. S. BELOWS & T. M. PERRING. 1996. Behaviors of female Eretmocerus sp. nr californicus (Hymenoptera: Aphelinidae) attanking Bemisia argentifolii (Homoptera: Aleyrodidae) on cotton, Gossipyum hirsutum (Malvaceae) and melon Cucumis melo (Cucurbitaceae). Biol. Control 6: 64-75. [ Links ]
18. HEINZ K. H. & M. P. PARRELLA. 1998. Host location and utilization by selected parasitoids of Bemisia argentifolii (Homoptera: Aleyrodidae): implications for augmentative biological control. Environ. Entomol. 27 (3): 773-784. [ Links ]
19. HOELMER, K. A. 2007. Field cage evaluation of introduced Eretmocerus species (Hymenoptera: Aphelinidae) against Bemisia tabaci strain B (Homoptera: Aleyrodiae) on cantaloupe. Biol. Control 43: 156-162. [ Links ]
20. JONES, W. A. & S. M. GREENBERG. 1998. Suitability of Bemisia argentifolii (Homoptera: Aleyrodidae) instars for parasitoid Eretmocerus mundus (Hymenoptera: Aphelinidae). Environ. Entomol. 27: 1569-1573. [ Links ]
21. LA ROSSA, F.R. & N. KAHN. 2003. Dos programas de computadora para confeccionar tablas de vida de fertilidad y calcular parámetros biológicos y demográficos en áfidos (Homoptera, Aphidoidea). RIA 32 (3): 127-142. [ Links ]
22. LIU, T. X. 2007. Life history of Eretmocerus melanoscutus (Hymenoptera: Aphelinidae) parasitizing nymphs of Bemisia tabaci Biotype B (Homoptera: Aleyrodiae). Biol. Control 42: 77-85. [ Links ]
23. LÓPEZ, S. N. & G. A. EVANS. 2008. Nuevos registros y distribuciones de especies del género Eretmocerus (Hymenoptera: Aphelinidae), parasitoides de Trialeurodes vaporariorum y el complejo Bemisia tabaci (Hemiptera: Aleyrodidae) en Argentina. Rev. Soc. Entomol. Arg. 67 (1-2): 185-187. [ Links ]
24. MANZAROLINI, G., M. TOMMASINI, M. MOSTI & D. BRADI. 1997. Biological control of whitefly on poinsettia in Italy. OILB-SROP Bull. 20(4): 130-142. [ Links ]
25. MCAUSLANE, H.J. & R. NGUYEN. 1996. Reproductive biology and behavior of a thelytokous species of Eretmocerus (Hymenoptera: Aphelinidae) parasitizing Bemisia argentifolii (Homoptera: Aleyrodiae). Ann. Entomol. Soc. Am. 89: 686-693. [ Links ]
26. MESSENGER, P. S. 1964. Use of life tables in a bioclimatic study of an experimental aphid-braconid wasp host-parasite system. Ecology 45 (1): 119-131. [ Links ]
27. MUÑIZ, M. & G. NOMBELA. 2001. Bemisia tabaci: a new clip cage for biological studies. European Whitefly Studies Network Newsletter - FAIR 6 - Ct98 - 4303 6(2): 1-2. [ Links ]
28. POLACK, L. A., M. S. MITIDIERI, C. PINEDA, S. N. LÓPEZ, C. SILVESTRE, O. MARTÍNEZ QUINTANA & R. FERNÁNDEZ. 2005. Bemisia tabaci en tomate y pimiento en el cinturón hortícola platense. En: Actas y Trab. del XII Congreso Latinoamericano y XXVIII Congreso Argentino de Horticultura, General Roca, Río Negro. 2005. p. 76. [ Links ]
29. POWELL, D. A. & T. S. BELLOWS. 1992. Development and reproduction of two populations of Eretmocerus species (Hymenoptera: Aphelinidae) on Bemisia tabaci (Homoptera: Aleyrodidae). Environ. Entom. 21 (3): 651-658. [ Links ]
30. QIU, B., P. BARRO & S. REN. 2005. Development, survivorship and reproduction of Eretmocerus sp. nr. furushshi (Hymenoptera: Aphelinidae) parasitizing Bemisia tabaci (Hemiptera: Aleyrodidae) on glabrous and non-glabrous host plants. Bull. Entomol. Res. 95: 313-319. [ Links ]
31. QIU, B.; P. BARRO, S. REN & C. XU. 2007. Effect of temperature on the life history of Eretmocerus sp. nr. furuhashii, a parasitoid of Bemisia tabaci. BioControl. 52: 733-746. [ Links ]
32. QIU, Y. T., J. C. VAN LENTEREN, &. C. DROST & C.J.A.M. POSTHUMA-DOODEMAN. 2004. Life-history parameters of Encarsia formosa, Eretmocerus eremicus and E. mundus, aphelinid parasitoids of Bemisia argentifolii (Hemiptera; Aleyrodidae). Eur. J. Entomol. 101: 83-94. [ Links ]
33. ROSE, M. & G. ZOLNEROWICH. 2003. Eretmocerus picketti new species (Hymenoptera: Chalcidoidea: Aphelinidae), reared from Tetraleurodes acaciae (Quaintance) (Homoptera: Aleyrodida). Pan-Pac. Entomol. 79 (2): 119-127. [ Links ]
34. SHARAF, N. & Y. BATTA. 1985. Effect of some factors on the relationship between the whitefly Bemisia tabaci (Homopt., Aleyrodidae) and the parasitoid Eretmocerus mundus Mercet (Hymenopt., Aphelinidae). J. Appl. Entom. 99: 267-276. [ Links ]
35. STANSLY, P. A., J. CALVO & A. URBANEJA. 2005a. Release rates for control of Bemisia tabaci (Homoptera: Aleyrodidae) biotype "Q" with Eretmocerus mundus (Hymenoptera: Aphelinidae) in greenhouse tomato and pepper. Biol. Control 35: 124-133. [ Links ]
36. STANSLY, P. A., J. CALVO & A. URBANEJA. 2005b. Augmentative biological control of Bemisia tabaci biotype "Q" in Spanish greenhouse pepper production using Eretmocerus spp. Crop Prot. 24: 829-835. [ Links ]
37. STANSLY, P. A., P. A. SÁNCHEZ, J. M. RODRÍGUEZ, F. CAÑIZARES, A. NIETO, M. J. LÓPEZ LEYVA, M. FAJARDO, V. SUÁREZ & A. URBANEJA. 2004. Prospect for biological control of Bemisia tabaci (Homoptera, Aleyrodidae) in greenhouse tomatoes of southern Spain. Crop Prot. 23: 701-712. [ Links ]
38. STATSOFT INC. 2000. Statistica for Windows. Tulsa OX, United States. [ Links ]
39. TAWFIK, M. F., K. T. AWADALLAH, H. HAFEZ & A. SARHAN. 1979. Biology of the aphelinid parasite Eretmocerus mundus Mercet. Bull. Soc. Ent. Egypte 62 (33): 33-48. [ Links ]
40. TELLEZ, M. M., L. LARA, P. A. STANSLY & A. URBANEJA. 2003. Eretmocerus mundus (Hym.; Aphelinidae), parasitoide autóctono de Bemisia tabaci (Hom.; Aleyrodidae): primeros resultados de eficacia en judía. Bol. San. Veg. Plagas. 29: 511-521. [ Links ]
41. TORRES, I., J. GARZÓN, J. BROWN, A. BECERRA & R. RIVERA. 1996. Detection and distribution of geminiviruses in Mexico and the southern United States. Phytopathology 86: 1186-1192. [ Links ]
42. TRUOL, G., L. H. CORREO LIMA, M. R. VILLARINHO DE OLIVEIRA & I. G. LAGUNA. 2005. Análisis de biotipos de moscas blancas vectoras de geminivirus en Argentina. En: Actas y Trab. del XII Congreso Latinoamericano de Fitopatología. Villa Carlos Paz, Córdoba, 2005, p. 577. [ Links ]
43. URBANEJA, A., E. SÁNCHEZ & P. A. STANSLY. 2007. Life history of Eretmocerus mundus, a parasitoid of Bemisia tabaci, on tomato and sweet pepper. BioControl 52: 25-39. [ Links ]














