Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de la Sociedad Entomológica Argentina
Print version ISSN 0373-5680
Rev. Soc. Entomol. Argent. vol.69 no.3-4 Mendoza jul./Dec. 2010
NOTA CIENTÍFICA
Detección de Malpighamoeba mellifcae (Protista: Amoebozoa) en Apis mellifera (Hymenoptera: Apidae)de Argentina
Detection of Malpighamoeba mellifcae (Protista: Amoebozoa) in Apis mellifera (Hymenoptera: Apidae) of Argentina
Plischuk, Santiago y Carlos E. Lange
Centro de Estudios Parasitológicos y de Vectores (CEPAVE), CIC - CCT CONICET La Plata - UNLP. Calle 2 Nº 584 (B1902CHX) La Plata, Argentina; e-mail: santiago@cepave.edu.ar
RESUMEN. Debido a su rol como polinizador y productor de miel, la abeja Apis mellifera L. es considerado un insecto beneficioso. Si bien Argentina juega un papel de liderazgo en la producción de miel, existe un considerable vacío en el conocimiento acerca de las enfermedades de etiología protista que afectan las abejas en el país. La ameba Malpighamoeba mellificae Prell es un protista entomopatógeno que invade los túbulos de Malpighi de las abejas e interfiere con el proceso de excreción, debilitando al huésped y posiblemente facilitando la acción de otros patógenos. En esta contribución se presentan los primeros hallazgos de M. mellificae en Argentina y se brindan datos iniciales acerca de su frecuencia, intensidad de las infecciones, y co-ocurrencia con Nosema sp. Malpighamoeba mellificae se halló en dos de 36 localidades prospectadas: San Cayetano, al Sur de la provincia de Buenos Aires y San Carlos de Bariloche, en el Oeste de la provincia de Río Negro.
PALABRAS CLAVE. Abeja; Ameba; Entomopatógeno; Quiste; Túbulos de Malpighi.
ABSTRACT. Due to its role as a pollinator and honey producer, the honey bee Apis mellifera L. is considered a beneficial insect. Although Argentina plays a leading role in honey production, there is a considerable gap in knowledge regarding protistan diseases that affect honey bees in the country. The amoeba Malpighamoeba mellificae Prell is an entomopathogenic protist that invades the Malpighian tubules of honey bees and interferes with the excretory process, debilitating the host and possibly facilitating the action of other pathogens. In this contribution, we present the first reports of M. mellificae in Argentina, and provide some initial data about its frecuency, infection intensity, and co-occurrence with Nosema sp. Malpighamoeba mellificae was found in two out of 36 localities surveyed: San Cayetano, in southern Buenos Aires province, and San Carlos de Bariloche, in western Río Negro province.
KEY WORDS. Amoeba; Cyst; Entomopathogen; Honey bee; Malpighian tubules.
Recibido: 8-IX-2010;
Aceptado: 25-X-2010
Debido a su rol en la polinización y producción de miel, la abeja melífera (Apis mellifera L.) es considerada un insecto beneficioso, por lo cual mantener en condiciones sanitarias adecuadas sus poblaciones puede provocar un significativo incremento de la actividad desarrollada por este himenóptero. Aunque Argentina es uno de los tres países con mayor producción de miel, sólo en forma reciente se han identificado protistas patógenos distintos del microsporidio Nosema apis Zander (Plischuk & Lange, 2009a). Los protistas entomopatógenos no suelen causar efectos agudos, por el contrario, ocasionan enfermedades de tendencia crónica y debilitante, por ello pueden pasar desapercibidos, pero causan efectos negativos, sutiles a largo plazo (Lange, 1996).
Malpighamoeba mellificae Prell es una ameba entomopatógena que invade los túbulos de Malpighi de la abeja y provoca cambios patológicos que alteran su capacidad excretora y conducen a la intoxicación por acumulación de deshechos nitrogenados (Liu, 1985). El efecto debilitante parece exacerbar la susceptibilidad a otros agentes que causan dolencias (Aydin et al., 2006). Malpighamoeba mellificae tiene la capacidad de formar quistes, los cuales se acumulan en el lumen de los túbulos de Malpighi y son luego liberados al exterior, donde podrán ser ingeridos por otra abeja (Bailey & Ball, 1991). Dado que no existen registros de M. mellificae en Argentina, el objetivo central de esta contribución es dar a conocer su detección en nuestro país.
Entre marzo de 2006 y febrero de 2010, se colectaron y examinaron 400.100 individuos de Apis mellifera provenientes de colmenares comerciales y abejas pecoreadoras, distribuidos en 36 localidades de ocho provincias (Fig. 1). Las muestras fueron conservadas en etanol 70° o bajo congelación (-32° C) hasta su examen. Para la detección y aislamiento de protistas patógenos, se utilizaron técnicas de disección y homogeneización de los insectos en agua bidestilada (Lange & Henry, 1996; Undeen & Vávra, 1997). La observación,caracterización y fotografiado del patógeno se efectuó mediante un microscopio Nikon Optiphot-2, con contraste de fase (x400; x1000). La intensidad de las infecciones se estimó con cámara de Neubauer de acuerdo al protocolo de Undeen & Vávra (1997) y es indicada como promedio, ES y rango. Las mediciones de los patógenos se llevaron a cabo con micrómetros oculares y también se expresan como promedio, ES y rango.

Fig. 1. Los 36 sitios de muestreos de Apis mellifera en Argentina, incluyendo las dos localidades (San Cayetano y San Carlos de Bariloche) con detecciones de Malpighamoeba mellificae.
En un apiario de la localidad de San Cayetano (38°20'19"S; 59°34'55"O; Fig. 1), provincia de Buenos Aires, durante octubre de 2007, se colectaron 800 abejas y se detectaron en nueve de ellas, formas tróficas (trofozoítos) y quísticas cuyas características correspondían con las de una ameba. Se individualizaron los túbulos de Malpighi como el asiento de las infecciones. Éstos mostraron una condición diferente a la normal, presentaron un color blanco lechoso alternado por sectores oscuros, se notaron hipertrofiados y frágiles. El lumen de los túbulos resultó invadido por cuerpos refringentes, esférico-ovoideos, de tamaño homogéneo [7,48 ± 0,06 (6,80 - 8,00) µm x 6,33 ± 0,05 (5,60 - 6,80) µm (n = 60)]. En menor cantidad, se observaron cuerpos de dimensiones algo más reducidas, esféricos o semiesféricos, no refringentes y con contornos irregulares (Figs. 2-5). La intensidad media de las infecciones fue de 5,13 ± 0,94 x 105 (4,0 x 104 - 9,9 x 105) quistes/abeja (n = 9). No se detectaron infecciones mixtas con otra especie protista.
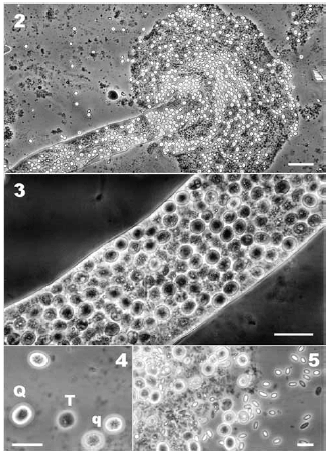
Figs. 2-5. Fotomicrografías de Malpighamoeba mellificae en Apis mellifera de Argentina. 2, túbulo de Malpighi seccionado liberando formas quísticas (Escala = 50 μm); 3, detalle de un túbulo de Malpighi infectado (Escala = 20 μm); 4, quiste maduro [Q], quistes inmaduros [q] y trofozoíto [T] (Escala = 10μm); 5, infección mixta con Nosema sp. (Escala = 10 μm).
En febrero de 2010, se colectaron 59 abejas obreras pecoreadoras en las cercanías de San Carlos de Bariloche (41°07'33"S; 71°23'55"O; Fig. 1), provincia de Río Negro. Uno de los ejemplares presentó, en sus túbulos de Malpighi, numerosos cuerpos coincidentes con los observados en las muestras de San Cayetano, correspondiendo también tanto a quistes como a trofozoítos. La intensidad de la infección fue 3,25 x 105 quistes/abeja. El ejemplar parasitado contenía también esporos del microsporidio Nosema sp. en el tubo digestivo (8,50 x 106 esporos) (Fig. 5).
Tanto las características morfológicas del patógeno (tamaño y forma de los quistes), como los órganos afectados y los signos observados, coinciden claramente con lo citado para M. mellificae (Prell, 1926; Schwantes & Eichelberg, 1984; Liu, 1985; Bailey & Ball, 1991). Los casos señalados en el presente trabajo constituyen los primeros registros de Malpighamoeba mellificae en Argentina. Cuantificando los hallazgos de ambos sitios (n = 10), se obtuvo una intensidad media de 4,95 ± 0,86 x 105 quistes de M. mellificae por abeja.
En relación al escaso número de casos detectados, los registros de Malpighamoeba mellificae en Europa también mencionan prevalencias bajas (Bailey & Ball, 1991), lo que sugiere una tendencia de este patógeno a ocurrir normalmente en forma enzoótica. Al menos en nuestro país, resulta llamativo que, a pesar del elevado número de colmenas emplazadas, esta ameba nunca haya sido registrada previamente. Una posible explicación radicaría en la alternancia natural de presencia y ausencia de quistes. Por su morfología definida y constante y su marcada refringencia, los quistes constituyen, como en otras amebas entomopatógenas (Lange, 2002), el estado más conspicuo de M. mellificae, y tradicionalmente la diagnosis de la enfermedad se ha basado en la observación de éstos (Bailey & Ball, 1991). En ausencia de formas quísticas, la enfermedad, aunque presente, podría pasar desapercibida dada la dificultad de distinguir los trofozoítos del contenido normal de los túbulos de Malpighi, sobre todo si la intensidad de la infección es baja. Las amebas en general suelen pasar períodos prolongados sólo en estado de trofozoítos, enquistándose únicamente ante condiciones desfavorables tales como nutrición deficiente o desecación (Schuster, 1990). Si bien los factores que gobiernan el enquistamiento aún son desconocidos, es posible que la real ocurrencia de M. mellificae se halle subdiagnosticada, si es que efectivamente la ameba transcurre períodos extensos sin formar quistes. Se requerirá el desarrollo de técnicas de índole molecular a fin de generar diagnósticos más precisos.
Los casos registrados en San Cayetano durante octubre parecen mostrar cierta concordancia con observaciones en apiarios del hemisferio Norte (Giordani, 1959; Bailey & Ball, 1991). Estos trabajos reportan los mayores niveles de Malpighamoeba mellificae durante el mes de abril (mediados de la primavera boreal). Se estima que el tiempo de vida de las abejas de verano no sería suficiente para que M. mellificae pueda completar su ciclo exitosamente, lo que sí ocurriría en las abejas de invierno o de larga vida (Giordani, 1959; Bailey & Ball, 1991).
El hallazgo de San Carlos de Bariloche podría relacionarse con que M. mellificae también ha sido detectada en Chile. El registro más reciente proviene de la décima región (Fuentealba, 2005), a igual latitud que San Carlos de Bariloche. Antecedentes en la misma zona, como la invasión de Vespula germanica Fabricius (Vespidae) y Acromyrmex lobicornis Emery (Formicidae) (Farji Brener & Corley, 1998), o la reciente entrada de Bombus ruderatus (Fabricius) y B. terrestris L. (Apidae), los cuales vehiculizan patógenos posiblemente exóticos (Plischuk & Lange, 2009b), sugieren un probable ingreso de esta ameba junto a A. mellifera desde el país vecino, al Oeste de la Patagonia.
La intensidad promedio de quistes por abeja que se indica en el presente trabajo, constituye uno de los primeros reportes en ese aspecto, ya que la mayoría de los trabajos referidos a Malpighamoeba mellificae no incluyen este parámetro. Solo Bailey & Ball (1991) han citado una carga aproximada de 5 x 105 quistes/abeja, coincidente con los hallazgos presentados en este estudio. Se desconocen la existencia y los límites de un posible umbral de patogenicidad para A. mellifera.
A partir de la detección de co-infecciones entre Malpighamoeba mellificae y Nosema sp. surge la necesidad de evaluar posibles sinergismos o antagonismos entre estos patógenos. Si bien el número de abejas infectadas (n = 10) podría ser poco representativo, el porcentaje de abejas coinfectadas con Nosema (10%) no diferiría sustancialmente de los valores reportados previamente de 10 - 15% para infecciones mixtas con N. apis (Giordani, 1959).
La presencia de Malpighamoeba mellificae en el país podría constituir otra amenaza para la apicultura. Si bien su prevalencia aún no pudo establecerse fehacientemente, no se descarta que causaría mermas en apiarios de ambas localidades donde se la ha detectado, en forma individual o en conjunto con Nosema sp.
AGRADECIMIENTOS
A la Comisión de Investigaciones Científicas (CIC) y al Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) por el apoyo económico brindado. Un especial agradecimiento a la Dra. B. Pión.
BIBLIOGRAFÍA CITADA
1. AYDIN, L., E. GULEGEN, I. CAKMAK, A. O. GIRISGIN & H. WELLS. 2006. Relation between Nosema and Chalkbrood diseases, and its implication for an apiary management model. Bull. Vet. Inst. Pulawy 50: 471-475. [ Links ]
2. BAILEY, L. & B. V. BALL. 1991. Honey bee pathology. Academic Press, London. [ Links ]
3. FARJI-BRENER, A. G. & J. C. CORLEY. 1998. Successful invasions of hymenopteran insects into NW Patagonia. Ecología austral 8: 237-249. [ Links ]
4. FUENTEALBA, V. E. Inéd. Presencia y niveles de infección de los protozoos Nosema apis Zander y Malpighamoeba mellificae Prell en apiarios asociados a Apicoop Ltda. en la X Región de Chile. Tesis, Valdivia, Universidad Austral de Chile, 2005, 79 pp. [ Links ]
5. GIORDANI, G. 1959. Amoeba Disease of the Honey Bee, Apis mellifera Linnaeus, and an Attempt at its Chemical Control. J. Insect Pathol. 1: 245-269. [ Links ]
6. LANGE, C. E. 1996. Protistas patógenos de insectos terrestres. En: Lecuona, R. (ed.), Microorganismos patógenos empleados en el control microbiano de insectos plaga, Mariano Mas, Argentina, pp. 87-104. [ Links ]
7. LANGE, C. E. 2002. La amebiasis debilitativa de los ortópteros y su potencial para el control biológico de acridios (Orthoptera: Acridoidea) en la Argentina. Rev. Inv. Agrop. 31 (3): 25-38. [ Links ]
8. LANGE, C. E. & J. E. HENRY. 1996. Métodos de estudio y producción de protistas entomopatógenos. En: Lecuona, R. (ed.), Microorganismos patógenos empleados en el control microbiano de insectos plaga, Mariano Mas, Argentina, pp. 169-176. [ Links ]
9. LIU, T. P. 1985. Scanning electron microscope observations on the pathological changes of Malpighian tubules in the worker honeybee, Apis mellifera, infected by Malpighamoeba mellificae. J. Invertebr. Pathol. 46: 125-132. [ Links ]
10. PLISCHUK, S. & C. E. LANGE. 2009a. Patógenos de himenópteros polinizadores en Argentina. En: Libro de Memorias del XXI Congr. Venez. Entomol., Caracas, 2009, 6, pp. 50. [ Links ]
11. PLISCHUK, S. & C. E. LANGE. 2009b. Invasive Bombusterrestris (Hymenoptera: Apidae) parasitized by a flagellate (Euglenozoa: Kinetoplastea) and a neogregarine (Apicomplexa: Neogregarinorida). J. Invertebr. Pathol. 102: 263-265. [ Links ]
12. PRELL, H. 1926. Beiträge zur Kenntnis der Amoebenseuche der erwachsenen Honigbiene. Arch. Bieuenkd. 7: 113-121. [ Links ]
13. SCHUSTER, F. L. 1990. Phylum Rhizopoda. En: Margulis, L., J. O. Corliss, M. Melkonian & D. J. Chapman (eds.), Handbook of Protoctista, Jones and Bartlett, Boston, pp. 3-18. [ Links ]
14. SCHWANTES, U. & D. EICHELBERG. 1984. Elektronenmikroskopische untersuchungen zum parasitenbefall der malpighischen gefässe von A. mellifera durch M. mellificae (Rhizopoda). Apidologie 15: 435-450. [ Links ]
15. UNDEEN, H. H. & J. VÁVRA. 1997. Research methods for entomopathogenic Protozoa. En: L. Lacey (ed.), Manual of Techniques in Insect Pathology, Academic Press, San Diego, pp. 117-151. [ Links ]














