Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista de la Sociedad Entomológica Argentina
versão impressa ISSN 0373-5680
Rev. Soc. Entomol. Argent. vol.70 no.3-4 Mendoza jul./dez. 2011
TRABAJOS CIENTÍFICOS
Redescripción de los estados preimaginales de Rachiplusia nu (Lepidoptera: Noctuidae)
Redescription of the immature stages of Rachiplusia nu (Lepidoptera: Noctuidae)
Barrionuevo, María José
Instituto Superior de Entomología "Dr. Abraham Willink" (INSUE), Fac. Cs. Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán; Miguel Lillo 205, CP: 4000, San Miguel de Tucumán, Tucumán, Argentina. e-mail: mariajosebarrionuevo@gmail.com
Recibido: 28-V-2011
Aceptado: 29-VI-2011
RESUMEN. Se redescriben e ilustran todos los estados preimaginales de Rachiplusia nu (Guenée) de acuerdo a estándares actualizados de patrones descriptivos. Los estados inmaduros de R. nu fueron obtenidos a partir de crías de laboratorio, bajo condiciones controladas de 27 ± 2ºC de temperatura, 14:10 (luz/oscuridad) de fotoperíodo artificial y 70-75% de humedad relativa. Por primera vez, se describen todos los estadios larvales previos al de larva madura. Todos los estados inmaduros fueron comparados con aquellos de Pseudoplusia includens (Walker), con los que usualmente pueden ser confundidos a campo. La estimación de la edad larval permitió determinar que la mayor razón de crecimiento se verifica en el cuarto estadio larval y de allí decrece paulatinamente hacia larva madura.
PALABRAS CLAVE. Huevo; Larva; Pupa; Morfología; Rachiplusia nu.
ABSTRACT. The immature stages of Rachiplusia nu (Guenée) are redescribed and illustrated, according to current standards of descriptive patterns. The immature stages of R. nu were obtained from laboratory cultures under controlled conditions of temperature at 27 ± 2ºC, 14:10 (light/darkness) artificial photoperiod and 70-75% of relative humidity. For the first time, the larval instars previous to the larvae mature are described. All immature stages were compared with those of Pseudoplusia includens (Walker), with which they can often be confused in the field. The estimation of the larval age allowed to determine that the highest rate of growth takes place in the fourth larval instar and then decreases gradually to mature larva.
KEYWORDS. Egg; Larva; Pupa; Morphology; Rachiplusia nu.
INTRODUCCIÓN
Entre las especies de noctuidos plaga que pueden hallarse en el cultivo de soja se destaca la falsa medidora de la soja, Rachiplusia nu (Guenée) (Pastrana, 2004; Pastrana et al., 2004). Esta especie se encuentra en Bolivia, Chile, Brasil y Argentina (Kitching, 1987). Dada su importancia, se han publicado diversos trabajos referidos a distintos aspectos de esta plaga: descripción superficial de estadios preimaginales (Angulo & Weigert, 1975; Igarzábal et al., 1994), estadísticos vitales (Sanchez & Pereyra, 1995), asociación fitófago-hospedero (Pastrana, 2004; Pastrana et al., 2004; Silveira et al., 1965), enemigos naturales (Margheritis & Rizzo, 1965; Araya et al., 1997), bioecología y daños (Leiva & Iannone, 1993; Luna & Greco, 1998; Pereyra, 1995; Rizzo & Saini, 1990). En términos generales, esta especie es bien conocida en lo que respecta a la larva de último estadio y los adultos. Sin embargo, la información que se dispone del huevo, los estadios larvales tempranos-tardíos y la pupa es desactualizada, poco exhaustiva y se encuentra dispersa en la literatura. Este vacío produce problemas, especialmente en la correcta identificación de los estadios larvales tempranos-tardíos y su diferenciación de otras especies similares como Pseudoplusia includens (Walker), con la que coexiste en el cultivo de soja y que usualmente se la confunde a campo. Por tal motivo, el objetivo de este trabajo es proveer, a partir de crías de laboratorio, una descripción formal y detallada de todos los estados preimaginales (huevo, estadios larvales y pupa), ajustándola a estándares actualizados de patrones descriptivos.
MATERIAL Y METÓDOS
Los estados inmaduros de R. nu fueron obtenidos a partir de crías de laboratorio, bajo condiciones controladas de 27 ± 2ºC de temperatura, 14:10 (luz/oscuridad) de fotoperíodo artificial y 70-75% humedad relativa a lo largo de todo el día. Los huevos fueron obtenidos a partir de adultos mantenidos en tubos cilíndricos de oviposición, de 10 cm de diámetro y 25 cm de altura; los mismos fueron alimentados por capilaridad a través de un algodón embebido en solución de sacarosa al 10%. Después de la oviposición, los huevos fueron dispuestos en cápsulas de Petri con papel de filtro humedecido diariamente con agua destilada hasta la eclosión de las larvas. Un total de 10 huevos fueron utilizados para evaluar la altura y diámetro. Para describir la micrópila, se siguió el método propuesto por Angulo & Weigert (1975), que consistió en vaciar el contenido de 10 huevos recién puestos con un alfiler entomológico 00. Las micrópilas fueron estudiadas bajo microscopio óptico y para la terminología se siguió a Salkeld (1984).
Después de la eclosión, 200 larvas fueron colocadas individualmente en cápsulas de Petri. Las larvas fueron alimentadas con dieta artificial (Osores et al., 1982). La evaluación del crecimiento larval y la diferenciación de los estadios larvales se llevó a cabo por mediciones de la capsula cefálica (en mm) y longitud total del cuerpo de 20 individuos en cada estadio larval. El ancho de la cápsula cefálica se midió según el método de Dyar (1890), siguiendo a Spetch et al. (2007), para lo cual se consideró la distancia entre los puntos más extremos de los bordes laterales de la cápsula cefálica, a la altura de las genas. Para este fin, después de cada muda se recogieron 20 cápsulas cefálicas por cada estadio y se almacenaron en tubos pequeños con alcohol al 70%. Debido a la dificultad para diferenciar patrones de coloración, en larvas alimentadas con dieta artificial, la descripción de los mismos fue realizada a partir de larvas vivas alimentadas con dieta natural (hojas de soja), obtenidas del excedente de larvas de las cruzas de parejas que no se emplearon para mantener el "pie de cría". La terminología empleada para la quetotaxia larval corresponde a la de Hinton (1946), con las modificaciones incluidas por Stehr (1987) y los patrones de líneas en el cuerpo de las larvas fueron descriptos de acuerdo a la terminología usada por Lafontaine & Poole (1991).
Las pupas fueron mantenidas individualmente en frascos de 100 ml, sobre papel de filtro humedecido diariamente hasta la emergencia del adulto. Se midieron la longitud total del cuerpo y el ancho máximo (tomado al nivel de las alas mesotorácicas) de 20 pupas. La terminología empleada sigue a Mosher (1916).
Todas las observaciones morfológicas, patrones de coloración y datos merísticos de cada estado/estadio se registraron bajo microscopio estereoscópico equipado con ocular micrométrico (0,01 mm de resolución).
Las tomas fotográficas fueron realizadas con una cámara digital. Las medidas tomadas se calcularon en milímetros (mm) y son expresadas en términos de rangos, promedios y desvío estándar (D. E.).
RESULTADOS
Huevo. (Figs. 1-4). Diámetro: 0,48 a 0,51 mm; altura: 0,33 a 0,35 mm.

Figs. 1-4. Huevo de Rachiplusia nu. 1. Vista dorsal. 2. Vista lateral. 3. Micrópila central. 4. Micrópila. (cp, celdas primarias; cs, celdas secundarias; ct, celdas terciarias; m, micrópila).
Coloración. Blanco-amarillento brillante cuando está recién puesto, tornándose pálido amarillento al avanzar el desarrollo embrionario. Al finalizar la incubación, con dos puntos oscuros en el área polar que corresponden a la cabeza y al escudo protorácico de la larva.
Morfología. Recto, subesférico, con una base plana y lisa (Figs. 1, 2). Corion delgado, transparente, con diseño débilmente marcado. Tiene 32 a 38 costillas longitudinales bien marcadas (Fig. 3), sólo algunas se extienden desde la base hasta las áreas micropilar; costillas longitudinales conectadas por estrías transversales finas, irregulares y débilmente marcadas. Roseta micropilar de 0,012 mm de ancho formada por un ciclo completo, cerrado, conspicuo y regular en tamaño y forma (Figs. 3, 4); con 7 a 8 celdas primarias en forma de petaloides, yuxtapuestas en la base, con margen distal redondeado (Fig. 4). Por fuera de las celdas primarias, dos ciclos de 24 a 26 celdas secundarias y terciarias (Fig. 4); el primer ciclo (= celdas secundarias) completo, cerrado y semejante en forma a la roseta micropilar, aunque con celdas de mayor tamaño; el segundo ciclo (= celdas terciarias) a veces incompleto y poco conspicuo en algunos huevos, con celdas de forma irregular y el margen extremo distal redondeado, puntiagudo o truncado. Celdas primarias dispuestas en un mismo plano respecto a las celdas secundarias. Alrededor del área micropilar se disponen celdas columnares de forma variada.
Larva
Primer estadio (Figs. 5-11). Ancho de la cabeza: 0,15-0,20 mm; longitud del cuerpo: 1,70-2,90 mm.

Figs. 5-11. Primer estadio larval de R. nu. 5. Vista dorsal del cuerpo. 6. Vista dorsal en T2-T3. 7. Vista lateral en T1-T3. 8. Vista ventral en A1-A4. 9. Vista lateral de las setas en A1-A4. 10. Vista dorsal en A10. 11. Superficie interna de la mandíbula. ( CC, cápsula cefálica; D1, D2, setas dorsales; E, espiráculo; EA, escudo anal; EP, escudo protorácico SD1, SD2, setas subdorsales; SV1, SV2, setas subventrales; V1, seta ventral; XD1, XD2, setas XD).
Coloración y patrón de diseño. Cuerpo hialino a blanquecino (con dieta artificial) o verde oscuro (con alimento natural); cabeza, escudo protorácico y anal, peritrema de espiráculos, pináculos del cuerpo, patas y placas de los espuripedios fuertemente esclerosados y de color castaño oscuro (Figs. 5-10); setas de la cabeza y cuerpo con coloración similar a los escudos o negras; suturas epicraneal, adfrontal y área stemmatal negras; antenas, palpos labiales, maxilares, ápice de mandíbulas e hipofaringe castaño claro; espuripedios abdominales con placas subcuadradas y los anales con placas triangulares, en ambos casos de color castaño oscuro.
Morfología. Cuerpo robusto, uniforme (Fig. 5).
Cabeza: MD1-M3 muy cortas, postero laterales a P2; seta MD2 más próxima a MD1 que a MD3; puntura MDa entre MD2 y MD3; P1 y P2 de largo similar; interespacio P2-P2 mayor que el de P1-P1; puntura Pb entre P1 y P2, más cercana a P2; AF2 y AF1 con longitud subigual; AF2 por encima del ápice de la frente, más próxima a P1 que a AF1; puntura AFa entre AF2 y AF1, más cercana a AF2; puntura Fa por debajo de F1; punturas Fa ligeramente separadas; setas C1 y C2 de igual longitud; seta C1 ubicada por encima del vértice superior del frontoclipeo, seta C2 en el vértice inferior del frontoclipeo. Seta L1 y puntura La dorsolaterales a A3; A3 más próxima al stemma 2 y más larga que A2; A1 en línea vertical con A2; A2 más cercana a A1 que a A3; puntura Aa próxima a A2; S1-S3 equidistantes y de longitud similar, S1 posterior y próxima al stemma 4, S2 posteroventral al stemma 1, S3 posteroventral a S2. Stemmata subcirculares de posición lateroanterior; stemma 5 ligeramente desplazado hacia el área ventral de la cabeza, próximo a la base de la antena; los restantes dispuestos en semicírculo; stemma 3 equidistante de los stemmata 4 y 2; stemma 6 posterodorsal al stemma 5; puntura Sa entre el stemma 6 y S3, mas próxima al stemma 6. Setas SS subiguales; SS1 anteroventral al stemma 5; SS2 posteroventral al stemma 5; SS3 a la derecha de SS2, puntura SSa entre SS2 y SS3, más próxima a SS2. Seta MG1 y puntura MGa posterodorsales a S3 (Fig. 13). Palpo maxilar subcónico, alargado; antena cilíndrica, alargada, trisegmentada, provista de cuatro sensilas; hilera cilíndrica, con la base más angosta que el ápice, extendida más allá del palpo labial; hipofaringe con región distal sin setas, región proximal media con setas pequeñas, región proximal lateral con setas grandes y pequeñas; palpo labial con dos sensilas, subcónico y bisegmentado. Mandíbula con seis dientes en serie, el 1º diente corto, dispuesta por encima del 2º; dientes 2º, 3º y 4º alargados, similares en tamaño; el 5º y 6º más pequeños; los primeros cinco de bordes aguzados y curvados hacia arriba y el 6º diente corto de borde amplio y romo; 2º, 3º y 4º dientes sin procesos internos en la mandíbula; setas mandibulares subiguales (Fig. 11). Labro bilobulado, con una hendidura medioventral.

Figs. 12-15. Segundo estadio larval de R. nu. 12. Vista lateral en T1-T3. 13. Vista frontal de la cabeza y setas. 14. Vista ventral en A1-A4. 15. Vista lateral en A1-A8 y A10. (A1, A2, A3, setas anteriores; AF1, AF2, setas adfrontales; Fa, puntura ; F1, seta frontal; L1, L2, L3, setas laterales; P1, P2, setas posteriores; SD1, SD2, setas subdorsales; SV1, SV2, setas subventrales; V1, seta ventral).
Tórax: dorsalmente, escudo protorácico subtrapezoidal, con XD1-XD2 y D1-D2; setas XD dispuestas a lo largo del margen anterior, ligeramente más largas que las del grupo D; XD2 ligeramente por detrás de XD1 (Figs. 5, 6); D2 próxima al margen posterior; D1 próxima a la línea media del cuerpo; SD2 más corta y gruesa que SD1, muy próximas entre sí, separadas del margen lateral del escudo y dispuestas en un mismo pináculo, al igual que las setas L1-L2 y SV1-SV2 (Fig. 7). Espiráculo protorácico subigual al de A8; A1-A8 con espiráculo redondeado, en A8 es ligeramente mayor que los otros. Lateralmente, grupo-L anterior al espiráculo y con setas muy próximas entre sí; L1 anterodorsal y más larga que L2; L2 fina, ligeramente por encima o en línea con el borde ventral del espiráculo; L3 ausente. Ventralmente, grupo-SV en línea horizontal, por debajo del espiráculo; SV2 más gruesa que SV1; MV1 ligeramente anterior al margen anterior de las coxas; V1s próximas entre sí, ligeramente por delante del margen posterior de las coxas. T2-T3 con quetotaxia similar; D1, D2, SD2, SD1 en línea vertical; pináculos y setas de D2 y SD1 de mayor tamaño que los de D1 y SD2; L1 y L2 próximas, dispuestas en un mismo pináculo hacia el margen anterior; L1 dorsoposterior a L2, más larga y gruesa; L3 ausente; SV1 próxima a la región ventral; seta SV2 ausente; MV1 anterior a las coxas y V1s ligeramente posterior a las coxas, más apartadas que V1s en T1.
Abdomen: pináculos subiguales en tamaño dentro de un mismo segmento; disminución progresiva del tamaño de los pináculos hacia los segmentos posteriores. Dorsalmente, D1 y D2 de longitud similar; en A1-A7, D1 dorsoanterior a D2 y cercano a la línea media dorsal; A8 con D1 y D2 al mismo nivel; A9 con D1 anteroventral a D2; A10 con escudo anal subtriangular, con setas D1, D2, SD1, SD2 (Fig.10). Setas D1, SD1 y SD2 subiguales en largo y equidistantes, D2 más próxima a línea media dorsal que D1. Lateralmente, A1 y A7 con SD1 alineada verticalmente con el espiráculo y L2, L1 posterior al espiráculo, al mismo nivel o ligeramente por debajo del mismo; A2-A6 y A8 con SD1 dorsal y anterior al espiráculo, L2 anterior y por debajo del espiráculo y L1 posteroventral al espiráculo; A9 sólo con setas SD1 y L1, ligeramente en línea vertical; A10 con setas L1-L2 próximas, dispuestas hacia el margen posterior de los espuripedios anales; ausente L3 en todos los segmentos abdominales. Ventralmente, A1 sólo con SV1, V1 más corta que SV1; A2-A4 con grupo-SV bisetoso; en A2 SV2, SV1 y V1, cada una en un pináculo y equidistantes entre sí; A3-A4 con setas SV1 y SV2 dispuestas en un mismo pináculo, seta V1 en un pináculo diferente, SV3 ausente en A1-A4 y A10 (Fig. 8); A5-A9 solo con setas V1 y SV1; A10 con grupo-SV bisetoso, con SV1 y SV2 dispuestas hacia el margen anterior de los espuripedios anales y V1 ventral al mismo. Espuripedios abdominales en A5-A6 con 7 a 9 crochets en mesoserie y anal en A10 con 8 a 9 crochets en mesoserie, ausencia de espuripedios en A4-A5.
Segundo estadio (Figs. 12-15). Ancho de la cabeza: 0,25-0,30 mm; longitud del cuerpo: 3,20-4,50 mm.
Coloración y patrón de diseño. Cabeza amarillo verdoso; suturas epicraneal y adfrontal de color castaño claro a oscuro; setas castaño oscuro a negras; stemmata negros; segmentos medio y distal de la antena, labro, palpo labial y maxilar e hipofaringe esclerosados, de color anaranjado a castaño oscuro; cuerpo de color blanquecino (con dieta artificial) a verde claro (con alimento natural); escudos protorácico y anal, placas de patas y espuripedios de color castaño claro o del color del cuerpo; patas color castaño claro a oscuro; pináculos y setas de color negro; espiráculos como en la larva del primer estadio; peritrema de espiráculos, crochets abdominales y anales esclerosados, de color castaño claro.
Morfología. Estructuras y quetotaxia similares al primer estadio, salvo las siguientes excepciones.
Cabeza: seta A3 más del doble de largo que A2 (Fig. 13); antena con segmento basal más ancho que largo, el medio más corto que el distal, segmento distal.
Tórax: T1 con setas SD1-SD2, L1-L2, SV1-SV2 en pináculos separados; T2-T3 con setas L1 y L2 como en T1, la seta L3 aparece por primera vez, posterior y en línea horizontal con L1 (Fig. 15).
Abdomen: dorsalmente, A8-A9 con setas D2 de longitud subiguales al resto de las setas D2 del abdomen (Fig. 13). Lateralmente, pináculos SD1 de A1-A4 ligeramente más grandes que los de A5-A9 (Fig. 15); seta L3 presente; A1-A6 y A8 con L3 posteroventral a L2; A7 con L3 en línea vertical con SD1, espiráculo y L2 (Fig. 15); en A10 setas L1, L2 y L3 próximas, dispuestas hacia el margen posterior de los espuripedios anales; seta SV3 presente en A1-A4. Ventralmente, A1 con SV3 en línea recta o ligeramente posterior a L2, V1 más corta que SV1 y SV3; A2-A4 con grupo-SV trisetoso; A2 con setas SV1, SV2, SV3 y V1, dispuestas en pináculos individuales; SV1, SV2 y SV3 guardan equidistancia entre sí; A3-A4 con setas SV1 y SV2 dispuestas en un pináculo común, mientras que SV3 y V1 se ubican en pináculos individuales (Fig. 14) Espuripedios abdominales en A5-A6 con 8 a 10 crochets en mesoserie y anal en A10 con 9 a 12 crochets en mesoserie.
Tercer estadio (Figs. 16-19). Ancho de la cabeza: 0,40-0,45 mm; longitud del cuerpo: 6,50-8,50 mm.
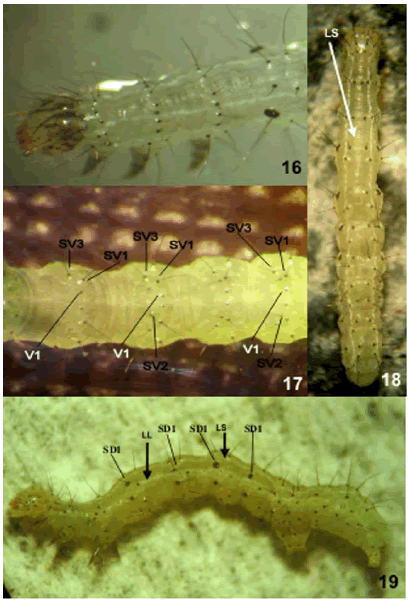
Figs. 16-19. Tercer estadio larval de R. nu. 16. Vista dorsal de la cabeza, se destaca el patrón de manchas. 17. Vista ventral de los segmentos A1-A4. 18. Vista dorsal del cuerpo. 19. Vista lateral del cuerpo. (LS, línea subdorsal; LL, línea lateral; SD1, seta subdorsal; SV1, SV2, SV3, setas subventrales; V1, seta ventral).
Coloración y patrón de diseño. Cabeza castaño claro a verde claro; algunos ejemplares con manchas en forma dendrítica (Fig. 16), castaño claro, oscuro o negras, la cubren total o parcialmente y que pueden permanecer en los estadios sucesivos; suturas epicraneal y adfrontal, región distal de antena, labro, último segmento del palpo labial y maxilar y ápice mandibular de color castaño claro a oscuro; pináculos y setas de color castaño claro, oscuro o negro; stemmata negros. Tórax-abdomen blanquecino (con dieta artificial) o verde claro a oscuro (con dieta natural); por primera vez aparecen dos pares de líneas bien definidas, subdorsal y lateral, delgadas, continuas y blancas; el parlateral, ventral a SD1; el par dorsal, próximo a la línea media dorsal, entre las setas D1; el par de líneas dorsal y addorsal son aún poco conspicuas en este estadio (Figs. 18, 19); escudos protorácico y anal del color del cuerpo, ligeramente visibles; pináculos y setas de color negro, las últimas subiguales en longitud; espiráculos como en las larvas del primer estadio; patas negras, castaño claro o del color del cuerpo; las placas de patas torácicas y espuripedios abdominales y anales son indistinguibles; crochets abdominales y anales esclerosados, de color castaño claro a anaranjado.
Morfología. Estructuras y quetotaxia similares al segundo estadio, salvo las siguientes excepciones: microespinas conspicuas de tamaño semejante, negras, distribuidas en casi todo el cuerpo, excepto sobre el patrón de líneas.
Abdomen: dorsalmente, en A3-A4 los pináculos SD1 y D1-D2 no sobresalen a manera de cono por encima del tegumento. Lateralmente, A1-A4 con pináculo SD1 ligeramente más grande que el espiráculo y los pináculos L1-L3. Ventralmente, A3-A4 con setas SV1-SV2 dispuestas en pináculos separados; SV1 más cerca de SV2 que de V1 (Fig. 17). Espuripedios abdominales en A5-A6 con 14 a 16 crochets en mesoserie y anal en A10 con13 a 16 crochets en mesoserie.
Cuarto estadio (Figs. 20-23). Ancho de la cabeza: 0,65-0,70 mm; longitud del cuerpo: 9,60-10,50 mm.

Figs. 20-23. Cuarto estadio larval de R. nu. 20. Vista lateral del cuerpo. 21. Vista lateral de la cabeza, se destaca la banda diagonal. 22. Vista dorsal en T1-T2, se destaca el patrón de líneas. 23. Vista dorsal, se destacan las microespinas en A1. (LA, línea addorsal; LD, línea dorsal; LL, línea lateral; LS, línea subdorsal).
Coloración y patrón de diseño: color de fondo variable, el más frecuente es el verde claro brillante a pálido, con dos bandas de color verde oscuro, una superior (entre las líneas dorsales) y otra supraespiracular (Figs. 20, 22); algunos individuos con el cuerpo completamente verde oliva u oscuro, sin bandas diferenciables; pináculos negros o blancos; setas delgadas, de longitud subigual, castaño oscuro o negras; peritrema de espiráculos castaño oscuro o del color del cuerpo e interior castaño claro, blanquecino o del color del cuerpo; escudos protorácico y anal, placas de patas torácicas, espuripedios abdominales y anales y crochets similares al tercer estadio.
Cabeza verde claro a verde amarillento; algunos ejemplares con bandas diagonales, negras en las genas, dispuestas sobre o por debajo del stemma 5 y stemma 6, en línea recta con SS1, alcanzan la región posterior de la cabeza (Fig. 21); manchas como las descriptas para la larva del tercer estadio; estos dos caracteres, si están presentes, persisten en los estadios más avanzados; suturas epicraneal y adfrontal castaño claro o del color de la cabeza; stemmata, pináculos, setas, región distal de la antena, labro, palpo maxilar y labial con coloración semejante al tercer estadio. Tórax-abdomen con cuatro pares de líneas conpiscuas, continuas y blancas: dorsales, addorsales, subdorsales, y laterales (Figs. 20, 22).
Tórax: espiráculo de T1 con peritrema castaño oscuro e interior castaño claro o del color del cuerpo; escudo protorácico del color del tegumento atravesado medialmente por las líneas dorsales, bordes laterales remarcados por las líneas addorsal y subdorsal que se fusionan en una sola; desde T2 en adelante, las líneas addorsal y subdorsal se mantienen separadas; línea lateral por debajo del grupo-L y el espiráculo; T2-T3 con línea dorsal más fina que las otras y próxima a la línea media dorsal; línea addorsal de ancho similar a la lateral dispuesta al nivel de D1, rodeándola completamente y, además, envuelve parcialmente en su lado dorsal la seta D2; la línea subdorsal es más angosta que la addorsal, ubicada por debajo de D2, envolviéndola por el lado ventral; línea lateral más del doble de ancho que la línea dorsal, ubicada por debajo del área espiracular (Fig. 22).
Abdomen: descripción de patrón de líneas similar a T2-T3, salvo las siguientes excepciones: el par lateral recorre el área espiracular; A10 con líneas dorsal, addorsal y subdorsal que alcanzan el escudo anal y fusionadas en la región media, línea lateral ventral a SD1 y SD2, descienden hacia la región ventral (Fig. 20).
Morfología. Cuerpo robusto, ligeramente más estrecho en el tórax. Cabeza, tórax y abdomen con estructuras y quetotaxia con descripción similar a las larvas del tercer estadio, salvo las siguientes excepciones: tegumento cubierto por microespinas de diferentes tamaños, distribuídas de manera extensiva sobre la banda superior (entre las líneas dorsales), la banda supraespiracular y toda la región ventral (Figs. 22, 23); todos los espiráculos son ovalados. Espuripedios en A5 con 16 a 19 crochets; en A6 con 18 a 20 crochets; espuripedios anales con 17 crochets; crochets en mesoserie.
Quinto estadio (Figs. 24-26). Ancho de la cabeza: 0,90-0,95 mm; longitud del cuerpo: 16,50-21,00 mm

Figs. 24-26. Quinto estadio larval de R. nu. 20. Vista lateral del cuerpo. 21. Vista lateral, se destacan las microespinas 22. Vista ventral, se destacan las microespinas. (L, setas laterales; SD1, seta subdorsal; SV, setas subventrales; V1, seta ventral).
Coloración y patrón de diseño. Similar a los descriptos para las larvas del cuarto estadio, salvo por las siguientes excepciones: cuerpo moteado, de color blanco. Cabeza con pináculos de color castaño oscuro a negro; palpo labial y maxilar con el extremo distal esclerosado, castaño oscuro a anaranjado; antena con los segmentos distal y/o medio esclerosados, de color castaño claro a oscuro.
Tórax pináculos D1 y D2 blancos o negros; pináculos SD1 y SD2 negros o del color del tegumento; los laterales (L1-L3) del color del tegumento, blancos o negros; todas las setas castaño claro a oscuro; patas parcial o totalmente del color del cuerpo, castaño claro o negro brillante.
Abdomen pináculos dorsales (D1 y D2) blancos o negros; subdorsales (SD1) negros o del color del tegumento; laterales del color del tegumento, blancos o negros; setas castañas oscuras, claras o sin coloración.
Morfología. Cuerpo robusto, con mayor tamaño de los segmentos abdominales y el tórax marcadamente más estrecho (Figs. 24, 25). Cabeza, tórax y abdomen con estructuras y quetotaxia similar a las larvas del cuarto estadio, salvo las siguientes excepciones: cabeza redondeada, proporcionalmente más pequeña respecto al cuerpo; microespinas del tegumento típicamente formando anillos alrededor de la base de SD, L, SV y V (Figs. 25, 26). Espuripedios en A5 con 19 a 20 crochets, en A6 con 20 a 21, espuripedios anales con 19 crochets; crochets en mesoserie.
Sexto estadio. Ancho de la cabeza 1,10-1,20 mm; longitud del cuerpo 24,00-30,00 mm. La larva conserva todas las características del estadio anterior. Dos o tres días antes de empezar a tejer el capullo, la coloración y patrones pierden intensidad.
Pupa (Figs. 27-34). Longitud en hembra: 12,00-13,30 mm, ancho 2,90-3,17mm; longitud en macho: 15,00-16,20 mm, ancho: 3,20-3,90 mm. Obtecta, adéctica, con delicado capullo glauco (Fig. 27). Dorsalmente castaño oscuro a negruzca y ventralmente castaño claro a rojizo, se oscurece gradualmente en los días próximos a la emergencia del adulto (Figs. 28-30). Tegumento del tórax (Pt, Mst, Mt) y abdomen (A1-A10) rugoso (Fig. 30). Esculturación del margen anterior de los segmentos abdominales con puntuaciones dorsales, esclerosadas y más concentradas en la región media que hacia los lados; margen posterior de los segmentos A4-A6 con una banda transversal y dorsal de espinas pequeñas; margen anterior de los segmentos A5-A6 con una hilera dorsal de espinas grandes que puede o no alcanzar la región media ventral (Fig. 34). Segmentos A2-A7 con espiráculos ovalados; el de A8 de mayor tamaño que los restantes; todos con peritrema de color castaño oscuro a negro e interior castaño claro a rojizo. Palpo labial (Pl) se extiende desde el clípeo hasta la mitad o más allá de la mitad del fémur anterior (Fa); fémur anterior corto, entre la parte anterior de la maxila (Mx) y la pata protorácica (Ppt); maxilas largas, se extienden hasta el margen posterior de A4, dejando expuesto el ápice distal de la pata metatorácica (Pmt); pata mesotorácica (Pms) ligeramente más corta que la pata metatorácica; antena (A) ampliamente arqueada anteriormente, convergente posteriormente, ligeramente más corta que las patas medias (Figs. 28-30); A8-10 fusionados; orificio genital (Og) sobre A8 en el macho (Fig. 32) y A7 en la hembra (Fig. 31). Cremáster más ancho que largo, rugoso; ventralmente, con un par central de espinas dobles unidas por su base, gruesas, 2 veces la longitud de las espinas adyacentes; dorsalmente con tres pares de espinas simples, pequeñas, delgadas (un par central y dos pares laterales), esclerosadas, de color castaño oscuro, con el extremo curvado a modo de gancho (Fig. 33).

Figs. 27-34. Pupa de R. nu. 27. Capullo. 28. Vista lateroventral. 29. Vista lateral. 30. Vista dorsal. 31. Vista ventral de los segmentos A5-A10 en la hembra. 32. Vista ventral de los segmentos A5-A10 en el macho. 33. Detalle del cremáster y quetotaxia del último segmento abdominal. 34. Detalle de esculturaciones en los segmentos abdominales. (Aa, ala anterior; A, antena; be; banda de espinas; Fa, fémur anterior; he, hilera de espinas, Mst, mesotórax; Mt, metatórax; Mx, maxila; Oa, orificio anal; Og, orificio genital; O, ojo; Pl, palpo labial; Pmt, pata mesotorácica; Ppt; pata protorácica; Pt, protórax).
Determinación del estadio larval
El ancho promedio de la cápsula cefálica más su desviación estándar y la razón de crecimiento para cada estadio larval se muestran en la Tabla I. La mayor razón de crecimiento fue de 1,60 en el cuarto estadio larval y, a partir del mismo, decrece paulatinamente hacia el sexto estadio. La razón promedio de crecimiento para R. nu fue de 1,43. El ancho promedio de la cápsula cefálica es de suma utilidad en muestreos a campo, ya que, sin hacer la cría del insecto es posible estimar la edad aproximada de la larva en una especie dada (Fig. 35). Los seis estadios larvales encontrados para R. nu concuerdan con lo reportado por Pereyra & Sánchez (1991), quienes mencionan como más frecuentes los individuos con seis estadios larvales (69%) que los de cinco (31%).
Tabla I. Resultados de la media del ancho (mm) de la cápsula cefálica, con su desvío estándar y razón de crecimiento de larvas de Rachiplusia nu, alimentadas en laboratorio con dieta artificial.
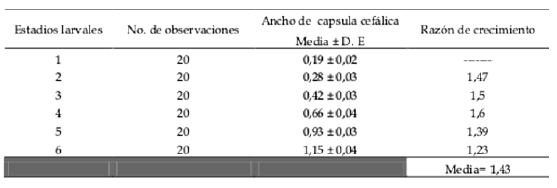

Fig. 35. Resultados de la medida del rango de tamaño de la cápsula cefálica (mm) para cada estadio larval de Rachiplusia nu.
DISCUSIÓN
Las dos especies de Plusiinae más relevantes en el cultivo de soja son Rachiplusia nu (Guenée) y Pseudoplusia includens (Walker). La correcta identificación de los estados inmaduros a campo y laboratorio de ambas especies presenta algunas dificultades. Por lo tanto, aquí se comentan los caracteres diagnósticos de R. nu en forma comparativa con los de P. includens (Angulo & Weigert, 1975; Eichlin & Cunningham, 1978; Lafontaine & Poole, 1991).
Los huevos de Rachiplusia nu presentan una roseta de aspecto petaloideo (Angulo & Weigert, 1975) con tres ciclos de celdas, regular en tamaño y forma, yuxtapuestas en su base y dispuestas en un mismo plano; mientras que en Pseudoplusia includens presenta dos a tres ciclos de celdas, irregulares en tamaño y forma, solo las celdas del primer ciclo se yuxtaponen en la base y las celdas primarias y secundarias no se disponen en un mismo plano.
En el primer estadio larval de R. nu, las setas SV1 y SV2 (en A3-A4) se ubican en un mismo pináculo, en tanto que la seta V1 se encuentra en un pináculo diferente. Esta disposición se mantiene estable hasta el último estadio larval y es típica de los representantes de la tribu Plusiini (Lafontaine & Poole, 1991). En contraposición, P. includens (tribu Argyrogrammatini) lleva esas tres setas (SV1, SV2 y V1) dispuestas en un mismo pináculo triangular. Además, el primer estadio larval de R. nu se puede reconocer fácilmente por la gran esclerotización de la cabeza, los escudos protorácico y anal, y los pináculos del cuerpo de color castaño oscuro, mientras que en P. includens la esclerotización es más débil y todas esas estructuras son de color castaño claro. Tales características son útiles solo para este estadio, ya que desaparecen en los subsiguientes. Adicionalmente, las mandíbulas de R. nu carecen de procesos internos en los dientes 2º, 3º y 4º, y la hilera presenta una forma tubular muy conspicua. En P. includens las mandíbulas se destacan por la presencia de procesos internos en los dientes 2º, 3º y 4º, y la hilera se reconoce por su forma cónica. Por último, ambas especies comparten la ausencia de L3 y SV3 en todos los segmentos abdominales, un carácter que separa el primer estadio de los siguientes.
En el segundo y tercer estadio larval de R. nu aparecen unas pocas microespinas distribuidas de manera homogénea en el cuerpo; los pináculos de SD1 (en A1-A4) son apenas más grandes que los pináculos L; los pináculos SD1 y D1-D2 en los segmentos abdominales no sobresalen a manera de cono por encima del tegumento y en A8-A9 las setas D2 son subiguales en longitud al resto de las setas D2 del abdomen. En contraposición, P. includens no presenta microespinas en el tegumento; los pináculos de SD1 (en A1-A4) son dos o tres veces más grandes que los pináculos L; los pináculos SD1 y D1-D2 en los segmentos abdominales sobresalen a manera de cono por encima del tegumento y en A8-A9 las setas D2 son más largas que el resto de setas D2 del abdomen.
A excepción de la quetotaxia, todos los caracteres larvales del último estadio recién aparecen a partir del cuarto estadio, con lo cual las descripciones disponibles se deben emplear con precaución en los estadios tempranos (primer al tercer estadio) (Angulo & Weigert, 1975; Betancourt & Scatoni, 2006; Ruffinelli, 1942).
En el cuarto estadio de R. nu, las microespinas son más abundantes, de tamaño variable, distribuidas de manera extensiva sobre banda superior (entre las líneas dorsales), banda supraespiracular y toda la región ventral; los cuatro pares de líneas blancas del patrón de diseño (dorsal, addorsal, subdorsal y lateral) se vuelven más conspicuos y definidos; la cabeza usualmente lleva una banda negra sobre las genas, que cuando está presente, incluye los stemmata 5 y 6. En contraposición, P. includens se reconoce porque por primera vez aparecen los esbozos de espuripedios vestigiales en A3 y A4, lo cual es característico de la tribu Argyrogrammatini; a su vez, aparecen también unas espínulas, que aún son poco notables (sólo visibles a 60X); tales espínulas son mucho más pequeñas y de naturaleza diferente a las microespinas de R. nu. De los cuatro pares de líneas del patrón de diseño (dorsal, addorsal, subdorsal y lateral), el par dorsal es aún poco notable y la cabeza lleva una banda negra sobre las genas, que si está presente, no incluye a los stemmata 5 y 6.
En el quinto y sexto estadio de Rachiplusia nu, la coloración resulta poco útil ya que es altamente variable; además de los caracteres mencionados para el cuarto estadio, las microespinas típicamente forman anillos alrededor de la base de SD, L, SV y V; este es el carácter quizás más importante para identificar a esta especie. Las larvas se pueden reconocer por la forma redondeada de la cabeza, proporcionalmente más pequeña respecto al cuerpo; el tórax es marcadamente más estrecho que el abdomen; carecen de pseudopatas vestigiales en A3 y A4 y en la cabeza los pináculos posteriores, A3 y L1 son subiguales en tamaño. Por su parte, Pseudoplusia includens se puede diferenciar por la cabeza proporcional al tamaño del cuerpo; el tórax y el abdomen ligeramente uniforme en ancho; la presencia de pseudopatas vestigiales en forma de botón en A3 y A4 (sólo visibles a 40x) (Argyrogrammatini); los pináculos SD1 a menudo negros y del doble de tamaño, en relación al espiráculo y los pináculos laterales y en la cabeza los pináculos posteriores, A3 y L1 se reconocen por su mayor tamaño.
La pupa de Rachiplusia nu dorsalmente presenta coloración castaña oscura a negruzca y ventralmente predomina una coloración castaño clara a rojiza; los segmentos T2-T3 están recorridos por una cresta longitudinal media bien conspicua; A4-A6 (en vista dorsal) con una banda de espinas formando un patrón de diseño particular; el cremáster es más ancho que largo y los últimos segmentos abdominales llevan setas castaño oscuras, conspicuas. La pupa de Pseudoplusia includens, por su parte, presenta coloración verde brillante; los ojos se destacan por su color castaño a anaranjado; dorsalmente el tórax y el abdomen llevan unas manchas conspicuas, circulares y en líneas transversas, de color castaño oscuro a anaranjadas; los segmentos T2-T3 no están recorridos por una cresta longitudinal media. Dorsalmente, entre el margen posterior de A4 a A6 se destaca una banda de espinas grandes; el cremáster es más largo que ancho y los últimos segmentos abdominales llevan setas incoloras e inconspicuas.
CONCLUSIONES
Los estudios morfológicos de Rachiplusia nu permitieron encontrar caracteres útiles que ayudan a diferenciar sus estados/estadios. A partir de este trabajo, se puede afirmar que, a pesar de la aparente similitud superficial, Pseudoplusia includens y Rachiplusia nu son completamente diferenciables en los estados preimaginales.
En el estado de huevo, la forma de la roseta y sus celdas, así como la disposición de estas últimas son caracteres decisivos para la identificación.
El primer estadio cuenta con caracteres únicos para su diferenciación, como la esclerotización de la cabeza y los escudos, y la ausencia de setas L3 y SV3; éstos se pierden en los estadios posteriores. Durante el segundo y tercer estadio los caracteres de quetotaxia cobran más relevancia.
A excepción de la quetotaxia, todos los caracteres larvales del último estadio recién aparecen a partir del cuarto estadio, con lo cual las descripciones disponibles se deben emplear con precaución en los estadios tempranos (primer al tercer estadio).
El tamaño, la coloración y la ornamentación de los segmentos abdominales en el estado de pupa resultan suficientes para diferenciar este taxón.
El tamaño de la cabeza ha sido empleada con éxito en la determinación de los estadios larvales de especies de lepidópteros (Iannacone & Alvariño, 2007; Specht, et al, 2007; Zenker, et al, 2007).
La determinación de la edad larval a partir de este estudio puede realizarse tomando en cuenta el ancho de la cápsula cefálica. Esta medida podría emplearse en conjunto con la longitud del cuerpo, debido a que para R. nu las mediciones de esta última no mostraron solapamiento en los distintos estadios. Toda vez que esta especie se detecte en el cultivo, se podría estimar el tiempo disponible para tomar medidas correctivas, considerando los datos de diagnosis morfológica y edad larval.
AGRADECIMIENTOS
Deseo agradecer a los Ing. Juan Carlos Morales y Maximiliano Alcocer (Consultora Rurais SRL, Tucumán, Argentina), por facilitarme el uso de los laboratorios y la cámara de cría. A Fernando Navarro, por las valiosas sugerencias aportadas durante la elaboración del manuscrito. Este estudio ha sido parcialmente financiado por el Proyecto CIUNT Nº G431 y PIP CONICET N° 0696.
BIBLIOGRAFÍA CITADA
1. ANGULO, A. O & G. T. H. WEIGERT. 1975. Estados inmaduros de Lepidopteros Noctuidos de importancia económica en Chile y claves para su identificación (Lepidoptera: Noctuidae). Soc. Biol. Concepción, Publ. Especial Nº 2. 153 pp. [ Links ]
2. ARAYA, C. J., V. P. ARRETZ, S. M. A. GUERRERO & C. L. LAMBOROT. 1997. Observaciones de Polistes buyssoni (Brethes) (Hymenoptera: Vespidae), depredador de larvas de Rachiplusia nu (Guenée) (Lepidoptera: Noctuidae) en Fréjol en la Región Metropolitana, Chile. Bol. San. Veg. Plagas 17(1-2): 19-23. [ Links ]
3. BETANCOURT, C. M. & I. B. SCATONI. 2006. Lepidópteros de importancia económica en el Uruguay. Reconocimiento, biología y daños de las plagas agrícolas y forestales. 2da Edición, Hemisferio Sur, Montevideo. [ Links ]
4. DYAR, H. G. 1890.The numbers of molts of lepidopterous larvae. Psyche 5: 420-422. [ Links ]
5. EICHLIN, T. D. & H. B. CUNNINGHAM. 1978. The Plusiinae (Lepidoptera: Noctuidae) of America north of Mexico, emphasizing genitalic and larval morphology. U. S. Dept. Agric. Tech. Bull. 1-27. [ Links ]
6. HINTON, H. E. 1946. On the homology and nomenclature of the setae of lepidopterous larvae, with some notes on the phylogeny of the Lepidoptera. Trans. R. Ent. Soc. Lond. 97: 1-37. [ Links ]
7. IANNACONE, J. & L. ALVARIÑO. 2007. Crecimiento alométrico de larvas de Spodoptera eridania (Cramer, 1782) (Lepidoptera: Noctuidae). Biologist 5(2): 52-59. [ Links ]
8. IGARZÁBAL, D., P. FICHETTI & M. TOGNELLI. 1994. Claves prácticas para la identificación de larvas de Lepidoptera en cultivos de importancia agrícola en Córdoba (Argentina). Gayana (Zoologia) 58(2): 99-142. [ Links ]
9. KITCHING, I. J. 1987. Spectacles and silver Ys: a synthesis of the systematics, cladistics and biology of the Plusiinae (Lepidoptera: Noctuidae), Bull British Mus. Nat. Hist. Ent. Ser. 49: 153-234. [ Links ]
10. LAFONTAINE , J. D. & R. W. POOLE. 1991. Noctuoidea (part) : Plusiinae. En: Hodges, R. W., D. R. Davis, T. Dominic, D. C. Ferguson, J. G. Franclemont, E. G. Munroe, & J. A. Powell (eds.) The Moths of America North of Mexico, fasc.25.1, Allen Press, Lawrence, pp. 1-182. [ Links ]
11. LEIVA , P. D. & N. IANNONE. 1993. Bioecología y daños de isoca medidora R. nu (G.), y gata peluda S. virginica (F.) en girasol. Carpeta de Producción Vegetal. INTA, EEA Pergamino, SERIE: GIRASOL, Tomo XII, Información Nº 55, Septiembre, 4 pp. [ Links ]
12. LUNA, M. G. & N. M. GRECO. 1998. Disposición espacial de larvas de Rachiplusia nu Guenée (Lepidoptera: Noctuidae) asociados en el cultivo de soja. Ecol. Austral 8: 41-47. [ Links ]
13. MARGHERITIS, A. E. & H. F. RIZZO. 1965. Lepidópteros de interés agrícola. Sudamericana, Buenos Aires. [ Links ]
14. MOSHER, E. 1916. A classification of the Lepidoptera based on characters of the pupa. Bull. Illinois State Lab. Nat. Hist. 12:13-159. [ Links ]
15. OSORES, V., E. WILLINK & M. COSTILLA. 1982. Cría de Diatraea saccharalis F. en laboratorio. Bol. de la EEAOC.139: 1-10 p. [ Links ]
16. PASTRANA, J. A. 2004. Los lepidopteros argentinos: sus plantas hospedadoras y otros sustratos alimenticios. Sociedad Entomológica Argentina, Buenos Aires.334 pp. [ Links ]
17. PASTRANA, J. A., O. R. DI DORIO, F. NAVARRO, A. CHALUP & M. E. VILLAGRAN. 2004. Lepidoptera. En: Cordo, H. A., G. Logarzo, K. Braun & O. Di Iorio (dir.). Catálogo de Insectos Fitófagos de la Argentina y sus Plantas Asociadas, Sociedad Entomológica Argentina, Buenos Aires. pp. 416-515. [ Links ]
18. PEREYRA, P. C. & N. E. SANCHEZ. 1991. Tablas de vida de Rachiplusia nu (Lepidoptera: Noctuidae) en laboratorio. En: Res. XV Reunión Argentina Ecología, Rosario, 1991, pp. 9. [ Links ]
19. PEREYRA, P. C .1995. Ecología nutricional de la "oruga medidora" Rachiplusia nu (Lepidoptera: Noctuidae). Rev. Soc. Entomol. Argent. 54(1-4):31-40. [ Links ]
20. RIZZO, H. F. E. & E. D. SAINI. 1990. Insectos perjudiciales al cultivo de soja en Argentina y sus principales enemigos naturales. INTA, Buenos Aires. [ Links ]
21. RUFFINELLI, A. 1942. La oruga del girasol y sus parásitos naturales. Rev. de la Asoc. de Ing. Agrónomos 4: 29-35. [ Links ]
22. SALKELD, E. H. 1984. A catalogue of the eggs of some Canadian Noctuidae (Lepidoptera). Mem. Ent. Soc. Can. 127: 1-167. [ Links ]
23. SÁNCHEZ, N. E. & P. C. PEREYRA. 1995. Life tables of the soybean looper Rachiplusia nu (Lepidoptera: Noctuidae) in the laboratory. Rev. Soc. Entomol. Argent. 54 (1-4): 89-96. [ Links ]
24. SANNINO, L. & B. ESPINOSA. 1999. Morphological notes on Mamestra brassicae (Lepidoptera: Noctuidae). II Tabaco, 7: 13-24. [ Links ]
25. STEHR, F. W. 1987. Order Lepidoptera. En: Stehr, F. W. (ed.) Inmature Insects, Kendall/Hunt Publ., Dubuque, pp 288-340. [ Links ]
26. ZENKER, M. M. & A. SPECHT & E. CORSEUIL. Estagios imaturos de Spodoptera cosmioides (Walker), (Lepidoptera: Noctuidae). Rev. Bras. Zool. 24(1): 99-107. [ Links ]














