Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de la Sociedad Entomológica Argentina
versión impresa ISSN 0373-5680
Rev. Soc. Entomol. Argent. vol.72 no.1-2 Mendoza jun. 2013
TRABAJOS CIENTÍFICOS
Oribátidos (Acari: Oribatida) de la Selva Marginal de Punta Lara, Buenos Aires, Argentina
Oribatid mites (Acari: Oribatida) from the riparian forest of Punta Lara, Buenos Aires, Argentina
Accattoli, Cecilia1, Ana E. Salazar Martínez1, Pablo A. Martínez2
1División Entomología, Museo de La Plata. Universidad Nacional de La Plata. Paseo del Bosque, s/n. La Plata, Argentina. CP: 1900.
2Departamento de Biología, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata. Funes 3350. Mar del Plata, Argentina. CP: 7600. ceaccattoli@fcnym.unlp.edu.ar
Recibido: 3-XII-2012;
Aceptado: 18-IV-2013
RESUMEN. En el presente trabajo se relevaron diversos biotopos de la Selva Marginal de Punta Lara, provincia de Buenos Aires, Argentina, para conocer el elenco de ácaros oribátidos que allí habitan. Se hallaron 28 especies, de las que siete resultaron nuevas para Argentina: Epilohmannia sculpturata Balogh & Mahunka, Nothrus willmanni Mahunka, Xenillus (Xenillus) fecundus P. Balogh, Xenillus (Xenillus) superbus (Perez-Íñigo & Baggio), Zetomimus (Protozetomimus) polpaicoensis (Hammer), Pseudotocepheus (Pseudotocepheus) pauliensis Pérez-Íñigo & Baggio y Lohmannia (Lohmannia) juliae Mahunka. El biotopo más diverso resultó la hojarasca de la selva con 20 especies. Se discuten cuestiones zoogeográficas del sistema estudiado.
PALABRAS CLAVE. Suelo; Mantillo; Oribatida; Selva marginal; Región Neotropical.
ABSTRACT. Several biotopes in the riparian forest of Punta Lara, Buenos Aires province, Argentina, were sampled for oribatid mites. Twenty eight species were found, of which seven are recorded for Argentina for the first time: Epilohmannia sculpturata Balogh & Mahunka, Nothrus willmanni Mahunka, Xenillus (Xenillus) fecundus P. Balogh, Xenillus (Xenillus) superbus (Perez-Íñigo & Baggio), Zetomimus (Protozetomimus) polpaicoensis (Hammer), Pseudotocepheus (Pseudotocepheus) pauliensis Pérez-Íñigo & Baggio and Lohmannia (Lohmannia) juliae Mahunka. The most diverse biotope was forest litter, with 20 species. Some zoogeographical issues are discussed.
KEY WORDS. Soil; Litter; Oribatida; Riparian forest; Neotropical Region.
INTRODUCCIÓN
En el cono sur de América del Sur, en el área ocupada actualmente por Argentina y Chile, existen diversas formaciones boscosas, desde tropicales en el noreste hasta subantárticas en el sur. Argentina posee más de 30 millones de hectáreas de bosques nativos, lo que representa un 15% del total del territorio nacional. Si bien han sido alteradas en gran parte, por la explotación maderera y/o desmontadas para implantar cultivos, procedimientos que actualmente se mantienen, aún perduran áreas de bosque primario.
Este trabajo es el primero de una serie dedicada al estudio de la fauna de ácaros oribátidos de Argentina que habita suelos de bosques nativos en Parques Nacionales y/o Reservas Naturales, y trata de las especies halladas en la selva marginal de Punta Lara (Reserva Natural Integral de Punta Lara, Buenos Aires). Mientras que algunos grupos de fauna y flora de este ambiente han sido objeto de estudios [e.g., aves (Klimaitis & Moschione, 1987; Darrieu et al., 1988), roedores y sus ectoparásitos (Massoia, 1961; Lareschi, 2000), líquenes (Osorio, 1976), helechos (Giudice et al., 2011) y plantas compuestas (Colares, 2010)], la fauna de microartrópodos edáficos, y la de ácaros en particular, han permanecido largamente ignoradas.
En Argentina el conocimiento del Suborden Oribatida Dugès (Norton & Behan-Pelletier, 2009) es escaso a pesar de ser uno de los grupos de artrópodos de suelo más numeroso y de mayor diversidad específica. En cuanto a su presencia en bosques nativos, sólo se efectuaron relevamientos en un sector del bosque Atlántico del Alto Paraná, en el límite entre Argentina y Brasil (Martínez et al., 2009) y en bosques andino patagónicos dominados por especies de Nothofagus (Kun et al., 2010), en el noroeste de la Patagonia Argentina. Se estima que las especies citadas hasta el presente en nuestro país representan 3-4% de las especies conocidas a nivel mundial (Subías, 2004; Martínez, 2008), pero que dicho valor subestima varias veces el valor real.
Nuestro objetivo es incorporar información sobre la distribución geográfica de especies de oribátidos para estimar su biodiversidad en Argentina y en la región Neotropical. En esta publicación se presentan los resultados obtenidos para la Reserva Natural Integral de Punta Lara, provincia de Buenos Aires.
- Punta Lara, selva marginal:
Hace más de medio siglo la ribera argentina del Río de la Plata debió estar cubierta por una densa selva marginal que se extendió hasta el Partido de Magdalena, interrumpiéndose al aumentar la salinidad por el ingreso de agua desde el Atlántico (Cabrera & Dawson, 1994). Hoy sólo quedan de ella dos porciones: una a la altura de la localidad de Hudson y otra de mayor extensión en Punta Lara. La ribera del Río de La Plata está formada por un albardón arenoso o limoso-arcilloso y por bancos de conchillas. Sobre las partes arenosas o limosas se desarrolla una sucesión vegetal que, de no ser alterada por el hombre, culmina en la selva marginal. En una región donde la vegetación clímax es la estepa de gramíneas, la selva marginal es considerada un subclimax que se mantiene gracias a factores de compensación, tales como un microclima más húmedo y cálido que el clima de la región circundante, un suelo aluvial arcilloso-limoso pobre en humus y con un alto contenido de agua, y la influencia del río y el viento (Cabrera & Dawson, 1994; Dascanio & Ricci, 1988). Durante la primavera, vientos del sudeste que influyen notablemente sobre el oleaje, acompañados por fuertes lluvias, incrementan el nivel del río causando inundaciones que degradan el suelo, trasladan materiales y actúan sobre la vegetación socavando raíces, dispersando semillas, redistribuyendo los restos orgánicos sobre el sustrato, etc.
En esta zona pueden distinguirse varias comunidades vegetales, desde la costa hacia el interior: el juncal dominado por Scirpus californicus (Meyer) Steud., sucedido por ciperáceas, entre las que se destaca por su abundancia Heliocharis bonariensis Nees. Luego se observan asociaciones de Panicum decipiens Nees., Leersia hexandra Sw. y H. bonariensis. Hacia el interior estas asociaciones de gramíneas y ciperáceas son sustituidas por matorrales arbustivos de Phyllanthus sellowianus Müll. y Sesbania punicea Benth. Le siguen bosques claros de Salix humboldtiana Willd., Sapium haematospermun Müll., culminando con la selva marginal (Cabrera & Dawson, 1994). La selva marginal (34º 48'S; 58º 00'O), ubicada a unos 12 km de la ciudad de La Plata y a unos 10 km de Ensenada, ocupa actualmente una superficie estimada de 6000 hectáreas, de las cuales 3000 están protegidas y 31 de estas últimas corresponden a la Reserva Natural Integral de Punta Lara (ver Fig. 1). El 38% de la superficie de la reserva son bosques, de los cuales el 24% corresponde a selva marginal y el 14% a bosques de ligustro (Ligustrum lucidum Ait., exótica), el 55% de la superficie restante está ocupada por gramíneas (Cabrera & Dawson, 1994; Dascanio et al., 1994; Burkart et al., 1999). La selva marginal, dominada por árboles nativos como Pouteria salicifolia (Spr.) Ralk (28%), Blepharocalyx tweediei Hook et Arn. (16%) y Ocotea acutifolia (Nees) Mez (13%), constituye el 82% de la biomasa vegetal (Cabrera & Dawson, 1994). Debido a la tasa de producción y descomposición de materia orgánica, la selva tiene una alta disponibilidad de material orgánico que podría ser exportado, pero esto se ve interrumpido por el desarrollo urbano, y por la ruta provincial número 11, que actúan como barrera para la circulación de materiales y alteran el régimen hídrico de la zona. Esta carretera, mayormente pavimentada y de 583 km, une las localidades de Punta Lara y Mar del Sur bordeando las costas del río de La Plata y el Océano Atlántico. En Punta Lara, la misma se halla separada de la línea de costa por sólo 15 m, y provoca la acumulación de materia orgánica haciendo del suelo un medio óptimo para el desarrollo de comunidades edáficas.

Fig. 1. Imagen satelital de la ribera del Río de La Plata y alrededores (Punta Lara), provincia de Buenos Aires. Se señala la ubicación de los ecosistemas muestreados.
MATERIAL Y MÉTODOS
Para el desarrollo de este trabajo se seleccionaron al azar 20 espacios de 1 m2 cada uno, en la selva marginal dentro del área protegida destinada a investigación. En mayo de 2010 se recolectaron muestras de suelo, mantillo, troncos en avanzado estado de descomposición y cubierta musgosa. Además, se incluyeron 10 unidades muestrales de suelo del pastizal aledaño (ver Fig. 1). La unidad de muestreo de suelo fue de aproximadamente 300 cm3 y el mantillo se retiró de un cuadrado de 20 cm x 20 cm. El tamaño de las muestras restantes fue adecuado al desarrollo del sustrato. En total, se tomaron 80 muestras: 30 de suelo, 20 de mantillo, 15 de troncos y 15 de musgos. El material faunístico fue extraído en embudos Berlese de 2,5 mm de abertura de malla, durante quince días y conservado en alcohol 70%. Los oribátidos fueron identificados a nivel especie, mediante las claves de Balogh & Balogh (1988,1992a,1992b). La nomenclatura empleada sigue a Subías (2004). La riqueza específica se estimó a través del número de especies por sustrato y la afinidad entre los grupos de oribátidos en éstos, mediante el índice de similitud J de Jaccard.
RESULTADOS
Se recolectaron 777 individuos pertenecientes a 28 especies (Tabla I); 96,4% de los individuos y 89,3% de las especies fueron recolectados en la selva marginal. Del total de especies identificadas, cuatro fueron halladas en suelos de pastizal (3,6% del total de individuos) y entre ellas sólo Oribatella (O.) neonominata Fernández & Alzuet [= Oribatella longisetosa Fernández & Alzuet, 1978. pg. 61-65], fue registrada también en la selva marginal. Aunque el número de muestras recolectadas en el pastizal fue menor, interpretamos el alto número de especies propias de los sistemas ecológicos relevados como un índice de la individualidad estructural de las comunidades de oribátidos de la Reserva y de la importancia de las prospecciones sobre mesofauna edáfica a la hora de evaluar la biodiversidad de la misma. El número de especies de oribátidos halladas es bajo en comparación con otros sistemas naturales de la zona; Fredes (com. pers., 2013) menciona hasta 47 especies en talares y pastizales de Magdalena. Atribuimos la diferencia a que nuestro relevamiento se realizó en un único momento del año y a que los suelos estudiados están sometidos a pulsos de inundación.
El mantillo presentó la mayor riqueza específica con 20 especies, seguida por el suelo con nueve especies. Siete especies fueron comunes a ambos ambientes. El elenco oribatológico del mantillo se diferenció en un 60% del resto de los sustratos (J= 40%) (Tabla I).
Tabla I: listado de especies registradas en ecosistemas de la Reserva Natural de Punta Lara: selva marginal y pastizal. * = nuevas cita de la especies para el país. ■ = nueva cita del género para la provincia de Buenos Aires.
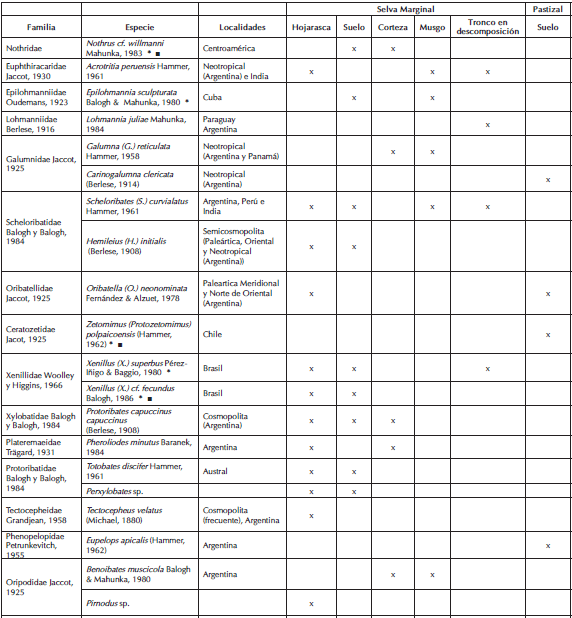

Benoibates muscicola Baranek, fue hallado exclusivamente en muestras de musgo y corteza arbórea de la selva marginal. Estos resultados coinciden con las observaciones realizadas por Baranek quien describió a la especie como característica de suelos húmedos cubiertos por un tapete de musgo (Baranek, 1981; 1982).
Las especies correspondientes a la familia Phthiracaridae fueron registradas sólo en muestras de mantillo. Woas (2002) sostiene que los ptiracáridos son comunes en suelos húmedos y especialmente diversos en áreas con mantillo bien desarrollado. Esta familia reúne especies que son en su mayoría macrofitófagas y algunas presentan preferencia alimentaria por madera en descomposición (Romani & Haq, 1991; 2001). Esto explicaría la presencia de al menos tres especies en el estrato superficial de la selva marginal, que aunque se caracteriza por un suelo con escaso desarrollo de mantillo, posee una gran cantidad de troncos caídos en descomposición.
Se citan por primera vez para el país siete especies, de las cuales 5 corresponden a nuevas citas del género para la provincia de Buenos Aires (Tabla I).
NUEVAS CITAS:
1 -Epilohmannia sculpturata Balogh & Mahunka. La especie fue citada inicialmente para Cuba en mantillo en un bosque montano a 1450 msnm. En Punta Lara se encontró en suelo y cobertura musgosa en troncos, en la selva marginal. Tres especies del género fueron citadas con anterioridad en Argentina; E. ovalis Berlese y E. maurii Fernández, ambas registradas en la provincia de Buenos Aires, en las localidades de La Plata y Río Luján respectivamente, y E. pallida americana Balogh & Mahunka, de amplia distribución, citada para localidades de la provincia de Buenos Aires, como Miramar y La Plata (Fredes et al., 2009; Salazar Martínez et al., 2010).
2 -Nothrus willmanni Mahunka. La descripción original se realizó sobre la base de ejemplares de Guatemala recolectados en mantillo en un bosque tropical y ha sido registrada en Panamá, Costa Rica, Cuba y en Quintana Roo (México), asociada a sistemas forestales tropicales especialmente en el mantillo (Schatz, 2006; Rodríguez-Arrieta & Retana-Salazar, 2010), donde las especies del género Nothrus son comunes. En Punta Lara fue una especie frecuente en suelo y corteza de árboles.
En Argentina fueron citadas con anterioridad cuatro especies de este género, para las provincias de Salta, Mendoza, Santa Cruz (N. suramericanus Hammer), Río Negro y Tierra del Fuego (N. peruensis Hammer); en Miramar, provincia de Buenos Aires, se han citado N. ananuniensis Canestrini & Fanzago (=N. biciliatus Koch "sp. inq.") y N. becki Balogh & Mahunka (Fredes et al., 2009).
3, 4 -Xenillus (Xenillus) fecundus P. Balogh y Xenillus (Xenillus) superbus (Perez-Íñigo & Baggio) (Dinoxenillus). Ambas especies fueron registradas previamente en San Pablo, Brasil, en mantillo y humus de bosque. En Punta Lara fueron halladas en mantillo, suelo y troncos en descomposición; sólo dos especies del género han sido citadas con anterioridad para Argentina, Xenillus (X.) argentinensis Balogh & Balogh, y Xenillus (X.) lawrencei Balogh & Balogh, ambas en la provincia de Córdoba.
5 -Zetomimus (Protozetomimus) polpaicoensis (Hammer) (Ceratozetes). La especie fue descripta en suelo bajo pastos y Ranunculus sp. en la ribera del estero Polpaico en Chile, al norte de la Región Metropolitana. En Punta Lara se registró en pastizal en suelo de la planicie de inundación del Arroyo Las Cañas. Una especie del género fue citada con anterioridad para Argentina en la provincia de Río Negro, Z. (Z.) furcatus (Warburton 6 Peace) (=Ceratozetes argentinensis Hammer,1958:86).
6 -Pseudotocepheus (Pseudotocepheus) pauliensis Perez-Íñigo & Baggio. Esta especie de distribución neotropical fue registrada previamente en Brasil y Uruguay. En Punta Lara fue registrada en mantillo y corteza de árboles cubierta por musgos. Tres especies de este género fueron citadas para Argentina, P. ( P. ) andinus (Fernández, Martínez & Eguaras) en la provincia de Mendoza, P ( P. ) australis Mahunka y P ( P.) hauseri Mahunka en Tierra del Fuego.
7 -Lohmannia (Lohmannia) juliae Mahunka. La especie fue descripta sobre la base de ejemplares recolectados en mantillo de un bosque en galería en Concepción, Paraguay. En Punta Lara se encontró en troncos en descomposición. Tres especies correspondientes a este género presentan distribución Neotropical, Lohmannia (L.) similis Balogh, Lohmannia (L.) lanceolata Grandjean y Lohmannia (L.) jornoti Mahunka.
Se identificaron también individuos pertenecientes a la especie Protoribates (Protoribates) capuccinus Berlese. Esta especie fue citada con anterioridad para la provincia de Buenos Aires como Xylobates capuccinus angustior (Jacot).
Protoribates es un género cosmopolita (excepto Antártida), frecuente en la región tropical y subtropical. Fueron citadas con anterioridad para Brasil las especies Protoribates ( P. ) iracemae Pérez-Íñigo & Baggio y Protoribates (P.) rioensis Badejo, Woas & Beck. Protoribates (Triaungius) praeoccupatus Subías (=Brasilobates bipilis Pérez-Íñigo & Baggio, 1980:135. "nom. praeoc."por Hammer, 1972: 44 como Xylobates bipilis) constituye la primera cita del género para el país.
Al mismo tiempo se citan por primera vez para la provincia de Buenos Aires Eupelops apicalis (Hammer) y Acrotritia peruensis (Hammer), citadas previamente en Argentina para la provincia de Río Negro, en Bariloche y El Bolsón, respectivamente
Aspectos zoogeográficos. Existen pocos trabajos que hayan caracterizado los ensambles de oribátidos propios de diferentes ecosistemas. Uno de ellos es el de Woas (2002), que hizo énfasis en los agrupamientos propios de bosques tropicales y templados. De acuerdo con este autor, existen cuatro agrupamientos de oribátidos, correspondientes a: bosques tropicales + subtropicales, propiamente subtropicales, bosques templados del hemisferio sur y fauna propia del hemisferio norte. Dependiendo del porcentaje, de cada una de esas faunas, hallado en un ambiente en particular, puede estimarse qué tan alejado se halla del ambiente tipo. En el presente estudio, la fauna de la selva marginal de Punta Lara muestra el mayor porcentaje (17,9) de especies de regiones templadas del hemisferio sur. Este hecho podría parecer obvio, dada la ubicación de la reserva, pero está informando, además de que se caracteriza como un bosque templado, que dicho bosque está en un grado aceptable de conservación. De lo contrario, el porcentaje de especies indicadoras podría ser menor, al ser reemplazadas por especies generalistas. Por otra parte, el hecho de que las especies tropicales + subtropicales sea bajo (10,7), habla de una escasa influencia de esa fauna en este ambiente. Cabe destacar que se halló una sola especie de un género caracterizado por Woas como tropical (Benoibates) y otra de un género propio del hemisferio norte (Eupelops). El género Eupelops es en realidad cosmopolita, pero es mucho más diverso en el hemisferio norte, habiéndose hallado en Sudamérica tres especies y sólo una en nuestro país.
CONCLUSIONES
Del material recolectado en suelos de selva marginal y pastizal, en Punta Lara, se citan por primera vez siete especies para Argentina. A partir de esta información se destaca la diferencia entre el elenco oribatológico de los dos ambientes analizados. El análisis de la taxocenosis de ácaros oribátidos nos permite sostener que la selva marginal de Punta Lara, a pesar de la cercanía a centros urbanos y la gran afluencia de visitantes, es un bosque que se halla en buen estado de conservación.
El número de nuevas citas de especies y géneros detallados en este trabajo evidencia la importancia de los sistemas forestales nativos como reservorios de biodiversidad, y la relevancia de este tipo de estudios.
BIBLIOGRAFÍA CITADA
1. BALOGH, J. & P. BALOGH. 1988. Oribatid mites of the neotropical region I. En: Balogh, J. & (eds.). The soil mites of the world, Elsevier. Amsterdam, pp. 1-335. [ Links ]
2. BALOGH, J. & P. BALOGH. 1992a. The Oribatid Mites Genera of the World. Volume I. Hungarian Natural History Museum Press, Budapest. [ Links ]
3. BALOGH, J. & P. BALOGH. 1992b. The Oribatid Mites Genera of the World. Volume II. Hungarian Natural History Museum Press, Budapest. [ Links ]
4. BARANEK, S. E. 1981. Contribución al estudio de la familia Oripodidae (Acari, Oribatei). I. Physis, Sección C 40(98): 19-25. [ Links ]
5. BARANEK, S. E. 1982. Contribución para el conocimiento de la familia Oripodidae (Acari, Oribatei). II. Physis, Sección C 41(100): 99-124. [ Links ]
6. BURKART, R., N. BÁRBARO, R. O. SÁNCHEZ & D. A. GÓMEZ. 1999. Eco-regiones de la Argentina. Administración de Parques Nacionales y Secretaría de Recursos Naturales y Desarrollo Sustentable. Buenos Aires. [ Links ]
7. CABRERA, A. L. 1971. Fitogeografía de la República Argentina. Boletín de la Sociedad Argentina de Botánica. Buenos Aires 14(1-2): 1-42. [ Links ]
8. CABRERA, A. L. & G. DAWSON. 1994. La Selva Marginal de Punta Lara en la ribera argentina del Río de La Plata. Revista del Museo de La Plata. Sección Botánica 22: 267-382. [ Links ]
9. COLARES, M. N. 2010. Mikania cordifolia y Mikania micrantha (Asteraceae): Especies medicinales nativas de las Reservas Naturales de Punta Lara e Isla Martín García, Buenos Aires, Argentina. Tesis de Magister, Universidad Nacional de La Plata, Buenos Aires, Argentina. 148 pp. [ Links ]
10. DARRIEU, C. A., G. SOAVE & E. SOAVE. 1988. Nidificación de Passeriformes en la Reserva Integral de Punta Lara y sus alrededores, Buenos Aires, Argentina. El Hornero 13: 53-58. [ Links ]
11.DASCANIO, L. M. & S. E. RICCI. 1988. Descripción florístico-estructural de las fisonomías dominadas por árboles en la Reserva Integral de Punta Lara (Provincia de Buenos Aires, República Argentina).Revista del Museo de La Plata (Nueva Serie). Sección Botánica 97(14): 191-206. [ Links ]
12. DASCANIO, L. M., M. D. BARRERA & J. L FRANGI. 1994. Biomass structure and dry matter dynamics of subtropical alluvial and exoctic Ligustrum forests at the Río de La Plata, Argentina. Vegetatio 115: 61-76. [ Links ]
13. FERNÁNDEZ, N. A. & A. BISCHOFF DE ALZUET. 1978. Notas sobre la fauna oribatológica argentina I. Oribatella longisetosa n. sp. (Acari, Oribatellidae). Revista de la Sociedad Entomológica Argentina 37(1-4): 61-65. [ Links ]
14. FREDES, N. A., P. A. MARTÍNEZ, V. BERNAVA LABORDE & M. L. OSTERRIETH. 2009. Microartrópodos como indicadores de disturbio antrópico en entisoles del área recreativa de Miramar, Argentina. Ciencia del Suelo 27(1): 89-101. [ Links ]
15. GIUDICE, G. E., J. P. RAMOS GIACOSA, M. L. LUNA, A. YAÑEZ & E. R. DE LA SOTA. 2011. Diversidad de helechos y licófitas de la Reserva Natural Punta Lara, Buenos Aires, Argentina. Revista de Biología Tropical 59: 1037-1046. [ Links ]
16. HAMMER, M. 1958. Investigations on the Oribatid Fauna of the Andes Mountains. I. The Argentine and Bolivia. Biologiske Skrifter udgivet af Det Kongelige Danske Videnskabernes Selskab 10(1): 1-129. [ Links ]
17. HAMMER, M. 1972. Investigation on the Oribatid Fauna of Tahiti, and some oribatids found on the Atoll Rangiroa. Biologiske Skrifter udgivet af Det Kongelige Danske Videnskabernes Selskab 19(3): 1-65. [ Links ]
18. KLIMAITIS, J. F. & F. MOSCHIONE. 1987. 18. Aves de la Reserva Integral de Selva Marginal de Punta Lara y sus alrededores. Ministerio de Asuntos Agrarios de la Provincia de Buenos Aires, Buenos Aires. [ Links ]
19 KUN, M. E., P. A. MARTÍNEZ & A. GONZÁLEZ. 2010. 19. Oribatid mites (Acari: Oribatida) from Austrocedrus chilensis and Nothofagus forests of Northwestern Patagonia (Argentina). Zootaxa 2548: 22-42. [ Links ]
20. LARESCHI, M. 2000. Estudio de la Fauna Ectoparásita 20. (Acari, Phthiraptera y Siphonaptera) de Roedores Sigmodontinos (Rodentia: Muridae) de Punta Lara, Provincia de Buenos Aires. Tesis de doctorado. Facultad de Ciencias Naturales y Museo. Universidad Nacional de La Plata, Buenos Aires, Argentina.174 pp. [ Links ]
21. MARTÍNEZ, P. A. 2008. Oribatida. 21. En: Claps, L. E., G. Debandi & S. Roig-Juñent. (dirs.) Biodiversidad de artrópodos argentinos 2. Editorial Sociedad Entomológica Argentina, pp. 129-140. [ Links ]
22. MARTÍNEZ, P. A., N. A. FREDES, L. F. MONTTI & S. A. 22. CASERTANO. 2009. Soil oribatid mites in four typical vegetation communities of Misiones forest in the Iguazú area (Argentina). Pesquisa Agropecuária Brasileira 44(8): 1021-1026. [ Links ]
23. MASSOIA, E. 1961. Notas sobre los cricétidos de la Selva 23. Marginal de Punta Lara (Mammalia, Rodentia). Publicaciones del Museo Municipal de Ciencias Naturales y Tradicional de Mar del Plata 1: 115-124. [ Links ]
24. MORRONE, J. J. 2001. Panbiogeografía, componentes 24. bióticos y zonas de transición. Revista Brasileira de Entomología 48(2): 149-162. [ Links ]
25. NORTON, R. A. & V. M. BEHAN-PELLETIER. 2009. 25. Suborder Oribatida. En: G. W. Krantz & D. E. Walter (eds.). A Manual of Acarology, Third Edition, Texas Tech University Press, pp. 430-564. [ Links ]
26. PÉREZ-IÑIGO & BAGGIO. 1980. Oribátidos edáficos do 26. Brasil. I. Boletim de Zoologia, Universidade São Paulo 5: 111-117. [ Links ]
27. OSORIO, H. 1976. Contribution to the lichen flora of 27. Argentina. VIII. Lichens from Punta Lara, Buenos Aires Province. Bryologist 79: 358-360. [ Links ]
28. RODRIGUEZ-ARRIETA, J. A. & A .P. RETANA-SALAZAR. 28. 2010. Dynamics of soil oribatids (Acari) in a tropical regeneration ecosystem of Costa Rica. Entomotropica 25(3): 125-132. [ Links ]
29. ROMANI, N. & M. A. HAQ. 1991. Potencial of 29. Meristocarus degradatus y Xylobates rhomboides (Acari: Oribatei) in the degradation of higher plant materials. En: Dusbábek F. & V. Bukva (eds.), Modern Acarology, Vol 1, Proceedings of the VIII International Congres of Acarology, held in ceske Budlojvice, Czechoslovacia, 6-11 August 1990. Academic, Prague and SPB academic Publishing, The Hague, pp. 411-415. [ Links ]
30. ROMANI, N. & M. A. HAQ. 2001. Feeding habits of the 30. Indian oribatid mites Hoplophthiracarus rimosus (Phthiracaridae) and Lohmannia n.sp. (Lohmanniidae) and their role in decomposition. En: R. B. Halliday, D. E. Walter, H. C. Proctor, R. A. Norton & M. J. Colloff (eds.). Acarology Proceedings of the 10th International Congress. CSIRO Publishing Melbourne, pp. 262-265. [ Links ]
31. SALAZAR MARTÍNEZ, A., C. ACCATTOLI, P. MARTÍNEZ 31. & J. A. SCHNACK. 2010. Diversidad de oribátidos (Acari: Oribatida) del "Paseo del Bosque", La Plata (Buenos Aires, Argentina). Ciencia del Suelo (Argentina) 28(2):181-190. [ Links ]
32. SCHATZ, H. 2006. Catalogue of known oribatid mite 32. species (Acari: Oribatida) from the Central American landbridge (First part). Tropical Zoology 19: 209-288. [ Links ]
33. SUBÍAS, L. S. 2004 (actualizado en 2011). Listado 33. sistemático, sinonímico y biogeográfico de los Ácaros Oribátidos (Acariformes, Oribatida) del mundo (1758-2002). Graellsia 60 (número extraordinario). 305 pp. [página web], dirección página web, [fecha de acceso]. [ Links ]
34. WOAS, S. 2002. Morphological organization and systematic 34. groups of Oribatida. Joachim Adis (eds.). Amazonian Arachnida and Myriapoda, pp. 21-291 [ Links ]













