Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de la Sociedad Entomológica Argentina
versión impresa ISSN 0373-5680
Rev. Soc. Entomol. Argent. vol.74 no.1-2 La Plata jun. 2015
TRABAJO CIENTÍFICO
Chironomidae (Diptera) en cursos de agua de Puna y Chaco Serrano de Catamarca (Argentina): primeros registros y distribución de géneros y especies
Chironomidae (Diptera) in water courses of the Puna and Chaco Serrano of Catamarca (Argentina): first records and distribution of genus and species
Rodríguez Garay, Gretel N.1 & Analía C. Paggi2
1CONICET, UNCa, Fac de Tecnología y Cs Aplicadas, UNCa, Maximio Victoria 55, Catamarca (4700), Argentina. E-mail: rodnarda@hotmail.com
2Instituto de Limnología "Dr. R.A.Ringuelet" (ILPLA, CONICET, UNLP), Boulevard 120 y 62, La Plata, (1900), Argentina. E-mail: anpaggi@ilpla.edu.ar
Recibido: 10-VIII-2014
Aceptado: 24-II-2015
RESUMEN. La distribución en América del Sur (Region Neotropical) de Stictocladius prati Saether & Cranston, Podonomus. regalis Brundin y P. setosus Brundin 1966 es ampliada a partir de primeros registros de la Argentina. Podonomus fastigians Brundin, y Allocladius quadrus Andersen et al. se citan por primera vez de Catamarca Se describe el morfotipo pupal de Barbadocladius sp. "Chaco"(cerca de B. andinus Cranston & Krosh). Se incorporan las variables ambientales de los cursos de agua donde se registraron las especies. Los ríos de Puna presentan aguas muy alcalinas, pH (8.12-8.8), alta conductividad y alto contenido en MO, mientras que el arroyo de Chaco Serrano es de aguas débilmente alcalinas, pH (7), baja conductividad y bajo contenido en materia orgánica (MO). Las especies Stictocladius prati, Allocladius quadrus, Podonomus fastigians, P. setosus y P. regalis estuvieron presentes en ríos de altura con aguas alcalinas y alta conductividad, mientras Barbadocladius sp. "Chaco"se registró en un arroyo de menor altura, con aguas de baja alcalinidad y conductividad.
PALABRAS CLAVE: Primeros registros; Allocladius; Stictocladius; Barbadocladius; Podonomus; Nueva distribución; Podonominae; Orthocladiinae; Región Neotropical.
ABSTRACT. The distribution in South America (Neotropical Region) of Stictocladius prati Saether & Cranston, Podonomus regalis Brundin, and P. setosus Brundin is enlarged as a result of new records from Argentina. Podonomus fastigians Brundin and Allocladius quadrus Andersen et al. are first recorded from Catamarca. The pupal type of Barbadocladius sp. "Chaco"(near B. andinus Cranston & Krosh) is described. Environmental variables in the sites where the species were collected are incorporated. Punean rivers presented alkaline waters and pH (8.12-8.8), high conductivity and organic matter (OM) content. The Chaco Serrano stream presented slightly alkaline waters, pH (7), low conductivity and OM content. The species Stictocladius prati, Allocladius quadrus, Podonomus fastigians P. setosus and P.regalis were present at high altitude rivers, alkaline waters and high conductivity while Barbadocladius sp. "Chaco"was sampled at a low altitude stream, with less alkaline and low conductivity waters.
KEY WORDS: New records; Allocladius; Stictocladius; Barbadocladius; Podonomus; New distribution; Podonominae; Orthocladiinae; Neotropical Region.
INTRODUCCIÓN
La familia Chironomidae (Insecta Diptera) está representada a nivel mundial, por 11 subfamilias, nueve de las cuales se encuentran en América del Sur. De Argentina se reportan siete subfamilias. Actualmente existen 463 especies válidas citadas de América del Sur; este valor va aumentando a medida que se estudian nuevos ambientes (Paggi, 2009). Estudios realizados en cursos de agua de diferentes regiones geográficas de Argentina, los ubican primeros en orden de abundancia y diversidad. Así lo muestran, en la región del Noroeste y Centro Argentino, los trabajos de Medina & Paggi (2004); Fernández et al. (2001, 2002, 2006); Tejerina & Molineri (2007); Scheibler et al., (2008) y en el Sur Argentino, el de Miserendino (2007).
Se realizó el primer análisis de biodiversidad de Chironomidae en un río de la Reserva de Biósfera Laguna Blanca, ubicada al norte del departamento Belén, y en otro ubicado en el departamento de Antofagasta, ambos pertenecientes a la ecorregión de la Puna catamarqueña, y en un arroyo ubicado en la localidad de Concepción, Dpto. Capayán, perteneciente a la ecorregión de Chaco Serrano.
El propósito de este trabajo fue ampliar la distribución geográfica hacia el sur de Stictocladius prati Saether & Cranston 2012 originalmente descripta para Perú, y de Podonomus regalis Brundin 1966, descripta para Bolivia, Ecuador y Perú; y hacia el norte de Podonomus setosus Brundin 1966 descripta para el sur de Chile. Brindar el primer registro para Catamarca de Allocladius quadrus Andersen, Saether & Mendes 2010 y Podonomus fastigians Brundin 1966. A su vez, describir un nuevo morfotipo de Barbadocladius sp. "Chaco"Cranston & Krosh 2011. Se presentan los parámetros ambientales que caracterizan los diferentes tipos de ambientes donde las especies fueron halladas.
MATERIALES Y MÉTODOS
Descripción del área de estudio
El área de estudio (Fig. 1) está ubicada en la Puna, fitogeográficamente representa a la provincia Puneña (3300-4300 m.s.n.m.), que corresponde al dominio Andino-Patagónico (Cabrera, 1971).
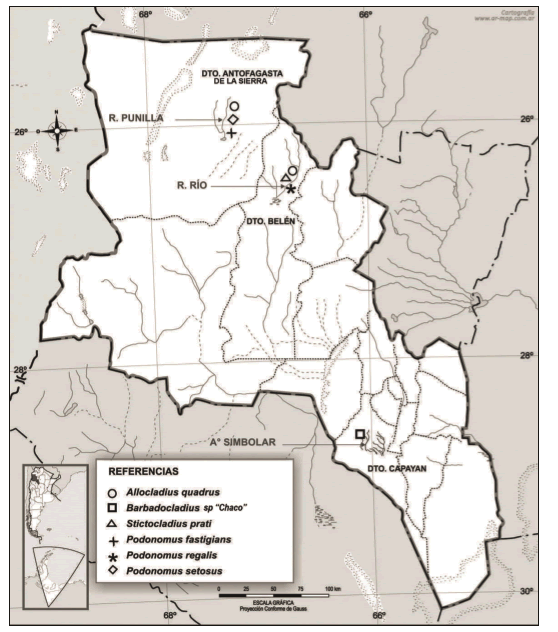
Fig. 1. Ubicación de los sitios de muestreo y distribución de las especies en los diferentes Departamentos de la Provincia de Catamarca, Argentina.
El río Río se ubica a una altitud de 3.345 m.s.n.m. pertenece a la cuenca cerrada de Laguna Blanca, a los 26°32'12.60'' S 66°44'59.82'' W, esta cuenca está delimitada al naciente por el cordón Tierras Coloradas-Moradito y al poniente por la Sierra de Laguna Blanca (Turner, 1973). El clima es seco y frío, con una gran amplitud térmica diaria; con lluvias estivales. El invierno es extremadamente seco, con vientos del oeste, con frecuentes nevadas en las partes altas. Las precipitaciones son escasas alrededor del 90% ocurren en los meses de diciembre y marzo, oscilan entre 450 mm a menos de 50 mm; con un promedio para el Distrito entre 100 a 250 mm anuales (Cajal, 1988). La vegetación de Laguna Blanca, (Borgnia et al., 2006) se caracteriza por ambientes de estepas arbustivas y graminosas o pastizales y estepas mixtas, vegas, salinas y peladares. La región fue declarada el 12 de agosto de 1982 Reserva de Biosfera y forma parte de la red internacional del programa MAB (Hombre y Biósfera) de la UNESCO.
El río Punilla se ubica a una altitud de 3.400 msnm a los 26°02'638'' S y 67°24'692'' W en la cabecera departamental de Antofagasta de la Sierra. Su agua proviene de deshielos, de las vegas congeladas ubicadas en la Sierra de Calalaste (5.200 m) y en las laderas occidentales del cerro Galán. La alimentación subterránea también es esencial. La cuenca del río Punilla se caracteriza por una red de drenaje de carácter endorreico y pobremente organizada que muestra una disposición centrípeta hacia los niveles de base locales representados por depresiones ocupadas por lagunas y salares, es el caso de la Laguna de Antofagasta. Los cauces son sinusoidales y angostos y en las márgenes de los cursos de agua se generan vegas (Niz & Viera, 2007). La vegetación ribereña se caracteriza por presentar Ciperáceas, Juncáceas (Juncus sp.) Cortaderia ridiuscula y gramíneas.
El Chaco serrano es un distrito que corresponde a la provincia fitogeográfica Chaqueña y al dominio Chaqueño (Cabrera, 1971). En Catamarca cubre la cima y faldeos oriental y occidental de Las Sierras Gracianas y de El Alto-Ancasti, hasta aproximadamente los 28° Latitud Sur. El Chaco Serrano se presenta a través de las quebradas más húmedas de la parte central y austral de la Sierra de Ambato, hacia su vertiente occidental. La vegetación se dispone en tres "pisos", típicamente se encuentra un primer piso de bosque serrano, con fisonomía de bosque, seguido de un piso de arbustos y pastos; a mayores valores de altura, las leñosas desaparecen, dejando lugar al tercer piso, un pastizal de altura (Morlans, 1995).
El arroyo El Simbolar se sitúa a una altitud de 980 msnm a los 28°39'02.21''S y 66°03'11.69''W en la localidad de Concepción, Dpto. Capayán. Esta localidad se encuentra enmarcada en las sierras de Ambato, al suroeste de la Capital de la provincia a unos 47 km, presenta en su recorrido hasta alcanzar los 811 msnm un diseño de drenaje de tipo dendrítico, con un régimen pluvio-nival como alimentación principal en cuanto a los mayores módulos de escorrentía, pero también cuenta con una alimentación secundaria, generada a partir de los interflujos que se manifiestan como vertientes a lo largo de la cuenca, los que se constituyen en las fuentes de alimentación durante el invierno (Salas, 1997). Es un arroyo de orden 4 según la clasificación de Strahler (1981). El clima es árido, de sierras y bolsones, con precipitaciones entre 450 y 550 mm anuales de tipo torrencial, siendo diciembre, enero y febrero los más lluviosos del año. La vegetación de ribera está representada por Prosopis chilensis, Acacia visco, Celtis tala, Fagara coco, Lithraea ternofolia, Ruprechtia apetala, Schinopsis haenckeana, también hay bromelias epífitas, Tillandsia spp. y Usnea spp.
Muestreos e identificación del material
Los muestreos fueron estacionales en los meses de Abril, Agosto y Octubre de 2011 y Junio, Julio y Diciembre de 2012. En cada curso de agua seleccionado se obtuvieron tres réplicas (n=3) con un muestreador Surber de 900 cm² de superficie y 300 µm de abertura de malla. Se registraron variables ambientales en cada sitio de muestreo (Tabla I). La localización georeferenciada de las estaciones de muestreo y altura sobre el nivel del mar, se obtuvo con un GPS Garmin eTrex Legend. El ancho del lecho mojado se midió con una cinta métrica, considerando sólo el espacio ocupado por el agua. La profundidad en el sitio de muestreo, se midió con una regla graduada donde se colocó el muestreador. La temperatura del agua fue medida con termómetro de mercurio; el pH, conductividad eléctrica, oxígeno disuelto y total de sólidos disueltos fueron medidos con un multimétrico. Los restantes parámetros de calidad de agua fueron medidos en laboratorio, carbonatos, bicarbonatos, calcio, magnesio, cloruros, contenido de materia orgánica y dureza total, siguiendo métodos normalizados por el Standard Methods (APHA, 1998). La vegetación marginal se describió por observación directa, relevando y listando presencia-ausencia de árboles y arbustos de la vegetación de ribera. En la Tabla II se presenta la densidad de larvas, de los géneros de Orthocladiinae y Podonominae aquí considerados, durante dos períodos estacionales, en los dos ríos de Puna.
Tabla I. Variables ambientales de tres cursos de agua de Catamarca.

Tabla II. Densidad de larvas (ind/m²) de tres especies de Chironomidae colectadas en dos ríos puneños de Catamarca.

En laboratorio y bajo lupa binocular, se separaron los quironómidos (larvas y pupas) del resto del material que compone cada muestra. Se realizaron las determinaciones taxonómicas siguiendo lo propuesto por Epler (1995), Paggi (2009), Prat et al., (2011, 2014). Los adultos obtenidos por una red manual fueron conservados en alcohol al 80% y montados en preparaciones microscópicas en bálsamo de Canadá. Las medidas están expresadas en µm, excepto la longitud total y la longitud del ala en mm. Parte del material estudiado fue depositado en el Instituto de Limnología (ILPLA, CONICET, UNLP) y parte en la colección personal del primer autor.
RESULTADOS Y DISCUSIÓN
Subfamilia Orthocladiinae
Allocladius Kieffer
El género Allocladius Kieffer, 1913 (Chironomidae, Orthocladiinae) tiene una distribución mundial, se conocen para el Neotrópico 6 especies: 4 adultos macho, 1 adulto macho y hembra, 1 adulto y exuvia pupal y 2 morfotipos: 1 exuvia pupal y 1 larva respectivamente. Las especies sudamericanas están distribuidas en Argentina, Bolivia, Chile, Ecuador y Perú (Andersen et al., 2010).
Allocladius quadrus Andersen, Saether & Mendes
Allocladius quadrus Andersen, Saether & Mendes 2010: 17; Ferrington & Saether 2011: 96; Mauad et al., 2013: 456.
Se describen con el nuevo material aquellos caracteres que se diferencian de la descripción original y de la redescripción de Mauad et al., 2013.
Material examinado. ARGENTINA: Catamarca, Río Punilla, 26°02'638'' S, 067°24'692'' W, 3.400 msnm, 19/10/2011, 1 macho, Rodríguez Garay col. (ILPLA); Río Río, 26°32'12.60'' S 66°44'59.82'' W, 3.345 msnm, 19/04/2011, 2 machos, Rodríguez Garay col. (ILPLA).
Macho (n=3). Las siguientes medidas son diferentes de la descripción original y del material salteño. Longitud Total: 2,8-3,09 (2,98); longitud del ala: 1,58-1,68; long.total/ long.del ala: 1,67-1,93; long del ala/ long. profémur: 3,16-3,23. Cabeza: relación antenal (AR): 1,63; longitud del último flagelómero: 538; longitud del tentorio : 142-174 (159); long. palpómeros (2-5): 36- 43 (40): 81- 97 (89): 101- 110 (105): 140-142 (141). Ala: relación del ala (VR): 1,34. Relación de las patas: (LR) anterior: 0,39-; media: 0,38; posterior: 0,50-0,51; (BV) anterior: 2,92-3,18 (3,05), media: 3,94, posterior: 3,32-3,45 (3,38); (SV) anterior: 3,67-4,38 (4,09), media: 4,43, posterior: 3,61-3,75(3,68). Hipopigio: longitud de la parte distal desnuda de la punta anal 20; longitud del falapodema 43-51 (46); vosella superior alcanzando 0.35 la longitud del gonocoxito, volsella inferior 0.67 la longitud del gonocoxito, HR: 2,80, HV: 3,46-4,30 (3,83). Pars ventralis: 57-69 (65) de largo por 63-71 (68) de ancho.
Comentarios. Allocladius quadrus pertenece al grupo bilobulatus, el cual contiene a todas las especies que poseen pars ventralis (Fig. 2). Los especímenes estudiados presentan entre otros caracteres una longitud total mayor, longitud del ala menor, long total/long. del ala, long del ala/ long profemur y AR mayor, al material tipo chileno y al salteño. Los ejemplares provenientes de la Puna catamarqueña, comparten las mismas características ambientales que los especimenes salteños (Mauad et al., 2013), conjuntamente con los registros chilenos y de Patagonia (Andersen et al., 2010), se confirma la amplia distribución andino patagónica de la especie.

Figs. 2-12. 2, Allocladius quadrus Andersen, Saether & Mendes: pars ventralis, hipopigio; 3-5, Barbadocladius sp. "Chaco": pupa, 3: distribución de ganchos y espinas en los TIII-V, 4: detalle de espinas y ganchos del TIII, 5: distribución de ganchos y espinas en los T V-VIII y S VII-VIII, lóbulos anales y macrosetas; 6-7, Stictocladius prati Saether & Cranston, 6: abdomen pupa, vista dorsal, 7: hipopigio, vista dorsal; 8-9, Podonomus fastigians Brundin, pupa, 8: cuerno torácico, parte distal, 9: cuerno torácico, parte basal; 10-11, Podonomus regalis Brundin, pupa, 10, cuerno torácico, 11: cefalotórax y cuerno torácico; 12, Podonomus setosus Brundin, pupa, cuerno torácico.
Barbadocladius Cranston & Krosch
El género Barbadocladius fue recientemente creado por Cranston & Krosh (2011) a partir de material inmaduro y adultos farados proveniente de los Andes patagónicos. La asociación de los estados de desarrollo permitió compararlos con material inmaduro colectado por Roback & Coffman en Bolivia como resultado de la Expedición Catherwood a Bolivia y Perú en 1977. La descripción del morfotipo larval conocido como "Genus 9 sp" y la exuvia pupal "Genus 4 sp" (Roback & Coffman, 1983) coincidieron con el actual género Barbadocladius (Cranston & Krosh, 2011). Hasta el presente se conocen dos especies B. andinus y B. limay descriptas para Chile y Argentina entre los 39º y 41º S. Las especies sudamericanas están distribuidas en Argentina, Bolivia, Chile y Perú considerando al género como trans-andino de origen gond-wanico (Cranston & Krosch, 2011). Prat et al. (2013) amplía su distribución en Perú hacia el norte hasta los 9° S, pero limita la presencia del género a ambientes de gran altitud caracterizados por poseer fauna esternotérmica, si bien, las especies citadas de Argentina y Chile se encuentran a menor altitud (hasta los 1.100 msnm) comparten con aquéllas la presencia de fauna estenotérmica Los ejemplares aquí estudiados fueron hallados en ambientes del Chaco Serrano a los 28º S y 980 msnm, ubicado a lo largo del sistema de Sierras Pampásicas con preponderancia de especies euritérmicas (Medina et al., 2008). Este nuevo registro constituye un ejemplo más de la presencia de especies de estirpe andino patagónico en zonas de transición de origen brasílico (Roig-Juñent et al., 2008).
Barbadocladius sp. "Chaco"
Material examinado. ARGENTINA: Catamarca, Arroyo El Simbolar, Dpto. Capayán, 980 msnm, 28°39.02'21''S y 66° 03'11.69''W, 13/12/2012, 3 exuvias pupales, Rodríguez Garay col., (ILPLA).
Exuvia pupal (n = 3). Largo total 3,00 - 3,29. Color marrón claro.
Cefalotórax: Setas frontales 45 de largo. Antepronoto con una seta media y una seta lateral 101 de largo. Cuerno torácico aparentemente ausente o perdido. Setas precorneales dispuestas a lo largo la anterior alejada 26 de las otras dos, longitud de las setas precorneales: anterior: 65, media: 71 y posterior: 91. Longitud de las setas dorsocentrales alrededor de 20, separadas la Dc1 - 2: 45, Dc2 - 3: 59, Dc3 - 4: 91. En estos ejemplares no se observa la seta prealar. Abdomen. Tergito III con 6-8 espinas, 30 -34 ganchos, IV con 14-28 espinas, 30-40 ganchos, V con 30-36 espinas, VI con 25-27 espinas, VII con 15-22 espinas, VIII con 12-14 espinas. Esternito III con 30-31 ganchos, IV 22-38 ganchos, V con 26-30 ganchos, VI con 16- 22 ganchos, VII con 14-22 espinas, VIII 14-20 espinas. Lóbulo anal 83-92 más corto que el saco genital del macho.
Comentarios. La presencia de ganchos finos en los esternitos III y IV, además del mayor número de ganchos en los esternitos V y VI, diferencia a los ejemplares de Catamarca de las dos especies hasta ahora conocidas. La ausencia de ganchos en el TII y las 3 macrosetas anales de igual longitud los separa de B. limay. Mientras que, a excepción del mayor número de ganchos en los T III y IV, menor número de espinas en TIII y presencia de espinas en el SVIII, por el resto de los caracteres se aproxima a B. andinus. La asociación de los estados inmaduros con adultos macho podría dar como resultado una nueva especie (Figs. 3-5).
Stictocladius Edwards
Se conocen, hasta el momento, para el Neotrópico y en especial para Sudamérica 10 especies y los estados inmaduros no asociados de 5 pupas y 2 larvas. Las especies centro y sudamericanas están distribuidas en Argentina, Bolivia, Chile, Costa Rica, Ecuador y Perú (Saether & Cranston, 2012).
Stictocladius prati Saether & Cranston
Stictocladius prati Saether & Cranston 2012: 135.
Se describen los caracteres que se diferencian de la descripción original.
Material examinado. ARGENTINA: Catamarca, Río Río, 26°32'12.60'' S 66°44'59.82'' W, 3.345 msnm, 19/04/2011, 21/10/2011, 6 machos, 4 exuvias pupales, 3 larvas, Rodríguez Garay col (ILPLA).
Macho (n=6). Longitud Total : 2,14-2,7 (2,44); longitud del ala: 1,22-1,35 (1,29); long. total/ long.del ala: 1,74-2,0 (1,89); long del ala/long. profémur: 2,71-3,54 (3,14) (n=4). Cabeza: relación antenal (AR): 0,68-0,71 (0,69) (n=4), último flagelómero: 215-240 (230); tentorio: 122-142 (134); long. palpómeros : 10- 26 (20): 15-41 (35): 26-57 (49.5): 34-71 (58): 49-101 (85). Ala: relación del ala (VR): 1,08-1,22 (1,16). Relación de las patas: (LR) (n=3) anterior: 0,43-0,54 (0,50); media: 0,39-0,42 (0,41); posterior: 0,54-0,57 (0,55); (BV) anterior: 2,68-3,44 (3,06), media: 3,48-3,88 (3,72), posterior: 3,11-3,50 (3,29); (SV) anterior: 3,21-4,5 (3,65), media: 4,55-5,0 (4,53), posterior: 3,31- 3,5 (3,41).
Hipopigio: tergito IX con 6-11 (9) setas, lateroesternito IX con 5-6 setas; longitud del falapodema 46-51 (50); longitud del sternapodema transverso 47-61 (51); longitud de la volsela inferior: 65; relación de la volsela inferior/ longitud del gonocoxito: 0.36-0.46 (0.40); longitud del gonocoxito 142-152 (145); longitud del gonostilo 53-61 (56), base del gonostilo: 10-14 (11) de largo, parte distal desnuda: 30-33 (31) de largo; longitud del apéndice accesorio (en esta especie desnudo) : 51-63 (56), con 5 setas en la porción distal; HR: 2,49-2,69 (2,58), HV: 3,75-4,91 (4,33).
Pupa (n=4). Longitud total: 2,86-3,05 (3,0); setas cefalotórax (n=3): antepronotales (Aprn): 41-53 (44); precorneales anterior (Aprc): 61-71 (65); media (Mprc): 24-44 (37); posterior (Pprc): 20-32 (27). Abdomen: nº de espinas posteriores en los tegitos II-VIII: 10-13 (12), 10-13 (12), 10-12(11), 10-13 (12), 10-17 (14), 15-22 (18), 24-30 (27); nº de espinillas en el esternito II: 165-190 (179); longitud del lóbulo anal: 281-290 (288) longitud de la proyección del lóbulo anal: 141-157 (153), ancho: 21-25 (23), ancho/ longitud: 0,13-0,16 (0,15), longitud de la proyección/ long. lóbulo anal: 0,49- 0,56 (0,53), longitud de la macroseta: 148-165 (156) por 6-7 (6,25) de ancho, saco genital macho: 29-41 (34) más corto que el lóbulo anal, saco genital hembra: 116 más corto que el lóbulo anal.
Larva (n=3). Longitud total: 3,7 - 3,8; longitud de la cápsula cefálica: 201-210 (206); longitud de los segmentos de la antena: 49-51 (50), 59-69 (63), 4, 2, 6; AR: 0,63-0,70 (0,67), ancho del segmento basal de la antena: 12-22 (16), distancia del órgano anular desde la base: 10, longitud de la hoja antenal: 57, parte esclerotizada del 2° segmento/ longitud del 2° segmento: 0,46-0,62(0,54); longitud de la mandíbula: 63-75(70); ancho del mentón: 41-61(51), ancho del diente central: 20-22(21); postmentun: 91-93(92). Abdomen: longitud de los procercos: 16 , ancho: 6-8, longitud de la seta anal: 91-122(107), longitud de los parápodos posteriores: 81-95(90), ancho: 24-36(28), longitud de los túbulos anales: 122, ancho: 20.
Comentarios. Si bien los ejemplares de Argentina presentan métricas intermedias entre S. acutus y S. prati, se diferencian del primero por presentar en los adultos el apéndice del gonostilo totalmente desnudo. Las pupas se diferencian de S. acutus por presentar casi el doble de finas espinas en el esternito II y los sacos genitales del macho muy cerca de la finalización de las prolongaciones del lóbulo anal. Las larvas presentan el diente central del mentón con escotaduras laterales. El resto de los caracteres coincide ampliamente con S. prati, (Figs. 6-7).
La especie es citada para Perú (Arroyo Ancharacancha) con este nuevo registro S. prati amplía su distribución latitudinal hacia el sur, especialmente sobre la vertiente oriental de la cordillera andina, manteniendo su distribución altitudinal de 3000-4000 msnm.
Subfamilia Podonominae
Podonomus Philippi
El género Podonomus Philippi incluye 34 especies válidas distribuidas en 5 grupos. El mismo está ampliamente distribuido en el Hemisferio Sur desde los Andes tropicales de Perú y Bolivia hasta la península Magallánica y la selva Amazónica (Siri et al., 2009). Las especies P. setosus y P. regalis pertenecen al grupo albinervis, son citadas por primera vez para la República Argentina y P. fastigians pertenece al grupo nudiventris y se cita para una nueva localidad de la provincia biogeográfica de Puna.
La presencia de estas especies en la Puna catamarqueña confirma la amplia distribución de las mismas desde los Altos Andes de Bolivia y Perú hasta el sur de Chile y Patagonia (Brundin, 1966).
Podonomus fastigians Brundin
Podonomus fastigians Brundin 1966: 228; Siri et al., 2009: 523.
Se describen con el nuevo material aquellos caracteres que se diferencian de la descripción original y de la redescripción de Siri et al. (2009). Asimismo, se enmiendan para la citada publicación el valor de HV para el hipopigio del macho en lugar de 0,33-0,38 (0,35) es 3,3-3,8 (3,5) y la longitud total de las pupas 0,66-0,74 (0,70) mm por 6,6-7,4 (7,0) mm.
Material examinado. ARGENTINA: Catamarca, Río Punilla, 26°02'638'' S, 067°24'692'' W, 3.400 m.s.n.m, 19/10/2011, 1 exuvia pupal y 1 macho farado, 17/08/2011, 3 exuvias pupales, Rodríguez Garay col. (ILPLA).
Macho (n=1). (los caracteres no se pudieron medir en el ejemplar farado).
Exuvias pupales (n=3). Longitud total: 3,94-4,54 (4,22); cuerno torácico: longitud de la placa porosa 505-555 (534), ancho de la placa porosa 248-265 (252), largo/ancho 2,03-2,23 (2,12) el doble de larga que ancha, longitud del pie: 83, L del pie/L de la placa porosa 0,10-0,15 (0,12) 1/8 del largo de la placa porosa (Figs. 8-9).
Comentarios. Se cita el primer registro de P. fastigians Brundin 1966 para el Río Punilla coincidiendo con la distribución en la misma provincia biogeográfica de Puna para registros anteriores de esta especie (Siri et al., 2009).
Podonomus regalis Brundin
Podonomus regalis Brundin 1966: 235.
Se describen aquellos caracteres que se diferencian de la descripción original.
Material examinado. ARGENTINA: Catamarca, Río Río, 26°32'12.60'' S 66°44'59.82'' W, 3345 msnm, 21/10/2011, 3 exuvias pupales, Rodríguez Garay col (ILPLA).
Exuvia pupal (n=3). Longitud Total 2.49-2.63 (2.57); Cuerno torácico: longitud placa porosa 182-190 (186), ancho placa porosa 116-124 (121), largo/ ancho: 1.47-1.60 (1.53) más larga que ancha, longitud del pie 99-120 (112), L pie/ L placa porosa: 0.54-0.63 (0.60) poco menos que 2/3 de la placa porosa.
Comentarios. El material estudiado presenta, a diferencia de la diagnosis de la especie, un pie del cuerno torácico algo más corto que la longitud de la placa porosa, el resto de los caracteres coincide ampliamente con P. regalis (Figs. 10-11).
La especie es originalmente descripta para Bolivia, Cordillera Real, arroyo en el macizo Nevado Huayna Potosí; para Ecuador, Río Pilaló, Prov. Cotopaxi y para Perú, Río Chanchamayo, arriba de San Ramón. Con el nuevo registro para Argentina, Catamarca, rio Rio, se amplía su distribución al sur de los Andes Tropicales.
Podonomus setosus Brundin
Podonomus setosus Brundin 1966: 232.
Se describen aquellos caracteres que se diferencian de la descripción original.
Material examinado. ARGENTINA: Catamarca, Río Punilla, 26°02'638'' S, 067°24'692'' W, 3400 msnm, 19/10/2011, 1 exuvia pupal, Rodríguez Garay col. (ILPLA).
Exuvia pupal (n=1): Longitud Total 2,80; Cuerno torácico: longitud placa porosa 257, ancho placa porosa 124, el doble de larga que de ancha, longitud del pie 116, pie/ placa porosa L: 0,45, algo más que ½ del largo de la placa porosa; setas lateral del segmento abdominal VIII: 12, setas laterales del segmento IX: 16.
Comentarios. Esta especie es cercana a P. albinervis y P. inermis. Comparte con la primera la forma ancha de la cámara sensorial del cuerno torácico, no obstante, es más ancha en setosus y el número de wavy setae del segmento IX. Se diferencia por la longitud del pie que es mucho más larga en setosus que en albinervis. La débil separación entre el pie y la placa porosa del cuerno torácico la comparte con inermis, no obstante el número de wavy setae del segmento IX es muy superior en ésta última (Brundin, 1966). Si bien Cranston et al. (2010) considera que serían todas la especie alvinervis, hasta el momento no se ha confirmado la sinonimia, manteniéndose aquí el criterio de Brundin (1966) debido a que el ejemplar estudiado coincide ampliamente con los caracteres diagnósticos de P. setosus (Fig. 12).
La especie es originalmente descripta para el sur de Chile Río Rosario, Rio Fortuna, Bahía Inutil, Tierra del Fuego; Rio Tres Brazos, cerca de Punta Arenas; Río Payne, Ultima Esperanza, Territorio Magallánico. El nuevo registro para Argentina, Catamarca, rio Punilla amplía la distribución hacia el norte.
ECOLOGÍA Y CONCLUSIONES
La caracterización ambiental de los sistemas fluviales estudiados, así como los primeros registros de Chironomidae, presentan diferencias entre ríos de Puna y Chaco Serrano; y difieren de (Medina & Paggi, 2004; Medina et al., 2008; Scheibler et al., 2008) en la conductividad eléctrica, dureza total, profundidad y velocidad de la corriente.
El pH fue similar a (Scheibler et al., 2008) varió entre neutro y alcalino y la velocidad de la corriente fue similar a (Tejerina & Molineri, 2007) con valores entre (0,23 m/s² y 2,05 m/s²).
Las subfamilias Orthocladiinae y Podonominae están adaptadas a ambientes reófilos y fríos (Pinder, 1995) y se componen de taxones estenotérmicos fríos, como lo demuestran Acosta, (2009); Epele et al. (2012); Medina et al. (2008); Scheibler et al., (2008, 2014); Tejerina & Molineri (2007) y los primeros registros en este trabajo.
Se registraron en el río Río, una densidad de 11 ind/m² y 133 ind/m² larvas de Stictocladius (Abril 2011 y Junio 2012) respectivamente y 111 ind/m² larvas de Allocladius en Junio 2012. En el río Punilla sólo estuvieron presentes 22 ind/m² prepupas de Podonomus fastigians en aguas bajas (Agosto 2011) (Tabla II).
Las exuvias pupales de P. setosus, P. fastigians y A. quadrus fueron colectadas en el río Punilla, caracterizado por presentar gran velocidad de corriente, aguas con pH alcalino, conductividad elevada, alta concentración de sólidos totales disueltos y materia orgánica en las dos estaciones del año muestreadas (Tabla I) (Fig. 1).
Allocladius quadrus, S. prati y P. regalis fueron colectadas en el río Río, el cual se caracteriza por ser de agua alcalina, de alta conductividad, proporcionada por altas concentraciones de carbonatos, cloruros y magnesio El agua es dura durante las dos estaciones hidrológicas (Tabla I) (Fig.1). Posee caudal permanente hasta que llega al Campo de la Laguna Blanca, donde al poco trecho sus aguas se insumen en el acarreo cuartario (Turner, 1973).
Barbadocladius sp. "Chaco"fue colectado en el arroyo El Simbolar, de menor altitud, el cual es de agua bien oxigenada, débilmente alcalina, pH neutro, baja conductividad y bajo contenido en MO; de mineralización media a baja, con valores de cloruros y magnesio relativamente bajos, en ambos períodos de aguas bajas y altas (Tabla I) (Fig.1).
Allocladius quadrus y Stictocladius prati presentan una distribución andino-patagónica (Saether & Cranston, 2012; Mauad et al., 2013) con gran amplitud latitudinal y altitudinal, sin embargo en este estudio estuvieron únicamente presentes en ríos de Puna a una altitud de 3000- 4000 msnm y bajas temperaturas y no se encontraron en ríos de Chaco serrano a menor altitud pero a mayores temperaturas.
El género Podonomus presenta una amplia diversidad y distribución en Sudamérica tal como lo demuestran los trabajos de (Brundin, 1966; Roback & Coffman, 1983; Siri & Donato, 2012), sin embargo, la mayoría de los trabajos ecológicos realizados desde los Andes tropicales, de Perú (Acosta, 2009), el Monte y las Yungas del Noroeste Argentino (Tejerina & Molineri, 2007), hasta los Andes Centrales de Mendoza (Scheibler et al., 2008), basados solamente en las larvas, no mencionan las especies que lo componen.
El conocimiento de la diversidad de Chironomidae se continúa incrementando en el Noroeste Argentino con el aumento en el número de géneros y especies de Argentina y particularmente de la provincia de Catamarca.
AGRADECIMIENTOS
Este trabajo se realizó durante el desarrollo de una Beca Tipo I del Consejo Nacional de Investigaciones Científicas y Tecnológicas (CONICET) y la Universidad Nacional de Catamarca (UNCa). Un especial agradecimiento a Miguel Rodríguez, Ariel Rodríguez, Silvestre Rodríguez y Cristian Torres por la colaboración en el trabajo de campo. A Luciana de Tezanos por la preparación y el armado de las figuras. Es una Contribución Científica Nº 949 del Instituto de Limnología "Dr. R. A. Ringuelet" (ILPLA, CONICET, UNLP).
BIBLIOGRAFÍA CITADA
1. ACOSTA RIVAS, C. R. 2009. Estudio de la cuenca altoandina del río Cañete (Perú): Distribución altitudinal de la comunidad de macroinvertebrados bentónicos caracterización hidroquímica de sus cabeceras cársticas. Tesis doctoral, Universidad de Barcelona, 177 pp. [ Links ]
2. ANDERSEN, T., SAETHER O. A. & H. F. MENDES. 2010. Neotropical Allocladius Kieffer, 1913 and Pseudosmittia Edwards, 1932 (Diptera: Chironomidae) Zootaxa 2472: 1-77. [ Links ]
3. APHA. 1998. Standard Methods for the examination of water and wastewater. Clesceri, L. S., A. E. Greenberg & A. D. Eaton (eds), American Public Health Association, Washington D.C. [ Links ]
4. BORGNIA, M., A. MAGGI, M. ARRIAGA, B. AUED, B. L. VILÁ & M. H. CASSINI. 2006. Caracterización de la vegetación en la Reserva de Biósfera Laguna Blanca (Catamarca, Argentina). Ecología Austral 16(1): 29-45. [ Links ]
5. BRUNDIN, L. 1966. Transantartic relationships and their significance, evidenced by chironomid midges. With a monograph of the subfamilies Podonominae and Aphroteniinae and the austral Heptagyiae. Kongliga Svenska Vetenskaps Akademiens Handlingar 11: 1-472. [ Links ]
6. CABRERA, A. L. 1971. Fitogeografía de la República Argentina. Sociedad Argentina de Botánica, Buenos Aires. [ Links ]
7. CAJAL, J. 1988. Organización Laboral de Comunidades Marginadas Involucradas en Proyectos de Ecodesarrollo. CEIL/ CONICET. Informe PID. Copia mimeografiada. [ Links ]
8. CRANSTON P. S., N. B. HARDY, G. E. MORSE, L. PUSLEDNIK & S. R. McCLUEN. 2010. When molecules and morphology concur: the ‘Gondwanan' midges (Diptera: Chironomidae) Systematic Entomology 35: 636-648.
9. CRANSTONP. S. & M. KROSCH. 2011. Barbadocladius Cranston & Krosch, a new genus of Orthocladiinae (Diptera: Chironomidae) from South America. Neotropical Entomology 40(5): 560-567. [ Links ]
10. EPELE, L. B., M. L. MISERENDINO & C. BRAND. 2012. Does nature and persistence of substrate at a mesohabitat scale matter for Chironomidae assemblages? A study of two perennial mountain streams in Patagonia, Argentina. Journal of Insect Science 12: 68. [ Links ]
11. EPLER, J. H. 1995. Identification Manual for the Larval Chironomidae (Diptera) of Florida. Florida Department of Environmental Protection, Tallahassee. [ Links ]
12. FERNÁNDEZ, H., E. DOMÍNGUEZ, F. ROMERO & G. CUEZZO. 2006. La calidad del agua y la bioindicación en los ríos de montaña del Noroeste Argentino. Serie Conservación de la Naturaleza Nº 16, Fundación Miguel Lillo, Tucumán. [ Links ]
13. FERNÁNDEZ, H.; F. ROMERO; M. PERALTA & L. GROSSO. 2001. La diversidad del zoobentos en ríos de montaña del noroeste de Argentina: comparación entre seis ríos. Ecología Austral 11: 9-16. [ Links ]
14. FERNÁNDEZ, H.; F. ROMERO; M. VECE; V. MANZO; C. NIETO & M. ORCE. 2002. Evaluación de tres índices bióticos en un río subtropical de montaña (Tucumán-Argentina). Limnetica, Revista de la Asociación Española de Limnología 21(1-2): 1-13. [ Links ]
15. FERRINGTON, L. C. & O. A. SæTHER. 2011. A revision of the genera Pseudosmittia Edwards, 1932, Allocladius Kieffer, 1913, and Hydrosmittia gen. n. (Diptera: Chironomidae, Orthocladiinae). Zootaxa 2849: 1-134. [ Links ]
16. MAUAD, M.; A. SIRI & M. DONATO. 2013. New species of Pseudosmittia Edwards, 1932 and new records of Allocladius Kieffer, 1913 (Diptera : Chironomidae, Orthocladiinae) from South America. Zootaxa 3694(5): 445-460. [ Links ]
17. MEDINA, A. I. & A. C. PAGGI. 2004. Composición y abundancia de Chironomidae (Diptera) en un río serrano de zona semiárida (San Luis, Argentina). Revista de la Sociedad Entomológica Argentina 63(3-4): 107-118. [ Links ]
18. MEDINA, A., E. E. SCHEIBLER & A. C. PAGGI 2008. Distribución de Chironomidae (Diptera) en dos sistemas fluviales ritrónicos (Andino- serrano de Argentina) Revista de la Sociedad Entomológica Argentina 67(1-2): 69-79. [ Links ]
19. MISERENDINO, M. L. 2007. Macroinvertebrate functional organization and water quality in a large arid river from Patagonia (Argentina) Annales de Limnologie 43(3): 133-145. [ Links ]
20. MORLANS, M. C. 1995. Regiones Naturales de Catamarca. Provincias Geológicas y Provincias Fitogeográficas. Centro Editor de la Secretaría de Ciencia y Tecnología de la Univ. Nacional de Catamarca. Revista de Ciencia y Técnica II 2: 1-42. [ Links ]
21. NIZ, A. & O. VIERA. 2007. Informe final proyecto SPU "Plan Puna": Agua para comunidades campesinas. Editorial Científica Universitaria, Antofagasta - San Antonio de Los Cobres. [ Links ]
22. PAGGI, A. C. 2009. Chironomidae. En: Dominguez, E. & H. Fernandez (eds), Macroinvertebrados bentónicos sudamericanos. Sistemática y biología, Fundación Miguel Lillo, Tucumán, Argentina, pp. 383-409. [ Links ]
23. PINDER, L. C. V. 1995. The habitats of chironomid larvae. En: Armitage, P. D., P. S. Cranston & L. C. V. Pinder (eds.), The Chironomidae. Biology and ecology of non-biting midges, Chapman & Hall, New York, pp. 107-135. [ Links ]
24. PRAT, N., RIERADEVALL. M., ACOSTA, R. & C.VILLAMARÍN. 2011. Guía para el reconocimiento de las larvas de Chironomidae (Diptera) de los ríos altoandinos de Ecuador y Perú. Clave para la determinación de los géneros. (versión on-line en www.riosandes.ub.edu). [ Links ]
25. PRAT, N., RIBERA, C., RIERADEVALL, M., VILLAMARIN, C., & ACOSTA, R. 2013. Distribution, abundance and molecular analysis of Barbadocladius Cranston & Krosch (Diptera, Chironomidae) in tropical, high altitude Andean streams and rivers. Neotropical Entomology 42: 607-617. [ Links ]
26. PRAT, N., J. D. GONZALEZ - TRUJILLO & R. OSPINA - TORRES. 2014. Clave para la determinación de las exuvias pupales de los quironómidos (Diptera, Chironomidae) en ríos altoandinos tropicales. Revista de Biología Tropical 62(4): 1385-1406. [ Links ]
27. ROBACK, S. S. & W. P. COFFMAN. 1983. Results of the Catherwood Bolivian- Peruvian Altiplano expedition part II. Aquatic diptera including Montane Diamesinae and Orthocladiinae (Chironomidae) from Venezuela. Proceedings of the Academy of Natural Sciences of Philadelphia 135: 9-79. [ Links ]
28. ROIG-JUÑENT, S., M. F. TOGNELLI & J. J. MORRONE. 2008. Aspectos Biogeográficos de los insectos de la Argentina. En: Claps, L. E., G. Debandi & S. Roig-Juñent (eds), Bioversidad de Artrópodos argentinos, vol. 2, Sociedad Entomológica Argentina ediciones, Tucumán, pp. 11-30. [ Links ]
29. SAETHER, O. A. & P. S. CRANSTON. 2012. New World Stictocladius Edwards (Diptera: Chironomidae). Neotropical Entomology 41: 124- 149. [ Links ]
30. SALAS, L. B. 1997. Contribución al conocimiento de la biodiversidad de invertebrados bentónicos del arroyo El Simbolar (Concepción, Capayán, Catamarca). Trabajo final de Licenciatura, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Catamarca. [ Links ]
31. SCHEIBLER, E. E., V. POZO & A. C. PAGGI. 2008. Distribución espacio- temporal de larvas de Chironomidae (Diptera) en un arroyo andino (Uspallata, Mendoza, Argentina). Revista de la Sociedad Entomológica Argentina 67(3-4): 45-58. [ Links ]
32. SCHEIBLER, E. E., S. A. ROIG-JUÑET & M. C. CLAPS. 2014 Chironomidae (Insecta: Diptera) assemblages along an Andean altitudinal gradient. Aquatic Biology 20: 169-184. [ Links ]
33. SIRI, A., A. C. PAGGI & M. DONATO. 2009. Podonomus fastigians Brundin 1966 (Chironomidae: Podonominae): Redescription of the adult male and female, the pupa, and description of the larva. Entomological News 120(5): 522-529. [ Links ]
34. SIRI, A. & M. DONATO. 2012. Two new species of Podonomus (Diptera: Chironomidae: Podonominae) of the Brundin's decarthrus group from Ventania system, Argentina. Zootaxa 3548: 39-54. [ Links ]
35. STRAHLER, A. 1981. Geografía Física. Ediciones Omega S.A., Barcelona. [ Links ]
36. TEJERINA, E. & C. MOLINERI. 2007. Comunidades de Chironomidae (Diptera) en arroyos de montaña del NOA: comparación entre Yungas y Monte. Revista de la Sociedad Entomológica Argentina 66(3-4): 169- 177. [ Links ]
37. TURNER, J. C. 1973. Descripción de la Hoja 11d, Laguna Blanca. Provincia de Catamarca. Carta Económico-Geológica de la República Argentina Escala 1:200.000. Ministerio de Industria y Minería, Subsecretaria de Minería, Servicio Nacional Minero Geológico, Buenos Aires. [ Links ]













