Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de la Sociedad Entomológica Argentina
versión impresa ISSN 0373-5680versión On-line ISSN 1851-7471
Rev. Soc. Entomol. Argent. vol.75 no.3-4 La Plata dic. 2016
Trabajo Científico
Sistema para la cría de larvas de Haematobia irritans (Diptera: Muscidae) a partir de ejemplares salvajes de Argentina
A system for rearing larvae of wild specimens of Haematobia irritans (Diptera: Muscidae) in Argentina
FILIBERTI, Adrian1,3, Alejandro RABOSSI2, Daniela JACQUELIN3 & Carlos E. ARGARAÑA3
1Department of Medicine, University of Oklahoma Health Science Center (OUHSC) and Oklahoma Medical Research Foundation (OMRF), Oklahoma City, OK, USA.
2Instituto de Investigaciones Bioquímicas de Buenos Aires (IIBBA). CONICET y Fundación Instituto Leloir, Av. Patricias Argentinas 435 (1405), Buenos Aires, Argentina
3Centro de Investigaciones en Química Biológica de Córdoba (CIQUIBIC). CONICET y Universidad Nacional de Córdoba, Departamento de Química Biológica, Facultad de Ciencias Químicas. E-mail: adrianfiliberti@gmail.com
Received: 09-VI-2016; accepted: 18-XI -2016; published: 23-XII-2016
RESUMEN. Se describe un sistema simple para sostener el desarrollo larval de moscas de los cuernos salvajes, Haematobia irritans (L.) en condiciones controladas de laboratorio. Dicho sistema consiste en un medio de cultivo y una cámara de cría. El medio de cultivo se basa en una suspensión bacteriana obtenida a partir de materia fecal bovina. Además, se establecen las condiciones óptimas para la extracción y conservación de la suspensión bacteriana. Dada una concentración óptima de suspensión bacteriana que permite el desarrollo de un número establecido de larvas, se determinó que la duración de la etapa larval fue de 96 ± 4 h. El porcentaje de larvas vivas a las 48 h fue del 86,5%, mientras que el 68,5% (96 h) logró iniciar la metamorfosis y alcanzar el estado adulto. Utilizando la materia fecal bovina (MFB) fresca como medio de cultivo, se obtuvieron resultados comparables. Además de su fácil preparación, prolongado almacenamiento y alta reproducibilidad, la utilización de la suspensión bacteriana como medio de cultivo permite la inspección visual permanente de las larvas y puede ser empleada para realizar bioensayos sobre larvas de mosca de los cuernos con compuestos insecticidas solubles. Por otra parte, en este trabajo se describen las características y parámetros de funcionamiento de una cámara de cría simple y económica, que permite la incubación de los medios de cultivo a una temperatura y humedad controlada.
PALABRAS CLAVE. Mosca de los cuernos. Dieta olídica larval. Desarrollo larval.
ABSTRACT. A simple laboratory system to sustain the development of the larva to adult stage of the wild-type horn fly, Haematobia irritans (L.) is described. The culture medium is based on a bacterial suspension obtained from bovine fecal feces (olidic diet) and a support material consisting of cotton gauze where the bacterial suspension is deposited. The conditions for optimal bacterial extraction as well as the conditions for its preservation are described. The optimal concentration of bacterial suspension that supports the development of a fixed number of larvae was determined. At this concentration, the percentage of larvae alive at 48 h was 86.5% and 68.5% (96 h) of the initial number of larvae seeded could pupate and initi-ate metamorphosis. Comparable results were obtained (93 and 75% respectively) using bovine fecal feces as a culture medium. Since the medium consisted of a bacterial suspension, it allows an easy visual inspection of the larvae to study their developmental stages, and it also permits the bioassay of soluble insecticidal compounds. The construction and operating parameters of a breeding chamber, which allows incubation of the culture media at a controlled temperature and humidity, are also described in this work.
KEY WORDS. Horn fly. Fecal olidic diet. Larval stages.
Haematobia irritans (Linneus), es un díptero que en su fase adulta es hematófago obligado y ataca principalmente al ganado bovino. La "mosca de los cuernos" es originaria de Europa central y en la Argentina fue detectada por primera vez en 1991 (Luzuriaga et al., 1991). Representa una plaga mundial con alto impacto económico y en la Argentina se encuentra poblacionalmente distribuida en las 3/5 partes del área continental (Tarelli, 2004; Bulman, 2012), lo que representa aproximadamente el 90% del territorio nacional dedicado a la explotación pecuaria (Torres et al., 2002). Las pérdidas económicas ocasionadas por esta mosca se deben principalmente a la acción irritante que provoca su picadura (Guglielmone et al., 2002). La picadura de esta mosca es dolorosa y persistente (entre 10 y 40 veces por día, por mosca); que multiplicada por los cientos de ejemplares que parasitan un individuo producen una acción irritante severa, que finalmente se traduce en importantes mermas en la producción. Se ven afectados principalmente: la producción de carne, leche, la libido del toro y el valor del cuero; asimismo, la herida provocada incrementa el riesgo sanitario (Bulman, 2012).
Las etapas inmaduras de H. irritans se desarrollan exclusivamente en la materia fecal bovina, allí transcurren el desarrollo embrionario y los tres estadios larvales (Bruce, 1964). Este complejo sustrato le ofrece el aporte nutricional de bacterias, factores solubles y condiciones fisicoquímicas apropiadas, tales como temperatura, pH, oxigenación y humedad (Stanley & Kunz, 1996). Como consecuencia de su fuerte impacto económico existen numerosos estudios focalizados en analizar distintos métodos de control, diferentes principios activos y el grado de resistencia a insecticidas que presentan las poblaciones silvestres. Debido a las dificultades que presenta la cría de este insecto en laboratorio, la mayoría de estos estudios fueron realizados con moscas aclimatadas, criadas en condiciones de semicautiverio sobre ganado estabulado (Burg et al., 1994; Floate et al., 2001). En la Argentina no hay laboratorios de cría de H. irritans y, a nivel mundial, aún no se ha logrado un sistema de cría en cautiverio que permita el desarrollo a ciclo completo de todos los estadios de desarrollo de ejemplares silvestres. Por esta razón, resulta esencial generar un método de producción de moscas de los cuernos en cautiverio donde se puedan mantener condiciones controladas y reproducibles. En este sentido, un aspecto fundamental a resolver es la dieta larval. En H. irritans el sustrato de crecimiento más empleado es la materia fecal bovina fresca (MFB) (Alves de Carvalho et al., 2009; Ferraz Lima et al., 2014). Las bacterias presentes en la MFB hacen una contribución significativa al desarrollo de las larvas (Temeyer & Clay, 1993; Temeyer, 1998; Perotti et al., 2001). Sin embargo, la utilización de este material presenta problemas de reproducibilidad, ya que no todas las heces bovinas tienen igual rendimiento (depende del estado fisiológico del animal que les dio origen, su estado sanitario, parasitosis, alimentación, contenido de agua, etc.). Por otra parte, la manipulación, almacenamiento y preservación de la MFB resulta dificultosa (su consistencia fibrosa impide la distribución homogénea de compuestos activos, etc.). Existen pocos antecedentes de diseño de medios sintéticos para la cría de H. irritans. Como antecedentes de diseño de medios sintéticos de H. irritans, se encuentran un medio de cría compuesto por una mezcla de MFB/agar (Gough et al., 2002) y un medio de cría sintético basado en la utilización de yema de huevo y alfalfa en agar (Perotti & Lysyk, 2003). Sin embargo, a pesar de reiterados intentos realizados en nuestro laboratorio no se pudieron reproducir los resultados reportados por estos autores. En este trabajo se describen los resultados obtenidos mediante un medio semisintético (dieta olídica), lo que posibilita la realización de bioensayos sobre estadios inmaduros con ejemplares salvajes (no aclimatados). Este medio es libre de agar, fácil de homogenizar con compuestos activos y es propicio para la realización de bioensayos de toxicidad. Asimismo, en este trabajo se presenta por primera vez el diseño de una cámara de cría con control de temperatura y humedad, económica y de fácil construcción.
MATERIALES Y MÉTODOS
Etapa Adulta. Los adultos silvestres de H. irritans fueron capturados de su hábitat natural, sobre el lomo de bovinos acorralados en el Mercado Concentrador de Hacienda (Ferreyra, Provincia de Córdoba). Dicha captura se realizó con una red entomológica de 0,8 mm de trama. Las moscas atrapadas fueron transferidas a una jaula de 15 x 15 x 25 cm forrada con la misma tela que la red entomológica (microtul), y con un cierre móvil en un extremo (Fig. 1A y 1B). Las moscas adultas se alimentaron con una solución de sangre bovina (anticoagulada) al 70% volumen en volumen (V/V) en solución fisiológica, NaCl 0,85% peso en volumen (P/V), a 37 ºC (provistas en paños de algodón). La sangre utilizada para alimentar las moscas se extrajo de ejemplares bovinos e inmediatamente se mezcló (20% V/V) con una solución anticoagulante y preservante compuesta de: 0,023M ácido cítrico (C6H8O7); 0,053M citrato de sodio (Na3C6H5O7); 0,082M dextrosa (C6H12O6); 0,46mM cloranfenicol (C11H12Cl2N2O5) según Kuramochi (2000a). La sangre se fraccionó y congeló a -20 °C conservando sus propiedades hasta seis meses.
Colecta de huevos. La recolección de los huevos fue realizada en un paño embebido con solución fisiológica a 30 °C, en oscuridad y a humedad ambiente. Los huevos depositados durante 5 h en el paño fueron colectados en un vaso de precipitados de 5 litros como se describe a continuación. El paño se colocó en la pared del vaso, se enjuagó con agua destilada, de modo que los huevos arrastrados por la corriente de agua, se depositaran en el fondo del vaso de precipitados y desde allí se colectaron usando una pipeta de 5 ml con la punta cortada (aprox. 3 mm). Los huevos fueron dispuestos en otro paño embebido en solución fisiológica e incubados en cámara húmeda durante aproximadamente 12 h a 30 °C, hasta la eclosión (Fig. 1B).
Etapa larval (bioensayos). Las larvas recién eclosionadas se colectaron con un pincel entomológico y se sembraron sobre la superficie de los diferentes sustratos de cría. Se colectaron muestras de MFB recién depuesta, libre de orina. Las muestras de MFB se preservaron a 4 °C durante su traslado al laboratorio. Antes de ser usadas para bioensayos se comprobó su viabilidad tomando una muestra de 30 g de MFB y se registró la supervivencia de 15 larvas I luego de 48 h. Los lotes de MFB seleccionados, para realizar los diferentes experimentos, fueron aquellos donde la sobrevida de las larvas superó el 90%. Para los bioensayos se realizó un modelo experimental completamente aleatorizado a un factor, se sembraron15 larvas por réplica y 3 réplicas por tratamiento. Como variable respuesta se cuantificó la supervivencia de larvas luego de diferentes tiempos de incubación.
Se determinó la homogeneidad de varianza. Para la comparación de medias de a pares, 48, 72 y 100 h (Fig. 3) se realizó la prueba T de Student de dos colas con varianza homogénea. Para la comparación de medias múltiples se realizó un análisis de varianza ANOVA. A fin de estudiar la diferencia entre medias se realizó el test de comparaciones múltiples de Tukey o método HSD “Honestly Significant Difference”. Para todos los análisis estadísticos el nivel de significancia fue de 5% (α = 0,05).
Preparación del extracto fecal bovino (EFB). La materia fecal bovina (MFB) es el sustrato natural que le proporciona alimento y refugio a las larvas de H. irritans. A fin de reemplazar la MFB como sustrato de cría, se implementó un protocolo para extraer las bacterias presentes y elaborar un extracto fecal bovino (EFB). Se preparó una suspensión de MFB en solución fisiológica (400 g MFB en 400 ml de solución fisiológica) que fue posteriormente procesada durante dos minutos en una licuadora de paletas. El material vegetal se eliminó con una malla de tela de 0,1 mm de trama. Esta primera extracción se centrifugó por 12 min a 5000 x g, el “pellet” se resuspendió en aproximadamente 10 ml de sobrenadante y el resto del sobrenadante se descartó (400 g de MFB producen aproximadamente 6 g de pellet resuspendido con 20 ml de sobrenadante). El sustrato obtenido fue utilizado inmediatamente como sustrato nutricional de larvas de H. irritans. Las distintas diluciones de EFB fueron realizadas con el mismo EFB previamente esterilizado por autoclave (120 °C; 100 kPa; 40 min).
Preparación del recipiente de cría para larvas. Como recipiente de cría de larvas se emplearon vasos de precipitado de 150 ml, conteniendo en el fondo del recipiente un disco de papel secante de 7 cm de diámetro saturado con solución fisiológica. Sobre esta base de papel se colocaron dos círculos de gasa de 5 cm de diámetro previamente humedecidos con agua destilada. Se empleó gasa hospitalaria (100% algodón, trama regular de 6x6 fibras por centímetro cuadrado, y libre de acondicionadores). Sobre esta capa de gasa se vertieron 5 ml de EFB precalentado a 37 °C, y se agregaron otros 2 círculos de gasa. Se añadieron otros 5 ml de EFB y una última capa de gasa. Finalmente, sobre esta superficie fueron sembradas las larvas I de H. irritans. El recipiente de cría se mantuvo destapado para mantener su interior húmedo y oxigenado durante toda la etapa larval.
Cámara de cría y condiciones de incubación. La cámara de cría diseñada tiene una capacidad para 40 recipientes y consistió de un contenedor de plástico transparente (60 x 40 x 30 cm) con tapa (Fig. 1A, 1B, 1C). La temperatura de la cámara de cría fue de 30 ºC y se controló mediante dos almohadillas térmicas San-up® ubicadas del lado exterior de la misma (localizados una por debajo y la otra encima de la tapa a fin de promover la distribución homogénea de la temperatura y prevenir la condensación de humedad en la parte superior de la cámara, tapa). Dichas almohadillas fueron conectadas a un termostato con sensor de temperatura dentro de la cámara de cría. La humedad fue suministrada por un humidificador ultrasónico que distribuye una fina neblina de agua destilada, sin aporte de calor. El flujo de neblina a temperatura ambiente se suministró desde la parte inferior de la cámara mediante dos entradas no enfrentadas, a fin de favorecer corrientes de convección que homogenizaran el ambiente interno de la misma. El flujo de vapor fue de 4-5 litros de aire por minuto. La humedad fue estabilizada a "punto de rocío". El tiempo de operación del humidificador fue 15 min/h el primer día, 10 min/h el segundo día, 6,7 min/h el tercer día, y 5 min/h en el cuarto día de incubación. Los cultivos de larvas se llevaron a cabo en oscuridad. La cámara de cría fue emplazada en una habitación termostatizada a 25 ºC durante todo el periodo de experimentación.
Supervivencia larval en diferentes estrategias de criopreservación de EFB. Al extracto EFB se agregó glicerol a una concentración final de15% V/V y se conservó a -70 °C hasta su uso. El glicerol fue removido del EFB antes de ser empleado debido a que es tóxico para las larvas. Para ello se centrifugó el EFB durante 10 min a 5000 x g, se extrajo el sobrenadante y antes de descartarlo se midió su volumen, volumen "S1". El "pellet" fue lavado tres veces con dos volúmenes iguales a S1 de solución fisiológica. Luego de cada lavado, el EFB se resuspendió y centrifugó a 5000 x g durante 10 min. Finalmente, el "pellet" se resuspendió en el mismo volumen S1 de EFB esterilizado y se empleó como alimento para las larvas.
RESULTADOS
Etapa Adulta. En cada campaña, se capturaron aproximadamente 1000 individuos y la relación de machos y hembras fue 1:1 coincidiendo con lo reportado previamente por Kuramochi (2000b). Los adultos capturados fueron transferidos a una jaula por geotropismo negativo y fototropismo positivo y la sobrevida de los mismos en cámara de cría a 30 ºC y humedad ambiente fue de 15 días. Durante este período los adultos se alimentaron con sangre bovina anticoagulada. Colecta de huevos. Las hembras grávidas mantenidas a 30 °C, en oscuridad y a humedad ambiente, depositaron los huevos en un paño embebido con solución fisiológica, dispuesto en el fondo de la jaula. Cada hembra depositó entre 10 a 17 huevos que fueron incubados en las condiciones antes mencionadas hasta su eclosión, y las larvas emergentes utilizadas para los posteriores experimentos. Fue posible retardar la eclosión hasta 16 h incubando los huevos a 21 °C y luego incrementando la temperatura a 35 °C hasta la eclosión. Etapa larval (bioensayos).
Supervivencia larval en diferentes medios de cría. En la Tabla I se muestra la efectividad del EFB puro (100%), del EFB diluido al 50% V/V con el mismo EFB previamente esterilizado por autoclave y de la MFB, luego de 48 h de incubación en las condiciones reportadas para la cámara de cría. Como era de esperar, la MFB es el mejor sustrato para el crecimiento larval con un 93% ± 6,7 de supervivencia mientras que con el EFB puro fue del 55,6% ± 10,2 y con el diluido a la mitad fue del 73% ± 6,1. La supervivencia larval disminuyó significativamente en la MFB remanente luego de realizar el extracto, indicando que gran parte de los requerimientos para el desarrollo larval fueron extraídos en la elaboración del EFB (Tabla I).
Supervivencia larval en diferentes diluciones de EFB. La diferente supervivencia larval registrada con el EFB puro y al 50% indica una correlación entre la supervivencia larval y la concentración del EFB. Por lo tanto, se analizó la supervivencia de larvas crecidas en diferentes concentraciones de EFB (Fig. 2). El valor crítico para la distribución F de Snedecor (Fc) fue Fc = 2,845. En tanto que el valor F observado (Fo) para el mismo nivel de significancia fue Fo = 12,65 con una probabilidad de 0,0000595 (p < 0,001) y nivel de significancia del 5% (α = 0,05). El valor de tabla para la distribución de Tukey fue q (7,14) = 4,83 con lo cual el valor HSD =17,6. Aquellas diferencias de medias cuyo valor absoluto superaron el valor HSD fueron consideradas estadísticamente significativas (Fig. 2).
La supervivencia larval varió significativamente para las distintas diluciones de EFB. Si bien entre 20, 30 y 50% de EFB no hubo diferencias significativas, la concentración óptima se registró alrededor del 30% de dilución del extracto fecal bovino, con una supervivencia larval de 86,5% ± 6,5, ligeramente inferior a la supervivencia obtenida con MFB (93,3%; Tabla I).
Supervivencia larval a diferentes tiempos de incubación en EFB (30% V/V). En las condiciones de cría utilizadas, la duración promedio de la etapa larval no presentó diferencias cuando se las alimentó con MFB (20 g) o con EFB 30% (10 ml). Con ambos sustratos la duración fue de 96 ± 4 h desde la eclosión del huevo y el inicio del proceso de la metamorfosis. La supervivencia de las larvas durante esta etapa del desarrollo post-embrionario, decreció con el tiempo de desarrollo, tanto para MFB como para EFB (Fig. 3). Luego de 48 h de incubación en cámara de cría, la supervivencia larval en ambos medios no resultó significativamente diferente (p = 0,111; t = 2,035. Para 72 h; p = 0,025; t = 3,499. Para 100 h (pupa); p = 0,309; t = 1,163. Para los tres tiempos a = 0,05).
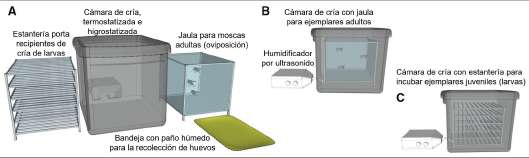
Fig. 1. Esquema de los componentes de la cámara de cría (A) con temperatura y humedad controlada. Dicha cámara puede alojar alternativamente la jaula para moscas adultas (B), o la estantería porta recipientes de cría de larvas (C). La estantería C es un "rack" para alojar los recipientes de cría donde se ensamblan los elementos que componen el medio de cultivo de larvas.

Fig. 2. Supervivencia de larvas de Haematobia irritans 48 h después de la eclosión del embrión y mantenidas en distintas diluciones del EFB (5, 10, 20, 30, 50, 70 y 100%). Los valores seguidos por la misma letra no difieren significativamente entre ellos. F de Snedecor (p < 0,001). Tukey (a = 0,05); q (7,14) = 4,83; HSD=17,6.

El 75% de las larvas I sembradas en MFB lograron completar esta etapa del desarrollo e iniciar la metamorfosis, mientras que en EFB (30%) fue del 68,5%. Finalmente, independientemente del medio de cría empleado, el 90% de las larvas que iniciaron metamorfosis completaron esta etapa dando adultos activos.
Supervivencia larval en diferentes estrategias de criopreservación de EFB. Se analizaron diferentes formas de preservación del EFB determinando la supervivencia larval luego de 48 h de incubación. Utilizando EFB fresco, la supervivencia larval fue del 86,5% ± 6,5; reduciéndose a un 51% ± 7,8 para el EFB conservado 15 días a 4 ºC y a 31,5% ± 8,2 utilizando EFB conservado durante 15 días a -70 °C sin glicerol. Sin embargo, la sobrevida larval fue del 73% ± 7,2 cuando se empleó el EFB preservado durante 15 días a -70 °C con 15% de glicerol, removido antes del bioensayo. Todos los valores difirieron significativamente entre sí (test de Tukey, a = 0,05).
En este trabajo se presenta un sistema de cría económico y fácil de construir para mantener individuos salvajes de H. irritans durante el desarrollo embrionario y larval en condiciones de temperatura y humedad controlada. El empleo de este sistema de cría ha sido utilizado para analizar el efecto de Bacillus thuringiensis (Filiberti, 2007) y de floxina B sobre el desarrollo postembrionario de H. irritans (Filiberti et al., 2009). También fue empleado para estudiar el ciclo de vida y desarrollo gonadal de las mismas (Basso et al., 2011). Sin embargo, hasta el presente no habíamos descripto la cámara de cría empleada ni el detalle de la preparación de un extracto EFB a partir de materia fecal bovina. La preparación de EFB 30% V/V mantuvo las principales propiedades requeridas para el completo desarrollo larval. El 68,5% de las larvas mantenidas en EFB logró completar el desarrollo e iniciar metamorfosis, alcanzando valores similares a los reportados por Perotti & Lysyk (2003) con un medio constituido por materia fecal bovina estéril suplementado con bacterias Acinetobacter sp. y Pseudomonas sp. El empleo de EFB presenta varias ventajas sobre el MFB ya que es más fácil de almacenar y puede ser preservado por un tiempo prolongado en glicerol y a -70 ºC, evitando así el requerimiento de MFB fresca. Por otra parte, el empleo del EFB facilita la realización de bioensayos, ya que al ser un medio líquido, la solubilidad y homogenización de diferentes sustancias que se quisieran ensayar es más simple y reproducible. Asimismo, el sistema permite localizar y observar fácilmente a las larvas durante su desarrollo, sin interferir en el sistema.

Fig. 3 . Supervivencia larval de Haematobia irritans en diferentes tiempos de incubación, comparando MFB y EFB 30%. Las barras verticales indican los valores promedios y las líneas verticales los valores de desviación estándar. Valores seguidos por la misma letra no difieren significativamente entre ellos, mientras que en los valores seguidos por letras diferentes existe diferencia significativa entre ellos. Comparación de medias de a pares entre grupos del mismo tiempo, T de Student (a = 0,05). Para 48 h: p = 0,111. Para 72 h: p = 0,025. Para 100 h: p = 0,309.
Los medios de cría reportados aportan los factores nutricionales en tanto que la cámara de cría reportada suministra las condiciones ambientales (humedad y temperatura). Ambos sistemas se complementan para sustentar el desarrollo larval. Resulta importante comentar que, además de la humedad, la aireación constante que le proporcionó el humidificador pareció ser un factor crucial para el desarrollo larval, porque cuando los medios de cría fueron tapados las larvas rápidamente abandonaron el sustrato de cría y murieron.
Debido a que no se observó desarrollo larval cuando las diluciones del EFB se realizaron con solución fisiológica en vez de EFB esterilizado, sugerimos que el EFB estaría aportando, además de las bacterias vivas como sustrato nutricional, otros factores que promueven el desarrollo larval.
Cuando los medios de cría ensayados MFB o EFB, fueron esterilizados mediante autoclave, no se registró crecimiento de las larvas, ratificando lo mencionado por diversos autores en cuanto a que la presencia de bacterias vivas, resulta fundamental para la viabilidad de las larvas de H. irritans.
Debido a que el EFB estéril no fue capaz de soportar el desarrollo larval y altas concentraciones de EFB resultaron inhibitorias del desarrollo, consideramos que en la elaboración del EFB, además de las bacterias nutricionalmente valiosas para las larvas, existe la posibilidad de que también se hayan concentrado bacterias que afectan el desarrollo de las mismas manifestando un efecto "anti promotor" o tóxico para el desarrollo larval.
AGRADECIMIENTOS
Se agradece especialmente a los Dres. L.A. Quesada-Allué, J.L. Barra y A.M. Smania por el aporte de ideas y discusión durante la etapa experimental. Se agradece particularmente al Ingeniero Martín Acosta quién ofreció su asesoramiento, rodeo e instalaciones de su estancia "La Azucena" para realizar múltiples experimentos a campo. Estos estudios fueron financiados por aportes de la Agencia Nacional de Promoción de Ciencia y Técnica y la Secretaría de Ciencia y Técnica (SECYT-UNC).
BIBLIOGRAFÍA CITADA
- Alves De Carvalho, L., Da Silva Mendes, L., Mazzi Nakao, A., Gonçalves Mendonça Oliveira, T. & Vieira Da Cunha, W. (2009) Formulação e avaliação de meio artificial para crescimento de larvas de Haematobia irritans (Diptera: Muscidae). Revista do Núcleo Interdisciplinar de Pesquisa e Extensão do UNIPAM, 6, 1-8. [ Links ]
- Basso, A.R, Forneris, N.S., Filiberti, A., Argaraña, C.E., Rabossi, A. & Quesada-Allue, L.A. (2001) Metamorphosis and gonade maturation in the horn fly Haematobia irritans. Journal of Insect Science, 11 , 174. doi: 10.1673/031.011.17401 [ Links ]
- Bruce, W.G. (1964) The history and biology of the horn fly, Haematobia irritans (Linnaeus); with comments on control. North Carolina Agricultural Experiment Station Technical Bulletin, 157, 32. [ Links ]
- Bulman, G.M. (2012) Pérdidas económicas directas e indirectas por parásitos internos y externos de los animales domésticos en Argentina. Anales Academia Nacional de Agronomía y Veterinaria, 64, 76-176. [ Links ]
- Burg, J.G., Knapp, F.W. & Silapanuntakul, S. (1994) Blood meal manipulation and in vitro colony maintenance of Haematobia irritans (Diptera: Muscidae). Journal Medical Entomology, 31, 868-874. [ Links ]
- Ferraz Lima, L.G., Beloti, C.A.C., Perri, S.H.V., Kaneto C.N., Bresciani, K.D.S. & Do Prado, A.P. (2014) Raising of Horn Fly Haematobia irritans (L.) (Diptera: Muscidae) in Laboratory by Means of Egg and Larva Inoculation. Advances in Entomology, 2, 76-80. [ Links ]
- Filiberti, A. (2007) Caracterización molecular y funcional de proteínas con actividad biopesticida, principalmente contra la Mosca de los Cuernos (Haematobia irritans). Tesis Doctoral, UNC. [ Links ]
- Filiberti, A., Rabossi, A., Argaraña, C.E. & Quesada-Allué, L.A. (2009) Evaluation of phloxine B as photo insecticide on im-mature stages of the Horn Fly, Haematobia irritans (L.) (Diptera: Muscidae). Australian Journal of Entomology, 48, 72-77. [ Links ]
- Floate, K.D., Spooner, R.W. & Colwell, D.D. (2001) Larvicidal activity of endectocides against pest flies in the dung of trea-ted cattle. Medical and Veterinary Entomology, 15, 117-120. [ Links ]
- Gough, J.M., Akhurst, R.J., Ellar, J., Kemp, D.H., Wijffels, G.L. (2002) New isolates of Bacillus thuringiensis for the control of livestock ectoparasites. Biological Control, 23, 179-189. [ Links ]
- Guglielmone, A.A., Volpogni, M.M, Castro, H., Mangold, A.J. & Anziani, O.S. (2002) A study of relative horn fly, Haema-tobia irritans (Diptera: Muscidae), abundance on Holstein steers and steers of two Holstein crosses. Veterinary Para-sitology, 16, 141-145. [ Links ]
- Kuramochi, K. (2000a) Survival, ovarian development and blood meal size for the horn fly Haematobia irritans irritans reared in vitro. Medical Veterinary Entomology, 2, 201-206. [ Links ]
- Kuramochi, K. (2000b) Ovipositional behavior of the horn fly (Diptera: Muscidae) in the field. Journal of Medical Ento-mology, 37, 461-466. [ Links ]
- Luzuriaga, R., Eddi, C., Caracostantogolo, J., Botto, E. & Pereira J. (1991) Diagnóstico de parasitación con Haematobia irritans (L.) en bovinos de Misiones, República Argentina. Revista de Medicina Veterinaria (Buenos Aires), 72, 262-263. [ Links ]
- Perotti, M.A. & Lysyk, T.J. (2003) Novel growth media for rea-ring larval horn flies Haematobia irritans (Diptera: Muscidae). Journal of Medical Entomology, 40, 22-29. [ Links ]
- Perotti, M.A., Lysyk, T.J., Kalischuck-Tymensen, L.D., Yanke, L.J. & Selinger. L.B. (2001) Growth and survival of immature Haematobia irritans (Diptera: Muscidae) is influenced by bacteria isolated from cattle manure and conspecific larvae. Journal Medical Entomology, 38, 180-187. [ Links ]
- Stanley, R.J. & Kunz, S.E. (1996) Effects of immersion in water on survival of preimaginal stages of Haematobia irritans (Diptera: Muscidae). Journal of Medical Entomology, 33, 27-31.
- Tarelli, G.J. (2004) Mosca de los cuernos Haematobia irritans (L.): biología, comportamiento y control. 1st ed. Hemisferio Sur S.A. Buenos Aires, Argentina.
- Temeyer, K.B. 1998. Antifungal agents and solvents for use in horn fly larval rearing or bioassays. Southwestern Entomologist, 23, 237-245.
- Temeyer, K.B. &. Clay, C.A. (1993) Choice of antibiotics to control microbial activity in bovine faeces used forhorn fly bioassays. Southwestern Entomologist, 18, 213-217.
- Torres, P. , Cicchino, A.C. &. Rosa, A. (2002) Historia del ingreso y dispersión de la mosca de los cuernos Haematobia irrritans irritans (LO.1758) en la República Argentina. Actualización en Antropología Sanitaria Argentina (ed. Salomon O. D.), pp. 269-272. Serie de Enfermedades Transmisibles, Publicación Monografica 2, Fundacion Mundo Sano, Buenos Aires.














