INTRODUCCIÓN
Periplaneta americana (L.) (Blattodea: Blattidae), la "cucaracha americana”, es una plaga sinantrópica de interés médico, veterinario y económico. Tiene importancia como vector mecánico de enfermedades, ya que se asocia a una amplia variedad de patógenos (bacterias, hongos, virus) y parásitos perjudiciales para el hombre (;, ; Alonso et al., 2014). Se han hallado compuestos alérgenos en sus heces, regurgitaciones y fragmentos de exoesqueleto (;, . Se conoce, además, que sus detritos ocasionan daños al patrimonio documental de archivos y bibliotecas () y que es un insecto causante de entomofobia (.
Las cucarachas tienen capacidad para desarrollar resistencia a la mayoría de los insecticidas químicos. Por ello, en la actualidad, se busca controlarlas mediante el manejo integrado de plagas (MIP) (). En el caso de P americana, se ha evaluado la eficiencia de productos naturales, tales como extractos vegetales (; Arce Barrera, 2009; Jaramillo & Armijos, 2015) o patógenos (; .
Los nematodos entomopatógenos de las Familias Steinernematidae y Heterorhabditidae son parásitos obligados de insectos que ocasionan un efecto letal sobre sus hospedadores (Adams & Nguyen, 2002; ). Por ello, son agentes de control biológico de amplia utilización a escala mundial, y existen numerosos productos comerciales en países de América, Europa y Asia (). Su ciclo de vida incluye huevo, cuatro estadios juveniles y el estado adulto. El tercer estadio juvenil es el infectivo y es el único que se encuentra en el suelo. Este estadio es el encargado de la búsqueda y localización del insecto hospedador. Los juveniles infectivos (JIs) se hallan en asociación simbiótica con enterobacterias de los géneros Xenorhabdus Thomas & Poinar, en el caso de Steinernematidae, y Photorhabdus (Thomas & Poinar) en Heterorhabditidae. Cuando estos JIs localizan a su hospedador, penetran a través de las aberturas naturales y se dirigen al hemocele, donde liberan a su simbionte. La acción conjunta nematodo- microorganismo, provoca la muerte del hospedador entre 24 y 48 h posteriores a la infección. Dentro del insecto los nematodos continúan su desarrollo, sucediéndose dos o más generaciones de individuos adultos de sexos separados, dependiendo del tamaño del insecto. El ciclo se completa con la formación de nuevos JIs que se originan a partir de todas las generaciones. Éstos abandonan el cadáver del insecto en busca de un nuevo hospedador entre los 7 y 10 días posteriores al inicio de la infección , ; .
El empleo de nematodos en control biológico de plagas requiere, entre otros aspectos, evaluar previamente su infectividad y rango de hospedadores susceptibles. Se han observado diferencias intraespecíficas en la infectividae ionadas con el comportamiento (Fairbairn et al., 1999), morfología y fisiología del nematodo, así como con caractecto y factores ambientales (El-Sadawy & Saleh, 1999). Por esta razón es muy importante estudiar, para cada nuevo aislado y/ o especie que se detecta, la infectividad frente a diferentes hospedadores. Los nematodos entomopatógenos parasitan un amplio rango de hospedadores, comario (Ahmad et al., 201y i et al., 1998; García et al., 2004; Cagnolo & Almirón, 2010).
Steinernema rarum (Doucet) se halló por primera vez d de Río Cuarto, Córdoba (Agüera de Doucet, 1986). Desde entonces, esta especie na incia (Cagnolo et al., 2016; Bertolotti & Cagnolo, 2019). El aislado (OLI), procedente de la localidad de Oliva, ha sido evaluado contra diferentes invertebrados en numerosas experiencias de laboratorio y los resultados mu amplio rango de hospedadores (Bertolotti et al., 2011). El aislado N105 fue detectado en un muestreo más recio Boulevares de Córdoba Capital (Cagnolo et al., 2016), y a la fecha no se ha publicado ningún ensayo de infectividad, por lo que se desconoce su comportamiento frente a insectos y otros invertebrados.
Con respecto a la utilización de nematodos entomopatógenos para controlar a la cucaracha americana, existen algunas experiencias realizadas en laboratorio con representantes de las Familias eterorhabá 989), Egipt; t al., 201& García del (Koehler et al., 1992) y Tailandia (Maketon et al., 2010). En estos trabajos se observó una mayor susceptibilidad de P americana a la familia Steinernematidae. En Córdoba sólo se ha realizado un ensayo en laboratorio con un aislado autóctono de Heterorhr, con resultado positivo (de Doucet & Giayetto, 1994). Se desconoce hasta el momento la infectividad de otros representantes nativos de nematodos entomopatógenos sobre P americana, como es el caso de los aislados (OLI) y N105 de S. rarum.
Considerando la mayor eficiencia de la familia Steinernematidae contra P americana y la falta de información sobre el comportamiento de aislados autóctonos pertenecientes a esta familia sobre la cucaracha americana, en este trabajo se evaluó el parasitismo de dos aislados de Córdoba: S. rarum (OLI), y S. rarum N105. El primero fue elegido por su marcada virulencia, y el segundo porque se desconoce su infectividad.
MATERIAL Y MÉTODOS
Los dos aislados de S. rarum utilizados en el experimento provienen de suelos de la provincia de Córdoba. El aislado (OLI) fue detectado en la localidad de Oliva (32°02'30"S; 63°34'11"O) ( ), mientras que el aislado N105 en la ciudad de Córdoba (31°20'17"S; 64°13'19"O) ( ). Los nematodos, luego de ser detectados, se mantuvieron mediante la multiplicación periódica en laboratorio sobre larvas de la polilla de la cera Gallería mellonellaL. (Lepidoptera), según técnicas
convencionales (Kaya & Stock, 1997). En las experiencias se emplearon únicamente juveniles infectivos (JIs).
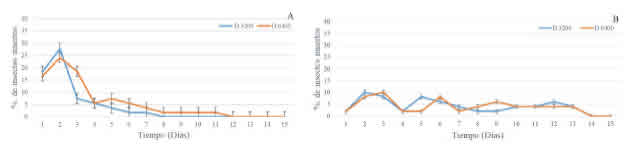
Fig. 1: Mortalidad diaria de Periplaneta americana. A: Steinernema rarum(OLI). B: Steinernema rarumN105. Los puntos en el gráfico indican el porcentaje de mortalidad diaria y las líneas verticales, la desviación estándar.
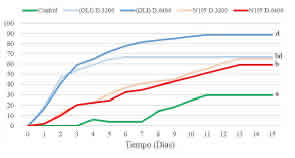
Fig. 2: Mortalidad acumulada de Periplaneta americana por Steinernema rarum. Letras distintas indican diferencias significativas (p ≤ 0,001).

Fig. 3: Porcentaje de insectos parasitados por Steinernema rarum en los que se observó emergencia de JIs en función de la dosis. Las líneas representan la desviación estándar.

Tabla I: Emergencia de JIs de los aislados de Steinernema rarum por insecto. Se indica el valor promedio ± desviación estándar. Letras distintas indican diferencias significativas (p ≤ 0,001).
Insectos
Se utilizaron individuos adultos de ambos sexos de P americana recolectados en diferentes domicilios y plazas de la ciudad de Córdoba. Para la captura se empleó una trampa consistente en un frasco de vidrio con trozos de frutas y/o verduras maduras como cebo, colocado de manera horizontal en el suelo. Los insectos se mantuvieron en el laboratorio de la Cátedra de Parasitología de la FCEFyN-UNC, en un período de cuarentena previo al desarrollo de los experimentos. Para ello se utilizaron recipientes plásticos de tamaño variable cubiertos con una malla de tela y provistos de una plancha de espuma de poliuretano y tubos de cartón, a fin de asegurar un ambiente propicio para su mantenimiento (25 ± 2 °C; 65-75% HR). Durante ese tiempo, fueron alimentados con una dieta a base de levadura en polvo, harina de trigo y harina de maíz, similar a la que se utiliza para G. mellonella (Crespo et al., 1996), a la que se le adicionó frutas y verduras desecadas, pan triturado y sacarosa, y se les aseguró el aprovisionamiento de agua.
Bioensayos
Se usaron JIs de nematodos que no superaban los 30 días de almacenamiento a partir de la fecha de emergencia del hospedador auxiliar utilizado (larvas de G. mellonella). En este período los Jls mantienen su viabilidad. Los inóculos se prepararon 24 h antes de comenzar con los bioensayos. Se evaluaron dos dosis: 3.200 y 6.400 JIs por hospedador, equivalentes a 163 nematodos/cm2 y 326 nematodos/cm2, respectivamente, y un grupo control ( ). Las infecciones se llevaron a cabo en cajas de Petri plásticas, de 5 cm de diámetro ( ;). Los inóculos conteniendo las diferentes dosis de JIs se obtuvieron mediante diluciones (). Para ello, se colocaron en un recipiente 100 ml de agua estéril conteniendo nematodos. De dicha solución se extrajeron 0,5 ml y se contaron los nematodos presentes. El procedimiento se repitió cinco veces. Se calculó el número promedio de nematodos presentes y por regla de tres simple, la cantidad de agua a colocar a fin de obtener el número de Jls necesarios para la dosis. El volumen de agua conteniendo la dosis y que fue filtrada antes de ser aplicada a cada insecto, estuvo relacionada a la cantidad de Jls presentes en la suspensión inicial. En cada caja de Petri se colocó un disco de papel de filtro Whatman #2 seco, y sobre éste, el papel de filtro con la dosis de nematodos. Por último se agregó el insecto. Por cada tratamiento, se consideraron 10 cajas de Petri, conformando 10 réplicas. Las experiencias se repitieron cuatro veces. Al grupo control sólo se le agregó un volumen de agua equivalente al que contenía las dosis, sin nematodos. Las infecciones se mantuvieron a 25 ± 1 °C.
Determinación del parasitismo, desarrollo de los nematodos, obtención y estimación del número de JIs producidos por insecto
Se registró la muerte de los insectos cada 24 h, durante 15 días seguidos. Las cucarachas muertas fueron retiradas de las cajas de Petri, se les extrajeron las alas y se enjuagaron con agua a fin de eliminar los posibles JIs adheridos al cuerpo. Luego se colocaron individualmente en una cápsula de Petri provista de un disco de papel de filtro seco y se mantuvieron a 25 ±
1 °C durante 10 días para permitir el desarrollo de los nematodos dentro del insecto. Transcurrido ese tiempo, cada insecto fue transferido a una trampa White ( ). Estas trampas se observaron cada 24 h a fin de registrar la fecha de emergencia de los JIs, y al cabo de 10 días se procedió a la recolección de éstos en frascos plásticos, que se conservaron a 21 ±
1 °C para su posterior recuento. La estimación de los JIs producidos por hospedador y por dosis se realizó mediante dilución (). Los insectos en los que no se observó emergencia de JIs pasados los 10 días, fueron diseccionados para constatar si la muerte fue causada por el nematodo. En el caso del grupo control, las cucarachas se mantuvieron durante los 15 días en la misma caja de Petri, sin suministrarles alimento.
Análisis de resultados
Los insectos muertos se examinaron bajo lupa estereoscópica marca Zeiss, modelo 47 50 52-990, a fin de observar por transparencia de la cutícula la presencia de nematodos en su interior. También se analizó la consistencia y el cambio de coloración de los tejidos parasitados.
Se calculó la mortalidad diaria y el porcentaje de mortalidad acumulado por dosis cada 24 h para los dos aislados de los nematodos. Los datos se transformaron según la ecuación de Schneider-Orelli () que brinda valores corregidos de mortalidad, a partir de la relación: mortalidad por tratamiento vs mortalidad en el testigo absoluto:
% mortalidad corregida = [(%mt - %mta) / (100 - %mta)] x 100
donde mt = mortalidad en el tratamiento, y mta = mortalidad en testigo absoluto.
Se calculó y comparó el porcentaje de insectos en los cuales se observó eúmero medio de nuevos juveniles infectivos producidos por insecto en cada tratamiento.
La evaluación de los tratamientos se realizó mediante Análisis de la Varianza (ANOVA, p < 0,05) previa comprobación de los supuestos de normalidad, homogeneidad e independencia de los datos
obtenidos. El número medio de JIs producidos por insecto fue transformado a raíz cuadrada, para que se cumpliera el supuesto de normalidad y homogeneidad. La comparación de los valores medios se realizó mediante el test de comparaciones múltiples de Duncan. Los análisis estadísticos se implementaron en InfoStat versión libre (Di Rienzo et al., 2018).
Resultados
Mortalidad diaria
La mortalidad de P americana por Steinernema rarum (OLI), fue observada durante 7 días con 3.200 JIs/hospedador y durante 11 días con 6.400 Jls/ hospedador (Fig. 1A). Los valores máximos de mortalidad diaria correspondieron al segundo día, con 28% y 24% para la dosis baja y alta, respectivamente.
La mortalidad ocasionada por S. rarum N105 fue observada durante 13 días independientemente de la dosis empleada (Fig. 1B). Los valores máximos de mortalidad diaria fueron del 10% y se registraron al segundo día con 3.200 JIs/hospedador, y al tercer día con 6.400 JIs/hospedador.
Mortalidad acumulada por tratamiento
Las curvas de mortalidad acumulada mostraron diferencias entre aislados (Fig. 2). En el caso de S. rarum (OLI), al inicio, presentaron un crecimiento exponencial, que disminuyó progresivamente hasta alcanzar el máximo. Con la dosis mayor, el valor máximo de mortalidad acumulada (89%) se observó el día 11, en tanto que con la dosis menor la máxima mortalidad (67%) se alcanzó el día 6.
En el tratamiento con S. rarum N105, las curvas de mortalidad acumulada presentaron un crecimiento aproximadamente lineal. El porcentaje máximo de hospedadores muertos se observó en ambos casos el día 13, siendo del 59% para la dosis mayor y del 65% con la dosis menor. Para el grupo control, el porcentaje máximo de hospedadores muertos (29,5%) correspondió al día 11.
El Análisis de la Varianza evidenció diferencias significativas en la mortalidad con los diferentes tratamientos y el grupo control (F4,15 = 18,95; p < 0,001). Asimismo, fueron significativas las diferencias en la mortalidad entre las dosis de S. rarum (OLI), no así con el otro aislado (Duncan p < 0,05).
Emergencia de nuevos Jls a partir de insectos parasitados
En ambos tratamientos, de más del 80% de las cucarachas infectadas se observó emergencia de JIs de nematodos (Fig. 3). El mayor porcentaje correspondió a aquellas inoculadas con la menor dosis de S. rarum (OLI), aunque no se evidenciaron diferencias significativas entre los tratamientos (F3,12 = 1,84; p < 0,2).
El mayor número medio de emergencia de JIs correspondió al tratamiento con S. rarum (OLI) 6.400 Jls/hospedador con un valor de 33 ± 3 x 104 JIs/ hospedador, mientras que el menor número medio, al tratamiento con S. rarum N105 3.200 Jls/hospedador (14 ± 3 x 104 JIs/hospedador) (Tabla I). Se encontraron diferencias significativas entre tratamientos (F3,126 = 5,26; p < 0,001).
Histopatología
Los tejidos de los insectos parasitados presentaron una consistencia blanda, degradada y sin signos de putrefacción, y no se observaron cambios en la coloración de los tejidos, manteniendo el color natural marrón-rojizo característico de este insecto. Los nematodos se observaron en regiones del tórax y abdomen (Fig. 4).
Discusión
Los resultados muestran que P americana es susceptible en laboratorio a los dos aislados de S. rarum utilizados. Por otro lado, este insecto se incorpora al rango de hospedadores conocidos para el aislado (OLI) (), y es el primer hospedador que se conoce en laboratorio para el aislado N105.
Steinernema rarum (OLI) causó mayor mortalidad que el aislado N105. Esto estaría reflejando diferencias en la capacidaddeinfectardeambosaislados, onfirmando una vez más la mayor virulencia del primero (). Se sabe que las especies del género Steinernema muestran diferentes comportamientos de búsqueda del hospedador, por ejemplo, S. glaseri (Steiner) tiene una estrategia de caza, mientras que S. carpocapsae (Weiser), de emboscador (). En el caso de S. rarum (OLI) se conoce que posee las dos estrategias de localización mencionadas (), lo que explicaría, en parte, su mayor eficiencia. Sin embargo, esta característica se desconoce para el otro aislado evaluado.
En relación a los porcentajes de mortalidad, en el aislado N105 no se encontraron diferencias significativas entre las dosis y ambas tuvieron un efecto similar a la dosis menor de S. rarum (OLI). Esta es la primera prueba de infectividad que se realiza con el aislado N105 en laboratorio, por lo que sería interesante evaluar para distintos insectos, un rango que abarque diferentes dosis y determinar cómo varían los porcentajes de mortalidad.
Para el aislado S. rarum (OLI), por el contrario, se registraron diferencias significativas entre las dosis, tal como fuera observado en otras experiencias de laboratorio contra insectos plaga de la agricultura y utilizando dosis de 50 y 500 Jls/hospedador. A modo de ejemplo, con adultos de Anticarsia gemmatalis (Hubner) y larvas de Diatraea saccharalis (Fabricius) (Lepidoptera) se obtuvo mayor mortalidad con la dosis más alta (;). Por otro lado, en pruebas realizadas contra invertebrados que habitan jardines, se encontró que los porcentajes de mortalidad, la duración del ciclo parasitario y la producción de progenie varían entre las distintas especies de hospedadores (Picca & Cagnolo, 2008).
Es posible que las diferencias observadas en la susceptibilidad de P americana a los aislados (OLI) y N105, puedan depender no sólo de las características biológicas de los nematodos utilizados, sino también de las condiciones fisiológicas del hospedador, por ejemplo, la respuesta de su sistema inmune (.
En distintos trabajos se ha evaluado la susceptibilidad tanto de P. americana como de otra especie de cucaracha, Blattella germánica (L.) frente a nematodos de la familia Steinernematidae. Maketon e) n el efecto de Steinernema sp. y S. carpocapsae y encontraron que las dosis que causaron mayor mortalidad fueron 1 x 106 y 5,4 x 104 JIs/ hospedador, respectivamente, y que los adultos de B. germanica fueron más susceptibles que los de P. americana. Por otra parte, ) observaron que las ninfas de P. americana fueron más susceptibles a S. carpocapsae que los adultos, con dosis de 500.000 JIs/hospedador. Al comparar los resultados obtenidos entre sexos, estos autores reportaron que no se diferenciaron significativamente. Por el contrario, ) observaron que los machos de P. americana fueron más susceptibles que las hembras con las dosis de 3.200 y de 6.400 JIs/caja de S. carpocapsae. Sería interesante realizar experiencias con los aislados (OLI) y N105 a fin de evaluar la existencia de una respuesta diferencial según el sexo de P. americana.
Las cucarachas del grupo control vivieron más tiempo que los insectos tratados con nematodos, pereciendo por inanición. En los insectos parasitados se evidenció el cambio característico en la consistencia de los tejidos internos, y ausencia de signos de putrefacción por la acción de los microorganismos simbiontes de S. rarum, Xenorhabdus sp. Se conoce que estas bacterias son las encargadas de degradar los tejidos del hospedador y transformarlos en alimento para los nematodos, además de impedir, mediante la producción y liberación de sustancias antibióticas, la proliferación de otros microorganismos. Las bacterias también son responsables de la producción de cristales rojos que brindan una coloración rosada en el hospedador (;, . Sin embargo, en los individuos de P americana parasitados, no se evidenció ese cambio de coloración, aunque la bacteria simbionte los preservó de la colonización de otros microorganismos. El color propio del insecto, marrón-rojizo, pudo haber enmascarado dicho cambio.
El elevado porcentaje de insectos a partir de los cuales se registró emergencia de JIs al final del ciclo parasitario, pone en evidencia que P. americana es un hospedador favorable para los dos aislados de S. rarum evaluados. Esto coincide con estudios similares con otras especies del género Steinernema, en los que se observó que P. americana brinda un medio favorable para el desarrollo y reproducción del parásito, permitiéndole completar su ciclo vital y perpetuarse (Koehler oa
En cuanto al número medio de JIs producidos por insecto, se observó que la producción de progenie fue siempre mayor a partir de los insectos tratados con S. rarum (OLI). Existen antecedentes de diferencias intraespecíficas en la infectividad, tal como ha sido señalado para Steinernema feltiae (Filipjev)t ;). Las diferencias entre poblaciones de una misma especie estarían relacionadas con el tiempo de liberación de la bacteria simbionte) y las variaciones en la virulencia de dicha bacteria ). Según estos estudios, las diferencias observadas en el presente trabajo en la producción de juveniles infectantes podrían estar influenciadas por las variables antes mencionadas, que afectarían la tasa de ingreso de los JIs, el desarrollo de los adultos dentro del hospedador y la progenie.
Los resultados de este trabajo y, particularmente, la mayor efectividad mostrada por S. rarum (OLI) contra P americana, es información a tener en cuenta, cuando se evalúan posibles estrategias de control de este insecto. Estudios como el presente son indispensables para reunir información de base sobre estos organismos, particularmente los nativos, y su probable empleo como bioinsecticidas. Sería interesante en futuros trabajos, evaluar otros aspectos del comportamiento de estos aislados, tales como tiempo de liberación del simbionte y su patogenia, considerando, además, variables como sexo, peso y edad del insecto. En el caso del aislado N105, otras características como supervivencia bajo diferentes variables, comportamiento de búsqueda del hospedador, virulencia y susceptibilidad de diferentes invertebrados deberían ser también evaluadas, así como utilizar un rango de dosis más amplio para estos nematodos. Sería igualmente interesante probar estos aislados en ambientes donde naturalmente se encuentra este insecto y estimar así las potencialidades reales de estos nematodos como agentes de control biológico.












 uBio
uBio