INTRODUCCIÓN
Los agroecosistemas son ambientes naturales modificados con el fin de obtener diversos productos para el aprovechamiento humano (Lombardo et al., 2014). Las modificaciones producidas ejercen profundas alteraciones sobre la estructura y el funcionamiento original, debido principalmente a la reducción de la biodiversidad, generando ecosistemas simplificados y homogéneos sostenidos por el aporte continuo de insumos (trabajo agrícola, agroquímicos y energía fósil) que reemplazan las funciones naturales (Swift et al., 2004). Los agroecosistemas presentan dos componentes de biodiversidad fundamentales: la
biodiversidad planificada, que incluye la variedad de especies vegetales y/o animales domesticadas que son incorporados en el ambiente; y la biodiversidad asociada, que incluye organismos cuya presencia no es mediada directamente por acción humana (Altieri, 1999). Generalmente, la biodiversidad asociada es escasamente conocida, aunque cumple importantes roles ecológicos para el sostenimiento de la productividad del agroecosistema. Estos roles son denominados servicios ecosistémicos, entre los que se encuentran la descomposición, el control biológico, la polinización, entre muchos otros (Altieri, 1999).
Los insectos cumplen con numerosos servicios ecosistémicos, y entre ellos, las moscas se destacan por presentar una enorme diversidad morfológica y funcional (McAlpine, 1981, 1987). En particular, las moscas de las flores o sírfidos (Diptera: Syrphidae), conforman una familia cosmopolita de unas 6.200 especies descritas (Young et al., 2016), muy diversa tanto en morfología como en sus ciclos de vida (Vockeroth & Thompson, 1987). La mayoría de los adultos son polinizadores (Doyle et al., 2020) y los estadios larvales exhiben una gran diversidad de comportamiento alimenticio. Existen especies saprófagas, depredadoras, polínivoras, minadoras de hojas, fitófagas y algunas que pueden producir miasis en humanos y en animales de cría (Thompson et al., 2010; Zuijen & Nishida, 2011; Pérez-Bañón et al., 2020).
En Argentina existen alrededor de 170 especies de moscas de las flores (López- García et al., 2019), de las cuales cuatro son exóticas (Torretta et al., 2021). De los pocos trabajos realizados sobre esta familia, la mayoría se basa en estudios taxonómicos (detallados en López-García et al., 2019) o en su rol como especies afidófagas (Greco, 1995; López-García & Maza, 2013; Maza, 2018); sin embargo, aún son escasas las investigaciones sobre esta familia en agroecosistemas y en ambientes naturales. Algunos trabajos acerca de visitantes florales de cultivos y flora acompañante en agroecosistemas de Argentina (principalmente en la región pampeana) citan especies de sírfidos, pero no como el grupo central del estudio (Torretta et al., 2010; Torretta & Poggio, 2013; Marrero et al., 2014; 2015; 2017; Chamer et al., 2020; Monasterolo et al., 2020). El conocimiento de la fauna nativa presente en agroecosistemas es un factor clave en la gestión y mantenimiento de los mismos (Sommaggio, 1999) y resulta particularmente relevante el estudio en los agroecosistemas de la región Pampeana ya que se desconocen los efectos de la intensa transformación que sufrió esta región en las últimas décadas sobre la fauna silvestre local (Medan et al., 2011).
Los objetivos del presente trabajo fueron 1) conocer la diversidad de sírfidos en un agroecosistema pampeano, 2) reconocer las especies florales utilizadas por los adultos, y 3) indagar sobre el posible rol ecológico de las especies presentes, en relación al comportamiento alimenticio de sus larvas y las visitas florales de los adultos. Finalmente, discutir los resultados obtenidos con la información publicada para otras comunidades de moscas de las flores en agroecosistemas y áreas naturales de la región pampeana.
MATERIAL Y MÉTODOS
Sitio de estudio
La Estancia San Claudio (a partir de ahora, SC; partido de Carlos Casares, provincia de Buenos Aires; 36° 00’ S, 61° 50’ O) se encuentra dentro de la subregión Pampa Interior (Marrero et al., 2014). Esta subregión presenta un clima subhúmedo con un promedio de precipitación anual de 1.022 mm y una temperatura media anual de 15,8 °C (Tognetti et al., 2010). El área de estudio posee suelos Hapludols típico franco-arenosos, dominantes en la región (Facelli & D'Angela, 1990). Es un establecimiento agrícola-ganadero que posee una superficie aproximada de 5.600 hectáreas, dedicadas en su mayoría a agricultura de manejo tradicional (Marrero et al., 2014). Se utilizan principalmente sistemas de cultivo mixto con aplicación frecuente de agroquímicos (Graffigna et al., 2021). Los principales cultivos de primavera-verano son la soja (Glycine max (L.) Merr.) y el maíz (Zea mays L.), en menor medida el girasol (Helianthus annuus L.) y la alfalfa (Medicago sativa L.). Además existen sectores con árboles y/o pasturas implantadas (Tognetti et al., 2010). Aproximadamente, el 4% de SC presenta hábitats semi-naturales (por ejemplo, márgenes de cultivos, caminos y áreas peri-domésticas, clausuras) con diversas especies de plantas entomófilas nativas y exóticas (Marrero et al., 2014).
Moscas de las flores: material analizado y determinaciónSe analizaron los ejemplares de sírfidos depositados en la Colección Entomológica de la Cátedra de Botánica General de la Facultad de Agronomía (U.B.A.), colectados por J.P. Torretta, y H.J. Marrero (y colaboradores), en SC entre los años 2004 y 2018 (desde noviembre hasta abril, no todos los años fueron muestreados), en distintos trabajos de investigación de ambos autores. Debido a que los ejemplares fueron capturados durante distintos estudios, existen
diferencias en la manera que fueron colectados; no obstante, las capturas siempre fueron realizadas con redes entomológicas (Sakagami et al., 1967) en visitas primavero-estivales sobre flores de cultivos y/o especies espontáneas. En algunos casos, se registró la planta huésped mientras que en otros no. Las capturas fueron realizadas en lotes cultivados, márgenes/bordes de los cultivos, en caminos internos de SC y/o en caminos rurales, y en áreas cerradas al manejo agrícola (clausuras). Los insectos capturados fueron sacrificados in situ, en frascos con cianuro de potasio (KCN) y posteriormente fueron montados en alfileres entomológicos y etiquetados (fecha de captura, planta huésped [si tuviera] y colector/es).
Para la determinación de las moscas de las flores se utilizaron las claves de Hull (1946), Lagrange (1987; 1990a; 1990b; 1992), Thompson (1997, 1999; 2006), Thompson et al. (1990, 2000), Thompson & Thompson (2006), Borges & Couri (2009) y se actualizó la clasificación taxonómica de algunos géneros (Mengual et al., 2018a, 2018b; Miranda et al., 2020). En otros casos se compararon los especímenes con material de referencia determinado por F.C. Thompson depositados en la propia colección entomológica de la cátedra o en el Museo Argentino de Ciencias Naturales Bernardino Rivadavia (MACN). A los individuos que no lograron ser determinados a nivel específico se los consideró como morfoespecies.
Análisis de los datosA partir de los datos obtenidos se calcularon la riqueza (número de especies o morfoespecies) y la abundancia (número de individuos colectados de cada especie o morfoespecie). Se clasificó a cada especie según su origen (nativa o exótica). Para analizar los recursos florales utilizados por las moscas de las flores, se listaron todas las especies de plantas huéspedes y se clasificaron por afinidad taxonómica (familia) y origen (nativa o exótica). Además, se graficó una red de interacción entre las moscas de las flores y sus plantas huéspedes utilizando el paquete bipartite (Dormann et al., 2009) del software estadístico R (R Development Core Team, 2013); para ello, todas las interacciones observadas durante todos los años de muestreo fueron agrupadas en una única matriz.
Para aquellas especies determinadas fehacientemente, se realizó una búsqueda bibliográfica para registrar el comportamiento alimenticio de las larvas y poder asociarlas a un determinado grupo funcional: descomponedor, filtrador, depredador, de importancia sanitaria (por ejemplo, generador de miasis). Cabe destacar que no se han colectado/ estudiado estadios larvales, sino que los comportamientos alimenticios para las especies/ morfoespecies están inferidos a partir de datos conocidos para las mismas u otra/s especie/s de los géneros.
RESULTADOS
Diversidad y abundancia
En total, se analizaron 1.827 individuos adultos capturados a lo largo de todos los años de estudio. Las moscas de las flores de SC estuvieron representadas por tres subfamilias, ocho tribus, 17 géneros y 26 especies/morfoespecies (Tabla I). Todos los géneros capturados estuvieron representados por una o dos especies, excepto Palpada Macquart que estuvo representado por siete especies. De las 26 especies capturadas, 23 son especies nativas y tres son exóticas. Entre las especies nativas, se incluyeron a las cinco morfoespecies, ya que pertenecen a géneros exclusivamente americanos y con especies presentes en el país.
En relación a la riqueza, la subfamilia Eristalinae estuvo representada por ocho géneros y 14 especies (Tabla I), y fue ligeramente superior a la subfamilia Syrphinae (ocho géneros y 11 especies). En cuanto a la abundancia, la relación se invierte: la subfamilia Syrphinae fue la más abundante con 1.106 individuos, mientras que Eristalinae estuvo representada por 720 individuos capturados. La subfamilia Microdontinae solo estuvo representada por un único ejemplar. Sólo tres géneros (Allograpta Osten Sacken, Palpada y
Toxomerus Macquart) representaron casi el 91% de los ejemplares, y solamente dos especies Allograpta exotica Wiedemann (584 ejemplares) y Toxomerus duplicatus (Wiedemann) (483 ejemplares) dominaron la abundancia con el 58,4% de todas las moscas de las flores colectadas en SC. Veinte especies estuvieron representadas por menos de 25 ejemplares, 15 por seis o menos ejemplares, y cinco por un único ejemplar ("singletons”).
Recursos florales utilizadosSe registraron 576 interacciones entre 22 especies de sírfidos y flores de 44 especies de plantas cultivadas y/o espontáneas (Tabla II) pertenecientes a 15 familias vegetales. Las moscas de las flores forrajearon por recursos alimenticios (néctar y/o polen) en 16 especies nativas y 28 exóticas (o naturalizadas) (Flora Argentina, 2020; Fig. 1).

Tabla I: Diversidad de moscas de las flores (Diptera: Syrphidae) capturadas en flores silvestres y cultivadas en la Estancia San Claudio (C. Casares, Prov. de Buenos Aires), un agroecosistema pampeano. Origen E: exótica; N: nativa.
En relación a la abundancia y riqueza de sírfidos, las flores o inflorescencias más visitadas fueron las de las especies exóticas Hirschfeldia incana (L.) Lagr.-Fossat (38% de las visitas y 56% de las especies de sírfidos), Conium maculatum L. (17,2% y 48%, respectivamente), Carduus acanthoides L. (6,4% y 36%, respectivamente) y la especie nativa Baccharis pingraea DC. (11,3% y 44%, respectivamente). En total, estas cuatro especies vegetales soportaron al 72,9% de los individuos colectados y el 72% de las especies de moscas de las flores presentes en el sitio de estudio.
Servicios ecosistémicos brindados por los estadios larvales subfamilia a la que pertenecen (Tabla III). El 39,4% de los individuos (subfamilia Eristalinae) capturados se pueden catalogar como filtradores de ítems orgánicos en aguas polutas y/o descomponedores. De las 14 especies/morfoespecies de Eristalinae capturadas hay datos bibliográficos para cinco de ellas (35,7%); de las cuales tres son sinantrópicas y exóticas (Tabla III).
De acuerdo a los ciclos de vida de las moscas de las flores colectadas en SC, a las especies se las puede clasificar en dos grupos funcionales (filtradores/ descomponedores, depredadores) asociados a la
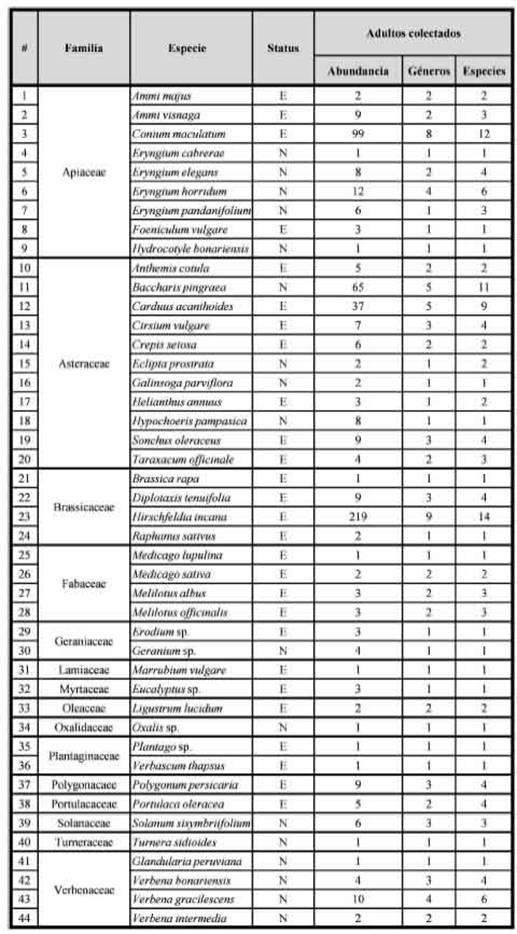
Tabla II: Plantas huéspedes de las moscas de las flores (Diptera: Syrphidae) capturadas en la Estancia San Claudio (C. Casares, Prov. de Buenos Aires), un agroecosistema pampeano. Origen: E = exótica; N = nativa.

Fig. 1: Red cuantitativa de interacciones entre las moscas de las flores (Diptera: Syrphidae) y sus plantas huéspedes en la Estancia San Claudio (C. Casares, Prov. de Buenos Aires), un agroecosistema pampeano. Las especies están representadas por rectángulos cuyo ancho es proporcional a la suma de interacciones que las involucran. Las especies de plantas (el número se corresponde con el de la Tabla II) están discriminadas por origen (nativas: negro; exóticas: naranja) y las especies de moscas de las flores a nivel de Subfamilia (Eristalinae: blanco; Syrphinae: azul). Los rectángulos rayados indican a las especies exóticas de Syrphidae. El ancho de las líneas que representan las interacciones entre las flores y las especies de sílfidos es proporcional a la cantidad de las mismas.
Por otro lado, el resto de los individuos (60%) se los puede catalogar como depredadores (subfamilias Syrphinae [excepto Toxomerus politus (Say)] y Microdontinae). La mayoría de las especies de Syrphinae son predadores de insectos de cuerpo blando (aunque existen especies polinívoras, minadoras de hojas). De las 11 especies/morfoespecies de Syrphinae capturadas hay datos bibliográficos para siete de ellas (Tabla III). La mayoría de las especies con ciclo de vida conocido resultaron ser depredadoras de áfidos, y para T. duplicatus además hay registros de consumo de larvas de dos especies de escarabajos del género Microtheca Stál (Coleoptera: Chrysomelidae) en el sur de Brasil. La excepción dentro de la subfamilia Syrphinae es T politus cuyas larvas se alimentan sobre granos de polen de maíz (Z. mays [Poaceae]; Tabla III), un cultivo estival abundante en el área de estudio. Por lo tanto, los diez individuos capturados de esta especie (0,6%) deben ser catalogados como polinívoros y no estarían brindado un servicio ecosistémico). Finalmente, al único individuo capturado de Microdontinae se lo puede clasificar también como depredador, debido al comportamiento de sus larvas de alimentarse de estadios inmaduros de hormigas (López-García et al., 2020).
DISCUSIÓN
Diversidad
Este trabajo representa el primer análisis de la comunidad de moscas de las flores en un agroecosistema o en un ambiente natural de Argentina. Los resultados muestran que la comunidad de moscas de las flores en el agroecosistema estudiado estuvo dominada por un pequeño grupo de especies muy abundantes y muchas especies poco frecuentes. Estas últimas pueden representar más del 50% de las especies colectadas en comunidades de insectos tropicales, incluso en grandes colecciones (Novotny & Basset, 2000).
Debido a los diferentes requerimientos de hábitats, los sírfidos podrían verse particularmente afectados por una disminución en la diversidad de paisajes (Sommaggio, 1999), tal como ocurre en hábitats homogéneos (es decir, grandes áreas de monocultivo) y profundamente modificados como los agroecosistemas pampeanos. La dominancia numérica de A. exotica y T. duplicatus podría deberse a sus comportamientos de forrajeo dentro de la matriz agrícola, es decir, que los lotes cultivados sean hábitats favorables para estas especies. Resultados similares fueron reportados para agroecosistemas en el sur de Brasil, donde las tres especies más abundantes representaron entre 81% (Medeiros et al., 2018) y el 85,5% (Bortolotto et al., 2016) de los individuos colectados, y A. exotica fue la especie más abundante en estos trabajos, representando el 52% (Medeiros et al., 2018) y el 60,5% (Bortolotto et al., 2016). Allograpta exotica es una especie muy abundante en su rango de distribución natural (Arcaya et al., 2017), con adultos activos durante el invierno en la región pampeana y probablemente exhiba un ciclo de vida mutivoltino (varias generaciones al año) (Greco, 1995). Souza et al. (2014) reportan que las comunidades de sírfidos en ambientes abiertos y de temprana sucesión ecológica, tal como los agroecosistemas, están dominadas por pocas especies muy abundantes; mientras que son más equitativas (con menor riqueza y similar abundancia entre especies) en bosques bien conservados. Es llamativa la baja abundancia de T politus, una de las pocas especies fitófagas del género (Reemer & Rotheray, 2009), cuyas larvas se desarrollan en granos de polen de maíz, un recurso muy abundante (al menos temporalmente) en el sitio de estudio. Sin embrago, debido a que los muestreos estuvieron sesgados hacia flores de plantas entomófilas, la representatividad real de esta especie podría ser mayor que la reportada en este trabajo.
El género Palpada estuvo representado por siete de las 27 reportadas en el país (Lagrange, 1992); la presencia de casi 26% de la riqueza nacional es llamativo para un agroecosistema altamente modificado como SC. Nuevamente, la mayor abundancia de individuos (ca. 92%) correspondió solamente a tres especies, con muy pocos ejemplares de las restantes. El suelo de la Pampa Interior, en la cual está situado nuestro sitio de estudio, presenta una topografía extremadamente chata, con un lento escurrimiento (Aragón et al., 2011). Este tipo de suelo, permite la formación de cuerpos de agua temporales donde las hembras adultas de estas especies podrían encontrar sitios aptos para la oviposición.
La baja representatividad de la subfamilia Microdontinae podría deberse a que los adultos no forrajean en flores; por lo tanto, el tipo de muestreo realizado (captura con redes entomológicas sobre flores) podría estar sesgando su presencia. Otra posible explicación podría ser que el manejo del agroecosistema (utilización de herbicidas y pesticidas, y otras prácticas agrícolas) disminuya la disponibilidad de nidos de hormigas.
Recursos florales utilizadosLas moscas de las flores forrajearon por néctar y/o polen en numerosas especies de plantas silvestres y/ o espontáneas presentes en los márgenes lineales de los lotes cultivados, en los caminos rurales y/o en áreas semi-naturales dentro del agroecosistema estudiado.
El número de plantas entomófilas presentes en SC y sus alrededores exhibe variabilidad interanual y geográfica: Marrero et al. (2014) citan 71 especies (bordes de cultivos, clausuras), Rosanigo et al. (2020) informan 48 especies (solo en las clausuras) y Monasterolo et al. (2020) reportan 72 especies en los caminos rurales. Las moscas de las flores utilizaron 44 especies vegetales con diferentes morfologías florales (formas, colores, tamaños, etc.). Las especies vegetales espontáneas más abundantes, y con mayores fenologías de floración (H incana, C. acanthoides, B. pingraea; obs. pers.) fueron la más utilizadas por los sírfidos. Otra especie vegetal exótica muy utilizada fue C. maculatum (Apiaceae), en la cual se han capturado muchas de las especies raras (es decir, poco colectadas): Lepidomyia ortaina Wulp, Meromacrus nectarinoides Lynch Arrabálzaga y Sphiximorpha barbipes Loew, solo capturadas en sus flores. Esta especie vegetal es una de las primeras en florecer, con el pico de abundancia floral en noviembre-diciembre, con una fenología de floración explosiva y con gran cantidad de recursos (néctar y/o polen) para sus polinizadores, como ocurre con otras Apiaceae (Lenardis et al., 2017). Posiblemente, en esa época del año sea una de las principales fuentes de recurso para los polinizadores. A excepción de B. pingraea, que forma manchones perennes, en general asociado a la base grandes árboles implantados (ej. Eucaliptus sp.; obs. pers.), las plantas nativas tienden a ser escasas y su oferta floral limitada. Por lo tanto, la comunidad de moscas de las flores en SC (y posiblemente en casi todos los agroecosistemas pampeanos) depende de los recursos aportados por la planta silvestres exóticas para mantener sus poblaciones. Esto mismo sucede con muchas otras especies de polinizadores presentes en nuestro sitio de estudio (Torretta & Durante, 2011; Torretta et al., 2012; Marrero et al., 2014).
Nuestros resultados muestran que los sírfidos de SC son visitantes florales generalistas como ya ha sido reportado generalmente para la familia (Lucas et al., 2018). La red de interacciones muestra que las visitas de los sírfidos a las flores/inflorescencias exhibe un patrón anidado, es decir, que hay un grupo de especies centrales generalistas que visitan plantas muy frecuentadas y otro grupo de plantas poco visitadas por otros sírfidos, y muchas especies especialistas (o raras) que visitan a plantas muy visitadas; un típico patrón observado en redes mutualistas planta-polinizador (Bascompte et al., 2003). Klecka et al. (2020) muestran que existe mayor especialización en especies de Eristalinae y Pipizinae comparadas con especies más generalistas de Syrphinae, sin embargo, nuestros datos están fuertemente dominados por muy pocas especies, por lo que cualquier conclusión parece especulativa.
Servicios ecosistémicosLas larvas de las especies colectadas en nuestro sitio de estudio ofrecen dos importantes servicios ecosistémicos: control biológico y descomposición. Las especies de la subfamilia Syrphinae se caracterizan por ser depredadoras voraces de áfidos y pulgones, alimentándose de numerosos individuos a lo largo de su desarrollo (Rojo et al., 2003; Arcaya et al., 2017). Este hábito alimentario las convierte en potenciales controladores biológicos dentro de los ecosistemas (Tenhumberg & Poehling, 1995; Maza, 2018). Las larvas de la subfamilia Eristalinae son saprófagas en materia en descomposición de diversos orígenes y/o en aguas polutas (Mengual et al., 2008). Existe escasa información sobre los hábitos particulares de saprofagia de las especies estudiadas en SC. Las especies de Palpada, debido a su abundancia, se presentan como grupos particularmente interesantes para ser estudiados en cuanto su aporte en el ciclado de nutrientes en el agroecosistema.
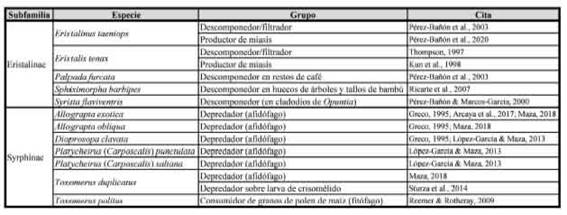
Tabla III: Datos biológicos bibliográficos para especies de moscas de las flores (Diptera: Syrphidae) capturadas en la Estancia San Claudio (C. Casares, Prov. de Buenos Aires), un agroecosistema pampeano.
Por otro lado, los adultos de dos de las tres subfamilias presentes en SC utilizan polen y/o néctar de flores para alimentarse. Debido a su abundancia y a su capacidad de transportar polen a través de largas distancias, las moscas de las flores podrían ser consideradas polinizadoras generalistas (Vockeroth & Thompson, 1987; Pérez-Bañón et al., 2007) y de gran importancia para las especies vegetales silvestres de SC. Algunos autores (Rader et al., 2016; Doyle et al., 2020) mencionan a los sírfidos como los dípteros polinizadores más importantes y más frecuentes después de los himenópteros. Sin embargo, su eficiencia en la polinización continúa en estudio. SegúnHolloway (1976), los miembros de la subfamilia Eristalinae podrían ser más eficientes respecto a los de la subfamilia Syrphinae, debido a la menor densidad de pilosidad y los frecuentes hábitos de acicalamiento de éstos últimos.
Finalmente, debido a su capacidad potencial para producir miasis, se deberían controlar las poblaciones de Eristalis tenax (L.) (Kun et al., 1998) y Eristalinus taeniops Wiedemann (Pérez-Bañón et al., 2020).
Comparación con otros ensambles de sírfidos en agroecosistemas y sistemas naturales pampeanosLa información acerca de la comunidad de moscas de las flores en agroecosistemas pampeanos es escasa. Greco (1995) estudió la fenología de las seis especies afidófagas más comunes en parcelas de cultivos agrícolas; de las cuales tres están presentes en SC: A. exotica, A. obliqua (Say) y E)ioprosopa clavata (Fabricius) (citada como Pseudodoros clavatus (Fabricius)) y las otras tres especies pertenecen a tres géneros también presentes en SC (Platycheirus Lepeletier & Serville, Ocyptamus s.l. Macquart y Syrphus Fabricius). Otros trabajos en los cuales se menciona la presencia de Syrphidae en agroecosistemas pampeanos, se focalizaron en interacciones de malezas, plantas silvestres (de bordes de cultivos, áreas semi-naturales, etc.) y/o cultivos y sus potenciales polinizadores. En lotes cultivados de girasol y la vegetación asociada en cercanías de Balcarce (37°46’ S, 58°18’ O), Torretta & Poggio (2013) reportan solamente la presencia de A. exotica y Palpada elegans Blanchard. Marrero et al. (2014) presentan datos de visitantes florales colectados en lotes ganaderos cercanos a la localidad Pila (36°16’ S, 58°1’ O) durante las estaciones primavero-estivales de tres años consecutivos (2009-2011) y reportan siete especies de sírfidos, de las cuales seis están presentes en SC: A. exotica, T duplicatus (citado como Toxomerus sp.) y cuatro especies de Palpada (P. distingüenda Wiedemann, P. elegans, P. meigenii Wiedemann y P. rufiventris (Macquart)). Para lotes de girasol y la vegetación asociada, en Gral. Villegas (34°43’ S, 63°12’ O), en el NO de la provincia de Buenos Aires, Chamer et al. (2020) mencionan a Allograpta sp., Palpada sp. y Toxomerus sp. Por último, Monasterolo et al. (2020) presentan datos de visitantes florales de flores silvestres en caminos rurales que rodean a SC (el mismo sitio de estudio que este trabajo); y reportan 14 especies de sírfidos: Palpada (6 spp.; sin mencionar abundancias específicas), Toxomerus (2 spp.) y Allograpta (1 sp.) representan las especies más abundantes.
Asimismo, también existen pocos registros de moscas de las flores en sitios naturales y/o protegidos de la región pampeana. Nuevamente, en base de trabajos relacionados a la interacción de plantas-polinizadores, se puede encontrar alguna información. En los bosques de tala protegidos en la Reserva de la Biosfera MAB-UNESCO ‘Parque Costero del Sur’ (35° S, 57°30’ O), Basilio et al. (2006) capturaron 13 especies de sírfidos durante tres años (desde agosto 1998 hasta mayo 2001). El elenco de sírfidos de estos bosques estuvo dominado nuevamente por Palpada (6 spp.), A. exotica, T duplicatus (citado como Toxomerus sp.), con la presencia en mucha menor abundancia de individuos de D. clavata, Syrphus reedi Shannon, Platycheirus (Carposcalis) spp., Copestylum sp., entre otros. Estos autores no listan las especies, pero los ejemplares pudieron ser estudiados debido a que se encuentran depositados en la Colección Entomológica de la Cátedra de Botánica General (FAUBA). En la Reserva Natural de Punta Lara (34°47’ S, 58°01’ O), Montaldo et al. (2017) reportan 10 especies de sírfidos en flores de seis especies de plantas leñosas, pero no indican sus abundancias; con la presencia de Allograpta, Palpada, Toxomerus, y Ocyptamus s.l. Por otro lado, en el parque provincial Ernesto Tornquist (38°03’ S, 62°02’ O), Haedo et al. (2017) evaluaron la atracción de las flores de plantas nativas silvestres hacia los visitantes florales con el fin de promover su utilización en agroecosistemas para mejorar la conservación de los polinizadores. Los autores reportan 11 especies de moscas de las flores pertenecientes a los géneros Palpada (4 spp.), Copestylum Macquart (3 spp.), y a las especies A. exotica (como Allograpta sp.), T. duplicatus (como Toxomerus sp.), E tenax (como Eristalis sp.) y Orthonevra argentina (Bréthes) (como especie
indeterminada). Finalmente, Sabatino et al. (2010) estudiaron redes de interacción planta-polinizador en 12 sierras del sistema Tandilia entre las localidades de Mar del Plata (37°51’ S, 57°50’ O) y Balcarce (37°57’ S, 58° 49' O). En las sierras están presentes especies de moscas de las flores pertenecientes a los géneros Allograpta, Palpada, Toxomerus (en todas las sierras muestreadas), Platycheirus (nueve sierras), Copestylum (cuatro sierras), Dloprosopa (como Pseudodoros, una sierra) y tres especies exóticas Syritta flaviventris Macquart (como Syritta sp., tres sierras), E taeniops (dos sierras) y E tenax (una sierra), y otras dos especies no determinadas observadas en una sierra cada una (Gilarranz et al., 2015). Por lo tanto, el número de especies de moscas de las flores en la región pampeana parece ser baja y estar dominado por algunas pocas especies muy abundantes. En todos los sitios con datos, la presencia de A. exotica, T. duplicatus y algunas especies de Palpada (principalmente P. distinguenda y P. elegans) es prácticamente constante. Por otro lado, hay especies de algunos géneros que se encuentran presentes en varios de los sitios relevados, por ejemplo: D. clavata, Platycheirus (Carposcalis) spp., S. reedi, otras especies de Palpada (como P. rufiventris, P. melgenli, y P furcata Wiedemman), Copestylum sp., aunque en abundancias bajas. La presencia de especies poco colectadas en estos ambientes pampeanos, por ejemplo L. ortalina, M. nectarinoides, S. barblpes, Leucopodella sp., Nuntianus sp. y Victoriana sp. (estas dos últimas anteriormente en Ocyptamus s.l.) podría ser más errática y depender de las condiciones ambientales o del estado de conservación del ecosistema. La presencia de especies exóticas aumenta la diversidad y la abundancia de estas moscas en la región pampeana, sin embargo, hasta el momento no hay trabajos que evalúen competencia entre especies exóticas y nativas.
El conocimiento de la diversidad de insectos es considerado esencial para establecer la calidad de los servicios ecosistémicos en los ambientes (Garibaldi et al., 2020). En particular para las moscas de las flores, es escasa la información sobre su biodiversidad en los agroecosistemas de nuestro país, incluso conociendo la potencialidad de ofrecer diversos servicios ecosistémicos (Dunn et al., 2020). Por lo tanto, son necesarios estudios que integren diferentes diversos aspectos de la ecología de esta importante familia de moscas, y la promoción de estudios sistemáticos que ayuden a mejorar la resolución taxonómica de muchas de las especies del país.
AGRADECIMIENTOS
Agradecemos a la Universidad de Buenos Aires, por el apoyo logístico y el permiso para conducir nuestras investigaciones en la Ea. San Claudio. Y al personal de la Estancia por su cordialidad. A M. Rosanigo, S. Olea, J. Sciarra, G. Cilla, G.A.R. Molina y P.R. Mulieri por su colaboración en el trabajo de campo. A X. Mengual por su colaboración en la determinación de los individuos de Nuntianus y Victoriana. A L. Patitucci, M. Sabatino y dos revisores anónimos por los comentarios constructivos del manuscrito. El trabajo de campo fue financiado por la Agencia Nacional de Promoción Científica y Tecnológica: PICT 2006-00851, PICT 08-12504, PICT 2015-2523, PICT 2017-3336 y la Universidad de Buenos Aires G065. Este trabajo formó parte de la Tesis de Licenciatura de M.C.L.












 uBio
uBio 

