Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de antropología biológica
versión On-line ISSN 1514-7991
Rev Arg Antrop Biol vol.14 no.1 La Plata dic. 2012
TRABAJOS ORIGINALES
Alometrías ontogénicas y dimorfismo sexual facial en dos poblaciones humanas modernas
Marisol Anzelmo*, Marina L. Sardi, Jimena Barbeito-Andrés y Héctor M. Pucciarelli
División Antropología. Facultad de Ciencias Naturales y Museo. Universidad Nacional de La Plata. La Plata. Argentina. Consejo Nacional de Investigaciones Científicas y Técnicas-CONICET. Buenos Aires. Argentina
Financiamiento: Agencia Nacional de Promoción Científica y Tecnológica (PICT 1822). Universidad Nacional de La Plata. Proyecto de Incentivos N531.
*Correspondencia a: Marisol Anzelmo. División Antropología. Museo de La Plata. Paseo del Bosque s/n. B1900ASV La Plata. Argentina. E-mail: manzelmo@fcnym.unlp.edu.ar
Recibido: 31 Diciembre 2011
Aceptado: 18 Abril 2012
Resumen
El dimorfismo sexual facial (DSF) involucra variación en tamaño y forma. Es aceptado que la variación en forma se asocia al tamaño (alometría) y que durante la ontogenia ambos sexos comparten las mismas alometrías y los hombres extienden la trayectoria alométrica, proceso conocido como escalamiento ontogénico. Aquí se analiza el DSF en dos muestras ontogénicas de humanos modernos -portugueses (muestra Coimbra) y africanos de origen bantú (muestra Dart)- para conocer si los sexos comparten trayectorias alométricas. Se relevaron 12 mediciones lineales de la cara. Previo cálculo de la media geométrica (MG) para estimar el tamaño, se estandarizaron para evaluar forma. Para cada muestra se realizó Análisis de Componentes Principales. Por Análisis Multivariado y Univariado de la Covarianza se evaluaron las trayectorias alométricas. Ambos métodos mostraron trayectorias no comunes entre los sexos para ambas muestras. Los primeros indicaron trayectorias diferentes en pendientes para Coimbra, mientras que en Dart las pendientes fueron homogéneas, aunque no la intersección. Los análisis univariados, sin embargo, indicaron que en ambas muestras las trayectorias no difieren en sus pendientes entre los sexos pero si en su intersección para el componente principal 1, siendo paralelas, por lo que habría diferencias sexuales con probable origen prenatal. Otro mecanismo involucra una extensión de la trayectoria masculina con respecto de la femenina. El escalamiento ontogénico también generaría diferencias sexuales. El grado de DSF en tamaño es mayor en Coimbra que en Dart. Dichas diferencias pueden deberse a variaciones poblacionales en los mecanismos de crecimiento y desarrollo.
Palabras clave: Crecimiento y desarrollo facial; Escalamiento ontogénico; Variación intraespecífica
Abstract
Facial sexual dimorphism (FSD) involves facial variation in size and shape. It is accepted that shape variation is associated with size (allometry), during ontogeny both sexes share the same allometric trajectory, and men lengthen the allometric trajectory, a process known as ontogenetic scaling. In this work, FSD was analyzed in two ontogenetic modern human samples -Portuguese (Coimbra sample) and Africans of Bantu origin (Dart sample)- in order to assess if both sexes share allometric trajectories. Twelve linear measurements were registered on the face. The geometric mean was calculated and measurements were standardized to evaluate shape variation. The Principal Components analysis was performed in each sample. In order to assess if allometric trajectories differ between males and females, the multivariate and univariate analyses of covariance were performed. Both methods showed no common trajectories between both sexes and samples. In the multivariate analyses, the Coimbra trajectories differ in their slopes, while the Dart trajectories are homogeneous in their slopes but not in their intersection. However, the univariate results indicate that in both samples allometric trajectories do not differ in their slopes between sexes but they are parallel for principal component 1; this may be the consequence of differentiation with probable prenatal origins. Another mechanism involves the lengthening of the male trajectory with regard to females. Ontogenetic scaling would generate differences between sexes in both samples. However, the degree of FSD in size is greater in the Coimbra than in the Dart sample. These differences may be explained by population variations in the mechanisms of growth and development.
Key words: Facial growth and development; Ontogenetic scaling; Intraspecific variation
El dimorfismo sexual (DS) en los seres humanos implica, entre varios caracteres, diferenciación en el tamaño y la forma corporal. Los hombres adultos tienen en promedio, mayor tamaño que las mujeres de su misma población (O'Higgins et al., 1990; Rosas y Bastir, 2002; Schaeffer et al., 2004; González et al., 2009) aunque muchos rasgos varían de modo proporcional, sea porque cambian a diferente tasa o distinto tiempo.
El DS, tanto en su grado como en su patrón, varía entre las poblaciones humanas (O'Higgins et al., 1990; Wood y Lynch, 1996). Para dar cuenta de estas diferencias se han planteado varios modelos explicativos (Frayer y Wolpoff, 1985; Plavcan, 2001). Éstas se han atribuido a: a) selección sexual, que contribuye a aumentar el DS, especialmente en aquellas poblaciones con apareamiento polígamo (Alexander et al., 1979); b) afinidad genética, por lo que poblaciones con parentesco cercano se asemejarían en sus grados y patrones de DS; c) factores medioambientales: uno de ellos puede relacionarse con el déficit nutricional, que afecta diferencialmente a los sexos, reduciendo el grado de DS ya que los hombres son más afectados por la reducción de nutrientes; otro involucra diferencias en los roles económicos y sociales de hombres y mujeres con acceso diferencial a los recursos o con diferencias en los requerimientos energéticos, respectivamente.
De acuerdo con Plavcan (2001), gran parte de las variaciones en forma son dependientes de la variación de tamaño; es decir, son alométricas (Gould, 1966; Klingenberg, 1998). Cuando se analizan individuos del mismo período ontogénico, frecuentemente adultos, se describen alometrías estáticas. Al analizar los cambios en forma que están asociados al cambio en tamaño en individuos en crecimiento se describe una alometría ontogénica: mientras los individuos crecen y aumentan de tamaño, cambia la forma principalmente porque diferentes estructuras presentan distintos patrones de crecimiento.
En los seres humanos, existe un importante dimorfismo sexual facial (DSF) principalmente resultante de una alometría (Uytterschaut, 1986; Wood et al., 1991; Wood y Lynch, 1996). Si bien se han evaluado las alometrías estáticas en adultos (O'Higgins et al., 1990; Rosas y Bastir, 2002), las diferencias entre los sexos surgen porque los mismos difieren en sus trayectorias ontogénicas (Shea, 1983, 1986).
Durante el crecimiento el esqueleto facial cambia en tamaño y forma y aunque distintas estructuras responden a la influencia de factores locales, también responden a factores sistémicos. Eso produce un crecimiento integrado a través de remodelado óseo (reabsorción y formación ósea) que actuaría como un mecanismo compensatorio manteniendo el apropiado alineamiento de los huesos durante el desplazamiento (Frost, 1964; Enlow, 1975; Canalis, 1993). El crecimiento por desplazamiento y por remodelado en la cara son constantes a través de la ontogenia, por lo que se espera que los cambios en forma asociados al crecimiento también lo sean (Enlow, 1975; O'Higgins y Jones, 1998). Entonces, dado que la cara permanece como un todo funcional a través de la ontogenia, es de esperar que las trayectorias de alometría ontogénica sean lineales (O'Higgins y Jones, 1998; Strand-Vidarsdóttir et al., 2002; Neubauer et al., 2009).
Las alometrías ontogénicas entre los sexos pueden ser similares si las tasas de cambio son iguales en ambos sexos. Así, las diferencias en la forma adulta pueden estar presentes al nacimiento y persistir durante la adultez o bien pueden surgir durante la ontogenia posnatal y ser el producto de la extensión o acortamiento por uno de los sexos de esta trayectoria compartida. Este fenómeno se conoce como escalamiento ontogénico e involucra diferencias en tamaño durante la adultez. Las alometrías ontogénicas pueden también ser divergentes si las tasas de cambio en forma asociadas al cambio en tamaño son diferentes en ambos sexos. Las diferencias adultas pueden también ser el producto de una combinación de estos mecanismos (Strand- Vidarsdóttir y O'Higgins, 2001; O'Higgins y Collard, 2002; Bulygina et al., 2006; Cobb y O'Higgins, 2007). Shea (1992), basándose en evidencia experimental y de comparación interpoblacional e interespecífica, concluye que el escalamiento ontogénico es producido por diferencias en factores promotores del crecimiento que actúan sistémicamente, tal como la hormona de crecimiento, que afectan al tamaño y en consecuencia, la forma, pero que no alteran los controles alométricos subyacentes. En caso contrario, cuando las trayectorias divergen, esto sería producido por genes y factores de crecimiento con efecto localizado y no sistémico, afectando por ejemplo, la tasa de regulación de la multiplicación celular.
En los primates, el escalamiento ontogénico es el principal mecanismo que interviene en el DS craneano (Cochard, 1985; Cheverud y Richtsmeier, 1986; Leigh y Cheverud, 1991; Ravosa, 1991, Berge y Penin, 2004) aunque su contribución como mecanismo que genera diferencias entre los sexos varía entre diferentes especies (Schaeffer et al., 2004). También en la especie humana las alometrías explican el DSF (Bulygina et al., 2006). Sin embargo, son todavía poco conocidos los procesos ontogénicos involucrados en la generación del DS adulto en los seres humanos y a excepción de la contribuciónde Strand-Vidarsdóttir y O'Higgins (2001), se desconoce si distintas poblaciones comparten los mismos mecanismos de variación morfológica.
El objetivo del presente trabajo es evaluar el DSF en dos muestras humanas -individuos de origen portugués e individuos sudafricanos de habla bantú- a lo largo de la ontogenia. Se espera conocer si el DSF es producido por escalamiento ontogénico o resulta de otros mecanismos. Se pondrán a prueba las siguientes hipótesis nulas: a) para cada muestra, no hay diferencias entre los sexos en sus trayectorias de alometría ontogénica facial; b) no hay diferencias entre las muestras en los mecanismos alométricos que generan el DSF.
Trabajos previos evaluaron el DS tanto en poblaciones europeas (Rosas y Bastir, 2002; Coqueugniot y Weaver, 2007; González et al., 2009; Bastir et al., 2011) como en poblaciones nativas de Sudáfrica (Steyn e Isçan, 1999; Patriquin et al., 2003; Franklin et al., 2005a, b, 2007). Las diferencias morfológicas entre ambas también han sido previamente evaluadas en asociación con sus diferencias genéticas (Cavalli-Sforza et al., 1988), geográficas (Frelat y Mitteroecker, 2011), nutricionales (Bogin, 1999) y del desarrollo (Bogin, 1999; Frelat y Mitteroecker, 2011; Sardi y Ramírez Rozzi, 2012) así como con el objetivo de crear estándares para la identificación sexual de los individuos en investigaciones forenses (Steyn e Isçan, 1999; Patriquin et al., 2003). Pocos trabajos han evaluado los mecanismos ontogénicos que generan diferencias morfológicas entre las poblaciones representadas por estas muestras (Frelat y Mitteroecker, 2011; Sardi y Ramírez Rozzi, 2012). Se ha demostrado que difieren en sus mecanismos de desarrollo facial (Sardi y Ramírez Rozzi, 2012), por lo que es esperable que también varíen en los mecanismos ontogénicos que producen DSF.
Materiales y métodos
Muestras
Se trabajó con dos muestras de cráneos de las que se conoce sexo y edad de muerte (Tabla 1). La muestra de portugueses, denominada en este trabajo muestra Coimbra, se encuentra depositada en el Museo Antropológico de la Universidad de Coimbra (Portugal) y consiste en esqueletos no reclamados obtenidos principalmente del cementerio de la ciudad de Coimbra. Los individuos que forman la colección murieron entre 1904 y 1938 (Rocha, 1995; Coqueugniot y Weaver, 2007) y presentan edades de muerte entre 2 y 39 años. De cada uno de ellos se conoce el lugar de nacimiento, el sexo, la ocupación y la fecha junto con la causa de muerte. Es probable que el enterramiento haya influido en la preservación de individuos menores a 2 años y por ello, están ausentes en la colección. Juzgando por sus ocupaciones (mayoritariamente empleados de servicio doméstico, obreros, soldados y artesanos) fueron personas de bajo estatus socioeconómico (Santos, 1995). El análisis de indicadores óseos de estrés corroboran el registro histórico (Cunha, 1995). Evidencias del esqueleto poscraneano no detectan desarrollo anormal de hueso que puede estar ligado con malnutrición (Coqueugniot y Weaver, 2007).
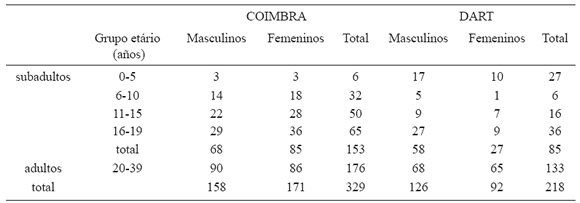
Tabla 1. Tamaño muestral según etapas ontogénicas
La muestra de sudafricanos, denominada en este trabajo muestra Dart, proviene de la colección Raymond Dart depositada en la Universidad de Witswatersrand (Johannesburgo). Está conformada por cuerpos no reclamados de los hospitales de la provincia de Gauteng (Sudáfrica) y desde 1958, de cadáveres provistos a la escuela de Ciencias Anatómicas (Dayal et al., 2009). Las edades de muerte se extienden entre 0 y 39 años. La muestra se conforma principalmente por individuos de diferentes tribus bantúes quienes murieron en el siglo XX. Debido a que esta colección se formó a partir de la disección de individuos, el sexo está documentado para cada esqueleto (Tobias, 1987) y la edad fue estimada por métodos desconocidos (Dayal et al., 2009). Se ha demostrado que no hay manifestaciones osteológicas de problemas nutricionales (Steyn e Isçan, 1999). Los individuos subadultos de la muestra fueron adquiridos entre 1927 y 1973 y se carece de datos publicados sobre su causa de muerte.
Método craneométrico y análisis estadísticos
El método craneométrico utilizado en este estudio fue desarrollado previamente (Pucciarelli, 1981; Sardi et al., 2006). El mismo se basa en la Hipótesis de la Matriz Funcional (Moss y Young, 1960) según la cual la morfología del cráneo no depende de un control genético propio sino de la influencia de las matrices funcionales asociadas. La cara puede ser dividida en cuatro componentes funcionales: óptico, respiratorio, masticatorio y alveolar. Cada componente funcional se conforma por una unidad esqueletaria a la que se asocian un conjunto de órganos, tejidos y cavidades, que constituyen la matriz funcional (Moss, 1973). Se registraron 12 variables lineales luego de realizar la digitalización de puntos craneométricos con Microscribe (Tabla 2, Fig. 1). El relevo de los puntos craneométricos fue realizado por unos de los autores (MLS). Las variables calculadas consisten en la longitud, ancho y altura de los cuatro componentes funcionales faciales.
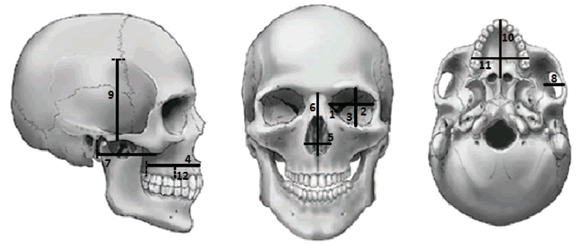
Fig. 1. Variables lineales relevadas sobre los cráneos según referencias de Tabla 2.
A fin de estimar el tamaño facial total, se calculó la media geométrica (MG) de todas las variables (Mosimann, 1970). Para obtener variables de forma, se realizó la estandarización propuesta por Mosimann (1970), calculadas como la proporción entre cada variable original con respecto de la media geométrica (Jungers et al., 1995).
Una subdivisión etaria (Tabla 1) evidencia que los individuos subadultos están diferencialmente representados en relación a los intervalos de edad para las muestras Coimbra y Dart, mientras que los adultos (≥20 años) se distribuyen de forma más homogénea. La representación de los sexos para cada uno de estos cohortes etarios también difiere, principalmente en la muestra Dart. Por esta razón, los análisis estadísticos se realizaron con cada muestra separadamente. Para evaluar las trayectorias alométricas de hombres y mujeres, se realizó Análisis de Componentes Principales (ACP) de las variables de forma de toda la muestra ontogénica (adultos y subadultos). Se usó la matriz de correlación y se obtuvo una serie de vectores que son los Componentes Principales (Cps).
Por un análisis de regresión simple se definieron Cps alométricos. Para esto se utilizó como variable dependiente a los scores de cada Cp y como variable regresora a la MG. La significancia en las diferencias de las trayectorias alométricas entre los sexos se evaluó por un Análisis Multivariado y Univariado de la Covarianza (MANCOVA y ANCOVA) (Mitteroecker et al., 2005; Cardini y Thorington, 2006; Lieberman et al., 2007; González et al., 2010). Se utilizó como variables dependientes, para hacer MANCOVA a los scores de los Cps que resumieron al menos el 80% de la variación en forma y para hacer ANCOVA a los scores de los Cps que por el análisis de regresión mostraron ser alométricos. En ambos casos, se utilizó al sexo como variable de agrupamiento y a la MG como covariable. MANCOVA y ANCOVA permiten testear la homogeneidad de las pendientes de las trayectorias usando el término interacción (sexo*MG). Si la interacción no es significativa, las pendientes no difieren entre los sexos. En este caso, un segundo MANCOVA o ANCOVA fue realizado después de remover el término interacción a fin de evaluar si hay diferencias significativas en la intersección de las trayectorias, ajustando los scores de los Cps para hombres y mujeres a una pendiente común. Si la variable agrupamiento (es decir, sexo) es significativa, las trayectorias alométricas entre ambos sexos son paralelas (Quinn y Keough, 2001). De ser no significativa, las trayectorias alométricas se encuentran superpuestas.
Resultados
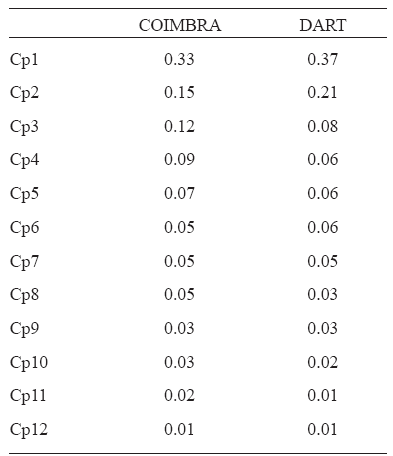
Del Análisis de Componentes Principales se retuvieron para posteriores análisis los seis primeros Cps que explicaron al menos el 80% de la variación en forma en cada muestra (Tabla 3). El resto de los Cps fueron descartados debido a que los mismos explican poco porcentaje de la variación en forma (igual o menor al 5%) (Tabla 3). Las muestras difieren en la proporción de varianza explicada por cada Cp y esto puede deberse a las diferencias en el tamaño muestral y en la distribución etaria.
Tabla 3. Proporción de varianza explicada por cada componente principal (Cp)
Para la muestra de Coimbra, el análisis de regresión demostró que el Cp1 y el Cp2 representan cambios en forma asociados a los cambios en tamaño durante la ontogenia (Tabla 4). La Tabla 5 muestra la contribución de cada una de las variables de forma para estos Cps. Para el Cp1 la variable con mayor contribución fue la altura alveolar asociada negativamente con las variables ópticas y de ancho alveolar. Para el Cp2, las variables con mayor contribución fueron la longitud alveolar, las variables masticatorias y la longitud respiratoria, todas asociadas positivamente entre sí y negativamente con la altura óptica. De acuerdo a la distribución de individuos en las Figuras 2a y 2b, los adultos de ambos sexos se caracterizan porque las variables alveolares y masticatorias son relativamente mayores que las ópticas. Considerando las rectas de regresión se observa que la trayectoria masculina está extendida con respecto de la femenina, debido a las diferencias de tamaño entre los sexos durante la adultez. El tamaño de los adultos fue mayor en los hombres (MG=39.33) que en las mujeres (MG=36.95).
Tabla 4. Análisis de regresión simple para cada componente principal (Cp)
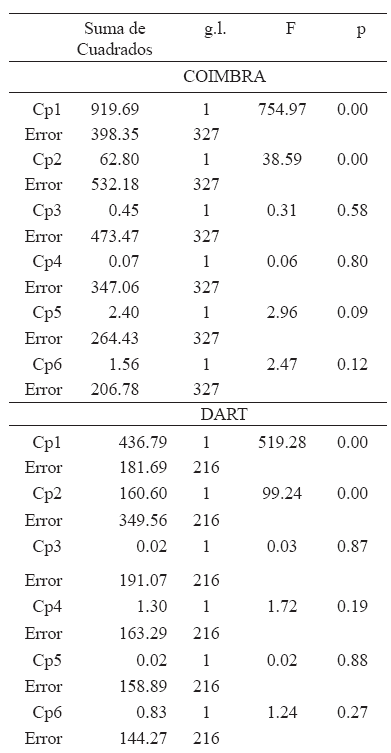
Tabla 5. Autovectores de los dos primeros componentes principales (Cp)
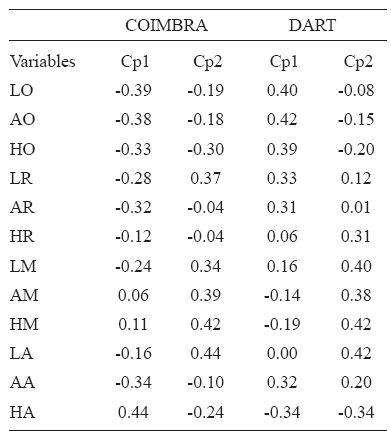
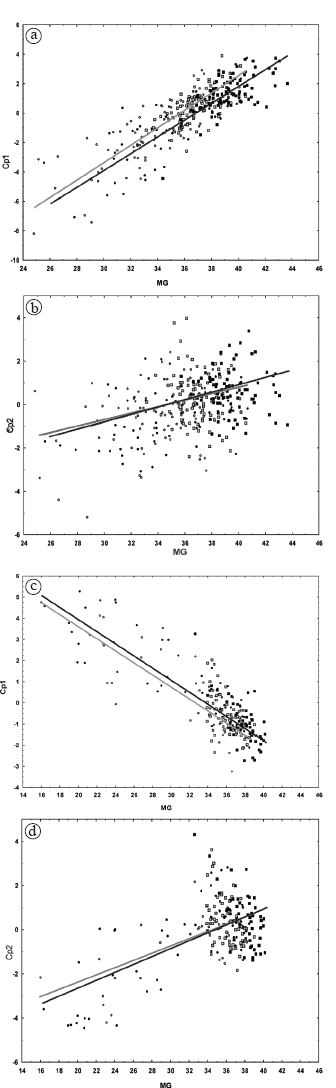
Fig. 2. Distribución de los individuos y recta de regresión linear según los Componentes principales (Cp) 1 y 2 y la Media Geométrica (MG) en la muestra de Coimbra (2a y 2b) y en la muestra Dart (2c y 2d). Círculos: subadultos; cuadrados: adultos. Gris: mujeres; negro: hombres.
En esta muestra, MANCOVA indicó que las trayectorias alométricas de hombres y mujeres difieren en sus pendientes (Tabla 6). Sin embargo, ANCOVA realizado sobre los Cps alométricos demostró que ni sobre el Cp1 ni sobre el Cp2 las trayectorias difieren en sus pendientes (Tabla 7, Figs. 2a y 2b). El ANCOVA realizado sin el término interacción demostró que los sexos, sin embargo, difieren significativamente en sus valores de intersección en el Cp1 (Tabla 7), tal como lo muestra la Figura 2a.
Tabla 6. Análisis multivariado de la covarianza de los seis primeros componentes principales
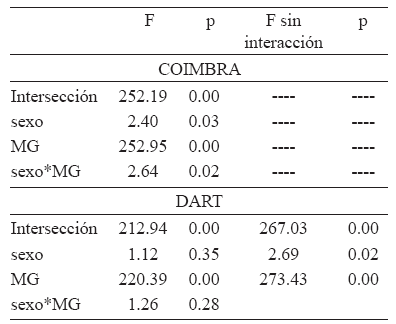
Tabla 7. Analisis de la covarianza de los componentes principales (Cp) alométricos
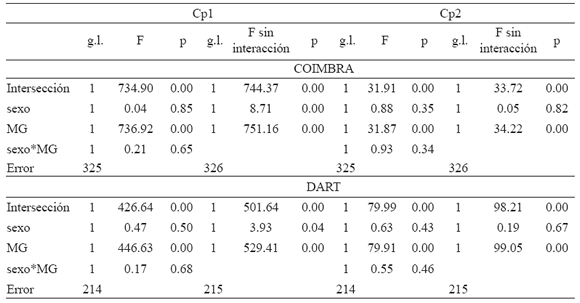
En la muestra Dart, el análisis de regresión demostró que los Cps 1 y 2 representan cambios alométricos durante la ontogenia (Tabla 4). Para el Cp1 las variables con mayor contribución fueron las ópticas y la longitud respiratoria, asociadas negativamente con la altura alveolar (Tabla 5). Para el Cp2 las variables con mayor contribución fueron la longitud alveolar y las variables masticatorias asociadas negativamente con la altura alveolar (Tabla 5). De acuerdo con la Figura 2c, los individuos adultos presentan variables ópticas y longitud respiratoria relativamente más pequeñas y mayor altura alveolar. El Cp2 (Fig. 2d) describe una morfología adulta con mayor desarrollo relativo de las variables masticatorias y de longitud alveolar. Al igual que en la muestra de Coimbra, la trayectoria masculina está extendida con respecto de la femenina debido a las diferencias de tamaño entre los sexos durante la adultez: en los hombres la MG es igual a 37.72 y en las mujeres es de 36.06. En esta muestra, MANCOVA indicó que las trayectorias alométricas no difieren en sus pendientes, aunque sí muestran diferencias en su intersección (Tabla 6). ANCOVA realizado sobre los Cps alométricos demostró que ni sobre el Cp1 ni sobre el Cp2 las trayectorias alométricas femenina y masculina difieren en sus pendientes (Tabla 7, Figs. 2c y 2d). ANCOVA realizado con los valores ajustados a una pendiente común demostró que los sexos, sin embargo, difieren significativamente en sus valores de intersección en el Cp1 (Tabla 7, Fig. 2c).
Discusión y conclusión
El análisis de regresión simple (Tabla 4) indicó que en la muestra Coimbra y Dart a lo largo de la ontogenia postnatal, hay una gran proporción de cambios de forma facial que corresponden a una alometría ontogénica, debido al crecimiento diferencial de distintos componentes del cráneo (Enlow y Hans, 1996). Ambas muestras presentan un patrón de cambio morfológico muy similar. Con el desarrollo se produce un incremento de la altura y longitud alveolares y de las variables masticatorias y las órbitas se hacen relativamente más pequeñas (Tabla 5, Fig. 2). El decrecimiento del tamaño relativo de la órbitas y el aumento de la altura masticatoria por un posicionamiento más postero-superior del estefanion en relación con el desarrollo del músculo temporal representan cambios alométricos compartidos por varias poblaciones (Strand- Vidarsdóttir et al., 2002). El mayor desarrollo de las variables alveolares con el aumento de tamaño durante la ontogenia se relaciona con el desarrollo dentario.
En este trabajo, el DSF en ambas muestras fue evaluado tanto a través de métodos estadísticos multivariados como univariados. Los primeros muestran que el DSF sería producido por trayectorias alométricas divergentes en Coimbra y por trayectorias paralelas en la muestra Dart. Los segundos, en cambio, indican que para los ejes que mayor proporción de la forma explican (Cp1 y Cp2), analizados independientemente entre sí, las trayectorias no difieren en sus pendientes para ninguna de las muestras. Mitteroecker et al. (2005) consideran que no se puede testear hipótesis alométricas evaluando Cps individuales, dado que éstos son construcciones estadísticas, en tanto que están forzados a ser independientes entre sí, mientras que los fenómenos biológicos generalmente están correlacionados. Plantean entonces, que las hipótesis alométricas deben ser evaluadas por métodos estadísticos multivariados haciendo uso de al menos, los tres primeros Cps (Mitteroecker et al., 2005). No obstante, el análisis de Cps individuales para testear hipótesis alométricas ha sido ampliamente utilizado (O'Higgins y Jones, 1998; O'Higgins y Strand-Vidarsdóttir, 1999; O'Higgins y Collard, 2002; Strand-Vidarsdóttir et al., 2002; Lieberman et al., 2007; Sardi et al., 2007), dado que cada Cp cuantifica patrones de covariación en forma que son independientes (Lieberman et al., 2007) reflejando la organización modular de las estructuras craneofaciales (Polanski y Franciscus, 2006; Bastir, 2008; Mitteroecker y Bookstein, 2008), organización que, según Lieberman et al. (2007), solo puede ser captada por una análisis de los Cps individuales.
Se evidencia que las trayectorias alómetricas entre los sexos para ambas muestras son paralelas para el Cp1 y 2 (Fig. 2) y las diferencias en la intersección fueron significativas solo para el primer Cp (Tabla 7). Este Cp muestra una asociación negativa entre la variable de altura alveolar y las variables ópticas (Tabla 5). Esto podría indicar que sobre estos aspectos de la forma habría diferencias con origen en la ontogenia posnatal temprana, quizás prenatal, entre los sexos (Quinn y Keough, 2001; Cardini y Thorington, 2006; González et al., 2010). En ambas muestras las trayectorias alométricas no muestran diferencias sexuales en las tasas de cambio alométrico para los dos primeros Cps. Sin embargo, los hombres extienden su trayectoria con respecto de la de las mujeres alcanzando mayor tamaño (Fig. 2) con las consecuentes diferencias en la forma facial para el Cp1 y el Cp2. Esto sugiere que el escalamiento ontogénico también es un mecanismo importante en el incremento de las diferencias sexuales en individuos adultos conduciendo a que los hombres tengan un mayor desarrollo con respecto de las mujeres de las variables de altura alveolar (Cp1) y de las variables masticatorias y de longitud alveolar (Cp2) (Tabla 5). Por lo tanto, la primera hipótesis nula se rechaza en ambas muestras analizadas. De acuerdo con Shea (1983, 1986), la extensión de la trayectoria masculina puede producirse por dos mecanismos de cambio en el tamaño asociado con la edad: a- los hombres tienen mayor tasa de crecimiento que las mujeres y el crecimiento finaliza a igual edad en ambos sexos, resultando que a una misma edad los hombres tienen mayor tamaño que las mujeres; b- los hombres crecen a igual tasa de cambio en tamaño respecto de la edad, pero durante más tiempo y c- existe combinación de ambos mecanismos. Esto puede relacionarse con factores hormonales que afectan al crecimiento (Shea, 1992; Simmons, 1999; Ramírez-Yañez et al., 2005). Debido a que los hombres y mujeres difieren en la secreción de hormona de crecimiento, siendo generador de DS (Badyaev, 2002; Cameron, 2002; Sanchez-Cárdenas et al., 2010), ésta puede ser la causa del mecanismo de escalamiento ontogénico encontrado en ambas muestras. Trabajos previos han demostrado que la hormona de crecimiento afecta al DS en el cráneo (Oyhenart y Pucciarelli, 1992) y probablemente las hormonas sexuales también intervengan a partir de la pubertad (Humphrey, 1998; Bulygina et al., 2006).
Otros estudios han planteado mayor complejidad en la ontogenia del DSF. Bulygina et al. (2006) evalúan el DSF en una población de origen europeo y observan que las diferencias en la forma facial entre ambos sexos tienen un origen temprano en la ontogenia, quizás prenatal siendo las trayectorias alométricas similares entre los dos sexos. Antes de alcanzar la pubertad, las mujeres tienen un mayor desarrollo de la forma que los hombres, pero con menor tamaño, revirtiéndose dichas diferencias luego del empuje puberal, con trayectorias extendidas para los hombres en la forma y tamaño (Bulygina et al., 2006). Esta misma combinación de mecanismos fueron encontradas trabajando con una muestra de americanos descendientes de africanos y en otras poblaciones humanas (Strand-Vidarsdóttir y O'Higgins, 2001).
La trayectoria masculina está más extendida con respecto de la femenina en la muestra de Coimbra que en la muestra Dart (Fig. 2) y la diferencia entre los promedios adultos de tamaño de ambos sexos es mayor en la primera muestra que en la segunda. Sin embargo, los resultados de los análisis estadísticos son muy similares en ambos grupos a pesar de que ambas difieren en la distribución etaria. Por lo tanto, la segunda hipótesis nula no puede rechazarse.
El grado de DS depende de muchos factores (Frayer y Wolpoff, 1985) pero uno de los principales se relaciona a la malnutrición proteicocalórica que actúa reduciendo las diferencias en tamaño entre los sexos (Pucciarelli, 1980). En casos de estrés nutricional los hombres son más susceptibles, por lo que reducen su tamaño, mientras que las mujeres son más estables (Stini, 1969). Entonces, diferencias poblacionales en las condiciones nutricionales podrían explicar las diferencias en los grados de DS en tamaño. Sin embargo, ambas muestras representan poblaciones de individuos de bajo estatus socieconómico y las evidencias histológicas y osteológicas no son concluyentes respecto a problemas nutricionales (Santos, 1995; Steyn e Isçan, 1999; Coqueugniot y Weaver, 2007). Es posible suponer, en cambio, que las diferencias entre las muestras en el DS podrían producirse por las diferencias poblacionales en el desarrollo. Numerosos estudios proponen que las poblaciones subsaharianas presentan una maduración ósea y sexual más avanzada que las poblaciones de ancestría europea (Bogin, 1999). Una comparación de trayectorias ontogénicas faciales (Sardi y Ramírez Rozzi, 2012) entre estas mismas muestras sugiere que la muestra Coimbra presenta mayores tasas de cambio en forma facial que la muestra Dart; además, Coimbra toma más tiempo en alcanzar el tamaño adulto que Dart. Así, la extensión en los tiempos y el aumento en las tasas de cambio en forma podrían contribuir a incrementar el DS en la muestra de Coimbra.
Ambas muestras se comportan de modo semejante en etapas ontogénicas tempranas, mostrando diferencias quizás de origen prenatal (Figs. 2a y 2c). Sin embargo, el escaso tamaño muestral de individuos infantes en la muestra de Coimbra, con ausencia total de individuos menores a los dos años, así como la desigual distribución del tamaño muestral para los sexos en las etapas más tempranas para la muestra Dart son problemas que sugieren prudencia en la interpretación de los resultados.
En síntesis, este trabajo aporta algunos elementos para comprender la generación del DSF a lo largo de la ontogenia en dos muestras de humanos modernos. Se concluye que a las diferencias existentes en etapas ontogénicas tempranas, de probable origen prenatal, se agregan las resultantes del escalamiento ontogénico, siendo éste un mecanismo importante en ambas muestras analizadas. Las diferencias en el grado de DS entre las muestras podrían relacionarse con variaciones en el grado de diferenciación prenatal entre los sexos para cada muestra, así como con variaciones poblacionales en las tasas de cambio alométrico o en los tiempos de maduración.
Agradecimientos
Agradecemos a Eugenia Cunha, Sofia Wasterlain, Nalini Pather, Poshia Mamiane por brindarnos el acceso a las colecciones a su cargo. A la Dra. Adriana Perez y a la Lic. Sabina Alzugaray por su colaboración en la metodología estadística. Los evaluadores realizaron importantes contribuciones sobre el manuscrito.
Literatura citada
1. Alexander RD, Hoogland JL, Howard RD, Noonan KL, Sherman PW. 1979. Sexual dimorphism and breeding systems in pinnipeds, ungulates, and humans. En: Chagnon NA, Irons WG, editores. Evolutionary biology and human social behavior: an anthropological perspective. North Scituate: Duxbury Press. p 402-435.
2. Badyaev A. V. 2002. Growing apart: an ontogenetic perspective on the evolution of sexual size dimorphism. Trends Ecol Evol 17:369-378.
3. Bastir M. 2008. A systems-model for the morphological analysis of integration and modularity in human craniofacial evolution. J Anthropol Sci 86:37-58.
4. Bastir M, Godoy P, Rosas A. 2011. Common features of sexual dimorphism in the cranial airways of different human populations. Am J Phys Anthropol 146:414-422. [ Links ]
5. Berge C, Penin X. 2004. Ontogenetic allometry, heterochrony, and interspecific differences in the skull of the African apes, using tridimensional Procrustes analysis. Am J Phys Anthropol 124:124-138. [ Links ]
6. Bogin B. 1999. Patterns of human growth. Cambridge: Cambridge University Press.
7. Bulygina E, Mitteroecker P, Aiello L. 2006. Ontogeny of facial dimorphism and patterns of individual development within one human population. Am J Phys Anthropol 131:432-443. [ Links ]
8. Cameron N. 2002. Human growth and development. California: Academic Press.
9. Canalis E. 1993. Regulation of bone remodelling. En: Favus M, editor. Primer on metabolic bone diseases and disorders of mineral metabolism. Nueva York: Rave Press. p 33-37.
10. Cardini A, Thorington Jr RW. 2006. Postnatal ontogeny of the marmot (Rodentia, Sciuridae) cranium: allometric trajectories and species divergence. Journal of Mammalogy 87:201-216. [ Links ]
11. Cavalli-Sforza LL, Piazza A, Menozzi P, Mountain J. 1988. Reconstruction of human evolution: bringing together genetic, archaeological, and linguistic data. Proc Nat Acad Sci USA 85:6002-6006.
12. Cheverud JM, Richtsmeier JT. 1986. Finite-element scaling applied to sexual dimorphism in rhesus macaque (Macaca mulatta) facial growth. Syst Zool 35:381-399.
13. Cobb SN, O´Higgins P. 2007. The ontogeny of sexual dimorphism in the facial skeleton of the African apes. J Hum Evol 53:176-190. [ Links ]
14. Cochard LR. 1985. Ontogenetic allometry of the skull and dentition of the rhesus monkey (Macaca mulatta). En: Jungers WL, editor. Size and scaling in primate biology. Nueva York: Plenum Press. p 231-256.
15. Coqueugniot H, Weaver TD. 2007. Brief communication: Infracranial maturation in the skeletal collection from Coimbra, Portugal: New aging standards for epiphyseal union. Am J Phys Anthropol 134:424-437.
16. Cunha E. 1995. Testing identification records: evidence from the Coimbra identified skeletal collections (19th- 20th centuries). En: Saunders SR, Herring A, editores. Grave reflections portraying the past through cemetery studies. Toronto: Canadian Scholars Press. p 179-198.
17. Dayal MR, Kegley ADT, Strkalj G, Bidmos MA, Kuykendall KL. 2009. The history and composition of the Ra ymond A. Dart Collection of human skeletons at the University of the Witwatersrand, Johannesburg, South Africa. Am J Phys Anthropol 140:324-335.
18. Enlow DH. 1975. Handbook of facial growth. Philadelphia: WB Saunders.
19. Enlow DH, Hans MG. 1996. Essentials of facial growth. Philadelphia: WB Saunders.
20. Franklin D, Freedman L, Milne N. 2005a. Sexual dimorphism and discriminant function sexing in indigenous South African crania. HOMO 55:213-228. [ Links ]
21. Franklin D, Freedman L, Milne N. 2005b. Three-dimensional technology for linear morphological studies: a reexamination of cranial variation in four southern African indigenous populations. HOMO 56:17-34.
22. Franklin D, Oxnard CE, O'Higgins P, Dadour I. 2007. Sexual dimorphism in the subadult mandible: quantification using geometric morphometrics. J Forensic Sci 52:6-10. [ Links ]
23. Frayer DW, Wolpoff MH. 1985. Sexual dimorphism. Annu Rev Anthropol 14:429-473.
24. Frelat MA, Mitteroecker M. 2011. Postnatal ontogeny of tibia and femur form in two human populations: a multivariate morphometric analysis. Am J Hum Biol 23:796-804. [ Links ]
25. Frost H. 1964. The laws of bone structure. Springfield: Charles C. Thomas.
26. González PN, Bernal V, Perez SI. 2009. Analysis of sexual dimorphism of craniofacial traits using geometric morphometric techniques. Int J Osteoarchaeol 21:82-91.
27. González PN, Perez SI, Bernal V. 2010. Ontogeny of robusticity of craniofacial traits in modern humans: a study of South American populations. Am J Phys Anthropol 142:367-379. [ Links ]
28. Gould SJ. 1966. Allometry and size in ontogeny and phylogeny. Biol Rev 41:587-640.
29. Humphrey LT. 1998. Growth patterns in the modern human skeleton. Am J Phys Anthropol 105:57-72.
30. Jungers WL, Falsetti AB, Wall CE. 1995. Shape, relative size, and size-adjustments in morphometrics. Am J Phys Anthropol 38:137-161. [ Links ]
31. Klingenberg CP. 1998. Heterochrony and allometry: the analysis of evolutionary change in ontogeny. Biol Rev 73:79-123.
32. Leigh SR, Cheverud JM. 1991. Sexual dimorphism in the baboon facial skeleton. Am J Phys Anthropol 84:193- 208. [ Links ]
33. Lieberman DE, Carlo J, Ponce de Leon M, Zollikofer CP. 2007. A geometric morphometric analysis of heterochrony in the cranium of chimpanzees and bonobos. J Hum Evol 52:647-662.
34. Mitteroecker P, Bookstein F. 2008. The evolutionary role of modularity and integration in the hominoid cranium. Evolution 62:943-958.
36. Mitteroecker P, Gunz P, Bookstein FL. 2005. Heterochrony and geometric morphometrics: a comparison of cranial growth in Pan paniscus versus Pan troglodytes. Evol Dev 7:244-258. [ Links ]
37. Mosimann JE. 1970. Size allometry: size and shape variables with characterizations of the lognormal and generalized gamma distributions. J Am Stat Assoc 65:930-945.
38. Moss ML. 1973. A functional cranial analysis of primate craniofacial growth. Symposium IVth. International Congress of Primatology 3:191-208.
39. Moss ML, Young RW. 1960. A functional approach to craniology. Am J Phys Anthropol 18:281-292. [ Links ]
40. Neubauer S, Gunz P, Hublin JJ. 2009. The pattern of endocranial ontogenetic shape changes in humans. J Anat 215: 240-255.
41. O´Higgins P, Collard M. 2002. Sexual dimorphism and facial growth in papionin monkeys. J Zool Lond 257:255-272. [ Links ]
42. O´Higgins P, Jones N. 1998. Facial growth in Cercocebus torquatus: an application of three-dimensional geometric morphometric techniques to the study of morphological variation. J Anat 193:251-272.
43. O´Higgins P, Strand-Vidarsdóttir U. 1999. New approaches to the quantitative analysis of craniofacial growth and variation. En: Hoppa RD, FitzGerald CM, editores. Human growth in the past: studies from bones and teeth. Cambridge: Cambridge University Press. p 128-160.
44. O´Higgins P, Moore WJ, Johnson DR, McAndrew TJ, Flinn RM. 1990. Patterns of cranial sexual dimorphism in certain groups of extant hominoids. J Zool Lond 222:399-420.
45. Oyhenart EE, Pucciarelli HM. 1992. Sexual cranial dimorphism in malnourished rats treated with growth hormone. Growth, Development & Aging 56:179-184.
46. Patriquin ML, Loth SR, Steyn M. 2003. Sexually dimorphic pelvic morphology in South African whites and blacks. HOMO 53:255-262.
47. Plavcan JM. 2001. Sexual dimorphism in primate evolution. Am J Phys Anthropol 116:25-53.
48. Polanski JM, Franciscus RG. 2006. Patterns of craniofacial integration in extant Homo, Pan, and Gorilla. Am J Phys Anthropol 131:38-49. [ Links ]
49. Pucciarelli HM. 1980. The effect of race, sex and nutrition on craniofacial differentiation in rats. A multivariate analysis. Am J Phys Anthropol 53:359-368. [ Links ]
50. Pucciarelli HM. 1981. Growth of the functional components of the rat skull and its alteration by nutritional effects. A multivariate analysis. Am J Phys Anthropol 56:33-41. Quinn GP, Keough MJ. 2001. Experimental design and data analysis for biologists. Cambridge: Cambridge University Press.
51. Ramírez-Yañez GO, Smid JR, Young WG, Waters MJ. 2005. Influence of growth hormone on the craniofacial complex of transgenic mice. European Journal of Orthodontics 27:494-500. [ Links ]
52. Ravosa MJ. 1991. The ontogeny of cranial sexual dimorphism in two old world monkeys: Macaca fascicularis (Cercopithecinae) and Nasalis larvatus (Colobinae). Int J Primatol 12:403-426.
53. Rocha MA. 1995. Les collections ostéologiques humaines identifiées du Musée Anthropologique de l'Université de Coimbra. Antrop Port 13:7-38.
54. Rosas A, Bastir M. 2002. Thin-plate spline analysis of allometry and sexual dimorphism in the human craniofacial complex. Am J Phys Anthropol 117:236-245. [ Links ]
55. Sanchez-Cardenas C, Fontanaud P, He Z, Lafont C, Meunier A-C, Schaeffer M, Carmignac D, Molino F, Coutry N, Bonnefont X, Gouty-Colomer L-A, Gavois E, Hodson DJ, Le Tissier P, Robinson I, Mollard P. 2010. Pituitary growth hormone network responses are sexually dimorphic and regulated by gonadal steroids in adulthood. PNAS 107:21878-21883.
56. Santos AL. 1995. Death, sex, and nutrition: analysis of the cause of death in the Coimbra human skeletal collection. Antrop Port 13:81-91.
57. Sardi ML, Ramírez Rozzi FV. 2012. Different cranial ontogeny in Europeans and Southern Africans. PlosOne 10.1371/journal.pone.0035917
58. Sardi ML, Novellino PS, Pucciarelli HM. 2006. Craniofacial morphology in the Argentine Center-West: consequences of the transition to food production. Am J Phys Anthropol 130:333-343.
59. Sardi ML, Ventrice F, Ramírez Rozzi F. 2007. Allometries throughout the late prenatal and early postnatal human craniofacial ontogeny. Anat Rec 290:1112-1120.
60. Schaefer K, Mitteroecker P, Gunz P, Bernhard M, Bookstein F. 2004. Craniofacial sexual dimorphism patterns and allometry among extant hominids. Ann Anat 186:471-478. [ Links ]
61. Shea BT. 1983. Allometry and heterochrony in the African apes. Am J Phys Anthropol 62:275-289.
62. Shea BT. 1986. Ontogenetic approaches to sexual dimorphism in anthropoids. Human Evol 1:97-110.
63. Shea BT. 1992. Developmental perspective on size change and allometry in evolution. Evolutionary Anthropology 1:125-134.
64. Simmons KE. 1999. Growth hormone and craniofacial changes: preliminary data from studies in Turner's syndrome. Pediatrics 104:1021-1024.
65. Steyn M, Isçan MY. 1999. Osteometric variation in the humerus: sexual dimorphism in South Afriacans. Forensic Science International 106:77-85. [ Links ]
66. Stini WA. 1969. Nutritional stress and growth: sex difference in adaptive response. Am J Phys Anthropol 31:417-426.
67. Strand-Vidarsdóttir U, O´Higgins P. 2001. Development of sexual dimorphism in the facial skeleton of anatomically modern Homo sapiens. Am J Phys Anthropol 114:139-152. [ Links ]
68. Strand-Vidarsdóttir U, O´Higgins P, Stringer C. 2002. A geometric morphometric study of regional differences in the ontogeny of the modern human facial skeleton. J Anat 201:211-229.
69. Tobias PV. 1987. Memories of Robert James Terry (1871- 1966) and the genesis of the Terry and Dart collections of human skeletons. Adler Mus Bull 13:31-34.
70. Uytterschaut HT. 1986. Sexual dimorphism in human skulls. A comparison of sexual dimorphism in different populations. En: Pickford M, Chiarelli B, editores. Sexual dimorphism in living and fossil primates. Firenze: II Sedicesimo. p 193-220.
71. Wood CG, Lynch JM. 1996. Sexual dimorphism in the craniofacial skeleton of modern human. En: Marcus LF, Corti M, Loy A, Naylor GJP, Slice DE, editores. Advances in morphometrics. Nueva York: Plenum Press. p 407-414.
72. Wood BA, Li Y, Willoughby C. 1991. Intraespecific variation and sexual dimorphism in cranial and dental variables among higher primates and their bearing on the hominid fossil record. J Anat 174:185-205.