Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de antropología biológica
versión On-line ISSN 1514-7991
Rev Arg Antrop Biol vol.14 no.1 La Plata dic. 2012
TRABAJOS ORIGINALES
Canalización e integración morfológica en poblaciones humanas modernas de diferentes contextos culturales y orígenes geográficos
Carolina Paschetta y Rolando González-José*
Centro Nacional Patagónico (CENPAT). Puerto Madryn. Chubut. Argentina
Financiamiento: Agencia Nacional de Promoción Científica y Tecnológica (PICT 01585) "Evolución craneofacial durante el Holoceno temprano de Asia y América: genética cuantitativa y estadística espacial aplicadas al poblamiento del Nuevo Mundo".
Correspondencia a: Rolando González-José. Centro Nacional Patagónico. Bvrd. Brown 2915. 9120 Puerto Madryn. Chubut. Argentina. E-mail: rolando@cenpat.edu.ar
Recibido: 07 Febrero 2012;
Aceptado: 14 Junio 2012
Resumen
La expresión fenotípica es el resultado de una compleja red de interacciones entre el genotipo y el ambiente. Entre los factores que contribuyen a establecer el fenotipo adulto, los procesos de desarrollo son de particular importancia como determinantes de los patrones de variación en distintos niveles de organización dentro del individuo. En este trabajo, dos resultados del actuar de dichos procesos, la canalización y la integración morfológica son evaluados en diferentes regiones del cráneo ó módulos en seis poblaciones humanas modernas que contrastan en sus estrategias económicas y sus orígenes geográficos. La canalización puede definirse como la resistencia de una población a responder a diferencias ambientales o genéticas mediante un aumento en la variación de sus fenotipos. La integración morfológica puede definirse como el grado de interrelación en la expresión de diferentes caracteres. Los resultados sugieren altos grados de canalización para el neuro y basicráneo y menos canalización en las restantes estructuras, más vinculadas con la masticación. Por otro lado, la integración morfológica es más evidente en la fosa temporal y la articulación temporo-mandibular. En general, los resultados indican que existen efectos diferenciales de la canalización e integración morfológica en los diferentes módulos craneales y que probablemente estas diferencias respondan a los efectos de variaciones en los estilos de vida.
Palabras clave: Morfometría geométrica; Variabilidad craneofacial; Procesos del desarrollo
Abstract
The adult phenotype is the result of a complex network of interactions between the genotype and the environment. Among the factors that contribute to establish the adult phenotype, developmental processes are particularly important in determining patterns of variation at different organization levels within the individual. In this work, two products of such developmental processes, canalization and morphological integration, are evaluated at different skull regions or modules in six modern human populations differing in their life-style and geographic origins. Canalization is defined as the resistance of a population to respond to environmental or genetic differences by increasing the variation in their phenotypes. Morphological integration is defined as the interrelationship degree in the expression of different characters. Results indicate that the neurocranium and the base are the most canalized of the studied structures, whereas structures related to mastication tend to show differing levels of canalization. Morphological integration is most evident in the temporal fossa and the temporo mandibular joint. In general, these results indicate that variable levels of canalization and morphological integration can arise as a response to different environmental stimuli like life strategy and/or diet hardness.
Key words: Geometric morphometrics; Craniofacial variability; Developmental processes
La variabilidad fenotípica es el resultado de una compleja red de interacciones entre el genotipo y el ambiente. Dicha red, llamada coloquialmente "mapa genotipo-fenotipo" es indescifrable a no ser que se tenga conocimiento detallado de los fenotipos y de sus interacciones (Falconer y Mackay, 1996; Lynch y Walsh, 1998; Hallgrímsson et al., 2005; Sholtis y Weiss, 2005; Houle et al., 2010). Dentro de esta compleja red, los procesos que ocurren durante el desarrollo determinan cuales serán los patrones de variación y covariación morfológica y establecen qué aspectos (o posiciones en el morfoespacio, para el caso de fenotipos morfométricos) podrán ser observados en el fenotipo adulto. En otras palabras, el hecho de que la predicción de los patrones de variación no sea una tarea simple no significa que la variación sea aleatoria o viable en cualquier dirección del morfoespacio (Salazar-Ciudad, 2007).
Partiendo del amplio abanico de factores (epigenéticos, ambientales, procesos del desarrollo, etc.) que determinan los fenotipos adultos, Hallgrímsson y Lieberman (2008) desarrollaron un modelo (llamado Modelo de Palimpsesto) que propone que el patrón de covariación en el cráneo adulto puede ser visto como el resultado final de la suma de sucesivos efectos, cada uno de los cuales deja una señal de covariación distintiva del grupo de interacciones del proceso del desarrollo involucrado en cada fase del desarrollo (Hallgrímsson et al., 2007; Hallgrímsson y Lieberman, 2008). De esta manera, el modelo propone que el patrón de covariación observado en el fenotipo adulto es resultado de la sumatoria o superposición (e.g. el palimpsesto) de los patrones de covariación determinados en todos y cada uno de los procesos del desarrollo que se sucedieron a lo largo del desarrollo (e.g. migración de las células de la cresta neural, condensación y diferenciación celular, interacción músculo-hueso, crecimiento somático, etc.). Estos procesos de desarrollo son fenómenos epigenéticos que emergen en la arquitectura del desarrollo y afectan la manera en que la variación genética es traducida a variación fenotípica (Hallgrímsson et al., 2002). Así por ejemplo, se ha enunciado que como resultado de los procesos de desarrollo, se ven afectadas propiedades o patrones como la canalización, estabilidad del desarrollo e integración morfológica que afectan la magnitud y la varianza del fenotipo y direccionan la variación (Hallgrímsson et al., 2002). Por lo expuesto, para Hallgrímsson y colaboradores (2002) la variabilidad fenotípica depende de la interacción de los tres factores interrelacionados, los cuales contribuyen a la misma ya sea limitándola cuando el organismo es expuesto a perturbaciones o desviando la dirección de la misma. A primera vista este efecto restrictivo puede ser visto como negativo, ya que reduce las chances de expresión de la variación fenotípica heredable (Steppan et al., 2002). Sin embargo, también es cierto que estas restricciones proveen rutas específicas a través de las cuales los organismos pueden evolucionar rápidamente (Gould, 1989; Schwenk, 1995; Richardson y Chipman, 2003), ya que éstas favorecen combinaciones de rasgos que presentan mayor covariación genética (Steppan et al., 2002; Marroig y Cheverud, 2005; Martínez-Abadías et al., 2009).
En este artículo se evalúan dos de los tres factores más importantes que determinan la variabilidad fenotípica: la canalización y la integración morfológica. La canalización es una propiedad de los organismos que garantiza expresiones fenotípicas similares dentro de los grupos aún cuando algunos individuos están expuestos a perturbaciones ambientales o cambios genéticos en relación con otros (Waddington, 1942, 1957; Zakharaov, 1992). Tiene la capacidad de permitir la acumulación de variación genética indetectable. Así, cuando un individuo es expuesto a una perturbación lo suficientemente brusca como para traspasar un umbral, su variación genética "encriptada" puede revelarse y ser sometida a los efectos de la selección (Waddington, 1957; Rutherford, 2000).
La integración morfológica se define como la covariación entre estructuras fenotípicas que proveen información de base para inferir conexiones entre rasgos a lo largo del desarrollo o a causa de demandas funcionales compartidas (Olson y Miller, 1958; González-José et al., 2004; Willmore et al., 2007). El concepto fue introducido por Olson y Miller (1958) quienes argumentaron que aquellos rasgos que comparten aspectos del desarrollo (e.g. precursores tisulares, cronología de desarrollo, proximidad topológica en el embrión, etc.) o demandas funcionales similares (e.g. masticación, visión, locomoción, etc.) evolucionarán como unidades integradas. Relacionado al concepto de integración morfológica está el de modularidad, que describe las diferencias en el grado de integración de rasgos entre y dentro de conjuntos y subconjuntos de estructuras (Klingenberg, 2008). La disociación de partes en regiones más discretas (módulos) incrementaría la probabilidad de que cambios favorables en una parte tengan efecto pequeño o nulo en otra y por lo tanto aumentaría la chance de que esos cambios perduren en la población (Willmore et al., 2007).
El objetivo de este trabajo es evaluar la variación craneana en diferentes módulos ó regiones del cráneo, desde la óptica de la canalización y la integración morfológica, en seis poblaciones humanas modernas que presentan alta variación genética estructurada filogenéticamente y que al mismo tiempo han estado sometidas a factores ambientales heterogéneos, como la dureza de la dieta, la cual ha sido postulada como uno de los efectos ambientales que pueden afectar el desarrollo del fenotipo craneofacial (Corruccini y Handler, 1980; Beecher y Corruccini, 1981; Corruccini y Beecher, 1982, 1984; Beecher et al., 1983; Corruccini et al., 1985; Ingervall y Bitsanis, 1987; Larsen, 1995, 1997; Ciochon et al., 1997; Corruccini, 1999; Lieberman et al., 2004; González-José et al., 2005; Lieberman, 2008; Paschetta et al., 2010).
Partiendo de lo anterior y considerando una muestra específicamente seleccionada para mostrar alta variabilidad genética y cambios importantes en un factor ambiental (la dureza de la dieta) de relevancia para el estudio del cráneo humano, podrían plantearse las siguientes predicciones. En primer lugar, las estructuras ligadas a la masticación estarán más integradas que aquellas no relacionadas a la función masticatoria, pues existen constricciones (constraints) en el morfoespacio que tienden a evitar fenotipos sub-óptimos desde el punto de vista funcional y a favorecer la evolución a lo largo de líneas de mínima resistencia evolutiva orientada con óptimos masticatorios. Por otro lado, las estructuras no afectadas por la masticación, pero altamente conservadas en la evolución humana, presentarán mayores niveles de canalización como respuesta a patrones conservados de variación intra e interpoblacional.
Material y métodos
La muestra
Este estudio incluye 205 cráneos adultos provenientes de seis poblaciones divergentes en cuanto a estrategia económica: aborígenes cazadores-recolectores de Australia (ACR), de California (CCR) y esquimales de Groenlandia (GCR), pastoralistas de Siberia (SP), agricultores extensivos de Perú (PA) y población urbana del siglo XVII-XVIII de Wamba, Valladolid, España (WU). El sexo y la edad fueron estimados de acuerdo con los caracteres diagnósticos propuestos por Buikstra y Ubelaker (1994). La composición de la muestra y otros detalles de interés se especifican en Tabla 1.
Tabla 1. Muestras usadas en el análisis
Para realizar este estudio se emplearon exclusivamente fotografías digitales de la base del cráneo, tomadas según el plano de Frankfurt establecido perpendicularmente al plano horizontal de apoyo del cráneo y controlando que ambos procesos mastoides, el derecho y el izquierdo se encuentren a igual distancia de la cámara. De ese modo se evita cualquier error de coplanaridad que surja de la orientación del cráneo en relación a la cámara. La norma basicraneal fue elegida pues permite acceder a configuraciones de landmarks correspondientes a diferentes estructuras del cráneo en una única toma fotográfica. El estudio de objetos tridimensionales con técnicas bidimensionales implica necesariamente la pérdida de variación de forma debida a la proyección de un objeto tridimensional sobre un plano. No obstante, el objetivo de este trabajo es, más que la captura precisa de los cambios de forma, la comparación de patrones de canalización e integración entre diferentes estructuras.
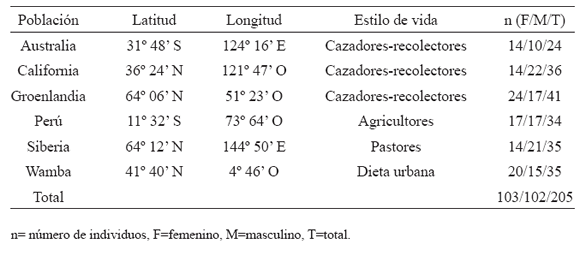
En cada individuo, 24 landmarks homólogos y semilandmarks bidimensionales fueron digitalizados usando el programa TPSDig (versión 1.40, Rohlf, 2004). Dichos landmarks y semilandmarks y sus definiciones se presentan en detalle en la Tabla 2 y Figura 1. Estos landmarks y semilandmarks fueron divididos en diferentes subconjuntos (módulos) que permiten estudiar la canalización y la integración morfológica en un esquema jerárquicamente anidado, describiendo los cambios en tamaño y forma de estructuras de primero, segundo, tercero y cuarto orden. Esta aproximación supera los enfoques tradicionales basados en el análisis de estructuras asumidas como de igual nivel jerárquico (e.g. no anidadas) debido a que permite una representación más exacta del patrón de integración morfológica del cráneo que la clásica separación de estructuras de igual nivel jerárquico (Bastir y Rosas, 2005) y además permite explorar si los patrones integración morfológica y canalización se mantienen en las diferentes jerarquías modulares o si presentan un comportamiento disruptivo. Debido a que la modularidad es una hipótesis no existe un único criterio (el origen embriológico, la función, la posición relativa, etc.) para plantearla y la misma debe ser puesta a prueba.
Tabla 2. Lista de landmarks y semilandmarks utilizados en el análisis y asignación al primero (mayúscula itálica), segundo (mayúscula), tercero (minúscula itálica) ó cuarto (minúscula) orden

Fig. 1. Landmarks (círculos) y semilandmarks (cuadrados) digitalizados en cada fotografía. La definición de los landmarks/semilandmarks se encuentra en la Tabla 2.
El cráneo humano está organizado jerárquicamente en dos unidades mayores: el neurocráneo y la cara (Bastir y Rosas, 2005; Willmore et al., 2006). Estos dos componentes pueden seguir subdividiéndose de acuerdo a diversos criterios (ver por ejemplo Cheverud, 1982, 1995; Pucciarelli et al., 1990; Willmore et al., 2006). Aquí se adopta una aproximación jerárquicamente anidada dividiendo al grupo de primer orden (cráneo entero) en dos grupos de segundo orden (neurocráneo: NC y facial: F). A continuación, estos componentes de segundo orden se subdividen en componentes de tercer orden: NC en bóveda craneana (BOV) y Base (B) y F en masticatorio (M) y alveolar (Al). Finalmente, el componente masticatorio M es dividido en dos subconjuntos de cuarto orden: la articulación temporo-mandibular (ATM) y la fosa temporal (FT).
Análisis estadísticos
Las configuraciones de landmarks y semilandmarks de cada subconjunto fueron superpuestas utilizando el Análisis Generalizado de Procrustes (GPA, Rohlf y Slice, 1990; Goodall, 1991) implementado en el programa TPSRelw (versión 1.45, Rohlf, 2007). La información de forma queda, de ese modo, condensada en las coordenadas alineadas de los individuos, mientras que el tamaño es expresado en el valor escalar de centroid size (cs).
La hipótesis de modularidad fue puesta a prueba antes de llevar a cabo los análisis para evaluar la canalización y la integración morfológica, utilizando el método propuesto por Klingenberg (2008). Se computó el coeficiente RV para cuantificar la fuerza de la asociación entre subsets de landmarks y semilandmarks correspondientes a los diferentes componentes detallados más arriba. El coeficiente RV multiset es una generalización del coeficiente RV (Escoufier, 1973) que cuantifica la asociación entre dos conjuntos de variables y puede ser interpretado como un análogo multivariado al coeficiente R2. El coeficiente RV multiset se obtuvo de las coordenadas alineadas de los distintos componentes y para 10000 particiones al azar de los landmarks conteniendo las mismas particiones (número) de landmarks. Si un componente presenta una estructura modular significativa en relación a otro, esto es, si pueden ser considerados módulos independientes, se espera que el RV sea menor que el 95% de las particiones obtenidas al azar (e.g. la covariación entre los componentes será significativamente menor que la covariación dentro de cada uno de los componentes).
La canalización se midió como la variación intrapoblacional para cada componente: a mayor varianza, menor canalización de la estructura en cuestión (Willmore et al., 2007). La varianza intragrupal se estimó calculando la distancia de Procrustes de cada individuo al consenso poblacional mediante el programa TPSSmall (versión 1.20, Rohlf, 2003). Paralelamente, se realizó un análisis no paramétrico de Kruskal-Wallis para verificar si existen diferencias significativas entre las varianzas de las poblaciones. Se calculó un test a posteriori entre cada par de poblaciones con el fin de determinar entre que poblaciones ocurren las diferencias significativas. Con el fin de contar con una aproximación gráfica a la canalización, se graficaron los dos primeros ejes de componentes principales para observar el grado de dispersión de los individuos dentro de cada muestra y para cada estructura estudiada.
La integración morfológica se evaluó a través del cálculo de la varianza estandarizada de los eigenvalores del análisis de componentes principales realizado para cada muestra/ estructura estudiada, de acuerdo a la propuesta de Wagner (1990), revisada por Pavlicev et al. (2009). Cada eigenvalor es igual a la cantidad de variación distribuida a lo largo del eigenvector correspondiente (Pavlicev et al., 2009). Cuando sólo unos pocos eigenvalores son grandes en relación al resto de los eigenvalores, entonces la varianza de la totalidad de eigenvalores será más alta que si todos los eigenvalores explicaran montos similares de variación. En este caso, se considera que el rasgo analizado está fuertemente integrado, pues los landmarks y semilandmarks que lo describen varían en un sub espacio morfológico limitado dentro del espacio total multivariado teórico disponible (Wagner, 1990). La varianza escalada (e.g. ponderada por la cantidad de eigenvectores de acuerdo a Pavlicev et al., 2009) fue entonces considerada como una medida de la integración morfológica de las estructuras estudiadas en las diferentes muestras.
Resultados
En relación a la evaluación de la modularidad mediante el estadístico RV, los resultados arrojaron que la hipótesis de modularidad para la división del primer orden (cráneo entero) en los dos módulos hipotéticos de segundo orden fue significativa (RV=0.38, p<0.05), al igual que la división de la región facial en alveolar y masticatorio (RV=0.22, p<0.01), aunque es no significativa para masticatorio subdividido en temporal y ATM (RV=0.29, p>0.05).
Canalización
En la Tabla 3 se presentan las varianzas intrapoblacionales para cada grupo y cada región del cráneo. Para verificar las diferencias entre poblaciones para los valores de varianza interna se calculó el test no paramétrico H de Kruskal-Wallis. Como puede observarse en la tabla, las poblaciones difieren en su grado de canalización para todas las estructuras, a excepción del neurocráneo y la base, que no presentan diferencias significativas entre sus valores de varianza interna a través de las poblaciones y presentan niveles bajos de varianza. En otras palabras, la estructura más canalizada de segundo orden tanto dentro como entre poblaciones es el neurocráneo y la de tercer orden es el basicráneo, contenido en la anterior. Las estructuras que presentaron mayor varianza interna fueron el componente masticatorio (tercer orden, 0.0095) y sus dos derivados de cuarto orden: la fosa temporal (0.0077) y la articulación temporo-mandibular (ATM 0.0183). La Figura 2a y b muestra la dispersión a lo largo de los dos primeros componentes principales para la estructura más canalizada (basicráneo) y la menos canalizada (ATM) y permite observar los diferentes patrones de comportamiento evolutivo para estos rasgos.
Tabla 3. Varianzas y test de Kruskal-Wallis (H) para cada grupo y región del cráneo
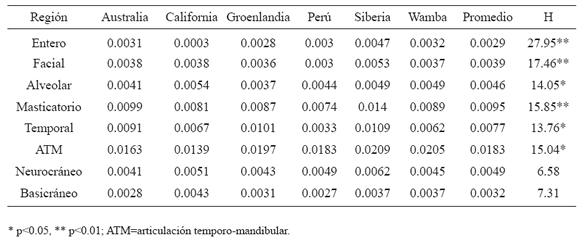
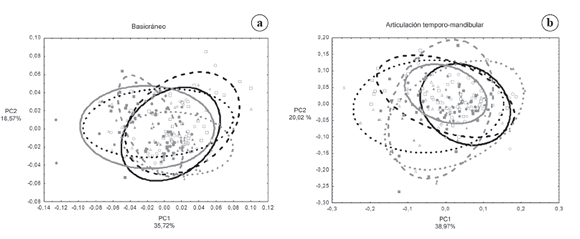
Fig. 2. Gráfico de dispersión de los dos primeros componentes principales (PC). a) Basicráneo. b) Articulación temporo-mandibular. Australia=círculo vacío negro y elipse continua negra, California=círculo relleno gris y elipse continua gris, Groenlandia=cuadrado vacío negro y elipse discontinua negra, Perú=cuadrado relleno gris y elipse discontinua gris, Siberia=triángulo vacío negro y elipse punteada negra, Wamba=triángulo relleno gris y elipse punteada gris.
Integración morfológica y modularidad La varianza escalada de los eigenvalores, calculada de acuerdo a Pavlicev et al. (2009) se presenta en la Figura 3. Las dos estructuras con mayor integración morfológica, resultado observado en todas las poblaciones por igual, son la fosa temporal y la articulación temporo-mandibular. Estos resultados indican que, para la variación morfológica en estas estructuras, existen regiones del morfoespacio no favorecidas. La Figura 4 muestra la dispersión de los grupos a lo largo de los dos primeros componentes principales (PC) y los polígonos de deformación asociados a los valores extremos de cada PC. Para el temporal, los mayores cambios de forma a lo largo de PC1 están asociados a la orientación del zigion, mientras que en el PC2 las mayores diferencias aparecen en la anchura del arco zigomático, en ambos PCs aparecen cambios en la región anterior de la fosa temporal. Entre los grupos existe una gran superposición y es difícil determinar qué grupos ocupan los diferentes espacios morfométricos (Fig. 4a). Para la ATM existe mayor diferenciación entre los grupos, hacia los valores positivos del PC1 se ubica Wamba, el grupo de dieta más procesada y blanda, que presenta una ATM más ancha y corta en su parte anterior, en el extremo negativo se ubica Siberia (pastores de dieta rígida) cuya ATM es más angosta y larga anteriormente, la diferenciación entre los grupos a nivel del PC2 no es tan clara, sin embargo se observan cambios a nivel de la concavidad de la ATM (Fig. 4b).
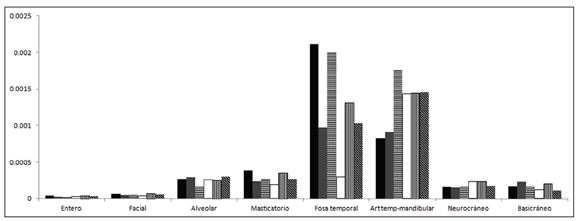
Fig. 3. Perfiles de las varianzas escaladas de los eigenvalores para cada población y región del cráneo. Australia=barra rellena negra, California=barra rellena gris oscuro, Groenlandia=barra de líneas horizontales negras, Perú=barra blanca, Siberia=barra de líneas verticales negras, Wamba=barra de líneas diagonales negras.
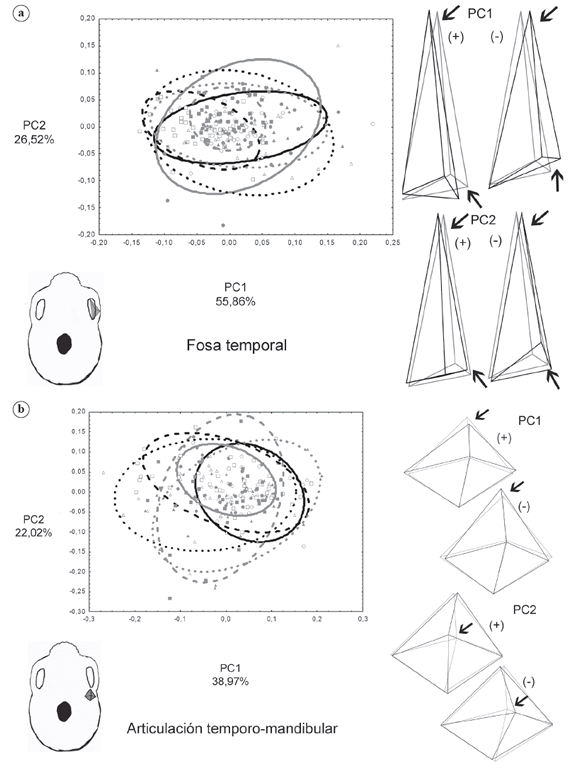
Fig. 4. Gráfico de dispersión de los dos primeros componentes principales (PC) y polígonos de deformación para los valores extremos (polígono negro) y promedio (polígono gris) de cada PC. a) Fosa temporal. b) Articulación temporo-mandibular. Australia=círculo vacío negro y elipse continua negra, California=círculo relleno gris y elipse continua gris, Groenlandia=cuadrado vacío negro y elipse discontinua negra, Perú=cuadrado relleno gris y elipse discontinua gris, Siberia=triángulo vacío negro y elipse punteada negra, Wamba=triángulo relleno gris y elipse punteada gris.
Discusión
En este artículo se ha intentado evaluar la variación en la canalización y la integración morfológica en un conjunto de poblaciones que difieren en cuanto a las cargas masticatorias experimentadas y en estructuras morfológicas del cráneo que participan en diferente grado de localización e importancia funcional durante los movimientos masticatorios. Este diseño de muestreo permite evaluar las fluctuaciones en ambos procesos del desarrollo, la canalización y la integración, intentando ver si son afectados por un efecto ambiental importante (la variación en las cargas masticatorias). Asimismo, el análisis realizado sobre estructuras morfológicas jerárquicamente anidadas permite la detección de aquellas regiones del cráneo que responden independientemente a estas variaciones ambientales, a través de lo cual pueden inferirse patrones de modularidad en el cráneo humano. De una estructura no afectada por el efecto ambiental en danza, en este caso las cargas masticatorias variables a través de las diferentes poblaciones estudiadas, se esperan menores niveles de integración que en aquellas estructuras impactadas directamente por el efecto (componente alveolar y masticatorio y sus subcomponentes, ATM y fosa temporal). Esto es así pues, al estar respondiendo a un estímulo puntual que requeriría fenotipos ubicados en un óptimo del morfoespacio, que en este caso puede ser delimitado por condiciones biomecánicas óptimas para la masticación (brazos de palanca, fuerzas de mordida, etc.), las variantes fenotípicas se integran y existen regiones del morfoespacio no óptimas desde el punto de vista biomecánico. En otras palabras, en las estructuras afectadas por el efecto ambiental la variabilidad puede ser alta o baja, pero siempre estará orientada en un eje de mínima resistencia evolutiva (Schluter, 1996) que evite zonas no óptimas en el morfoespacio y que permita una evolución rápida hacia óptimos adaptativos (Gould, 1989; Schwenk, 1995; Richardson y Chipman, 2003). Este parece ser el caso para las estructuras masticatorias (Figura 3), que presentan mayores niveles de integración morfológica que estructuras no vinculadas con la función masticatoria.
En relación a la canalización, los resultados también corroboran las predicciones descriptas arriba. Aquellas estructuras que no están respondiendo al estímulo, pero que al mismo tiempo son evolutivamente muy conservadas, como la base y el neurocráneo, han mostrado niveles muy altos de canalización. En otras palabras, la variabilidad intra e inter-poblacional (Tabla 3) desplegada por estas estructuras es baja en relación a otras estructuras, lo que refleja su alto grado de canalización.
Ambos efectos estudiados aquí pueden actuar aisladamente o en combinación (Willmore et al., 2007). Así, una región del fenotipo puede ser afectada por ninguno o por ambos, canalización e integración. Hallgrímsson et al. (2002) y Willmore et al. (2006) realizan sendas evaluaciones de ambos procesos (además de la inestabilidad en el desarrollo medida a través de asimetrías fluctuantes) en las extremidades de primates y cráneo de ratón respectivamente. Tal como resumen Willmore et al. (2007) los resultados de estos estudios conjuntos indican que existe una relación entre los tres procesos. La estabilidad del desarrollo refleja un tamponamiento a nivel intraindividual, de manera análoga a la canalización, que representa un tamponamiento de la variación a nivel poblacional. Ambos tienen el mismo efecto: son una limitante de la variabilidad. Por otro lado, la integración morfológica enlaza a diferentes estructuras, incluyendo sus propiedades de canalización y estabilidad del desarrollo. En este caso los efectos de la integración morfológica y de la canalización se evidencian en diferentes estructuras o módulos. El primero muestra un alto grado de integración en dos regiones fuertemente afectadas por las cargas masticatorias (fosa temporal y articulación temporo-mandibular), mientras que la canalización actúa con evidencia en el neurocráneo y la base, dos estructuras que no se encuentran directamente afectadas por el fenómeno evaluado, sino que se mantienen altamente conservadas evolutivamente.
En resumen, los resultados indican que los dos procesos actúan conjuntamente con claridad en dos regiones bien diferenciadas del cráneo. Por un lado, la ATM y la fosa temporal están respondiendo con mayores niveles de integración morfológica probablemente como respuesta a una demanda funcional específicamente atendida por músculos insertados directamente en estas regiones. Sus niveles de canalización no son particularmente diferentes a otras estructuras, lo que indicaría que las demandas ambientales son variables dentro de la población y no desencadenan pérdida de variabilidad fenotípica total, pero sí existen fenotipos "prohibidos" o "constreñidos" (de constraint, en inglés) que aumentan la integración morfológica interna de esas regiones y por lo tanto su modularidad (Steppan et al., 2002).
Un comportamiento contrario es el observado en la base y el neurocráneo, que sin presentar niveles altos de integración, sí presentan una fuerte canalización en las poblaciones. Estudios previos han demostrado que los primates presentan mayores niveles de integración en la cara que en el neurocráneo (Cheverud, 1982; Ackermann, 1998, 2002, 2003; Marroig y Cheverud, 2001) y que esta diferencia surge, probablemente dado el carácter fuertemente derivado de la globularidad del neurocráneo en humanos modernos, que se manifiesta como una tendencia a presentar bóvedas más grandes (relativamente) y redondeadas (González-José et al., 2008; Martínez-Abadías et al., 2009). Varios autores han postulado que uno de los principales determinantes de la forma del cráneo es el crecimiento del cerebro, que por continuidad arquitectural impactará en la forma del neurocráneo (Moss y Young, 1960; Enlow, 1990; Moss, 1997a, b, c, d; Lieberman et al., 2000). Dada su importancia a nivel evolutivo, funcional, y estructural y su temprano desarrollo, es plausible pensar entonces que el neurocráneo será una estructura más canalizada que otras. Nuestros resultados avalan esta noción. Es importante tener en mente que la selección natural opera en los fenotipos, pero sus resultados son transmitidos de generación en generación a un nivel exclusivamente genético (Hallgrímsson et al., 2005). Por lo tanto, sólo la expresión fenotípica está sujeta a la selección natural y ello desvía y condiciona los procesos de desarrollo disponibles para las siguientes generaciones. El resultado final es que los procesos de desarrollo también evolucionan, manteniendo activas las complejas interacciones que garantizan la variabilidad y su estructuración en el paisaje fenotípico (Jernvall y Jung, 2000; Weiss y Fullerton, 2000; Salazar-Ciudad et al., 2001a, b; Willmore et al., 2007).
Conclusiones
Tal como se planteó en la primera predicción, los resultados indican efectos diferenciales de la integración morfológica en las estructuras relacionadas con el efecto ambiental estudiado. Aquellas estructuras relacionadas a la masticación presentan fuerte integración en términos relativos. Asimismo, la segunda predicción se ve corroborada pues las estructuras sospechadas de ser las más conservadas en la evolución humana (la bóveda y la base del cráneo) presentaron una fuerte canalización, esto es, bajos niveles de variabilidad dentro y entre poblaciones. Este trabajo respalda conclusiones previas acerca del desarrollo y patrones de integración y modularidad en el cráneo humano y evidencia que la evaluación de bases de datos específicamente diseñadas para maximizar la variación en cuanto a efectos genéticos y ambientales son de utilidad para la discusión de estos fenómenos biológicos, tanto como una aproximación a la forma del cráneo que contemple el carácter jerárquicamente anidado de sus estructuras.
Agradecimientos
Agradecemos las correcciones y sugerencias de los revisores anónimos que han contribuido a mejorar el manuscrito.
Literatura citada
1. Ackermann RR. 1998. A quantitative assessment of variability in the australopithecine, human, chimpanzee, and gorilla face. Ph.D. Thesis. Washington University. St. Louis. USA. http://web.uct.ac.za/depts/age/people/ ack1998.pdf
2. Ackermann RR. 2002. Patterns of covariation in the hominoid craniofacial skeleton: implications for paleoanthropological models. J Hum Evol 42:167-187.
3. Ackermann RR. 2003. Morphological integration in hominoids: a tool for understanding human evolution. Am J Phys Anthropol Suppl 32:35.
4. Bastir M, Rosas A. 2005. Hierarchical nature of morphological integration and modularity in the human posterior face. Am J Phys Anthropol 128:26-34.
5. Beecher RM, Corruccini RS. 1981. Effects of dietary consistency on maxillary arch breadth in macaques. J Dent Res 60:68.
6. Beecher RM, Corruccini RS, Freeman M. 1983. Craniofacial correlates of dietary consistency in a nonhuman primate. J Craniofac Genet Dev Biol 3:193-202. [ Links ]
7. Buikstra JE, Ubelaker DH. 1994. Standards for data collection from human skeletal remains. Fayetteville, Arkansas: Arkansas Archeological Survey Research Series No44. [ Links ]
8. Ciochon RL, Nisbett RA, Corruccini RS. 1997. Dietary consistency and craniofacial development related to masticatory function in minipigs. J Craniofac Genet Dev Biol 17:96-102.
9. Corruccini RS. 1999. How anthropology informs the orthodontic diagnosis of malocclusion´s causes. Lewiston: The Edwin Meller Press.
10. Corruccini RS, Beecher RM. 1982. Occlusal variation related to soft diet in a nonhuman primate. Science 218:74- 76. [ Links ]
11. Corruccini RS, Beecher RM. 1984. Occlusofacial morphological integration lowered in baboons raised on soft diet. J Craniofac Genet Dev Biol 4:135-142. [ Links ]
12. Corruccini RS, Handler JS. 1980. Temporomandibular joint size decrease in American Blacks: evidence from Barbados. J Dent Res 59:1528.
13. Corruccini RS, Henderson AM, Kaul SS. 1985. Bite-force variation related to occlusal variation in rural and urban Punjabis (North India). Arch Oral Biol 30:65-69. [ Links ]
14. Cheverud JM. 1982. Phenotypic, genetic, and environmental morphological integration in the cranium. Evolution 36:499-516.
15. Cheverud JM. 1995. Morphological integration in the saddle- back tamarin (Saguinus fuscicolis) cranium. Am Nat 145:63-89.
16. Enlow DH. 1990. Facial growth. Philadelphia: Saunders.
17. Escoufier Y. 1973. Le traitement des variables vectorielles. Biometrics 29:751-760.
18. Falconer DS, MacKay TFC. 1996. Introduction to quantitative genetics. Harlow: Longman Group Ltd.
19. González-José R, Bortolini MC, Santos F, Bonatto S. 2008. The peopling of America: Craniofacial shape variation on a continental scale and its interpretation from an interdisciplinary view. Am J Phys Anthropol 137(2):175- 187. [ Links ]
20. González-José R, Ramirez-Rozzi F, Sardi M, Martínez- Abadías N, Hernández M, Pucciarelli HM. 2005. Functional-cranial approach to the influence of economic strategy on skull morphology. Am J Phys Anthropol 128:757-771.
21. González-José R, Van der Molen S, González-Pérez E, Hernández M. 2004. Patterns of phenotypic covariation and correlation in modern humans as viewed from morphological integration. Am J Phys Anthropol 123(1):69-77. [ Links ]
22. Goodall CR. 1991. Procrustes methods in the statistical analysis of shape (with discussion and rejoinder). J Roy Stat Soc Ser B 53:285-339.
23. Gould SJ. 1989. A developmental constraint in Cerion, with comments on the definition and interpretation of constraint in evolution. Evolution 43:516-539.
24. Hallgrímsson B, Brown JJY, Hall BK. 2005. The study of phenotypic variability: an emerging research agenda for understanding the developmental-genetic architecture underlying phenotypic variation. En: Hallgrímsson B, Hall BK, editores. Variation: a central concept in biology. Nueva York: Academic Press. p 525-551.
25. Hallgrímsson B, Lieberman DE. 2008. Mouse models and the evolutionary developmental biology of the skull. Integr Comp Biol 48:373-384. [ Links ]
26. Hallgrímsson B, Lieberman DE, Young NM, Parsons T, Wat S. 2007. Evolution of covariance in the mammalian skull. Novartis Found Symp 284:164-185.
27. Hallgrímsson B, Willmore K, Hall BK. 2002. Canalization, developmental stability, and morphological integration in primate limbs. Am J Phys Anthropol Suppl 35:131-158.
28. Houle R, Govindaraju DR, Omholt S. 2010. Phenomics: the next challenge. Nature Rev 11:855-866. [ Links ]
29. Ingervall B, Bitsanis E. 1987. A pilot study of the effect of masticatory muscle training on facial growth in longface children. Eur J Orthod 9:15-23.
30. Jernvall J, Jung HS. 2000. Genotype, phenotype, and developmental biology of molar tooth characters. Am J Phys Anthropol 43:171-190. [ Links ]
31. Klingenberg CP. 2008. Morphological integration and developmental modularity. Annu Rev Ecol Evol Syst 39:115-132.
32. Larsen C. 1995. Biological changes in human populations with agriculture. Ann Rev Anthropol 24:185-213.
33. Larsen C. 1997. Bioarchaeology: interpreting behavior from the human skeleton. Cambridge: Cambridge University Press.
34. Lieberman DE. 2008. Speculations about the selective basis for modern human craniofacial form. Evolutionary Anthropology 17:55-68.
35. Lieberman DE, Krovitz GE, Yates FW, Devlin M, St Claire M. 2004. Effects of food processing on masticatory strain and craniofacial growth in a retrognathic face. J Hum Evol 46:655-677.
36. Lieberman DE, Pearson OM, Mowbray KM. 2000. Basicranial influence on overall cranial shape. J Hum Evol 38(2):291-315.
37. Lynch JM, Walsh B. 1998. Genetics and analysis of quantitative traits. Sunderland: Sinauer Associates.
38. Marroig G, Cheverud JM. 2001. A comparison of phenotypic variation and covariation patterns and the role of phylogeny, ecology, and ontogeny during cranial evolution of New World monkeys. Evolution 55:2576-2600. [ Links ]
39. Marroig G, Cheverud JM. 2005. Size as a line of least evolutionary resistance: diet and adaptive morphological radiation in New World monkeys. Evolution 59:1128- 1142.
40. Martínez-Abadías N, Paschetta CA, Azevedo S, Esparza M, González-José‚ R. 2009. Developmental and genetic constraints on neurocranial globularity: insights from analyses of deformed skulls and quantitative genetics. Evol Biol 36:37-56.
41. Moss ML. 1997a. The funtional matrix hypothesis revisited.
1. The role of mechanotransduction. Am J Orthod Dentofacial Orthop 19:301-307.
42. Moss ML. 1997b. The funtional matrix hipothesis revisited.
2. The role of an oseosous connected cellular network. Am J Orthod Dentofacial Orthop 112:221-226.
43. Moss ML. 1997c. The funtional matrix hipothesis revisited.
3. The genomic thesis. Am J Orthod Dentofacial Orthop 112:338-342.
44. Moss ML. 1997d. The funtional matrix hipothesis revisited.
4. The epigenetic antithesis and the resolving synthesis. Am J Orthod Dentofacial Orthop 112:410-417.
45. Moss ML, Young RW. 1960. A funcional approach to craniology. Am J Phys Anthropol 18:281-291. [ Links ]
46. Olson EC, Miller RL. 1958. Morphological integration. Chicago: University of Chicago Press.
47. Paschetta CA, de Azevedo S, Castillo L, Martínez-Abadías N, Hernández M, Lieberman DE, González-José R. 2010. The influence of masticatory loading on craniofacial morphology: a test case across technological transitions in the Ohio Valley. Am J Phys Anthropol 141:297-314. [ Links ]
48. Pavlicev M, Cheverud JM, Wagner GP. 2009. Measuring morphological integration using eigenvalue variance. Evol Biol 36:157-170. [ Links ]
49. Pucciarelli HM, Dressino V, Niveiro M. 1990. Changes in skull components of the squirrel monkey evoked by growth and nutrition. An experimental study. Am J Phys Anthropol 81:535-543.
50. Richardson MK, Chipman AD. 2003. Developmental constraints in a comparative framework: test case using variations in phalanx number during amniote evolution. J Exp Zool B Mol Dev Evol 296:8-22. [ Links ]
51. Rohlf FJ. 2003. TPSSmallF. 1.2 ed. Stony Brook, NY: Department of Ecology and Evolution, State University of New York.
52. Rohlf FJ. 2004. TPSDig. 1.4 ed. Stony Brook, NY: Department of Ecology and Evolution, State University of New York.
53. Rohlf FJ. 2007. TPSRelw. 1.45 ed. Stony Brook, NY: Department of Ecology and Evolution, State University of New York.
54. Rohlf FJ, Slice DE. 1990. Extensions of Procrustes method for the optimal superimposition of landmarks. Syst Zool 39:40-59. [ Links ]
55. Rutherford SL. 2000. From genotype to phenotype: buffering mechanisms and the storage of genetic information. BioEssays 22:1095-1105.
56. Salazar-Ciudad I. 2007. On the origins of morphological variation, canalization, robustness, and evolvability. Integr Comp Biol 47(3):390-400.
57. Salazar-Ciudad I, Newman SA, Sole RV. 2001a. Phenotypic and dynamical transitions in model genetic networks I. Emergence of patterns and genotype-phenotype relations. Evol Dev 3:84-94. [ Links ]
58. Salazar-Ciudad I, Sole RV, Newman SA. 2001b. Phenotypic and dynamical transitions in model genetic networks II. Application to the evolution of segmentation mechanisms. Evol Dev 3:95-103.
59. Schluter D. 1996. Adaptive radiation along genetic lines of least resistance. Evolution 50:1766-1774.
60. Schwenk K. 1995. A utilitarian approach to evolutionary constraint. Zoology 98:251-262.
61. Sholtis S, Weiss KM. 2005. Genoypes, phenotypes and variation. En: Hallgrímsson B, Hall BK, editores. Variation: a central concept in biology. Nueva York: Academic Press. p 499-523.
62. Steppan SJ, Phillips PC, Houle D. 2002. Comparative quantitative genetics: evolution of the G matrix. Trends Ecol Evol 17:320-327.
63. Waddington CH. 1942. Canalization of development and the inheritance of acquired characters. Nature 150:563- 565.
64. Waddington CH. 1957. The strategy of the genes. London: George Allen and Unwin.
65. Wagner GP. 1990. A comparative study of morphological integration in Apis meliffera (Insecta, Hymenoptera). Z Zool Syst Evol-Forsch 28:48-61.
66. Weiss K, Fullerton SM. 2000. Phenogenetic drift and the evolution of genotype-phenotype relations. Theor Popul Biol 57:187-195. [ Links ]
67. Willmore KE, Leamy L, Hallgrimsson B. 2006. Effects of developmental and functional interactions on mouse cranial variability through late ontogeny. Evol Dev 8:550-567. [ Links ]
68. Willmore K, Young N, Richtsmeier JT. 2007. Phenotypic variability: its components, measurement and underlying developmental processes. Evol Biol 34:99- 120.
69. Zakharaov VM. 1992. Population phenotgenetics: analysis of developmental stability in natural populations. Acta Zoologica Fennica 191:7-30.














