Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de antropología biológica
versión On-line ISSN 1514-7991
Rev Arg Antrop Biol vol.16 no.2 La Plata dic. 2014
TRABAJOS ORIGINALES
Covariación ontogénica en el endocráneo de Pan troglodytes
Marina L. Sardi1,2*, Jimena Barbeito-Andrés1,2, Fernando Ventrice3, Fernando Ramírez-Rozzi4, Marisol Anzelmo1,2 y Anne-Marie Guihard-Costa4
1División Antropología. Museo de La Plata. Facultad de Ciencias Naturales y Museo. UNLP. La Plata. Argentina
2Consejo Nacional de Investigaciones Científicas y Técnicas. Buenos Aires. Argentina
3Laboratorio de Neuroimágenes. Departamento de Imágenes. Instituto de Investigaciones Neurológicas Raúl Carrea. FLENI. Buenos Aires. Argentina
4UPR 2147 Dynamique de l'Evolution Humaine-CNRS. Paris. Francia
Financiamiento: Proyecto de Incentivos N633 Universidad Nacional de La Plata. PIP 0079 CONICET.
*Correspondencia a: Marina L. Sardi. Museo de La Plata. Facultad de Ciencias Naturales y Museo. UNLP. Paseo del Bosque s/n. B1900ASV La Plata. Buenos Aires. Argentina. E-mail: msardi@fcnym.unlp.edu.ar
Recibido: 28 Junio 2013
Aceptado: 13 Marzo 2014
Resumen
Diversos estudios proponen que el neurocráneo en Homo sapiens es una estructura integrada y que la morfología de la bóveda y la base se asocia con modificaciones del cerebro. En este estudio se evaluó la covariación ontogénica en el endocráneo de Pan troglodytes, otro primate altamente encefalizado. Se analizaron 52 reconstrucciones 3D derivadas de tomografías computadas de individuos adultos y subadultos. Una vez segmentadas las cavidades endocraneanas, se relevaron 27 landmarks. A partir de su configuración, se obtuvieron el tamaño del centroide y las coordenadas de Procrustes y se realizó Análisis de Componentes Principales, regresión, correlación, ANOVA y análisis F de Goodall a fin de evaluar los cambios de tamaño y forma respecto de la edad y las alometrías. Los cambios en forma están fuertemente integrados y se producen hasta etapas tardías de la ontogenia: elongación de la bóveda y la base, distanciamiento entre el foramen magnun y la placa cribiforme, retroflexión del ángulo basicraneano y descenso de los polos temporales. A partir del análisis PLS se observó que los cambios en la base y la bóveda covarían, pero cuando se ajustó el efecto alométrico, dicha covariación se hizo no significativa, tal como ocurre en Homosapiens. Esto sugiere que el aumento ontogénico del volumen endocraneano -en relación con el crecimiento cerebral- constituye un factor común de integración entre la bóveda y la base en ambas especies. Sin embargo, es probable que en el chimpancé se sume la influencia de distintas estructuras faciales que promuevan variación y covariación en el endocráneo.
Palabras clave: Chimpancé; Tomografía computada; Integración; Cerebro
Abstract
Several studies propose that the neurocranium in Homo sapiens is an integrated structure, being the growing brain the factor that influences the vault and the base morphology. The goal of this study is to assess endocranial ontogenetic covariation in Pan troglodytes, another encephalized primate. Fifty-two 3D reconstructions derived from computed tomographies of adult and subadult specimens were analyzed. After segmentation of the endocranial volumes, twenty-seven landmarks were registered. Through their configuration, Centroid size and Procrustes coordinates were obtained, and Principal Components Analysis, regression, correlation, ANOVA and Goodall's F-test were performed in order to evaluate size and shape changes against age and allometries. The results indicated that significant morphological ontogenetic shape changes are highly integrated and they occur up to the late ontogeny: elongation of the vault and the base, separation of the foramen magnum and the cribiform plate, retroflection of the basicranial angle, and descent of the temporal poles. By means of PLS analysis, a significant covariation between the vault and the base was obtained. However, when the allometric effect was adjusted, the covariation became non-significant, as occurs in Homo sapiens. This suggests that the ontogenetic increase in the endocranial volume -related to the growing brain- may be a common integrative factor between the vault and the base in both species. Nonetheless, different facial structures are also likely to promote variation and covariation in the chimpanzee's endocranium.
Key words: Chimpanzee; Computed tomography; Integration; Brain
La evolución morfológica en el linaje hominino involucró numerosos cambios en el neurocráneo, tales como el aumento de la capacidad craneana (en relación con el tamaño cerebral), la forma globular de la bóveda, el ángulo sagital de la base, la posición central del foramen magnum en la base y la reducción de las superestructuras óseas (Aiello y Dean, 2002; Lieberman et al., 2002, 2004). Estas autapomorfías han sido centro del debate sobre las diferencias heterocrónicas entre el ser humano y el chimpancé (Gould, 1977). Se ha discutido además si representan adaptaciones independientes relacionadas con distintas transiciones evolutivas o si resultaron de pocos cambios en el desarrollo que habrían impactado coordinadamente en varias regiones del cráneo (Lieberman et al., 2002; Martínez- Abadías et al., 2012). En este último caso cabe suponer que las estructuras anatómicas involucradas se encuentran integradas a lo largo de la ontogenia.
Se ha demostrado a través de estudios de genética cuantitativa en individuos adultos que ambas estructuras están integradas en Homo sapiens (Martínez-Abadías et al., 2012) si bien los dos mayores componentes que conforman el neurocráneo -bóveda y base- difieren entre otros por su origen embriológico y modo de osificación. La covariación entre bóveda y base del neurocráneo humano es además significativa en un contexto filogenético, así como ontogenético (Bookstein et al., 2003).
Cuando se explica la diversidad entre especies a partir de cambios en el desarrollo se asume que los mecanismos que generan variación y covariación son compartidos. En Pan troglodytes, por ejemplo, parte de los cambios ontogénicos en el neurocráneo son compartidos con Homo sapiens dado que se evidencia una pérdida de la forma globular (Durrleman et al., 2012), aunque en el género Pan la elongación es más pronunciada (Neubauer et al., 2010). Otros cambios son propios del chimpancé, tales como la elongación de la base, la elevación del inion y la ubicación del foramen magnum en la parte posterior de la base (Lieberman y McCarthy, 1999; Penin et al., 2002; Berge y Penin, 2004; Cobb y O'Higgins, 2004; Mitteroecker et al., 2004; Schaefer et al., 2004; Lieberman et al., 2007; Neubauer et al., 2010). La covariación entre rasgos neurocraneanos no ha sido analizada en Pan sp., sin embargo la comparación de Ackermann (2005) de la covariación en la morfología facial entre distintos primates indicó que los patrones de integración ontogénica son similares entre especies, aunque también hay diferencias en ciertas regiones anatómicas particulares.
La variación y covariación entre rasgos de distintas regiones anatómicas resulta de la suma de distintos factores. El cerebro, por ser un órgano de gran tamaño, afecta la morfología de la bóveda y la base (Moss y Young, 1960; Enlow y Hans, 1996) y es determinante en el patrón de covariación neurocraneano (Hallgrímsson et al., 2007a). En Pan troglodytes y Homo sapiens el cerebro es el principal órgano en crecimiento durante el primer año de vida postnatal; sin embargo, la capacidad craneana adulta en Pantroglodytes representa la tercera parte de la de Homo sapiens (McHenry y Coffing, 2000; Coqueugniot et al., 2004; DeSilva y Lesnik, 2006). La morfología ósea también estaría afectada por las interacciones de los músculos masticatorios y posturales (Moss y Young, 1960; Aiello y Dean, 2002; Hallgrímsson et al., 2007a), dado que en el chimpancé presentan mayor tamaño relativo que en la especie humana.
Dada la influencia del tamaño de los órganos y tejidos sobre la morfología, la alometría debe considerarse un factor clave en estudios morfológicos de ontogenia porque su influencia global y coordinada sobre distintas estructuras tiende a producir integración (Chernoff y Magwene, 1999). En Homo sapiens la alometría contribuye al patrón de covariación ontogénica entre la bóveda y la base (Bookstein et al., 2003; Barbeito- Andrés et al., 2013). Considerando que existen diferencias relativas en los órganos y tejidos relacionados entre distintas especies (e.g. cerebro y músculos masticatorios), la evaluación de la covariación en el neurocráneo permite inferir la relevancia del crecimiento cerebral sobre la integración del neurocráneo en un contexto de interés para el estudio de la evolución entre primates.
El objetivo de este trabajo es evaluar la covariación ontogénica en la morfología endocraneana del chimpancé común. En este estudio, la modificación en tamaño se refiere al crecimiento, en tanto que la modificación en forma corresponde al desarrollo (Klingenberg, 1998). Si bien no hay correspondencia exacta (Coqueugniot y Hublin, 2012), el endocráneo es considerado una aproximación de la forma y del tamaño cerebral (Aiello y Dean, 2002) y de las membranas meníngeas que rodean al cerebro (Moss y Young, 1960). Se asume entonces que no estaría tan influido por factores ectocraneanos tales como los músculos y el esqueleto de la cara, por lo que el endocráneo representa un modelo adecuado de análisis que aporte elementos para desarrollar hipótesis acerca de la encefalización.
Las hipótesis a evaluar son: H1) la forma de la bóveda y la base covarían durante la ontogenia. H2) la alometría afecta la covariación entre rasgos. Siendo Pan troglodytes una especie encefalizada, aunque en menor grado que Homo sapiens, se espera observar covariación significativa entre la bóveda y la base. Dado que en Pan troglodytes al menos el 50% de la capacidad endocraneana adulta se alcanza durante la ontogenia postnatal (Coqueugniot et al., 2004; Durrleman et al., 2012), se espera que el tamaño resulte un factor integrador durante la ontogenia. Si la bóveda y la base están afectadas en algún grado por la morfología cerebral, se espera que dicha covariación sea significativa aún cuando el efecto tamaño se reduzca. En tanto la integración está involucrada en la dirección del cambio evolutivo al limitar o facilitar la evolución de determinados fenotipos (Ackermann, 2005), una comprensión de los procesos ontogénicos de covariación en una especie filogenéticamente cercana a Homo sapiens proveerá elementos para discutir diferencias y similitudes entre ellas e identificar posibles puntos de divergencia.
Material y métodos
Composición de la muestra
En este trabajo se utilizó una base de datos de imágenes craneales obtenidas a partir de tomografías computadas de 52 individuos de la especie Pan troglodytes de ambos sexos y con edades entre 8 meses y 11 años (Tabla 1). La edad fue estimada para cada espécimen considerando las referencias de Dean y Wood (1981) y Kuykendall (1996). La muestra fue dividida en cuatro etapas ontogénicas, basadas en la erupción dentaria (Tabla 1): M0, sin dientes permanentes en erupción gingival; M1, el primer molar permanente en erupción gingival; M2, el segundo molar permanente en erupción gingival y M3, el tercer molar en erupción gingival. Se asume que la etapa M2 se corresponde con el período de maduración sexual (Smith, 1989) y que M3 se corresponde con la adultez.
Tabla 1.Composición de la muestra

Los cráneos depositados en el Muséum National d'Histoire Naturelle (Paris, Francia), fueron escaneados con un equipo General Electric® CT (Genesis Hispeed RP) en el Hospital Quinze Vingt (Paris). Las reconstrucciones tridimensionales (3D) de los cráneos y las segmentaciones de las estructuras internas se realizaron con el software Amira (versión de prueba).
Análisis morfométrico
Se registraron 27 landmarks endocraneanos tridimensionales (Tabla 2, Fig. 1), algunos de ellos previamente descriptos (Howells, 1973; McCarthy, 2001). Catorce landmarks, correspondientes a intersecciones entre suturas, foramina o curvaturas máximas se ubicaron sobre las reconstrucciones 3D del cráneo. Los restantes trece landmarks se ubicaron sobre las reconstrucciones 3D del endocráneo (Tabla 2). La precisión en el registro de landmarks fue evaluada por uno de los autores (FV). Para ello, se tomaron los 27 landmarks endocraneanos de un chimpancé en cinco ocasiones; mediante un análisis de varianza (ANOVA) se estableció la existencia de diferencias entre las coordenadas de landmarks, obteniéndose una diferenciación no significativa (p>0,05). Los landmarks para cada espécimen fueron estandarizados de acuerdo a la simetría usando el plano sagital de modo de obtener individuos simétricos. Cuando se compararon los resultados de los individuos no estandarizados con los de individuos estandarizados no se encontraron diferencias.
Tabla 2. Landmarks registrados
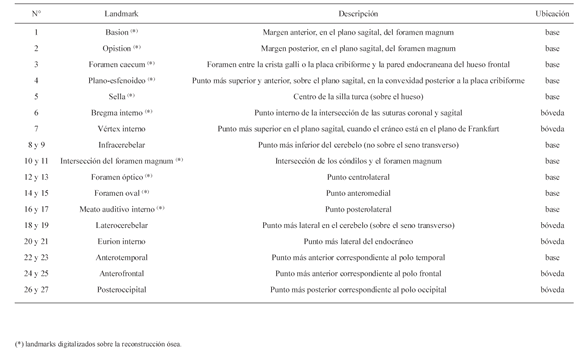

Fig. 1. Landmarks endocraneanos en vista basilar (a), vista frontal (b) y lateral (c). Referencias de la numeración en Tabla 2.
Sobre la configuración de landmarks se realizó Análisis Generalizado de Procrustes (AGP) a fin de minimizar las diferencias de escala, traslación y rotación (Gower, 1975; Rohlf y Slice, 1990; Bookstein, 1991; Goodall, 1991; O'Higgins y Jones, 1998). De este análisis se obtuvo una medida de tamaño (tamaño del centroide, TC) independiente de variables de forma (coordenadas de Procrustes), definido como la raíz cuadrada de la suma de las distancias euclidianas al cuadrado de cada landmark respecto del centroide (Bookstein, 1991; Goodall, 1991; Dryden y Mardia, 1998; O'Higgins y Jones, 1998).
Los análisis morfométricos y estadísticos se realizaron con los programas Morphologika© (O'Higgins y Jones, 1998) y MorphoJ (Klingenberg, 2011).
Análisis estadísticos
Las coordenadas obtenidas del Análisis Generalizado de Procrustes fueron sujetas a Análisis de Componentes Principales (ACP) en el espacio de forma de Kendall (Kent, 1994; Dryden y Mardia, 1998; O'Higgins y Jones, 1998). Con dichas coordenadas, consideradas como variables dependientes, se realizó una regresión multivariada a fin de evaluar la cantidad de ejes de variación en forma asociados con la edad y el TC. La probabilidad se estimó mediante un test de permutación con 10000 iteraciones. Además, un análisis de correlación de Pearson de cada componente principal (CP) respecto de la edad y el TC permitió detectar los CPs que representan cambio ontogénico, así como determinar si existen conjuntos de rasgos que varían de modo independiente. Los CPs que mostraron una correlación significativa se retuvieron para posteriores análisis.
Con el objeto de conocer cómo se estructura ontogénicamente la variación, la diferenciación entre grupos de etapas ontogénicas sucesivas fue evaluada mediante la prueba F de Goodall sobre las coordenadas de Procrustes. Los niveles de significación se obtuvieron por métodos de permutación luego de 10000 iteraciones. La diferenciación en tamaño se evaluó mediante ANOVA, luego de probar que se distribuye normalmente. Conocer en qué momento finaliza el crecimiento y el desarrollo permite inferir hasta qué etapa ontogénica la alometría actuaría como un factor integrador.
Siendo que todos los primates manifiestan algún grado de dimorfismo sexual (Leigh y Shea, 1996; Schaefer et al., 2004) y que éste constituye un potencial factor de confusión en el patrón de variación observado se evaluó la diferenciación entre sexos. Para ello, se realizó un análisis de regresión linear con variables categóricas utilizando solo los individuos de sexo conocido. Para evaluar el dimorfismo sexual en tamaño se utilizó el TC como variable dependiente, el sexo como variable categórica y la edad como covariable. Para evaluar el dimorfismo sexual en forma se utilizaron los escores de los CPs como variable dependiente, el sexo como variable categórica y la edad así como el TC como covariable. Simultáneamente, se evaluó la igualdad de las pendientes (o sea de las trayectorias) incorporando el término de interacción entre el sexo y la edad o el tamaño del centroide.
La integración morfológica entre landmarks de la bóveda y la base (Tabla 2) fue evaluada mediante el análisis Partial Least Squares (PLS) de dos bloques con la serie ontogénica completa. Esta técnica permite explorar la covariación entre dos bloques o conjuntos de variables definidos previamente y se basa en la descomposición del valor singular de la matriz de covarianza. Este procedimiento encuentra pares de ejes (uno por bloque) que representan nuevas combinaciones de las variables originales, explicando una cantidad decreciente de covariación (valor singular) entre bloques (Rohlf y Corti, 2000; Bookstein et al., 2003). Además se visualiza la ubicación de los individuos a lo largo de los ejes. A fin de evaluar el efecto de la alometría en la integración endocraneana, el PLS fue repetido usando los residuales de la regresión multivariada de las coordenadas de Procrustes sobre el tamaño del centroide (Martínez-Abadías et al., 2012). Los valores de probabilidad fueron establecidos por métodos de permutación.
Visualización
El patrón de cambio ontogenético de forma del endocráneo se evaluó visualmente mediante la construcción de grillas de deformación a lo largo de los CPs retenidos así como mediante deformación de las superficies generadas con Avizo. Para ello, la forma promedio fue deformada mostrando los extremos positivo y negativo de los vectores del ACP y del PLS.
Resultados
El análisis de regresión multivariada indicó que las coordenadas de Procrustes están asociadas a la edad y al TC de modo altamente significativo, con una predicción del 38,2 y 31% de la variación, respectivamente. A partir del ACP, se obtuvieron CPs cuya correlación respecto de la edad y del TC sólo fue significativa en el CP 1 (edad: r=-0,939; p<0,0001; TC: r=-0,847; p<0,0001). El CP 1 resume 43% de variación y los siguientes resumen individualmente menos del 10% (Tabla 3).
Tabla 3. Correlación de los CPs (solo se muestran los tres primeros

En la Figura 2 se observa la cantidad de cambio en tamaño (Fig. 2a) y forma del endocráneo (Fig. 2b), así como el cambio alométrico (Fig. 2c). Todos los grupos presentan cierto grado de diferenciación con grupos ontogénicos sucesivos. Se observa además solapamiento en las distribuciones de ambos sexos. Los análisis ANOVA y F de Goodall realizados con el TC y las coordenadas de Procrustes, respectivamente, indican que entre las edades M0 y M1 hay diferencias altamente significativas en tamaño y forma, entre los grupos M1 y M2 hay diferencias no significativas en tamaño y altamente significativas en forma y entre M2 y M3 hay variación altamente significativa en tamaño y forma (Tabla 4).

Fig. 2. Distribución de los individuos femeninos (círculos), masculinos (cuadrados) y de sexo desconocido (asteriscos) de acuerdo con: a- la edad vs el tamaño del centroide (TC), b- la edad vs el CP 1 y c- TC vs el CP 1. El color de gris claro (M0) a negro (M3) representa los grupos dentarios.
Tabla 4. Análisis de la varianza y F de Goodall entre grupos ontogénicos

Los cambios descriptos por el CP 1 (Fig. 3) indican que hacia la adultez: a) el foramen magnum pasa de tomar una posición central a otra más posterior; b) la placa cribiforme migra hacia adelante; c) hay retroflexión del ángulo basicraneano; d) se alarga relativamente la parte anterior de la base craneana; e) el ancho craneal máximo (eurion) toma una ubicación más inferior. En términos generales, el endocráneo pierde su forma globular de los individuos infantiles y adopta una forma más ovalada en los adultos.

Fig. 3. Variación en el PC1 en vista lateral (izquierda), frontal (centro) y superior (derecha). a) Forma de los individuos M0 tomando a los adultos como referencia. b) Forma de los individuos adultos tomando a individuos M0 como referencia. c) Deformación de la grilla en el extremo positivo (individuos adultos), tomando como referencia el extremo negativo.
El análisis del dimorfismo sexual en tamaño y forma (Tabla 5) indica que la interacción de la edad con el TC y con los escores del CP 1, así como del TC con el CP 1, fue no significativa. La diferenciación entre sexos tampoco fue significativa en ninguna de las comparaciones. Esto indica que machos y hembras no difieren en sus trayectorias de crecimiento y desarrollo ni en las trayectorias de cambio alométrico. Tampoco difieren en el tamaño y la forma endocraneana (Tabla 5), consistentemente con lo observado en otros estudios (Schaefer et al., 2004). Debido a la variación no significativa entre sexos, la interpretación de la morfología endocraneana se realizó considerando todos los individuos conjuntamente.
Tabla 5. Análisis de regresión lineal con variable categórica (sexo) para evaluar el dimorfismo sexual en tamaño (TC) y forma (CP 1)

El análisis de PLS indica que el primer par de ejes (PLS 1) fue el único que explicó una proporción significativa de covariación (86,6%) entre la bóveda y la base; es decir que existe una importante variación coordinada entre ambos bloques (Tabla 6). Los individuos se distribuyen a lo largo del PLS 1 diferenciándose por grupos etarios sucesivos (Fig. 4a). A medida que aumenta la edad (y los escores disminuyen), la bóveda se alarga y el ancho máximo se ubica más abajo, conjuntamente con el descenso de los lóbulos temporales, rasgos que covarían con la elongación de la base y el desplazamiento hacia atrás del foramen magnum (Fig. 4b, c). Luego del ajuste del efecto alométrico por medio de la utilización de los residuos de la regresión multivariada, la covariación entre la bóveda y la base no resultó significativa (Tabla 6). El PLS 1 explicó solo el 38,3% de la variación y los individuos se distribuyen sin evidenciar un patrón ontogénico; es decir, los individuos de distintas edades se solapan (Fig. 4d).

Fig. 4. a) Distribución de los individuos de acuerdo al PLS 1 de la bóveda y la base. b) Morfología de los individuos ubicados en el extremo positivo de ambos ejes (infantiles), en vista lateral (izquierda), frontal (centro) y basilar (derecha). c) Morfología de los individuos ubicados en el extremo negativo de ambos ejes (adultos), en vista lateral (izquierda), frontal (centro) y basilar (derecha) con el efecto alométrico (arriba). d) Distribución de los individuos de acuerdo al PLS 1 de la bóveda y la base luego de realizar el ajuste alométrico. El color de gris claro (M0) a negro (M3) representa los grupos dentarios.
Discusión
Los resultados de la evaluación de la morfología endocraneana de Pan troglodytes indicaron que durante la ontogenia postnatal se producen cambios en tamaño y forma que están significativamente asociados con la edad; el tamaño además, está significativamente asociado con la forma (Tablas 3, 4; Figs. 2, 3). La gran mayoría del cambio ontogénico en forma fue resumido por un único componente (Tabla 3), contrariamente a lo observado por Neubauer et al. (2010). El hecho de que no se observen CPs que representen cambio ontogénico independiente del representado por el PC 1 sugiere que existe un conjunto de rasgos morfológicos que se encuentran fuertemente integrados a lo largo del desarrollo endocraneano.
Dado que la superficie endocraneana se integra con la morfología del cerebro y de los tensores meníngeos (Moss y Young, 1960; Richtsmeier et al., 2006) y que el chimpancé ya presenta más del 90% del tamaño cerebral (Vrba, 1998) y endocraneano (Coqueugniot et al., 2004) alrededor de los 7 años de vida, es esperable que en etapas tardías el endocráneo no modifique su morfología de modo significativo. En la muestra analizada se obtuvieron de acuerdo a lo esperado, cambios altamente significativos entre los grupos M0 y M1, así como menores cambios entre los grupos M1 y M2, pero contrariamente a lo esperado, se observaron modificaciones significativas en tamaño y en forma luego de la emergencia de M2 (Tabla 4), momento que corresponde con la maduración sexual (Smith, 1989). Los resultados de este estudio coinciden con los de Durrleman et al. (2012), quienes observan variación significativa en el volumen endocraneano hasta etapas ontogénicas tardías y con Lieberman y McCarthy (1999), quienes observaron cambios en la forma basicraneana hasta la emergencia del M3.
El modo en que varían conjuntamente los rasgos endocraneanos es similar al observado por otros autores a partir de la morfología del exocráneo (Bastir y Rosas, 2004; Berge y Penin, 2004; Mitteroecker et al., 2004; Lieberman et al., 2007) y del endocráneo (Lieberman y McCarthy, 1999; Neubauer et al., 2010; Durrleman et al., 2012). Globalmente considerado, el endocráneo de Pan troglodytes deja de ser redondeado y adopta una forma ovalada hacia la adultez (Fig. 3). Uno de los cambios ocurridos en la base es la migración del foramen magnum hacia la parte posterior (Fig. 3) y su orientación hacia atrás y arriba (Berge y Penin, 2004), conjuntamente con la orientación de la bóveda hacia adelante. Otro cambio involucra a la placa cribiforme que adopta en los adultos una posición más anterior y vertical, relacionado probablemente con la integración y el desarrollo de las estructuras olfatorias (Penin et al., 2002; Berge y Penin, 2004; Cobb y O'Higgins, 2004; Mitteroecker et al., 2004) ya que la placa cribiforme constituye el pasaje para axones procedentes de las neuronas olfatorias que forman sinapsis con el bulbo olfatorio. Las estructuras olfatorias crecen y se desarrollan conjuntamente con las estructuras faciales que presentan importantes tasas de cambio en la vida postnatal (Bastir et al., 2006). Otro cambio basicraneano es la retroflexión del ángulo sagital. El polo frontal del endocráneo migra con el aumento de edad hacia arriba y puede, así como el anterior, relacionarse con la integración entre el basicráneo anterior y la cara. Un cuarto cambio es la expansión y extensión de la base endocraneana, que representa un patrón similar al de otros primates (Dean y Wood, 1984; Lestrel et al., 1993; Lieberman y McCarthy, 1999; Lieberman et al., 2000; Jeffery, 2003), pero diferente al de la especie humana (Lieberman y McCarthy, 1999). En vista frontal, se observa una flexión en el plano coronal debido a que las fosas temporales descienden respecto del plano sagital. En la bóveda se observa una elongación en sentido anteroposterior y un ensanchamiento, pero principalmente se destaca el descenso del eurion (ancho craneal máximo), acompañando el descenso de la fosa temporal respecto de las estructuras sagitales.
El análisis de la covariación ontogénica entre los rasgos de la bóveda y la base (PLS) indicó que el conjunto de cambios mencionado no es independiente confirmando lo observado por medio del ACP. Sin embargo, la covariación entre bóveda y base desaparece al remover el efecto tamaño. Dado que hay covariación entre bóveda y base, no se rechaza la hipótesis 1 y siendo que la alometría afecta dicha covariación, tampoco se rechaza la hipótesis 2. Estos resultados son similares a los observados en la ontogenia humana, a partir de rasgos exocraneanos (Barbeito-Andrés et al., 2013) e implican que el aumento en tamaño es el principal promotor de la covariación entre rasgos.
La covariación ontogénica entre la bóveda y la base es explicable porque el crecimiento de los órganos (por ejemplo, el cerebro) es un factor común de integración (Mitteroecker y Bookstein, 2008), aun cuando las estructuras anatómicas involucradas presentan diversos orígenes embriológicos. La morfología del endocráneo se corresponde con la del cerebro en Homo sapiens (Hadziselimovic y Ruzdic, 1966; Hadziselimovic y Cus, 1966; LeMay, 1976; Neubauer et al., 2010) y es esperable que en Pan exista similar correspondencia porque ambas especies pertenecen a un taxón que se distingue por su importante grado de encefalización (Aiello y Dean, 2002). Se infiere además la influencia del cerebro porque al momento de nacer en Pan troglodytes resta por desarrollarse más del 50% del tamaño adulto (Vrba, 1998). La ausencia de covariación cuando el efecto alométrico fue ajustado pondría en evidencia los múltiples factores intervinientes durante la vida pre y postnatal que difieren entre la bóveda y la base, tales como sus diferentes orígenes embriológicos y las restricciones estructurales impuestas por los órganos y tejidos relacionados, que impondrían una modularización de menor jerarquía (Bruner y Ripani, 2008).
Del PLS se observa además que la covariación se estructura ontogénicamente dado que se distinguen las cuatro etapas ontogénicas para rasgos de la base y se distinguen M0, M1 y M2-3 para rasgos de la bóveda (Fig. 4a). En tanto el endocráneo del chimpancé que presenta cambio morfológico hasta la emergencia de M3, no puede ser totalmente explicado por la influencia del cerebro. Considerando el patrón de cambio, es posible que el desarrollo de crestas óseas en el temporal que actúan como sitios de inserción de músculos nucales intervinientes en la postura y en menor medida, en la masticación (Herring y Teng, 2000; Zafar et al., 2000), influyan también en la forma endocraneana superponiéndose a la influencia del cerebro en el patrón de integración (Hallgrímsson et al., 2007a). Dichas crestas están ausentes en individuos infantiles y a medida que los músculos aumentan de tamaño y las fuerzas musculares se intensifican sobre el hueso, es probable que promuevan cambios en la morfología global del neurocráneo y también en la superficie endocraneana. Las articulación con estructuras faciales promoverían además variación en la base (Bastir et al., 2006), integrada a las paredes laterales de la bóveda (Hallgrímsson et al., 2007b). La suma de factores promovería modificaciones sobre la bóveda y la base hasta etapas ontogénicas tardías, así como su integración.
Los resultados presentados sugieren que el proceso de expansión ontogénica del cerebro sería de relevancia en la integración del neurocráneo en distintas especies de primates altamente encefalizados y probablemente constituye un ejemplo de homología en el factor de integración. Sin embargo, el patrón observado en chimpancés indicaría que existen otros procesos intervinientes por lo que no puede afirmarse que los mecanismos ontogénicos sean completamente compartidos entre estos taxa. Ackermann (2005) y Mitteroecker y Bookstein (2008) sugieren también que entre estas especies existen factores comunes de integración craneana, aunque destacan que factores locales propios de cada especie serían responsables de las diferencias observadas en sus patrones de covariación. Se ha propuesto que en primates no humanos los músculos ejercen una mayor influencia en la variación del cráneo (Moss y Young, 1960) y particularmente en el género Pan, la base varía coordinadamente con la cara (Lieberman y McCarthy, 1999), lo que probablemente afectaría la superficie endocraneana. En el género Homo en cambio, la reducción de los músculos masticatorios habría eliminado las restricciones evolutivas impuestas al proceso de encefalización (Stedman et al., 2004) que se habría convertido en el único factor conspicuo generador de los patrones de variación y covariación de rasgos morfológicos neurocraneanos.
Agradecimientos
Agradecemos especialmente a los evaluadores que contribuyeron con sus comentarios a mejorar notablemente este manuscrito. Agradecemos además a Dan Lieberman y a Ana Tropea por las sugerencias realizadas en versiones previas. También, a los responsables de las colecciones del Muséum National d'Histoire Naturelle (Paris, Francia) por el acceso a las mismas y al personal del Hospital Quinze Vingt (Paris, Francia) por acceder a la digitalización de los cráneos.
Literatura citada
1. Ackermann RR. 2005. Ontogenetic integration of the hominoid face. J Hum Evol 48:175-197. [ Links ]
2. Aiello L, Dean C. 2002. An introduction to human evolutionary anatomy. Londres: Elsevier Academic Press.
3. Barbeito-Andrés J, Ventrice F, Anzelmo M, Pucciarelli HM, Sardi ML. 2013. Estudio transversal sobre la covariación ontogénica entre la base y la bóveda craneana humana. En: Avena S, Lois MV, compiladores. Libro de resúmenes. Undécimas Jornadas Nacionales de Antropología Biológica. Buenos Aires. p 93.
4. Bastir M, Rosas A. 2004. Comparative ontogeny in humans and chimpanzees: similarities, differences and paradoxes in postnatal growth and development of the skull. Ann Anat 186:503-509. [ Links ]
5. Bastir M, Rosas A, O'Higgins P. 2006. Craniofacial levels and morphological maturation of the human skull. J Anat 209:637-654. [ Links ]
6. Berge C, Penin X. 2004. Ontogenetic allometry, heterochrony, and interspecific differences in the skull of African apes, using tridimensional Procrustes analysis. Am J Phys Anthropol 124:124-138. [ Links ]
7. Bookstein FL. 1991. Morphometric tools for landmark data: geometry and biology. Cambridge: Cambridge University Press.
8. Bookstein FL, Gunz P, Miteroecker P, Prossinger H, Schaefer K, Seidler H. 2003. Cranial integration in Homo: singular warps analysis of the midsagittal plane in ontogeny and evolution. J Hum Evol 44:167-187. [ Links ]
9. Bruner E, Ripani M. 2008. A quantitative and descriptive approach to morphological variation of the endocranial base in modern humans. Am J Phys Anthropol 137:31- 40 [ Links ]
10. Chernoff B, Magwene PM. 1999. Morphological integration: forty years later. En: Olson EC, Miller RL, editores. Morphological integration. Chicago: The University of Chicago. p 319-353.
11. Cobb SN, O'Higgins P. 2004. Hominins do not share a common postnatal facial ontogenetic shape trajectory. J Exper Zool (Mol Dev Evol) 302B:302-321. [ Links ]
12. Coqueugniot H, Hublin JJ. 2012. Age-related changes of digital endocranial volume during human ontogeny: results from an osteological reference collection. Am J Phys Anthropol 147:312-318. [ Links ]
13. Coqueugniot H, Hublin J-J, Veillon F, Houët J-J, Jacob T. 2004. Early brain growth in Homo erectus and implications for cognitive ability. Nature 431:299-302. [ Links ]
14. Dean MC, Wood BA. 1981. Developing pongid dentition and its use for ageing individual crania in comparative cross-sectional growth studies. Folia Primatol 36:111- 127. [ Links ]
15. Dean MC, Wood BA. 1984. Phylogeny, neoteny and growth of the cranial base in hominoids. Folia Primatol 43:157- 180. [ Links ]
16. DeSilva J, Lesnik J. 2006. Chimpanzee neonatal brain size: implications for brain growth in Homo erectus. J Hum Evol 51:207-212. [ Links ]
17. Dryden IL, Mardia KV. 1998. Statistical shape analysis. London: John Wiley.
18. Durrleman S, Pennec X, Trouvé A, Ayache N, Braga J. 2012. Comparison of the endocranial ontogenies between chimpanzees and bonobos via temporal and spatiotemporal registration. J Hum Evol 62:74-88. [ Links ]
19. Goodall CR. 1991. Procrustes methods and the statistical analysis of shape. J Roy Statist Soc B 53:285-340. [ Links ]
20. Gould SJ. 1977. Ontogeny and phylogeny. Cambridge: Harvard University Press.
21. Gower JC. 1975. Generalised Procrustes analysis. Psychmetrika 40:33-50. [ Links ]
22. Hadziselimovic H, Cus M. 1966. The appearance of internal structures of the brain in relation to configuration of the human skull. Cells Tissues Organs 63:289-299. [ Links ]
23. Hadziselimovic H, Ruzdic N. 1966. Appearance of the base of the brain in relation to the configuration of human skull. Cells Tissues Organs 65:146-156. [ Links ]
24. Hallgrímsson B, Lieberman DE, Young NM, Parsons T, Wat S. 2007a. Evolution of covariance in the mammalian skull. Novartis Found Symp 284:164-190. [ Links ]
25. Hallgrímsson B, Lieberman DE, Liu W, Hutchinson AF, Jirik FR. 2007b. Epigenetic interactions and the structure of phenotypic variation in the cranium. Evol Dev 9:76-91. [ Links ]
26. Herring SW, Teng S. 2000. Strain in the braincase and its sutures during function. Am J Phys Anthropol 112:575- 593. [ Links ]
27. Howells WW. 1973. Cranial variation in man. Papers of the Peabody Museum of Archaeology and Ethnology. Cambridge: Harvard University Press.
28. Kent JT. 1994. The complex Bingham distribution and shape analysis. J Roy Statist Soc B 56:285-299. [ Links ]
29. Klingenberg CP. 1998. Heterochrony and allometry: the analysis of evolutionary change in ontogeny. Biol Rev 73:79-123. [ Links ]
30. Klingenberg CP. 2011. MorphoJ: an integrated software package for geometric morphometrics. Mol Ecol Resour 11:353-357. [ Links ]
31. Kuykendall KL. 1996. Dental development in chimpanzees (Pan troglodytes): the timing of tooth calcification stages. Am J Phys Anthropol 99:135-157. [ Links ]
32. Leigh SR, Shea BT. 1996. Ontogeny of body size variation in African apes. Am J Phys Anthropol 99:43-65.
33. LeMay M. 1976. Morphological cerebral asymmetries of modern man, fossil man, and nonhuman primate. Ann New York Acad Sc 280:349-366. [ Links ]
34. Lestrel PE, Bodt A, Swindler DR. 1993. Longitudinal study of cranial base shape changes in Macaca nemestrina. Am J Phys Anthropol 91:117-129. [ Links ]
35. Lieberman DE, McCarthy RC. 1999. The ontogeny of cranial base angulation in humans and chimpanzees and its implications for reconstructing pharyngeal dimensions. J Hum Evol 36:487-517. [ Links ]
36. Lieberman DE, Carlo J, Ponce de León M, Zollikofer CPE. 2007. A geometric morphometric analysis of heterochrony in the cranium of chimpanzees and bonobos. J Hum Evol 52:647-662. [ Links ]
37. Lieberman DE, McBratney BM, Krovitz GE. 2002. The evolution and development of craniofacial form in Homo sapiens. Proc Natl Acad Sci USA 99:1134-1139. [ Links ]
38. Lieberman DE, Krovitz GE, McBratney-Owen B. 2004. Testing hypotheses about tinkering in the fossil record: the case of the human skull. J Exp Zool B Mol Dev Evol 302:284-301. [ Links ]
39. Lieberman DE, Ross CF, Ravosa MJ. 2000. The primate cranial base: ontogeny, function, and integration. Yrbk Phys Anthropol 43:117-169. [ Links ]
40. Martínez-Abadías N, Esparza M, Sjøvold T, González-José R, Santos M, Hernández M, Klingenberg CP. 2012. Pervasive genetic integration directs the evolution of human skull shape. Evolution 66:10-23. [ Links ]
41. McCarthy RC. 2001. Anthropoid cranial base architecture and scaling relationships. J Hum Evol 40:41-66. [ Links ]
42. McHenry HM, Coffing K. 2000. Australopithecus to Homo: transformations in body and mind. Ann Rev Anthropol 29:125-146. [ Links ]
43. Mitteroecker P, Bookstein F. 2008. The evolutionary role of modularity and integration in the hominoid cranium. Evolution 62:943-958. [ Links ]
44. Mitteroecker P, Gunz P, Bernhard M, Schaefer K, Bookstein FL. 2004. Comparison of cranial ontogenetic trajectories among great apes and humans. J Hum Evol 46:679-698. [ Links ]
45. Moss ML, Young RW. 1960. A functional approach to craniology. Am J Phys Anthropol 18:281-291. [ Links ]
46. Neubauer S, Gunz P, Hublin JJ. 2010. Endocranial shape changes during growth in chimpanzees and humans: a morphometric analysis of unique and shared aspects. J Hum Evol 59:555-566. [ Links ]
47. O'Higgins P, Jones N. 1998. Facial growth in Cercocebus torquatus. An application of three-dimensional geometric morphometric techniques to the study of morphological variation. J Anat 193:251-272. [ Links ]
48. Penin X, Berge C, Baylac M. 2002. Ontogenetic study of the skull in modern humans and the common chimpanzees: neotenic hypothesis reconsidered with a tridimensional Procrustes analysis. Am J Phys Anthropol 118:50-62. [ Links ]
49. Richtsmeier JT, Aldridge K, DeLeon VB, Panchal J, Kane AA, Marsh JL, Yan P, Cole TM. 2006. Phenotypic integration of neurocranium and brain. J Exp Zool Part B 306:360-378. [ Links ]
50. Rohlf F J, Corti M. 2000. Use of two-block partial leastsquares to study covariation in shape. Syst Biol 49:740- 753. [ Links ]
51. Rohlf F, Slice DE. 1990. Extensions of the Procrustes method for the optimal superimposition of landmarks. Syst Zool 39:40-59. [ Links ]
52. Schaefer K, Mitteroecker P, Gunz P, Bernhard M, Bookstein FL. 2004. Craniofacial sexual dimorphism patterns and allometry among extant hominids. Ann Anat 186:471- 478. [ Links ]
53. Smith HB. 1989. Dental development as a measure of life history in primates. Evolution 43:683-688. [ Links ]
54. Vrba ES. 1998. Multiphasic growth models and the evolution of prolonged growth exemplified by human brain evolution. J Theor Biol 190:227-239. [ Links ]
55.Zafar H, Nordh E, Eriksson PO. 2000. Temporal coordination between mandibular and head-neck movements during jaw opening-closing tasks in man. Arch Oral Biol 45:675-682. [ Links ]















