Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de antropología biológica
versión On-line ISSN 1514-7991
Rev Arg Antrop Biol vol.16 no.2 La Plata dic. 2014
TRABAJOS ORIGINALES
Convergencia en las proporciones craneanas entre primates del nuevo y el viejo mundo: un análisis craneofuncional
Guido Rocatti1, Héctor M. Pucciarelli1,2, María C. Muñe1,2 y S. Ivan Perez1,2*
1División Antropología. Museo de La Plata. Facultad de Ciencias Naturales y Museo. UNLP. La Plata. Buenos Aires. Argentina
2Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). Buenos Aires. Argentina
Financiamiento: FONCYT PICT-B 307.
*Correspondencia a: S. Ivan Perez. División Antropología. Museo de La Plata. Facultad de Ciencias Naturales y Museo. UNLP. Paseo del Bosque s/n. B1900ASV La Plata. Buenos Aires. Argentina. E-mail: ivanperezmorea@gmail.com
Recibido: 26 Noviembre 2013
Aceptado: 13 Marzo 2014
Resumen
Los humanos modernos han sido caracterizados por una morfología craneana extremadamente lobulada, considerada como una respuesta al aumento significativo en el tamaño del cerebro, que los diferencia de manera marcada del resto de los Primates. Otras especies, como algunos clados de platirrinos, cambiaron independientemente a lo largo de su historia evolutiva y alcanzaron valores elevados de tamaño relativo del cerebro. Este aumento del tamaño del cerebro ofrece una oportunidad para estudiar a escala macroevolutiva en qué medida existió una convergencia en la evolución de la morfología craneana externa de los Primates y qué cambios son particulares del linaje humano. En este trabajo estudiamos los cambios globales en la morfología craneofacial de varias especies de Primates de los infraórdenes Lemuriformes, Platyrrhini y Catarrhini y su relación con los cambios en el tamaño del cerebro empleando técnicas morfométricas, filogenéticas y comparativas. Un análisis de componentes principales mostró que existe una superposición en la distribución en el espacio de forma de Homo sapiens principalmente con los géneros Ateles, Saimiri y Cebus de Platyrrhini. Los análisis comparativos mostraron la falta de estructura filogenética en el eje de mayor variación morfométrica y su asociación con los cambios en el tamaño relativo del cerebro. Esto sugiere la existencia de convergencia evolutiva en la morfología externa del cráneo y señala al cambio relativo en el tamaño del cerebro como un factor intrínseco importante para comprender la variación morfológica en todo el orden Primates.
Palabras clave: Platirrinos; Catarrinos; Morfometría craneofuncional; Método comparativo
Abstract
Modern humans have been characterized by extremely lobulated cranial morphology, considered a response to the significant increase in brain size, which markedly differs from the rest of the Primates. Other Primate species, such as some platyrrhine clades, evolved independently along their evolutionary history to reach high values of relative brain size. The increase in relative brain size in these Primate clades offers an opportunity to study, at a macroevolutionary scale, to what extent there was a convergence in the evolution of external cranial morphology in Primates and what changes are specific to the human species. We study global changes in craniofacial morphology in several species of Lemuriformes, Platyrrhini and Catarrhini infraorders of Primates, and their relationship with changes in brain size, using morphometric, phylogenetic and comparative techniques. A principal component analysis showed that there is an overlap in the distribution on the shape space of Homo sapiens mainly with Ateles, Saimiri and Cebus Platyrrhini genera. The comparative analyses showed the lack of phylogenetic structure in the axis of greatest morphometric variation, and its association with the changes in relative brain size. This suggests the existence of evolutionary convergence in the external morphology of the skull and points to the change in the relative size of the brain as an intrinsic factor important for understanding morphological change in the Primate order.
Key words: Platyrrhines; Catarrhines; Craniofunctional morphometry; Comparative method
El estudio del proceso de diversificación craneofacial de los Primates es de gran interés en Antropología Biológica, Biología Evolutiva y Medicina (Ross y Henneberg, 1995; Bookstein et al., 2003; Hallgrímsson y Lieberman, 2008). En estos estudios, los humanos modernos han sido caracterizados por una morfología craneana extremadamente lobulada que los diferencian de manera marcada del resto de los Primates (Moss y Young, 1960; Mitteroecker et al., 2004). Esta morfología particular de los humanos es considerada una respuesta al aumento significativo en el tamaño del cerebro (Moss y Young, 1960) y puede estar asociada a la ventaja competitiva que un cerebro más desarrollado confirió a sus portadores (Barton, 2006).
Aunque los humanos modernos varían relativamente poco en estas características morfológicas craneanas, otras especies de Primates cambiaron a lo largo de su historia evolutiva hasta alcanzar valores elevados de tamaño relativo del cerebro (Isler et al., 2008; Bastir et al., 2010; Montgomery et al., 2011; Allen y Kay, 2012). Particularmente, los Monos del Nuevo Mundo presentan tres clados (Cebinos, Pithecinos y Atelinos) que evolucionaron de manera independiente y exhiben cerebros proporcionalmente grandes (Hartwig et al., 2011; Allen y Kay, 2012). Por otro lado, Alouatta ha sido descrito como uno de los géneros de primates con valores menores de tamaño relativo del cerebro, equivalentes a aquellos observados en Lemures (Lemuriformes; Isler et al., 2008; Montgomery et al., 2011).
El aumento del tamaño relativo del cerebro en diferentes clados de los Primates da una oportunidad para estudiar a escala macroevolutiva, en qué medida existió una convergencia en la evolución de la morfología craneana externa de los Primates y qué cambios son particulares del linaje humano. Sin embargo, en qué medida el aumento del cerebro, de manera independiente en varios clados de Primates, está asociado con una convergencia en la morfología externa del cráneo, no ha sido explorado sistemáticamente. En este trabajo estudiamos los cambios globales en la morfología craneofacial entre especies que incluyen los extremos de variación de Primates de los infraórdenes Lemuriformes, Platyrrhini y Catarrhini y su relación con los cambios en el tamaño del cerebro empleando medidas lineales craneofuncionales (Pucciarelli, 2008; Pucciarelli et al., 2010). En particular esperamos que los cambios principales en proporciones de medidas craneofuncionales se asocien a los cambios en el volumen del cerebro de las especies de Primates analizadas. Las medidas craneofuncionales son particularmente relevantes para este fin debido a que asumen que el cráneo está compuesto por unidades craneales relativamente independientes o módulos (e.g., neurocráneo) y que su crecimiento y diferenciación no son procesos uniformes (Pucciarelli et al., 2010). Asimismo, para explorar los cambios globales en la morfología craneofacial en Primates, así como su asociación con el tamaño del cerebro, medimos especies de Primates con valores extremos de tamaño cerebral (Isler et al., 2008), estimamos una crono-filogenia molecular (Drummond et al., 2006) y empleamos morfometría multivariada y método filogenético comparativo (Rohlf, 2001). Esto en conjunto genera una aproximación novedosa para comprender las particularidades evolutivas de nuestra especie.
Material y métodos
Muestras
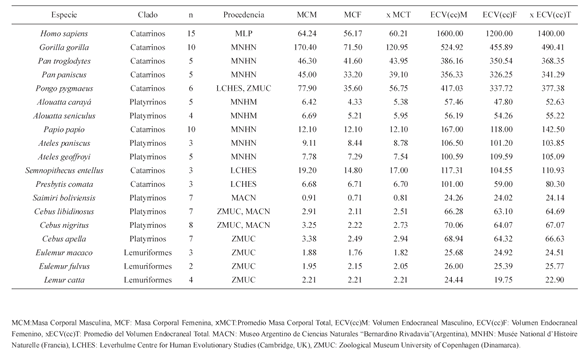
Para este estudio se analizaron cráneos de 124 individuos pertenecientes a 19 especies de primates (Infraórdenes Platirrhyni, Catarrhini y Lemuriformes). Los individuos analizados corresponden a la categoría adulto. La inclusión de cada individuo en esta categoría se realizó con base en el cierre de la sutura esfeno-basilar y la erupción del tercer molar. Las muestras utilizadas provinieron del Museo Argentino de Ciencias Naturales "Bernardino Rivadavia" (MACN, Buenos Aires, Argentina), del Musée National d'Histoire Naturelle (MNHN, París, Francia), Leverhulme Centre for Human Evolutionary Studies (LCHES, University of Cambridge, Cambridge, UK) y Zoological Museum University of Copenhagen (ZMUC, Copenhagen, Dinamarca). Más información acerca de las muestras utilizadas se presenta en la Tabla 1.
Estimación de las relaciones filogenéticas
Con el fin de considerar la estructura filogenética de las especies estudiadas en los subsiguientes análisis comparativos, se estimó un árbol crono-filogenético. Para las 19 especies de primates de la muestra se obtuvieron secuencias de 16 genes nucleares publicadas por Perelman et al. (2011) y 4 mitocondriales disponibles en GenBank (Tabla 2; Apéndice Online 1). Las secuencias para cada gen fueron alineadas utilizando ClustalW, examinadas y corregidas manualmente cuando fue necesario con el software BioEdit 7.0.0 (Hall, 2004).
Tabla 2. Secuencias moleculares usadas para Inferir el árbol crono-filogenético
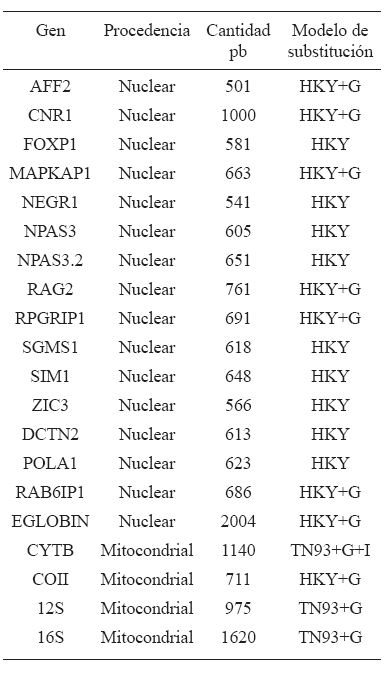
Los análisis filogenéticos moleculares se realizaron utilizando el método de Inferencia Bayesiana (BI; Drummond et al., 2006). Se llevaron a cabo análisis basados en una matriz molecular combinada con un total de 16.198 pares de bases (pb; Apéndice Online 1). Cuando no se contaba con la secuencia de un gen determinado para una especie en particular esta de Proceso de Yule (Drummond et al., 2006). Se usaron tres constrains temporales (Benton et al., 2009): a) Platyrrhini Offset 26 Ma, Log- Mean 1.5 y LogStdev 0.5, que da un intervalo entre 27 y 37 Ma; b) Catarrhini Offset 23.5 Ma, LogMean 1.5 y LogStdev 0.5, que da un intervalo entre 25 y 35 Ma; c) Root Offset 55.8 Ma, Initial value 60 Ma, LogMean 1.5 y LogStdev 0.5, que da un intervalo entre 57 y 67 Ma. El método de Inferencia Bayesiana se implementó usando el programa BEAST v1.6.1 (Drummond y Rambaut, 2007). Debido a que BEAST co-estima la topología y el tiempo de divergencia, no requiere el establecimiento de un grupo externo a priori. La convergencia de los estadísticos fue determinada usando Tracer 1.5 (Rambaut y Drummond, 2007) y el árbol filogenético fue generado excluyendo los primeros 2.500 árboles usando TreeAnnotator v1.6.1 (Drummond y Rambaut 2007). FigTree v1.4 fue usado para plotear el árbol consenso.
Análisis morfométricos
Sobre los cráneos se registraron 30 variables craneométricas (i.e., distancias lineales entre puntos anatómicos; Apéndice Online 2) que describen diferentes componentes o módulos del cráneo. Estas variables fueron definidas con base en la teoría craneofuncional (Pucciarelli, 2008; Pucciarelli et al., 2010). La teoría craneofuncional está inspirada en la teoría de la función independiente de los módulos o componentes craneales en mamíferos de van der Klaauw (1948-1952), así como también en los estudios de Moss y Young (1960). La craneología funcional asume que el cráneo está compuesto por módulos y por lo tanto permite medir los mismos de manera independiente (Pucciarelli et al., 2010). Para evitar el error interobservador, las medidas fueron tomadas por un solo investigador (HMP) y el error intraobservador fue reducido al mínimo (Pucciarelli et al., 2006; Pucciarelli 2008). Las medidas originales fueron usadas para calcular variables de forma de Mosimann mediante la división de cada variable por la media geométrica de todas las ellas (MG; media aritmética de las variables originales en escala logarítmica; Jungers et al., 1995). La lógica fundamental de las variables de forma de Mosimann es que son expresiones geométricas de la proporción, una medida de forma que es adimensional y refleja el tamaño relativo de un rasgo (Corruccini, 1995).
Posteriormente, se realizó un análisis de componentes principales (ACP) basado en una matriz de covarianza de las variables de forma de Mosimann. Éste análisis describe las tendencias de variación principales en la forma del cráneo entre las muestras, pero los valores de los primeros componentes principales pueden interpretarse como una representación de una matriz de distancia Euclideana entre muestras (Thalib et al., 1999).
Finalmente, con fines comparativos, se recolectaron datos de masa corporal (MC) y volumen endocraneal (VEC), como una medida indirecta del tamaño del cerebro y se calculó el volumen endocraneal relativo (VEC/MC). Estas variables pueden representar dimensiones importantes para entender la divergencia y convergencia en la forma del cráneo en primates del Viejo y Nuevo Mundo (Fleagle, 1999; Marroig y Cheverud, 2001, 2005; Wildman et al., 2009).
Los datos de Masa Corporal (MC; expresada en Kg) fueron obtenidos para cada una de las 19 especies a partir de Smith y Jungers (1997). A su vez, la información correspondiente al volumen endocraneal (VEC; expresado en cc) fue obtenida de Isler et al. (2008). Estas dos variables han sido ampliamente utilizadas en estudios de Primates y miden de manera independiente los cambios globales en el tamaño de la especie, así como las diferencias en el crecimiento del cerebro. Estos constituyen los dos procesos del desarrollo más importantes en la diferenciación craneofacial de primates y otros mamíferos (Hallgrímsson y Lieberman, 2008).
Análisis comparativo
En primer lugar, se calculó la concordancia entre la estructura filogenética y las variables morfométricas empleando la estadística K de Blomberg et al. (2003). Esta estadística mide la cantidad de ajuste de los cambios morfométricos relativo a lo esperado bajo un modelo de cambio aleatorio (modelo Browniano) a lo largo de la filogenia. Los valores de K cercanos a 0 indican falta de ajuste, mientras que los cercanos a 1 son esperados cuando los cambios se ajustan al modelo Browniano (Blomberg et al., 2003). Valores más altos pueden surgir cuando existe un ajuste mayor que el esperado por cambio aleatorio (Losos, 2008). La significación de K fue testeada mediante 9.999 permutaciones.
Para explorar la relación entre la variación en la forma craneal y las variables independientes consideradas -MC, VEC y VEC/MC- se ajustó un modelo lineal generalizado filogenético (MLGF; Rohlf, 2001). Para tomar en cuenta la falta de independencia entre las especies estudiadas debido a la historia evolutiva compartida, el MLGF asume que el término del error del modelo tiene una matriz de covarianza derivada del árbol filogenético estimado con BEAST. La significación estadística del modelo generalizado fue calculada con una prueba de F.
Los análisis estadísticos fueron efectuados usando los paquetes ape, caper y picante del programa R 2.13.0 (R-Development Core Team, 2012).
Resultados y discusión
Los análisis dieron como resultado un árbol crono-filogenético que es mostrado en la Figura 1. Específicamente, los Lemuriformes son el grupo más externo, mientras que las otras especies están en dos clados principales, Platyrrhini y Catarrhini. Dentro de estos clados se puede observar a Saimiri como grupo hermano de Cebus y Alouatta junto con Ateles. Asimismo, Semnopithecus, Papio y Presbytis conforman un clado dentro de los Catarrhini, mientras que en el clado restante Homo es la especie hermana de Pan (Fig. 1). Este árbol sugiere un origen para el orden Platyrrhini de alrededor de 28.5 millones de años, mientras que el origen de Catarrhini estaría alrededor de los 30.5 millones de años. La separación de estos dos clados con los Lemuriformes se habría dado hace unos 61 millones de años. Las relaciones filogenéticas y tiempos de divergencia obtenidos en este trabajo coinciden en general con los postulados por trabajos previos para el Orden Primates (Perelman et al., 2011; Wilkinson et al., 2011; dos Reis et al., 2012), sugiriendo que las mismas pueden ser usadas con confianza en los análisis estadísticos tendientes a comprender la diversificación del grupo.
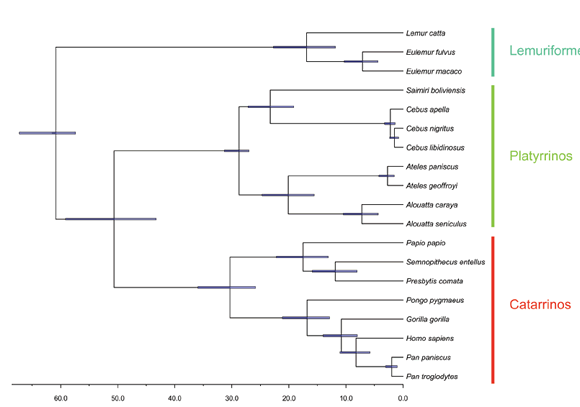
Fig. 1. Árbol crono-filogenético de las 19 especies de primates estudiadas, basado en secuencias de 20 genes nucleares y mitocondriales y utilizando el método de Inferencia Bayesiana. Todos los nodos tienen una probabilidad a posteriori igual a 1. Las barras horizontales en cada nodo representan el intervalo del 95% de credibilidad a posteriori para las estimaciones del tiempo de divergencia.
En el análisis de componentes principales de las variables de forma de Mosimann se puede ver una clara separación entre las especies de Lemuriformes y algunas especies de Platyrrhini (i.e., las especies de Alouatta) y Catarrhini (e.g. las especies de Papio, Pongo, Pan y Gorilla); esta separación se da de manera más pronunciada en el CP 2, que explica un 16.31% de la variación total (Fig. 2). A su vez, se puede observar que existe una relativa superposición en la distribución en el espacio de forma de Homo sapiens, Semnopithecus y Presbytis con los géneros Ateles, Saimiri y Cebus de Platyrrhini. En particular, Homo sapiens se encuentra más cercano a lo largo del CP 1 (43.34%) a los centroides de Saimiri y Ateles (Fig. 2). Por otro lado, los Lemuriformes se encuentran cercanos a las especies de Alouatta, en el espacio de los 2 primeros CPs. Las variables más influyentes a lo largo del CP 1 fueron la altura neurocraneana anterior (HNA), la longitud masticatoria (LM), la longitud neurocraneana posterior (LNP), el ancho facial (AF), el ancho neurocraneano anterior (ANA), el ancho neurocraneano (AN), la longitud respiratoria (LR), la longitud alveolar (LA), la altura neurocraneana (HN) y la longitud facial (LF). Mientras que las variables más importantes a lo largo del CP 2 fueron el ancho óptico (AO), la altura respiratoria (HR), la longitud óptica (LO), la altura óptica (HO) y la longitud neurocraneana (LN) (Tabla 3).

Fig. 2. Componentes principales (CP) obtenidos con la matriz de covarianza de las variables de forma de Mosimann
Tabla 3. Carga de los dos primeros componentes principales de las variables de Mossimman
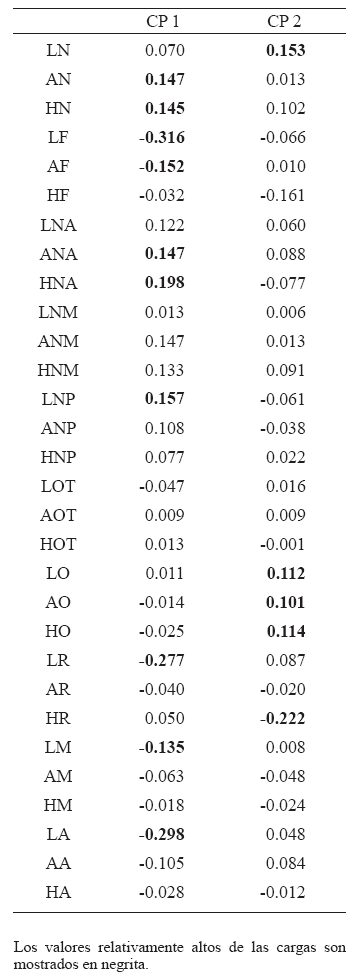
La variación observada en el segundo CP puede asociarse mayoritariamente con la estructura filogenética de los datos ya que para dicho CP obtuvimos un valor del estadístico K (Blomberg et al., 2003) muy cercano a 1 (0.906), que indica cambio siguiendo un modelo evolutivo browniano (Losos, 2008). El valor del estadístico K para el primer CP fue de 0.484, corroborando la falta de estructura filogenética y sugiriendo la existencia de convergencia evolutiva (Losos, 2008; Wiens et al., 2010; Tabla 4). Los valores de K para MC y VEC son significativamente más altos que aquellos observados en las variables de forma (Tabla 4), sugiriendo una fuerte estructura filogenética. Este patrón de covariación entre los CPs y el árbol filogenético estimado con datos moleculares sugiere que existe una mayor estructura filogenética en el CP 2 que se asocia a variables de la base del cráneo (Tabla 3), como ha sido señalado por trabajos previos efectuados a otras escalas filogenéticas en Primates y empleando otras variables morfométricas (Loockwod et al., 2004). Sin embargo, características globales de la forma del esqueleto facial y la bóveda del cráneo parecen no estar estructuradas filogenéticamente y muestran convergencia entre clados con una historia filogenética independiente (Fig. 2).
Tabla 4. Valores de K para las variables morfológicas estudiadas

Por lo tanto es posible señalar que mientras que algunas de las especies de Primates más relacionadas filogenéticamente tienden a ser más similares que lo esperado por azar, nuestros resultados de forma sugieren que el patrón principal de variación en la morfología externa del cráneo (i.e., la variación en el CP 1; Fig. 2) no está estrechamente relacionada con las relaciones filogenéticas entre las especies estudiadas. Este patrón de cambio es generalmente esperado para estas escalas evolutivas en dos escenarios diferentes, cuando existen radiaciones adaptativas o ante procesos de convergencia ecológica (Losos, 2008; Wiens et al., 2010; Moen et al., 2013); aunque también podría ser producto de la retención de variación ancestral en algunos miembros de un clado y no en otros. Debido a que el patrón de variación morfológica descrito por los CPs para Homo, Saimiri y Ateles no es ancestral en Antropoidea y que las especies que muestran mayor similitud morfométrica son parte de dos radiaciones independientes (Delson y Rosenberger, 1984), la existencia de convergencia podría ser el proceso ecológico responsable de la variación observada. Este resultado sugiere la existencia de factores intrínsecos o extrínsecos que modelaron la evolución de la morfología craneana entre las especies estudiadas en una dirección diferente a aquella esperada por cambio aleatorio.
Los resultados de la regresión filogenética (Tabla 5) sugieren que la variación en el tamaño relativo del cerebro es un factor intrínseco fundamental para comprender los patrones globales de cambio en la forma del cráneo de las especies de Primates estudiadas. Por lo tanto, estos resultados dan apoyo a nuestra expectativa, sugiriendo que los cambios principales en proporciones de medidas craneofuncionales se asocian a los cambios en el volumen del cerebro entre las especies de Primates. La importancia de este factor ha sido señalada para explicar los procesos de cambio morfológico a escala ontogenética (ver revisión en Hallgrímsson y Lieberman, 2008) pero no ha sido explorada de manera sistemática a escala macroevolutiva para el orden Primates. Estudios previos han sugerido que este factor afectó principalmente la evolución en la morfología de los humanos modernos (e.g., González-José et al., 2008; Hallgrímsson y Lieberman, 2008; Isler et al., 2008). Sin embargo, se podría sugerir que el mismo factor es importante para comprender los cambios morfológicos entre varias especies del orden; particularmente, que las re-configuraciones de la morfología externa del cráneo de los Primates han estado asociadas de manera significativa con los cambios en el tamaño relativo del cerebro. Estos resultados han podido ser alcanzados por las ventajas analíticas que ofrece la craneología funcional (Pucciarelli, 2008), combinada con el empleo de los métodos filogenéticos comparativos, una aproximación que no había sido utilizada hasta el presente para explorar este problema.
Tabla 5. Resultados del modelo de regresión filogenética

¿Cuáles son los factores externos -e.g. ecológicos- responsables de la convergencia en la morfología del cráneo observada en los análisis realizados en el presente trabajo? todavía no es comprendido. Particularmente, en los diferentes clados estudiados existen tendencias a la complejización en la organización social en aquellos géneros con aumento relativo en el tamaño del cerebro (Fleagle, 1999). Sin embargo, la escala de esta complejidad no es comparable entre Homo sapiens y las otras especies. Asimismo, es necesario explorar cuáles son los procesos que durante el desarrollo actúan en las diferentes especies estudiadas y que son responsables de los cambios observados a escala macroevolutiva. Futuros estudios que amplíen el muestreo de especies son necesarios para abordar este problema y comprender cuáles son los factores ecológicos y los procesos del desarrollo que subyacen a la convergencia en el tamaño relativo del cerebro y en la morfología craneal en los diferentes clados de Primates o si las mismas son sólo producto de cambios aleatorios.
Agradecimientos
Los autores desean agradecer a los curadores de las colecciones donde las muestras estudiadas se encuentran depositadas. También queremos agradecer al Editor Asociado de la RAAB y a dos revisores anónimos cuyas sugerencias ayudaron a mejorar este trabajo. Este trabajo fue realizado en el marco del proyecto PICT-1-B-2011-0307: Historia evolutiva y patrones de diversificación fenotípica en monos del Nuevo Mundo.
Literatura citada
1. Allen KL, Kay RF. 2012. Dietary quality and encephalization in Platyrrhine Primates. Proc R Soc B 279:715-721. [ Links ]
2. Barton RA. 2006. Primate brain evolution: integrating comparative, neurophysiological, and ethological data. Evolutionary Anthropology 15:224-236. [ Links ]
3. Bastir M, Rosas A, Stringer C, Cuétara JM, Kruszynski R, Weber GW, Ross CF, Ravosa MJ. 2010. Effects of brain and facial size on basicranial form in human and primate evolution. J Hum Evol 58:424-431. [ Links ]
4. Benton MJ, Donoghue PCJ, Asher RJ. 2009. Calibrating and constraining molecular clocks. En: Hedges SB, Kumar S. editores. The timetree of life. Oxford: Oxford University Press. p 35-86.
5. Blomberg SP, Garland T Jr, Ives AR. 2003. Testing for phylogenetic signal in comparative data: behavioral traits are more labile. Evolution 57:171-745. [ Links ]
6. Bookstein FL, Gunz P, Mitteroecker P, Prossinger H, Schaefer K, Seidler H. 2003. Cranial integration in Homo: singular warps analysis of the midsagittal plane in ontogeny and evolution. J Hum Evol 44:167-187. [ Links ]
7. Corruccini RS. 1995. Of ratios and rationality. Am J Phys Anthropol 96:189-191. [ Links ]
8. de Queiroz A, Gatesy J. 2007. The supermatrix approach to systematics. Trends Ecol Evol 22(1):34-41.
9. Delson E, Rosenberger AL. 1984. Are there any anthropoid primate "living fossils"? En: Eldredge N, Stanley S, editores. Casebook on living fossils. New York: Fischer Publishers. p 50-61.
10. dos Reis M, Inoue J, Hasegawa M, Asher RJ, Donoghue PCJ, Yang Z. 2012. Phylogenomic datasets provide both precision and accuracy in estimating the timescale of placental mammal phylogeny. Proc R Soc B 279:3491-3500. [ Links ]
11. Drummond AJ, Rambaut A. 2007. BEAST: Bayesian evolutionary analysis by sampling trees. BMC Evol Biol 7:214. [ Links ]
12. Drummond AJ, Ho SYW, Phillips MJ, Rambaut A. 2006. Relaxed phylogenetics and dating with confidence. PLoS Biol 4(5):e88.
13. Fleagle JG. 1999. Primate adaptation and evolution. New York: Academic Press.
14. González-José R, Escapa I, Neves WA, Cúneo R, Pucciarelli HM. 2008. Cladistic analysis of continuous modularized traits provides phylogenetic signals in Homo evolution. Nature 453:775-779. [ Links ]
15. Hall T. 2004. BioEdit 7.0.0. Disponible en: http://www.mbio.ncsu.edu/bioedit/bioedit.html.
16. Hallgrímsson B, Lieberman DE. 2008. Mouse models and the evolutionary developmental biology of the skull. Integrative and Comparative Biology 48(3):373-384.
17. Hartwig W, Rosenberger AL, Norconk MA, Owl MY. 2011. Relative brain size, gut size, and evolution in New World monkeys. Anat Rec 294:2207-2221. [ Links ]
18. Isler K, Kirk EC, Miller JMA, Albrecht GA, Gelvin BR, Martin RD. 2008. Endocranial volumes of primate species: scaling analyses using a comprehensive and reliable data set. J Human Evol 55:967-978. [ Links ]
19. Jungers WL, Falsetti A, Wall CE. 1995. Shape, relative size and size-adjustments in morphometrics. Yrbk Phys Anthropol 38:137-161. [ Links ]
20. Lockwood CA, Kimbel WH, Lynch JM. 2004. Morphometrics and hominoid phylogeny: support for a chimpanzee-human clade and differentiation among great ape subspecies. Proc Natl Acad Sci USA 101:4356-4360. [ Links ]
21. Losos JB. 2008. Phylogenetic niche conservatism, phylogenetic signal and the relationship between phylogenetic relatedness and ecological similarity among species. Ecology Letters 11:995-1007. [ Links ]
22. Marroig G, Cheverud JM. 2001. A comparison of phenotypic variation and covariation patterns and the role of phylogeny, ecology and ontogeny during cranial evolution of New World monkeys. Evolution 55:2576-2600. [ Links ]
23. Marroig G, Cheverud JM. 2005. Size as a line of least evolutionary resistance: diet and adaptive morphological radiation in New World monkeys. Evolution 59:1128-1142. [ Links ]
24. Mitteroecker P, Gunz P, Bernhard M, Schaefer K, Bookstein FL. 2004. Comparison of cranial ontogenetic trajectories among hominoids. J Hum Evol 46:679-698. [ Links ]
25. Moen DS, Irschick DJ, Wiens JJ. 2013. Evolutionary conservatism and convergence both lead to striking similarity in ecology, morphology and performance across continents in frogs. Proc R Soc B 280:20132156. [ Links ]
26. Montgomery SB, Lappalainen T, Gutierrez-Arcelus M, Dermitzakis ET. 2011. Rare and common regulatory variation in population-scale sequenced human genomes. PLoS Genet 7(7):e1002144.
27. Moss ML, Young RW. 1960. A functional approach to craniology. Am J Phys Anthropol 18:281-292. [ Links ]
28. Perelman P, Johnson WE, Roos C, Seuánez HN, Horvath JE, Moreira MAM, Kessing B, Pontius J, Roelke M, Rumpler Y, Schneider MPC, Silva A, O'Brien SJO, Pecon-Slattery J. 2011. A molecular phylogeny of living primates. PLoS Genet 7(3):e1001342.
29. Perez SI, Klaczko J, dos Reis SF. 2012. Species tree estimation for a deep phylogenetic divergence in the New World monkeys (Primates: Platyrrhini). Mol Phylogenet Evol 65:621-630. [ Links ]
30. Pucciarelli HM. 2008. Evolución y diversificación biológica humana desde la perspectiva craneofuncional. México: Universidad Autónoma de México, Instituto de Investigaciones Antropológicas, ENAH.
31. Pucciarelli HM, Ramírez-Rozzi FV, Muñe MC, Sardi ML. 2006. Variation of functional cranial components in six Anthropoidea species. Zoology (Jena) 109(3):231-243.
32. Pucciarelli HM, Perez SI, Politis GG. 2010. Early holocene human remains from the Argentinean Pampas: additional evidence for distinctive cranial morphology of early South Americans. Am J Phys Anthropol 143:298-305. [ Links ]
33. R-Development Core Team. 2012. R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Available at: http://www.R-project.org
34. Rambaut A, Drummond AJ. 2007. Tracer v1.5 software. <http://www.beast.bio.ed.ac.uk/Tracer>.
35. Rohlf FJ. 2001. Comparative methods for the analysis of continuous variables: geometric interpretations. Evolution 55:2143-2160. [ Links ]
36. Ross C, Henneberg M. 1995. Basicranial flexion, relative brain size, and facial Kyphosis in Homo sapiens and some fossil hominids. Am J Phys Anthropol 98:575- 593. [ Links ]
37. Smith RJ, Jungers WL. 1997. Body mass in comparative primatology. J Hum Evol 32:523-559. [ Links ]
38. Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. 2011. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution 28:2731-2739. [ Links ]
39. Thalib L, Kitching RL, Bhatti MI. 1999. Principal component analysis for grouped data: a case study. Environmetrics 10:565-574. [ Links ]
40. van der Klaauw CJ. 1948-1952. Size and position of the functional components of the skull. Archaeol Neerl Zool 9:1-559. [ Links ]
41. Wiens JJ, Ackerly DD, Allen AP, Anacker BL, Buckley LB, Cornell HV, Damschen EI, Jonathan Davies T, Grytnes JA, Harrison SP, Hawkins BA, Holt RD, McCain CM, Stephens PR. 2010. Niche conservatism as an emerging principle in ecology and conservation biology. Ecol Lett 13:1310-1324. [ Links ]
42. Wildman DE, Jameson NM, Opazo JC, Yi SV. 2009. A fully resolved genus level phylogeny of neotropical primates (Platyrrhini). Mol Phylogenet Evol 53:695-702. [ Links ]
43. Wilkinson RD, Steiper ME, Soligo C, Martin RD, Yang Z, Tavaré S. 2011. Dating Primate divergences through an integrated analysis of palaeontological and molecular data. Syst Biol 60:16-31. [ Links ]