Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista argentina de antropología biológica
versão On-line ISSN 1514-7991
Rev Arg Antrop Biol vol.20 no.1 La Plata jan. 2018
http://dx.doi.org/10.17139/raab.2018.0020.01.02
doi:10.17139/raab.2018.0020.01.02
TRABAJOS ORIGINALES
Comparación del daño cromosómico provocado in vitro por dos formas de administración del tratamiento preventivo de la anemia ferropénica
Comparison of in vitro chromosome damage caused by two ferrous sulphate methods of administration to prevent iron deficiency anemia
Rocío Celeste Gambaro 1; Analía Seoane 1 y Gisel Padula 1, 2 *
1 Instituto de Genética Veterinaria (IGEVET), Centro Científico y Tecnológico La Plata (CCT), Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). Facultad de Ciencias Veterinarias. UNLP. La Plata. Argentina
2 Facultad de Ciencias Naturales y Museo. Universidad Nacional de La Plata. La Plata. Argentina
Financiamiento: CONICET (PIP N° 0187). Universidad Nacional de La Plata (11/V212).
* Correspondencia a: Gisel Padula. IGEVET. Facultad de Ciencias Veterinarias. Universidad Nacional de La Plata. 118 y 60 s/n. 1900 La Plata. Argentina. E-mail: giselpadula@yahoo.com.ar
Recibido: 12 Julio 2016
Aceptado: 5 Junio 2017
RESUMEN
La deficiencia de hierro es la carencia nutricional más prevalente y la principal causa de anemia a escala mundial. Los grupos poblacionales con mayor riesgo son los niños de entre 6 y 24 meses de edad y las mujeres embarazadas. En los niños, la causa más común es el aumento del requerimiento ferroso, relacionado con la mayor velocidad de crecimiento. La Sociedad Argentina de Pediatría recomienda, como tratamiento preventivo de la anemia, la suplementación diaria con sulfato ferroso. Sin embargo, a partir de la década del 90, se ha planteado como tratamiento alternativo la suplementación con una dosis semanal única, la cual provocaría menos efectos adversos. En el presente trabajo se propone analizar el daño genómico inducido por ambos tipos de administración del hierro en linfocitos humanos cultivados in vitro. Los linfocitos fueron cultivados durante 7 días en 4 frascos: 1- Control negativo; 2- Tratamiento diario (0,13mg SO4 Fe/día); 3- Tratamiento semanal (0,55mg SO4Fe/semanal); 4- Control positivo (bleomicina). El daño cromosómico provocado por el exceso de hierro se determinó a través del ensayo de micronúcleos por bloqueo de la citocinesis y se estableció el índice mitótico, indicador de crecimiento celular. Las diferencias fueron evaluadas estadísticamente por ANOVA Simple. La frecuencia de micronúcleos resultó significativamente aumentada para el tratamiento diario respecto del semanal y del control negativo. Los resultados se corresponden con los esperados, en los cultivos con tratamiento semanal se observa un menor daño cromosómico, lo cual puede deberse a una menor producción de radicales libres del oxígeno. Rev Arg Antrop Biol 20(1), 2018. doi:10.17139/raab.2018.0020.01.02
PALABRAS CLAVE: Sulfato ferroso; Daño genómico; Prevención
ABSTRACT
Iron deficiency is the most prevalent nutritional deficiency, and the main cause of anemia worldwide. Children between 6 and 24 months of age and pregnant women are among the highest-risk groups. In the case of children, the most common cause of iron deficiency is an increase in iron requirement, directly associated with higher growth rates. The Argentine Society of Pediatrics recommends daily supplementation with ferrous sulphate to prevent anemia. However, an alternative treatment with a single weekly dose was proposed in the 90s, since it might produce fewer adverse effects. The aim of this work was to analyze the genomic damage caused by both ferrous sulphate preventive treatments. Human lymphocytes were cultured in vitro for seven days in four flasks: 1) negative control, 2) daily treatment (0.13mg SO4Fe/day), 3) weekly treatment (0.55mg SO4Fe/week), and 4) positive control (bleomycin). Chromosomal damage caused by excess iron was determined by the micronucleus test, and the mitotic index (cell growth indicator) was established. Differences were statistically evaluated by one-way ANOVA. Micronuclei frequency was significantly higher in the daily treatment group, as compared with the weekly treatment group and the negative control (pâ¤0.05). As expected, our results showed decreased chromosome damage in cultures subjected to the weekly treatment, probably due to a decreased oxygen free radical production. Rev Arg Antrop Biol 20(1), 2018. doi:10.17139/raab.2018.0020.01.02
KEYWORDS: Ferrous sulphate; Genomic damage; Prevention
La deficiencia de hierro es la carencia nutricional más prevalente y la principal causa de anemia a escala mundial (International Nutritional Anemia Consultive Group, 2003). En nuestro país, en general y en la provincia de Buenos Aires en particular, numerosos estudios demuestran que la prevalencia de anemia y deficiencia de hierro son muy elevadas (González et al., 2006; Malpeli et al., 2006; ENNyS, 2007; González et al., 2007; Apezteguía et al., 2008).
Los grupos poblacionales con mayor riesgo de sufrir dicha carencia son los niños de entre 6 y 24 meses de edad y las mujeres embarazadas. En los niños, la causa más común es el aumento del requerimiento ferroso, relacionado con la mayor velocidad de crecimiento (Clark, 2008).
La anemia por carencia de hierro (ADH) es una condición patológica, en la cual no hay suficiente mineral para la síntesis de proteínas y enzimas que contienen hierro, tales como hemoglobina, mioglobina, citocromos, catalasas y varias peroxidasas (Aksu et al., 2010). Se han descrito otras manifestaciones no hematológicas de la deficiencia de hierro como disminución de la capacidad de trabajo físico y de la actividad motora espontánea, alteraciones de la inmunidad celular y de la capacidad bactericida de los neutrófilos, disminución de la termogénesis, alteraciones funcionales e histológicas del tubo digestivo, falla en la movilización de la vitamina A hepática, disminución de la velocidad de crecimiento, alteraciones conductuales y del desarrollo mental y motor, velocidad de conducción más lenta de los sistemas sensoriales auditivo y visual y reducción del tono vagal, entre otros (Olivares et al., 2003; Swanson, 2003; Beard, 2008). La deficiencia de hierro, al igual que la de otros micronutrientes, tiene un mayor impacto cuando ocurre en etapas tempranas de la vida, llevando a un retardo crónico de crecimiento, bajas capacidades cognitivas, letargo y pobre atención (Rivera et al., 2003, González et al., 2007; Algarín et al., 2003).
Esta deficiencia puede prevenirse mediante el consumo de una dieta adecuada, la fortificación de los alimentos con hierro y la suplementación con hierro medicinal. Ninguna de estas medidas es excluyente. En cuanto a la suplementación con hierro medicinal, existe un consenso científico internacional avalado por la OMS, por el cual la suplementación universal farmacológica de lactantes y embarazadas es una estrategia prioritaria cuando la prevalencia en un grupo particular es alta, mayor a 40% (UNICEF/UNU/WHO, 2001; Lynch et al., 2007).
En este sentido, en el ámbito local, la recomendación actual de la Sociedad Argentina de Pediatría (2001/2009) es la suplementación diaria con sulfato ferroso. Sin embargo, a partir de los años noventa han aparecido publicaciones que demuestran que la eficacia de una dosis semanal de hierro es comparable a la de una dosis diaria (Viteri, 1997). Se ha planteado que con la administración diaria de hierro vía oral, la absorción se ve notablemente reducida días después del inicio del tratamiento, mientras que con dosis intermitentes los niveles de absorción permanecen elevados. La dosis diaria produciría una saturación de los mecanismos de transporte que se correlacionan con síntomas de intolerancia. La dosis semanal permitiría optimizar la absorción a través de los mecanismos de transporte y disminuir, así, los síntomas de intolerancia. La prevención semanal cuenta con otras ventajas, tales como mayor adherencia y cumplimiento y menores efectos adversos (Gross y Schultink, 1994; Cook y Reddy, 1995; Liu et al., 1995; Schultink et al., 1995; Viteri, 1997; Eickmann et al., 2008).
Asimismo, el tratamiento diario preventivo de la deficiencia de hierro puede llevar, como consecuencia no deseada, a la producción de un cuadro de sobrecarga tisular de dicho mineral. El hierro participa en las reacciones de óxido-reducción de la célula y en éstas, se generan especies reactivas del oxígeno (ROS), las cuales pueden ocasionar daño en las proteínas, en los lípidos y en el ADN (Brody, 1994; Jomova y Valko, 2011; Lin et al., 2011; Prá et al., 2012). Este daño puede ser permanente y provocar alteraciones estructurales y funcionales (Aksu et al., 2010). Concentraciones elevadas de hierro en plasma pueden amplificar los efectos de los radicales libres (Ashour et al., 1999). Como consecuencia de lo antedicho, las células han desarrollado diversos mecanismos para reducir la toxicidad de los iones de hierro, los cuales incluyen la regulación del transporte del hierro a través de las membranas y la producción de enzimas que eliminan ROS. Sin embargo, un desbalance en estos sistemas, causado por el exceso de hierro, incrementaría la susceptibilidad al daño oxidativo, resultando en un aumento de las mutaciones, pudiendo llevar, entre otros, al desarrollo de procesos neoplásicos (Stevens et al., 1988), diabetes (Salonen et al., 1998), enfermedades cardiovasculares (Salonen et al., 1992) y enfermedades neurológicas (Rogerio Meneghini de Freitas, 2001).
En trabajos donde se evaluó específicamente el efecto del tratamiento terapéutico de la anemia con hierro sobre la oxidación del ADN en niños con ADH, se observó un aumento significativo de fracturas del ADN y bases oxidadas respecto de niños sanos (Aksu et al., 2010). En un trabajo reciente, se demostró que el hierro era uno de los metales de transición que más inducen a la formación de 8-oxo-7,8 dihidro-guanina (8-OHdG), provocando más roturas de doble cadena que de simple cadena (Prá et al., 2012). En ratones a los que se les suministró un tratamiento con sulfato ferroso se observó, en médula ósea, un aumento de la frecuencia de micronúcleos (Mni) (Prá et al., 2008).
A raíz de lo anteriormente expuesto, el objetivo del presente trabajo es analizar in vitro la frecuencia de daño cromosómico provocado por la suplementación de sulfato ferroso en sus dos formas de administración para la prevención de la anemia, diario y semanal, a través del ensayo de micronúcleos por bloqueo de la citocinesis (CBMN).
Metodología
Diseño experimental
Para evaluar el daño genómico provocado por el exceso de hierro, se desarrolló un protocolo in vitro con cultivos celulares. Se establecieron 4 tratamientos:
1-Control negativo: sin tratar
2-Control positivo: 1µg/ml de bleomicina (Gador S.A., Buenos Aires, Argentina)
3-Tratamiento diario: suplementación con 0,14mg de sulfato ferroso (Ferdrómaco Pediátrico, laboratorios Andrómaco, Buenos Aires, Argentina)
4-Tratamiento semanal: suplementación con 0,55mg de sulfato ferroso (Ferdrómaco Pediátrico, laboratorios Andrómaco, Buenos Aires, Argentina)
Las concentraciones para simular in vitro los efectos de ambos tipos de tratamientos preventivos (cultivos 3 y 4), se calcularon utilizando los valores recomendados por la Sociedad Argentina de Pediatría (tratamiento preventivo diario: 1mg/kg/día; tratamiento preventivo semanal: 4mg/kg/semana) para 10ml de medio de cultivo. Las mediciones sobre la concentración exacta de hierro se realizaron en la Cátedra de Fisiología de la Facultad de Ciencias Veterinarias (UNLP).
Cultivo de sangre entera
Luego del consentimiento informado, se obtuvo una muestra de sangre de donantes sanos, la cual se recogió por punción venosa con jeringa heparinizada y se cultivó en frascos falcon utilizando como medio base al HAM F12 (Sigma-Aldrich, St. Louis, MO, USA), sin suero fetal bovino. Se adicionaron antibióticos (60UI de Penicilina y 50µg/ml de Estreptomicina) (Bagó Laboratorios, Buenos Aires, Argentina), para evitar el crecimiento bacteriano. La estimulación de los linfocitos se logró con 100ug/ml de Fitohemaglutinina (Gibco Thermo Fisher Scientific, Buenos Aires, Argentina). Las muestras se cultivaron a 37º C en 5% de CO2, durante 7 días (Fenech 2007, 2014, Fenech et al., 2011). Dado que las directrices para el análisis de micronúcleos (MacGregor et al. 1987) no establecen un número mínimo de donantes sanos para los protocolos in vitro y siendo cinco el número mínimo para los protocolos in vivo , en el presente trabajo se optó por realizar un pool génico proveniente de 10 individuos de sexo femenino de entre 20 y 40 años de edad.
Para evaluar el efecto del hierro sobre los cromosomas se realizó el ensayo de micronúcleos por bloqueo de la citocinesis (CBMN), indicador de daño cromosómico y a su vez, se calculó el índice mitótico, indicador de crecimiento celular.
Se realizaron 3 tandas experimentales para permitir una estimación precisa de la variación experimental.
Índice mitótico
A través del índice mitótico (IM) es posible determinar la velocidad del ciclo celular. Dos horas antes de finalizar los cultivos se adicionó 100ug/ml de colchicina (Sigma-Aldrich, St. Louis, MO, USA), para detener las células en metafase. Una vez trascurrido este tiempo se trasvasó el contenido del frasco a un tubo de centrífuga y se centrifugó por 10 minutos a 1000rpm, luego se sacó el sobrenadante y se agregó suavemente solución hipotónica (KCl 0,075 molar). El tubo se dejó en reposo en baño termostático por 20 minutos a 37ºC. A continuación se centrifugó nuevamente por 10 minutos a 1000rpm y luego de sacar el sobrenadante se agregó suavemente el fijador Carnoy (metanol-acético 3:1). Se realizaron dos cambios más de fijador en las condiciones especificadas en el paso inmediato anterior. Posteriormente se realizaron los preparados según procedimiento estándar y se analizaron con el microscopio óptico. El índice se establece contando el número de metafases en 1000 células.
Ensayo de micronúcleos por bloqueo de la citocinesis (CBMN)
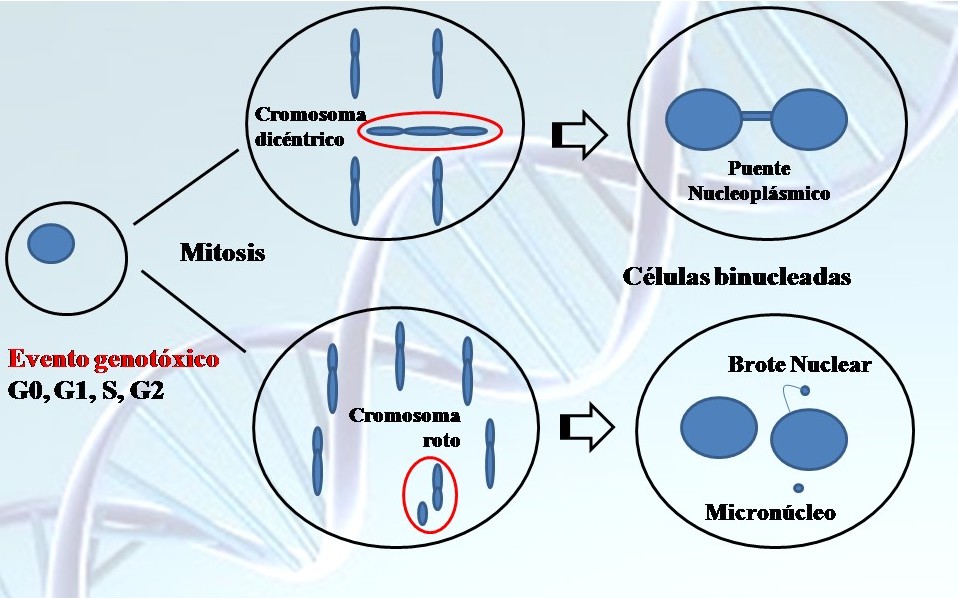
Si bien existen muchos métodos para evaluar la estabilidad genómica, a la fecha, el ensayo CBMN pareciera ser el más indicado para valorar el daño resultante de las deficiencias y excesos de micronutrientes (Fenech 2007, 2010). El micronúcleo (MNi) se origina de un fragmento cromosómico o de un cromosoma entero que queda retrasado en anafase durante la división celular (Fenech y Morley, 1986; Fenech, 2010). La citocalasina B (Sigma-Aldrich, St. Louis, MO, USA), producida por el hongo Helminthosporium dematioideum, en bajas concentraciones bloquea la citocinesis y la movilidad celular dando como resultado células binucleadas (BN). Elpropósito de este paso es circunscribir el análisis a aquellas células que en las últimas 18 horas de cultivo hicieron una división celular y son las que pueden presentar MNi como consecuencia de la inducción de fracturas de cromátida, de cromosoma o de alteraciones en los cinetocoros. Se registraron los puentes nucleoplásmicos (NPBs), que se forman entre los núcleos de una célula BN y los brotes nucleares (NBuds), los cuales representan otro mecanismo de formación de MNi (Shimizu et al. 1998, 2000) (Fig. 1). Debe demostrarse que la proliferación celular es suficiente para asegurar que la mayoría de las células contadas deriven de la primera, o de la primera y segunda división luego del tratamiento (Fenech, 2000), con lo cual se estableció el índice de división nuclear (IDN):
IDN=1 x n° células mononucleadas + 2 x n° células binucleadas + 3 x n° células tri y tetranucleadas / n° total de células contadas
Fig. 1. Diagrama de evento genotóxico: Micronúcleos, Puentes nucleoplásmicos y Brotes nucleares. Modificado de Fenech et al. (2011).
Veintiocho horas antes de finalizar los cultivos se adicionó 100ug/ml de citocalasina B, para detener la citosinesis. Una vez finalizado el tiempo de cultivo se trasvasó el contenido del frasco a un tubo de centrífuga y se centrifugó por 10 minutos a 1200rpm, luego se sacó el sobrenadante y se agregó suavemente solución hipotónica fría (KCl 0,075 molar). Sin mediar tiempo alguno, se centrifugó nuevamente por 6 minutos a 1200rpm. Luego de sacar el sobrenadante se agregó suavemente el fijador I (cloruro de sodio-metanol-acético 6:5:1). Se realizaron dos cambios más con fijador II (metanol-acético 5:1) por 10 minutos a 1200rpm. Posteriormente se procedió a realizar los preparados, se dejó caer el material celular en portaobjetos limpios y finalmente se tiñeron con Giemsa al 5% durante 10 min según procedimiento estándar y se analizaron con el microscopio óptico. Los MNi, NPBs y Nbuds fueron contabilizados en 1000 células.
Análisis estadístico
Los resultados del índice mitótico y del ensayo de micronúcleos fueron analizados estadísticamente a través de la prueba de ANOVA simple y el análisis por contraste de múltiples rangos para las variables distribuidas normalmente y de la prueba de Kruskal-Wallis, para aquellas variables no distribuidas normalmente. Fue considerado un nivel de significación p<0,05.Se utilizó el programa Statgraphics® 5.1 (Manugistics Inc., Rockville, MD).
RESULTADOS
Se analizaron los resultados de las tres tandas experimentales. En la Tabla 1, se muestran los promedios obtenidos para el IM y para los indicadores analizados con el ensayo CBMN (IDN, MNi, NPBs y NBuds). Los resultados se expresan como media ± desvío estándar.

Índice Mitótico (IM), Índice de División Nuclear (IDN), Micronúcleos (MNi), Puentes Nucleoplásmicos (NPBs), Brotes Nucleares (NBuds).
Entre paréntesis se indica el desvío estándar. Los grupos que no comparten la misma letra son significativamente diferentes entre sí (ANOVA: p<0,05).
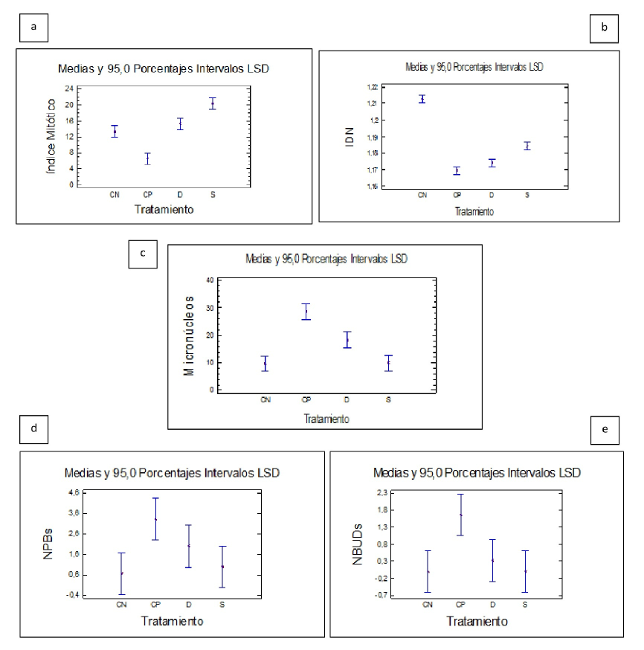
En lo que respecta al índice mitótico, se encontraron diferencias estadísticamente significativas entre tratamientos con la prueba de ANOVA (F=41,18; p=0,0000). A su vez, se efectuó un análisis por contraste de múltiples rangos en donde se detectaron tres grupos homogéneos. Formando un mismo grupo se encontraron los tratamientos de hierro diario y el control negativo y, en grupos distintos el hierro semanal y el control positivo (Fig. 2a). El tratamiento semanal presentó un índice mitótico significativamente más elevado que el tratamiento diario.
Fig. 2 Gráfico de medias y 95,0 porcentajes de LSD: a) Índice Mitótico, b) Índice de División Nuclear, c) Frecuencia de micronúcleos, d) Frecuencia de puentes nucleoplásmicos, e) Frecuencia de brotes nucleares.
El efecto citotóxico fue evaluado a través del IDN. Se observó una disminución del mismo en los cultivos con tratamiento diario y en el control positivo (Bleomicina). El IDN más elevado se observó en los cultivos correspondientes al control negativo. Se encontraron diferencias estadísticamente significativas entre los grupos (F=4,27; p=0,044). A su vez, para poder observar la homogeneidad al interior de los grupos, se realizó un análisis por contraste de múltiples rangos. El mismo permitió visualizar dos grupos homogéneos, uno de ellos formado por el control negativo, el tratamiento diario y el semanal, y otro sólo con el control positivo. El tratamiento semanal presentó un IDN ligeramente superior al tratamiento diario (Fig. 2b).
Para valorar el daño cromosómico, se contabilizó la frecuencia de MNi, NPBs y NBuds en 1.000 células binucleadas. Las mayores frecuencias de MNi se encontraron en el control positivo y en el tratamiento diario. El análisis por ANOVA simple arrojó diferencias estadísticamente significativas (F=26,69; p=0,0002). A su vez, el análisis por contraste de múltiples rangos separó los datos en 3 grupos. Por un lado, el control negativo y el tratamiento semanal; y en grupos separados el tratamiento diario y el control positivo. Se observó un aumento significativo de micronúcleos en el tratamiento diario respecto del semanal (Fig. 2c). Las frecuencias obtenidas de puentes (NPBs) y brotes (NBuds) fueron, en líneas generales, muy bajas para todos los tratamientos. En el caso de los NPBs se realizó un ANOVA simple el cual no resultó estadísticamente significativo (F=3,698; p=0,0620) (Fig. 2d). En el caso de los NBuds, como los datos no respondían a una distribución normal, se utilizó la prueba de Kruskal-Wallis. La comparación de a pares de tratamientos resultó estadísticamente significativa (F=8,46296; p=0,0373515) tanto para el control positivo respecto del negativo como para el control positivo respecto del hierro semanal. La comparación entre el resto de los tratamientos no reflejó diferencias significativas (Fig. 2e).
DISCUSIÓN
El objetivo del presente trabajo fue comparar la frecuencia in vitro de daño cromosómico provocado por la suplementación de sulfato ferroso diario y semanal. En trabajos previos, donde se evaluaron los parámetros bioquímicos asociados a ambas formas de tratamiento en niños de edad escolar con anemia ferropénica (diario 3mg/kg y semanal 6mg/kg) se observó que ambos tratamientos resultaron igual de eficientes, teniendo el tratamiento semanal menores efectos colaterales y mayor aceptación (Zalles Cueto et al., 2005). A su vez, Viteri et al. (1999) al comparar la eficacia nutricional de la suplementación diaria y semanal con sulfato ferroso en mujeres no embarazadas, observó que el tratamiento semanal no sólo presentó menos efectos adversos que el tratamiento diario, sino también que mantuvo y mejoró el estado nutricional en relación al hierro.
En lo que respecta a los resultados aquí analizados, se observó para el índice mitótico que las frecuencias de metafases en cada tratamiento presentaron variación en la viabilidad celular. De este modo, el tratamiento con hierro semanal obtuvo un aumento significativo de la viabilidad respecto del tratamiento diario. De todos modos, ambos tratamientos mostraron mayor cantidad de metafases que el control negativo, esto podría explicarse por el hecho de que el hierro es un micronutriente necesario para el desarrollo correcto y normal del ciclo celular. El efecto citotóxico también fue evaluado a través del IDN. En este caso, si bien el tratamiento semanal presentó un IDN superior al tratamiento diario, las diferencias no resultaron significativas. Para todos los tipos de tratamientos los valores de índice de división nuclear resultaron bajos con respecto a los publicados por Fenech (2007) para linfocitos humanos. Esto podría deberse al extenso tiempo de cultivo que requiere el protocolo llevado a cabo para evaluar el efecto de ambos tratamientos. Si bien existen ciertas diferencias, en líneas generales, los resultados obtenidos para el IM y el IDN presentan la misma tendencia.
Los resultados arrojados para el ensayo CBMN siguen la tendencia aquí propuesta, ya que el tratamiento con hierro semanal presenta las frecuencias más bajas de micronúcleos, significativamente inferiores a las observadas con el tratamiento diario. Cabe mencionar, que las frecuencias de micronúcleos encontradas en ambos tratamientos con sulfato ferroso se encuentran dentro del rango de normalidad establecido por Fenech (2007) para cultivos de linfocitos de sangre periférica. Dado que ninguno de los tratamientos con sulfato ferroso supera la dosis máxima establecida, era de esperarse que las frecuencias de ambos caigan dentro de los rangos de normalidad. Sin embargo, estos resultados sugieren que el tratamiento semanal produciría un menor daño genómico que el tratamiento establecido actualmente. Si bien es escasa la bibliografía publicada en relación al tratamiento con hierro, Prá et al. (2008) desarrollaron un modelo experimental in vivo en ratones suplementados con sulfato ferroso durante 6 días consecutivos (33,23mg Fe/kg). En este estudio se encontró un aumento estadísticamente significativo en las frecuencias de micronúcleos entre el grupo suplementado respecto del control negativo (agua). A su vez, estos autores (Prá et al., 2011) realizaron un estudio in vivo en niños cuyo objetivo fue evaluar la asociación entre la ingesta real de hierro y el daño genético. Observaron una correlación negativa entre la ingesta de hierro y la frecuencia de micronúcleos. Dicha frecuencia resultó significativamente más baja en aquellos niños cuya ingesta de hierro superaba a los 15mg/d. Por otro lado, Premkumar y Bowlus (2003) analizaron el efecto de la combinación de hierro y ácido ascórbico sobre la genotoxícidad a través del ensayo de micronúcleos en células de medula ósea de ratones. Concluyeron que una dieta con alto contenido en sulfato ferroso incrementa la frecuencia de daño cromosómico in vivo.
Dentro del ensayo de micronúcleos por bloqueo de la citocinesis, también se analizó la presencia de puentes y brotes nucleares. En ambos casos se puede vislumbrar la propensión hacia un menor daño genético con el tratamiento semanal en comparación con el tratamiento diario. Los resultados tanto para los NPBs como para los NBuds se encuentran dentro de lo que Fenech (2007) considera rangos normales de daño genómico.
CONCLUSIONES
En líneas generales, la administración de suplementos de sulfato de hierro in vitro en dosis únicas semanales provoca una disminución en el daño genómico. La suplementación semanal permitiría disminuir los efectos adversos y lograr un mayor cumplimiento del tratamiento preventivo. De todos modos, se recomienda realizar estudios complementarios utilizando otras técnicas, como por ejemplo la electroforesis unicelular para evidenciar el daño al ADN y diversas técnicas de estrés oxidativo, así como también la realización de estudios in vivo.
LITERATURA CITADA
1. Aksu BY, Hasbal C, Himmetoglu S, Dincer Y, Koc EE, Hatipoglu S, Akcay T. 2010. Leukocyte DNA damage in children with iron deficiency anemia: effect of iron supplementation. Eur J Pediatr 169(8):951-956. doi:10.1007/s00431-010-1147-1 [ Links ]
2. Algarín C, Peirano P, Garrido M, Pizarro F, Lozoff b. 2003. Iron deficiency anemia in infancy: long-lasting effects on auditory and visual system functioning. Pediatr Res 53(2):217-223. doi:10.1203/01.PDR.0000047657.23156.55 [ Links ]
3. Apezteguia MC, Varea A, Disalvo L, Pasarin L, Malpeli A, Gonzalez H. 2008. Deficiencia de micronutrientes en niños de 1 a 3 años de familias de bajos ingresos en dos regiones de la provincia de Buenos Aires (Argentina). En: Actas de la XLVI Reunión Anual de la Sociedad Latinoamericana de Investigación Pediátrica . Cusco: Sociedad Latinoamericana de Investigación Pediátrica. Disponible en: https://www.aacademica.org/lorena.pasarin/5.pdf [ Links ]
4. Ashour MN, Salem SI, El-gadban HM, Elwan NM, Basu TK. 1999. Antioxidant status in children with protein-energy malnutrition (PEM) living in Cairo, Egypt. Eur J Clin Nutr 53(8):669-673. [ Links ]
5. Beard JL . 2008. Why iron deficiency is important in infant development. J Nutr 138(12):2534-2536. [ Links ]
6. Brody T. 1994. Inorganic nutrients. En: Brody T, editor. Nutritional biochemistry. San Diego: Academic Press. p 527-544. [ Links ]
7. Clark SF . 2008. Iron deficiency anemia. Nutr Clin Pract 23(2):128-141. [ Links ]
8. Cook JD, Reddy MB. 1995. Efficacy of weekly compared with daily iron supplementation. Am J Clin Nutr 62(1):117-120. [ Links ]
9. Eickmann SH , Brito CM, Lira PI, Lima MC. 2008. Effectiveness of weekly iron supplementation on hemoglobin concentration, nutritional status and development of infants of public daycarecenters in Recife, Pernambuco State, Brazil. Cad Saúde Pública 24 (2):303-311. doi:10.1590/S0102-311X2008001400015 [ Links ]
10. ENNyS (2007). Encuesta Nacional de Nutrición y Salud. Documento de Resultados 2007. Buenos Aires: Ministerio de Salud. Disponible en: http://www.msal.gov.ar/htm/site/ennys/pdf/documento_resultados_2007.pdf [ Links ]
11. Fenech M. 2000. The in vitro micronucleus technique. Mutat Res 455(1)81-95. doi:10.1016/S0027-5107(00)00065-8 [ Links ]
12. Fenech M. 2007. Cytokinesis-block micronucleus cytome assay. Nat Protoc 2 (5):1084-1104. doi:10.1038/nprot.2007.77 [ Links ]
13. Fenech M. 2010. Nutriomes and nutrient arrays-the key to personalised nutrition for DNA damage prevention and cancer growth control. Genome Integr 1(1):1. doi:10.1186/2041-9414-1-11 [ Links ]
14. Fenech M. 2014. Nutriomes and personalised nutrition for DNA damage prevention, telomere integrity maintenance and cancer growth control. Cancer Treat Res 159:427-441. doi:10.1007/978-3-642-38007-5_24 [ Links ]
15. Fenech M, Morley AA. 1986. Cytokinesis-block micronucleus method in human lymphocytes: effect of in vivo ageing and low dose X-irradiation. Mutat Res 161(2):193-198. [ Links ]
16. Fenech M, Kirsch-Volders M, Natarajan AT, Surralles J, Crott JW, Parry J, Thomas P. 2011. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis 26(1):125-132. doi:10.1093/mutage/geq052 [ Links ]
17. González H, Varea A, Malpeli A. 2006. Evaluación de Impacto del Programa Plan Más Vida. Componente Nutricional. Informe Final. La Plata: Ministerio de Desarrollo Humano, Comisión de Investigaciones Científicas. [ Links ]
18. Gonzalez H Malpeli A, Etchegoyen G, Lucero L, Romero F, Lagunas C, Lailacar G, Olivares M, Uauy R. 2007. Acquisition of visuomotor habilitéis and intellectual quotient in children aged 4-10 y and relationship with micronutrient nutricional status. Biol Trace Elem Res 120(1-3):92-101. [ Links ]
19. Gross R, Schultink W. 1994. Treatment of anaemia with weekly iron supplementation. Lancet 344(8925):821. [ Links ]
20. International Nutritional Anemia Consultative Group: PAHO, UNICEF, WB, MI, USAID, FAO. 2003. Anemia prevention and control: what works. World Bank. Parte 1. Program guidance. Disponible en: http://siteresources.worldbank.org/NUTRITION/Resources/281846-1090335399908/Anemia_Part1.pdf. Parte 2. Tools and resources. Disponible en: http://www.a2zproject.org/pdf/Anemia%20Prevention%20and%20Control-%20Program%20Guidance,%20Part%20II.pdf [ Links ]
21. Jomova K, Valko M. 2011. Importance of iron chelation in free radical-induced oxidative stress and human disease. Curr Pharm Des 17(31):3460-3473. doi:10.2174/138161211798072463 [ Links ]
22. Lin H, Li L, Jia X, Ward DM, Kaplan J. 2011. Genetic and biochemical analysis of high iron toxicity in yeast: iron toxicity is due to the accumulation of cytosolic iron and occurs under both aerobic and anaerobic conditions. J Biol Chem 286(5):3851-3862. doi: 10.1074/jbc.M110.190959. [ Links ]
22. Liu X., Kang J, Zhao L, Viteri FE. 1995. Intermittent iron supplementation is efficient and safe in controlling iron deficiency and anaemia in pre-school children. Food Nutr Bull; 16(2):139- 146. [ Links ]
23. Lynch S , Stoltzfus R, Rawat R. 2007. Critical review of strategies to prevent and control iron deficiency in children. Food Nutr Bull 28(4):610-620. [ Links ]
24. MacGregor JT, Heddle JA, Hite M., Margolin BH, Ramel C, Salamone MF, .Wild D. 1987. Guidelines for the conduct of micronucleus assays in mammalian bone marrow erythrocytes.Mutat Res 189(2):103-112. [ Links ]
25. Malpeli A, Sala M, Bettiol M, Pattin J, Lazarte P, Tortarolo A, Gonzalez H. 2006. Diagnóstico del estado nutricional de micronutrientes y evaluación antropométrica en una población infantil suburbana de la provincia de Buenos Aires. Ludovica Pediátrica 8(2):45-52. [ Links ]
26. Olivares M, Walter, T. 2003. Consecuencias de la deficiencia de hierro. Rev Chil Nutr 30(3):226-233. doi:10.4067/S0717-75182003000300002 [ Links ]
27. Prá D, Franke SIR, Giulian R, Yoneama ML, Dias JF, Erdtmann B, Henriques JAP. 2008. Genotoxicity and mutagenicity of iron and copper in mice. Biometals 21(3)289-297. doi:10.1007/s10534-007-9118-3 [ Links ]
28. Prá D, Bortoluzzi A, Müller LL, Hermes L, Horta JA, Maluf SW,. Franke SIR. 2011. Iron intake, red cell indicators of iron status, and DNA damage in young subjects. Nutrition 27(3):293-297. doi:10.1016/j.nut.2010.02.001 [ Links ]
29. Prá D, Franke SI, Henriques JA, Fenech M. 2012. Iron and genoma stability: An Update. Mutat Res 733(1):92-99. doi:10.1016/j.mrfmmm.2012.02.001 [ Links ]
30. Premkumar K, Bowlus CL. 2003. Ascorbic acid reduces the frequency of iron induced micronuclei in bone marrow cells of mice.Mutat Res 542(1):99-103. doi:10.1016/j.mrgentox.2003.09.002 [ Links ]
31. Rivera JA, Hotz C, González-Cossío T, Neufeld L, García-Guerra A. 2003. The effect of micronutrient deficiencies on child growth: a review of results from community-based supplementation trials. J Nutr 133(11):4010S-4020S. [ Links ]
32. Rogerio Meneghini de Freitas JM. 2001. Iron and its sensitive balance in the cell. Mut Res 475:153-159. [ Links ]
33. Salonen JT, Nyyssönen K, Korpela H, Tuomilehto J, Seppänen R, Salonen R. 1992. High stored iron levels are associated with excess risk of myocardial infarction in eastern Finnish men. Circulation 86(3):803-811. [ Links ]
34. Salonen JT,Tuomainen TP,Nyyssönen K, Lakka HM,Punnonen K . 1998. Relation between iron stores and non-insulin dependent diabetes in men: case-control study. BMJ 317(7160):727. [ Links ]
35. Schultink W, Gross R, Gliwitzki M, Karyadi D,Matulessi P . 1995. Effect of daily vs twice weekly iron supplementation in Indonesian preschool children with low iron status. Am J Clin Nutr 61(1):111-115. [ Links ]
36. Shimizu N, Itoh N, Utiyama H, Wahl GM. 1998. Selective entrapment of extra chromosomally amplified DNA by nuclear budding and micronucleation during S phase. J Cell Biol 140(6):1307-1320. doi:10.1083/jcb.140.6.1307 [ Links ]
37. Shimizu N, Shimuara T, Tanaka T. 2000. Selective elimination of acentric double minutes from cancer cells through the extrusion of micronuclei. Mutat Res 448(1):81–90. doi:10.1016/S0027-5107(00)00003-8
38. Sociedad Argentina de Pediatría. 2001. Comité de Crecimiento y Desarrollo. Guías para la evaluación del crecimiento. Buenos Aires: Sociedad Argentina de Pediatría. [ Links ]
39. Stevens RG, Jones DY, Micozzi MS, Taylor PR . 1988. Body iron stores and the risk of cancer. N Engl J Med 319(16):1047-1052. [ Links ]
40. Swanson LW. 2003. Brain architecture: understanding the basic plan. New York: Oxford University Press. [ Links ]
41. UNICEF/UNU/WHO. 2001. Iron deficiency anaemia. Assessment, prevention and control. A guide for programme managers. WHO/NHD/01.3. Ginebra: World Health Organization. [ Links ]
42. Viteri FE. 1997. Iron supplementation for the control of iron deficiency in population at risk. Nutr Rev 55(6):195-209. doi: 10.1111/j.1753-4887.1997.tb01607.x [ Links ]
43. Viteri FE, Ali F, Tujague J. 1999. Long-term weekly iron supplementation improves and sustains nonpregnant women’s iron status as well or better than currently recommended short-term daily supplementation. J Nutr 129(11):2013-2020.
44. Zalles Cueto L, Rojas Meneces J, Rojas Soto S, Sejas E. 2005. Eficacia de la suplementación semanal versus diaria con sulfato ferroso en niños escolares con anemia ferropénica. Gaceta Médica Boliviana 28(2):3-8. [ Links ]