Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fave. Sección ciencias agrarias
versión impresa ISSN 1666-7719
FAVE. Secc. Cienc. agrar. vol.14 no.1 Santa Fe jul. 2015
ARTÍCULO ORIGINAL
Caracterización fenotípica y funcional de rizobios noduladores de dos especies del género Macroptilium
Toniutti, M. A.1 Fornasero, L.V.1 Trod, B.S.1 Zuber, N.E.1 Córdoba, M.S.1
1 Facultad de Ciencias Agrarias. Universidad Nacional del Litoral. R.P. Kreder 2805 CP 3080 Esperanza. Santa Fe. Te: 03496-420639 e-mail: matoniut@fca.unl.edu.ar
RESUMEN
Macroptilium atropurpureum y Macroptilium bracteatum son leguminosas de interés forrajero valoradas por su capacidad de fijar nitrógeno atmosférico en relaciones simbióticas con rizobacterias. Aislados provenientes de nódulos de ambas especies del género Macroptilium fueron caracterizados fenotípicamente y a nivel funcional. Las diecinueve cepas estudiadas presentaron colonias pequeñas, translúcidas, poco gomosas y de crecimiento lento. En el análisis de agrupamiento, las cepas de referencia se diferenciaron claramente de los aislados en estudio, los cuales se agruparon formando cuatro conglomerados según la velocidad de crecimiento, tolerancia a temperaturas, niveles de pH, concentraciones de sales y resistencia a diferentes antibióticos. Se identificaron siete aislados capaces de crecer en condiciones de altas temperaturas, alcalinidad y/o salinidad, los cuales tendrían un uso potencial como biofertilizantes.
Palabras claves:Macroptilium artropurpureum; Macroptilium bracteatum; Rizobios; Fenotípica; Tolerancia a factores abióticos.
SUMMARY
Functional and phenotypic characterization of nodular rhizobia from two species of macroptiliun genus
Macroptilium atropurpureum y Macroptilium bracteatum are legumes of forage interest recognized for their ability to fix atmospheric nitrogen in symbiotic relationships with rhizobacteria. Isolates coming from nodules of both Macroptilium species were characterized functional and phenotypically. The nineteen strains studied showed small colonies which were translucent, a bit gummy and low growth. In the grouping test, the previous strains clearly differed from the isolates under investigation. These gathered, making four mixtures according to the speed of growth, temperature tolerance, pH levels, salt concentration and resistance to different antibiotics. Seven isolates capable of growing under conditions of high temperature, alkalinity and / or salinity which would have a potential use as biofertilizers were identified.
Key words: Macroptilium artropurpureum; Macroptilium bracteatum; Rhizobia; Phenotypic; Tolerance to abiotic factors.
INTRODUCCIÓN
El empleo de leguminosas nativas asociadas a gramíneas constituye un recurso eficiente para mantener el suelo con buenos niveles de fertilidad debido al nitrógeno transferido a la gramínea proveniente de la fijación simbiótica entre la leguminosa y los rizobios asociados (35,38,42) lo cual podría minimizar el uso de fertilizantes químicos generalmente costosos, de baja eficacia y alto impacto ambiental. Las especies de leguminosas nativas adaptadas a nuestras condiciones edafoclimáticas presentan un gran potencial de producción forrajera. Entre estas especies se destacan las que pertenecen al género Macroptillum, tales como M. atropurpureum (MA) y M. bracteatum (MB), plantas herbáceas anuales o perennes y de ciclo primavero-estivo-otoñal (11,30).MA es una especie nativa de América que crece hasta el sur de Brasil, utilizada como forrajera en ambientes subtropicales y tropicales, existiendo dos cultivares, "Siratro" y "Aztec" (6, 8,32).M. bracteatum es una especie nativa de América y en Argentina se la encuentra en las regiones fitogeográficas Paranaense, Yungas y Chaqueña (23,33) de reconocido potencial forrajero, habiéndose liberado en Australia dos cultivares, "Cadarga" y "Juanita" (13,21,30). Estas leguminosas, al igual que la mayoría de las especies forrajeras perennes presentan un crecimiento iniciallento como limitante para su implantación (5,10). Otro de los factores determinantes de un establecimiento exitoso es una efectiva fijación biológica de nitrógeno a través de la simbiosis con rizobios noduladores (2,5,40).
Las leguminosas presentan distintos grados de especificidad en relación al rango de especies de rizobios capaces de nodularlas. En las Fabaceas, sub-familia Papilionoideaese encuentran las plantas más promiscuas o capaces de nodular efectivamente con varias especies de rizobios (24). Entre ellas se destaca por su promiscuidad el género Macroptilium (22,34), siendo generalmente nodulado por Bradyrhizobium sp. aislado de diversas leguminosas, incluyendo especies de Vigna, Lupinus, Ornithopus, Cicer, Sesbania, Leucaena, Mimosa, Lablab, y Acacia (22) y por B. japonicum y B. elkanii, simbiontes de Glycine max (27). Asimismo, las plantas de Macroptilium también pueden ser noduladas por cepas de crecimiento rápido de los géneros Rhizobium y Ensinfer, que se hallan filogenéticamente distantes de Bradyrhizobium como E. melilotti (7), R. leguminosarum biovar trifolii, y R. leguminosarum bv. phaseoli (41).
Por otro lado, diversos factores ambientales como acidez del suelo, temperaturas extremas o salinidad, serían perjudiciales para la supervivencia y diversidad de las poblaciones de rizobios nativos y para su capacidad de establecer asociaciones simbióticas (3,14). La caracterización fenotípica de los rizobios nativos adaptados a condiciones estresantes en los suelos constituye una de las primeras etapas para la obtención de un inoculante efectivo, que permita un mejor establecimiento de las leguminosas y con ello incrementar la producción agropecuaria y reducir el empleo de fertilizantes nitrogenados.
El objetivo de la presente investigación fue el aislamiento y la caracterización fenotípica y funcional de los rizobios simbiontes de M. atropurpureum y M. bracteatum.
MATERIALES Y MÉTODOS
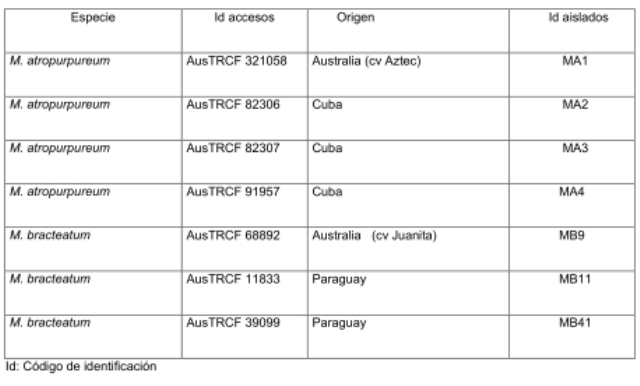
Se colectaron nódulos de dos especies del género Macroptilium, M. artropurpureum y M. bracteatum a partir de ensayos de laboratorio en cámara de crecimiento para plantas, en condiciones controladas (28°C de temperatura, foto período de 16/8 horas luz/oscuridad), empleando un suelo proveniente de la localidad de Charata, provincia del Chaco (S 27º 13'; W 61º 11') con buena aptitud potencial para el cultivo de estas especies leguminosas. Las características químicas del suelo fueron 2,3% de materia orgánica, 0,146% de nitrógeno orgánico total, 21ppm de fósforo asimilable, pH 6,5 y la conductividad eléctrica 2,6 dSm-1. Se utilizaron diferentes accesiones de cada especie como "plantas trampa" para la obtención de los nódulos. En la Tabla 1 se detallan los accesos seleccionados, provenientes del Banco de Germoplasma de Forrajeras Tropicales del Departamento de Industrias Primarias de Australia (Australian Tropical Crops and Forage Collection).
Tabla 1: Accesos seleccionados provenientes del Banco de Germoplasma de Forrajeras Tropicales del Departamento de Industrias Primarias de Australia (Australian Tropical Crops and Forage Collection)
Aislamiento y purificación de los rizobios
Para el procesamiento de los nódulos y aislamiento de rizobios se siguió la metodología descripta por Vincent (43). Los nódulos conservados en tubos con sílico- gel fueron rehidratados durante cinco horas en agua estéril. Se desinfectaron con agua oxigenada 30 volúmenes durante 3-4 minutos y luego se realizaron cinco lavados con agua destilada estéril. Los nódulos se maceraron y el producto obtenido se sembró en cajas de Petri con Agar Extracto de Levadura Manitol (LMA) e indicador rojo Congo (43). Posteriormente, fueron incubadas a 28°C durante 10 días y repicadas las colonias típicas de rizobios hasta colonia pura, confirmando la pureza por su escaso ó nulo crecimiento en medio Peptona-glucosa-agar (PGA). Los aislados fueron autenticados por su habilidad de formar nódulos en la planta huésped (43) y conservados en tubos eppendorf con caldo LMA+glicerol en freezer a -20°C. Para la autenticación de los aislados se emplearon semillas de Macroptilium las cuales fueron escarificadas manualmente con lija, desinfectadas y pregerminadas en placas de Petri con Agar-Agua 1% P/V e incubadas en estufa a 28°C. Las plántulas se colocaron en macetas conteniendo como soporte perlita estéril, y fueron llevadas a la cámara de crecimiento a 26°C y foto período de16/8 horas (luz/oscuridad) durante 45 días. Periódicamente se regaron con solución Jensen diluida (1/4). Los aislados se cultivaron en caldos LMA en agitación hasta obtener un título de 1.108UFC/mL. Posteriormente se inocularon las plántulas con 1mL del caldo/maceta y permanecieron en la cámara hasta el final del ensayo donde fueron examinadas para comprobar la formación de nódulos.
Caracteres culturales
Los rizobios se caracterizaron fenotípicamente a través de caracteres culturales tales como tamaño, color y apariencia de las colonias en medio sólido, clasificándolas según las categorías sugeridas por el Centro de Agricultura Tropical (9). Las características morfológicas y respuesta a la tinción de Gram se observaron a través de un microscopio óptico. La velocidad de crecimiento se evaluó visualmente determinando el tiempo de aparición de las colonias en placas incubadas en estufa a 28°C. Si éstas fueron visibles a los 2-4 días de incubación, las cepas respectivas se consideraron de crecimiento rápido y si se observaron dentro de los 5-7 hasta 10 días se consideraron de crecimiento lento a muy lento (22).
Producción de ácido ó base
De cada aislado proveniente de medio LMA sólido se tomó una asada y se sembró en caldo LMA (pH 6,8) e indicador azul de bromo timol (0,5% en NaOH 0,016N). Los aislados fueron incubados en estufa a 28°C, durante diez días y se observó el cambio de color a azul (alcalinidad) ó amarillo (acidez).
Crecimiento a diferentes temperaturas
Los aislados se hicieron crecer en medio LMA y se incubaron a 28°C, 35°C y 40°C.
Tolerancia a diferentes concentraciones de NaCl y pH
Se determinó en placas con medio LMA conteniendo 0,01; 0,5; 1; 2 y 3% (p/v) de NaCl y con el pH ajustado a 4, 5, 6, 7, 8, 9 y 10.
Resistencia intrínseca a antibióticos
Se sembraron los aislamientos en medio LMA con adición de los siguientes antibióticos: Ampicilina (Amp) 20 y 40µg/mL Kanamicina (Kan) 10 y 40µg/mL, Gentamicina (Gent) 5 y 20µg/mL y Estreptomicina (Estrep) 20 y 100µg/mL. Los antibióticos se adicionaron al medio de cultivo luego de ser esterilizado en autoclave.
Para todos los estudios de autenticación y caracterización morfológica, fisiológica, bioquímica y de resistencia se emplearon cinco cepas de referencia: B. liaoningense USDA 3622T, B. elkani USDA 76T B. yuanmingense CCBAU10071T, E. fredii USDA 205T y R. tropici CIAT 899T.
El análisis estadístico se realizó mediante un análisis multivariado para la estimación del patrón de variación entre las cepas estudiadas a partir de una matriz de 24 caracteres por 19 aislados, previa estandarización de los datos. Para el análisis de agrupamiento se empleó la distancia de Jaccard, generando un dendrograma mediante el empleo del método UPGMA. A través del análisis de Componentes Principales (ACP) se calcularon las contribuciones de las variables en cada componente y las relaciones fueron representadas mediante un gráfico Biplot. Las distorsiones de los agrupamientos y del ACP fueron testeadas mediante el coeficiente de correlación cofenetica (CCC) (37), que es una medida de la distorsión interna de la técnica e indica el ajuste del gráfico respecto a los coeficientes de asociación originales y considera que valores de CCC mayores a 0,8 indican escasa distorsión. Todos los análisis estadísticos fueron realizados con el paquete estadístico Infostat (15).
RESULTADOS Y DISCUSIÓN
En el presente trabajo, a partir de los ensayos de crecimiento en cámara bajo condiciones controladas fueron colectados veinte nódulos de cada acceso correspondiente a las dos especies en estudio. De los aislamientos realizados se seleccionaron un mínimo de dos cepas por acceso, conformando una colección de diecinueve aislados provenientes de plantas de Macroptilium, nueve de (MA)y diez de (MB).
Mediante la tinción de Gram se observó que la morfología de las células y sus características tintoriales se correspondían con las descritas para el grupo de los rizobios. En todos los aislados se observaron bacilos finos, Gram negativos y sin presencia de esporas (19).
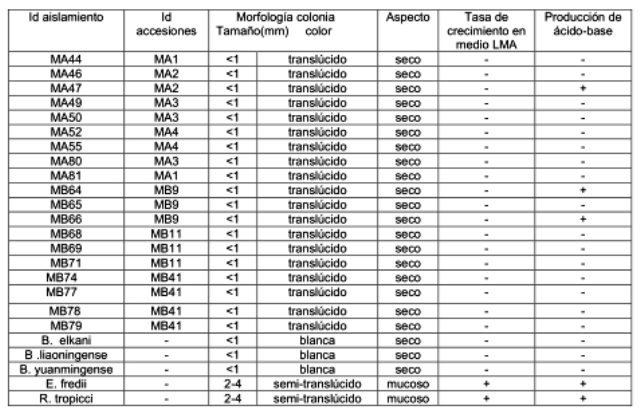
En la Tabla 2 se muestran las características morfo-culturales y fisiológicas estudiadas de los aislamientos y cepas de referencia. Los aislados presentaron crecimiento lento y extra-lento, siendo el tiempo de aparición de las colonias 5-6 días y 7-9 días respectivamente. Las colonias se caracterizaron por ser menores a un milímetro, circulares, con bordes regulares y presentar un color naranja translúcido y en ocasiones blanco hacia el centro. Además se identificaron por su escasa o ninguna producción de mucus y la excreción de base al medio, lo cual se evidenció por el cambio de coloración de verde a azul. Todas estas características morfo-fisiológicas coincidieron con las descriptas para el género Bradyrhizobium, por lo que pudiera considerarse a estos aislados como posibles miembros de este género (44). Sería necesario emplear técnicas de taxonomía polifásica que incluye estudios moleculares que permitan su ubicación filogenética. Así como también los genes involucrados en la fijación biológica de nitrógeno, para establecer relaciones con otras bacterias fijadoras ya que es una característica ancestral de amplio espectro filogenético, y el estudio de los genes de la nodulación, los cuales son marcadores de la coevolución de los rizobios con su hospedero y su origen biogeográfico (17).
Tabla 2: Características morfo-culturales y fisiológicas de los aislados de M. artropurpureum (MA), M. bracteatum (MB)y cepas de referencia.
| Id: Código de identificación | |
| (+) crecimiento rápido 2- 4 días | (-) crecimiento lento y extra-lento 5 - 7 a 9 días |
| (+)producción de ácido a los 10 días | (-) producción de base a los 10 días |
Los aislamientos obtenidos, provenientes de (MA)y (MB), se caracterizaron de acuerdo a la tolerancia a factores abióticos. En relación a la temperatura, el 90% de los aislados mostraron un crecimiento óptimo a 35°C, mientras que las cepas MA49, MB64 y MB68 toleraron temperaturas de 40°C. Estudios realizados por Munévar y Wollum (29) hallaron que las cepas de rizobios fueron capaces de crecer a temperaturas entre 27 y 45°C.
Las cepas provenientes de las dos especies en estudio crecieron adecuadamente en un rango de pH entre 5 y 8, mientras que ninguna se desarrolló en acidez extrema (pH 4). La mayoría de los aislados toleraron condiciones de alcalinidad, destacándose que el 70% de las cepas simbiontes de (MB)se desarrollaron a pH 10, mientras que los aislados de (MA)alcanzaron el 30% del total. Estos resultados contradicen a lo presentado por Hamdi (20) quien sitúa a las especies de Bradyrhizobium entre las menos tolerantes a la alcalinidad, así como los datos de Ezura, et al. (17) quienes afirman que no es común encontrar un buen desarrollo de los rizobios en pH igual o mayor a 8.
El nivel de salinidad en el suelo puede afectar el crecimiento y la supervivencia de los rizobios, disminuyendo la colonización de la raíz de la planta, inhibiendo el proceso de infección, deteriorando el funcionamiento activo del nódulo y la fijación de nitrógeno (25,36,39). En este trabajo solo el 30% de los aislamientos son tolerantes a NaCl al 0,5%, las cepas MA52 y MB77 crecieron hasta 1% de NaCl y la cepa MB68 se desarrolló a 2% de NaCl. En general los aislados de estas especies son sensibles a la presencia de sal de sodio en el medio al igual que las cepas de referencia del género Bradyrhizobium utilizadas. En los niveles extremos de NaCl no se encontraron cepas tolerantes, a excepción del aislamiento MB68, lo cual coincide con Elsheikh y Word; Mpepereki, et al.;Odee, et al. (16,28,31) quienes no obtuvieron crecimiento con cepas de Bradyrhizobium sp. en concentraciones mayores a 1%.
En relación a resistencia intrínseca a antibióticos todos los aislamientos de (MA) fueron resistentes a Ampicilina y el 70% de los aislados de (MB)toleraron las concentraciones más altas ensayadas (40µg/mL). La Gentamicina indujo el 100% de resistencia en las cepas de (MB), siendo solo la cepa MA80 sensible a este antibiótico. Todos los aislamientos son sensibles a Kanamicina y Estreptomicina salvo la cepa MB79 que tolera hasta10 µg/mL de Kanamicina y la cepa de referencia R. tropicci crece a concentraciones de 100µg/mL de Estreptomicina. Si bien la variación en la resistencia de cada cepa puede ser notable, en general los rizobios de crecimiento rápido son más sensibles que los de crecimiento lento a la Estreptomicina, contrariamente, en este trabajo las cepas de crecimiento lento fueron más sensibles. Estudios realizados por Alarcón, et al.; Cuadrado, et al. (1,12) obtuvieron resultados similares.
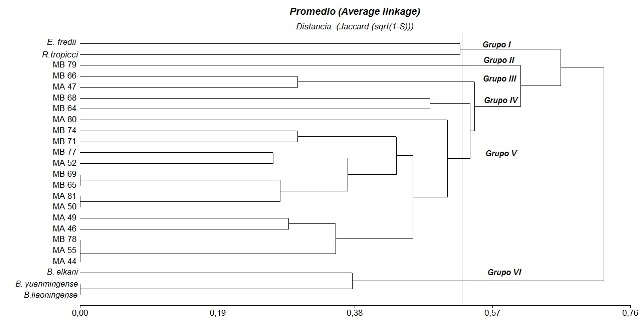
El dendrograma de la Figura 1 elaborado con base a 24 atributos relacionados a velocidad de crecimiento, tolerancia a diferentes temperaturas, rangos de pH, acidez o alcalinidad, concentración de sales y resistencia a diferentes antibióticos permitió reconocer seis grupos principales de actividad metabólica.
Figura 1: Dendrograma UGMA de las cepas autóctonas y de referencia relativos a todas las características fenotípicas provenientes de M. artropurpureum (MA)y M. bracteatum (MB)de la localidad de Charata, Pcia de Chaco.
El grupo I incluyó las cepas de referencia R. tropicci y E. fredii, de crecimiento rápido, productoras de acidez, tolerante a pH ácido y resistentes a Ampicilina, Gentamicina y Estreptomicina (100 µg/mL) para R. tropicci. El grupo II lo constituyó el aislado MB79 sensible a pH extremos, no toleró concentraciones de NaCl superiores a 0,01g/L y creció en los niveles inferiores de los rangos de antibióticos empleados. Dentro del grupo III las cepas MB66 y MA47 se caracterizaron por crecer a 35°C, no toleraron sales, produjeron acidez y mostraron resistencia a los antibióticos Ampicilina y Gentamicina. El grupo IV está representado por dos cepas de la especie (MB), MB64 y MB68, toleraron elevadas temperaturas (40°C), pH10, y concentraciones moderadas de Ampicilina y Gentamicina, siendo además la MB68 tolerante a concentraciones del 2% de NaCl. El grupo V estuvo representado por el 82% de los aislados nativos de ambas especies de Macroptilium, se caracterizaron por crecer a temperaturas hasta 35°C, pH 5-8, alcanzando el 57% de los aislados desarrollo a pH10. Además fueron sensibles a la salinidad, sólo las cepas MA52 y MB77 toleraron 1% de NaCl. Son sensibles a los antibióticos Kanamicina y Estreptomicina y tolerantes a Ampicilina y Gentamicina, excepto el aislado MA80 a Gentamicina 20 µg/ml y MB74 y MB77 a Ampicilina 40 µg/mL. El grupo VI está integrado por las cepas de referencia B. elkani, B. liaoningense y B. yuanmingense, de crecimiento lento, productoras de alcalinidad y sensibles a pH extremos, salinidad y todos los antibióticos ensayados.
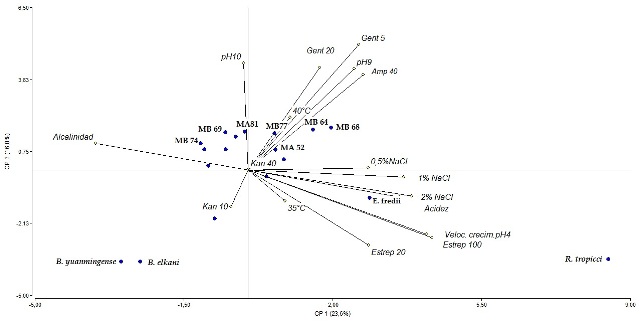
Por otro lado, en el ACP, las tres primeras componentes explicaron el 63% de la variación total, mostrando correspondencia con los resultados obtenidos en el análisis de agrupamiento. Las variables de mayor peso en el componente 1 fueron tolerancia a pH4, producción de acidez y resistencia a Estreptomicina, y las de mayor peso en el componente 3 la resistencia a los antibióticos Ampicilina y Gentamicina, y desarrollo a pH 9 y 10 (Figura 2). El valor del CCC fue 0,963 por lo que se consideró muy buena la representación gráfica asegurando fiabilidad y consistencia al dendrograma y al ACP con la matriz de similitud.
Figura 2: Gráfico Biplot a partir del Análisis de Componentes Principales. Los valores porcentuales en el rótulo de cada eje del componente 1 y 3 indican la proporción de la variación total. Se resaltan las cepas con mejor perfil como potenciales biofertilizantes.
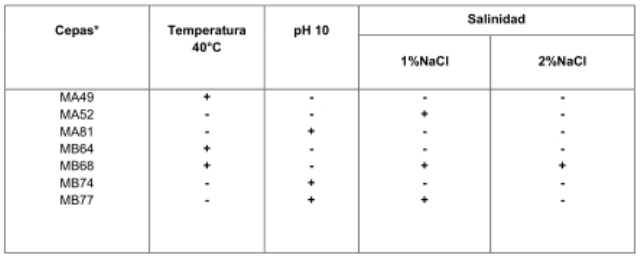
En la selección de cepas para ser utilizadas como posibles biofertilizantes además de considerar la capacidad de formar nódulos, fijar nitrógeno, sobrevivir en el suelo y en las semillas, y la estabilidad genética, es importante conocer su capacidad para tolerar condiciones de estrés como temperatura, pH, alcalinidad, antibióticos, entre otros, que permitan adaptarse y competir frente a condiciones ambientales adversas. En total, de las 19 cepas estudiadas, 7 aislados presentaron resistencia a algunos de los factores ensayados (Tabla 3). El crecimiento en diversos rangos de NaCl, alcalinidad y temperatura elevadas permitiría considerar a estas cepas de gran importancia para el estudio de la función ecológica de los rizobios en el ecosistema.
Tabla 3: Cepas de rizobios con mejor perfil para ser empleadas como potenciales biofertilizantes
| +: Crecimiento | - : No crecimiento |
| *seleccionadas en base a su resistencia a condiciones adversas: concentración de NaCl superior al 0,5%, alcalinidad y temperatura. | |
Este trabajo, basado en el estudio de características culturales, tintoriales y fisiológicas permitió ubicar a los aislados como posibles miembros del género Bradyrhizobium. Un grupo de cepas presentaron tolerancia a los factores ensayados por lo que consideramos necesario continuar con la selección de rizobios para las diferentes especies de Macroptilium, así como la clasificación más precisa de los aislados mediante el empleo de técnicas moleculares.
AGRADECIMIENTOS
Este trabajo fue financiado por el proyecto CAI+D UNL. N° 610/13
BIBLIOGRAFÍA
- Alarcón, E.P.; Lozano, A. y Chaparro, H.1997. Caracterización fenotípica de los aislamientos rizobianos de Acacia (Acacia sp.) y Retamo (Teline monpessulana), Rev. Colom. Quim, 26 (2): 21-33.
- Armstrong, R.D.; McCosker, K.; Johnson, S.B.; Walsh, K.B.; Millar, G.; Kuskopf, B.; Standley, J. y Probert, M.E. 1999. Legume and opportunity cropping systems in central Queensland. 1. Legume growth, nitrogen fixation, and water use. Aust. J. Agric. Res. 50(6): 909-924.
-
Bala, A.; Murphy, P.J.; Osunde, A.O. y Giller, K.E. 2003. Nodulation of tree legumes and the ecology of their native rhizobial populations in tropical soils. Appl. Soil Ecol. 22(3): 211-223.
-
Bécquer, C. J. 1998. Diversidad genética y posición taxonómica de rizobios, aislados de leguminosas forrajeras nativas en Sancti-Spíritus, Cuba, Tesis de Maestría, Universidad de La Habana. Cuba.
-
Brandon, N.J. y Shelton, H.M. 1997. Factors affecting the early growth of Leucaena leucocephala 1. Effects of nitrogen, phosphorus, lime and irrigation at three sites in south-east Queensland. Aust. J. Exp. Agric. 37(1): 27-34.
-
Bray, R.A. y Woodroffe, T.D. 1994. Macroptilium atropurpureum (DC.) Urban (atro) cv. Aztec. Aust. J. Exp. Agr. 35(1):121-121.
-
Bromfield, E.S.P. y Barran, L.R. 1990. Promiscuous nodulation of Phaseolus vulgaris, Macroptilium atropurpureum, and Leucaena leucocephala by indigenous Rhizobium meliloti, Can. J. Microbiol. 36(5): 369-372.
-
Cameron, D.G. 1985. Tropical and subtropical pasture legumes Siratro (Macroptilium atropurpureum): the most widely planted subtropical legume. Queens. Agric. J., 111:45-49.
-
CIAT. 1988. Simbiosis leguminosa-rizobio. Manual de métodos de evaluación, selección y manejo agronómico. Proyecto CIAT-UNDP. Cali, Colombia. 178 p.
-
Cooper, C.S. 1977. Growth of the legume seedling. Adv. Agr. 29: 119-139.
-
Covas, G. 1978. Forrajeras indígenas: Especies que requieren un plan de conservación de germoplasma. Cienc. Inv. 34: 209-213.
-
Cuadrado, B.; Rubio, G. y Santos, W. 2009. Caracterización de cepas de Rhizobium y Bradyrhizobium (con habilidad de nodulación) seleccionados de los cultivos de fríjol caupi (Vigna unguiculata) como potenciales bioinóculos. Rev. Colomb. Cienc. Quím. Farm. 38(1):78-104.
-
Dalzell, S.A.; Brandon, N.J. y Jones, R.M. 1997. Response of Lablab purpureus cv. Highworth, Macroptilium bracteatum and Macrotyloma daltonii to different intensities and frequencies of cutting Trop. Grassl. 31:107-113.
-
Diouf, D.; Samba-Mbaye, R.; Lesueur, D.; Ba, A. T.; Dreyfus, B.; de Lajudie, P. y Neyra, M. 2007. Genetic Diversity of Acacia seyal Del. Rhizobial Populations Indigenous to Senegalese Soils in Relation to Salinity and pH of the Sampling Sites Microb. Ecol. 54(3):553-566.
-
Di Rienzo, J.A.; Casanoves, F.; Balzarini, M.G.; Gonzalez, L.; Tablada, M. y Robledo, C.W. InfoStat versión 2013. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina.
-
Elsheikh, E.A.E. y Word, M. 1995. Nodulation and N2 fixation by soybean inoculated with sal tolerant rhizobia or salt-sensitive Bradyrhizobia in saline soil. Soil Biol. Biochem. 27 (4/5) 65-661.
-
Ezura, H.; Nukui, N.; Yuhashi, K.-I. y Minamisawa, K. 2000. In Vitro plant regeneration in Macroptilium atropurpureum a Legume with a broad symbiont range for nodulation. Plant Science, 159(1): 21-27.
-
Fernández, C. y Novo, R. 1988. En: Vida microbiana en el suelo. Universidad de La Habana, ed. Puebla y educación. 525 p.
-
Garrity, G. M. y Holt, J.G. 2001. The road map to the manual. Bergey´s Manual of systematic bacteriology. Second Edition, vol. I. (Eds. Boone, D. R., Castenholz, R. W. y Garrity, G. M.). Springer-Verlag, New York, USA, p. 119.
-
Hamdi, Y. A. 1985. La fijación biológica del nitrógeno, FAO Eds., Roma, 1985.
-
Jones R.M. y Rees, M.C. 1997. Evaluation of tropical legumes on clay soils at four sites in southern inland Queensland. Trop. Grassl. 31:95-106.
-
Jordan, D.C. 1984. Bradyrhizobium, in: Krieg, N.R. y Holt, J.G. (Eds.), Bergey's Manual of Systematic Bacteriology, vol. 1, Williams & Wilkins, Baltimore, MD, p. 242-244.
-
Juarez F.C. y Perez, S.M. 1987. El género Macroptilium (Fabaceae) en la Provincia de Salta, Argentina. Anales INTA Salta 1:31-42.
-
Lloret, L. y Martínez-Romero, E. 2005. Evolución y filogenia de Rhizobium. Rev. Latinoam. Microbiol. 47(1-2): 43-60.
-
Kassem, M.; Capellano, A. y Gounot, A.M. 1985. Effets du chlorure sodium sur la croissancein vitro, l'infectivité et l'efficience de Rhizobium meliloti. MIRCEN J. Appl. Microbiol. Biotech. 1(1):63-75.
-
Martínez-Viera, R. (1986): En: Ciclo biológico del nitrógeno en el suelo. Editorial Científico-Técnica. La Habana. 167 p.
-
Minamisawa, K.; Onodera, S.; Tanimura, Y.; Kobayashi, N.; Yuhashi, K. y Kubota, M. 1997. Preferential nodulation of Glycine max, Glycine soja and Macroptilium atropurpureum by two Bradyrhizobium species japonicum and elkanii, FEMS Microbiol. Ecol. 24(1):49-56.
-
Mpepereki, S.; Makonese, F. y Wollun, A.G. 1997. Physiological characterization of indigenous rhizobia nodulating Vigna unguiculata in Zimbabwean soils. Symbiosis. 22: 275-292.
-
Munévar, F. y Wollum, A. G. 1981. II, Effect of high root temperature and Rhizobium strain on nodulation, nitrogen fixation, and growth of soybeans, Soil Sci. Soc. Am. J., 45(6) 1113-1120.
-
Nichols, P.; Loi, A.; Nutt, B.J.; Evans, P.M.; Craig, A.D.; Pengelly, B.C.; Dear, B.S.; Lloyd, D.L.; Revella, C.K.; Fair, R.M.; Ewinga, M.A.; Howiesona, J.G.; Auricht, G.A.; Howie, J.H.; Sandral, G.A.; Carra, S.J.; de Koning, C.T.; Hackney, B.F.; Crocker, G.J.; Snowballa, R.; Hughes, S.J.; Hall, E.J.; Fostera, K.J.; Skinnera, P.W.; Barbetti, M.J. y You, M.P. 2007. New annual and short-lived perennial pasture legumes for Australian agriculture—15 years of revolution. Field Crops Res. 104(1):10-23.
-
Odee, D. W.; Sutherland, J.M.; Makatiani, E.T.; McInroy, S.G. y Sprent, J.I. 1997. Phenotypic characteristic and composition of rhizobia associated with wood legumes growing in diverse Kenyan conditions. Plant and Soil. 188(1):65-75.
-
Oram, R.N. 1990. Macroptilium atropurpureum (DC.) Urban cv. Siratro (reg. No. B-10a-11) Register of Australian Herbage Plant Cultivars. (CSIRO, Australia). p. 239.
-
Perez, S.M.; Camardelli, M.C.; Juarez, F.; Bianchi, A.R. y Newman, R. 1999. Geographical distribution of Macroptilium species in Argentina. Trop. Grassland 33:22-33.
-
Ridge, W.R.; Kim, R. y Yoshida, F. 1998. The diversity of lectin-detectable sugar residues on root hair tips of selected legumes correlates with the diversity of their host ranges for rhizobia, Protoplasma 202(1-2):84-90.
-
Rumbugh, M. y Johnson, D. 1986. Annual medics and related species as resending legumes for Northem Utah pastures. J. Range Management, 39:52-58.
-
Singleton, P.W.; El Swaify, S.A. y Bohlool, B.B. 1982. Effect of salinity on Rhizobium growth and survival. Appl. Environ. Microbiol. 44(4): 884-890.
-
Sokal, R. R. y Rohlf, F. J. 1962. The comparison of dendrograms by objective methods. Taxon 11:33-40.
-
Sprent, J. I. 2008. Evolution and diversity of legumes symbiosis. In: Dilworth, M.J.; James, E. K.; Sprent, J. I. y Newton, W.E. (Eds.). Nitrogen fixing Leguminous Symbioses. Nitrogen Fixation: Origins, Applications, and Research Progress 7:1-21.
-
Sunita Sheokand, S.; Dudeja, S. y Swaraj, K. 2012. Nitrogen fixation in tropical environments-Adaptive responses and benefits. Res. on Crops. 13(2):743-753
-
Thrall, P. H.; Millsom, D. A.; Jeavons, A.C.; Waayers, M.; Harvey, G. R.; Bagnall, D. J. y Brockwell, J. 2005. Seed inoculation with effective root-nodule bacteria enhances revegetation success. J. Appl. Ecol. 42(4):740-751.
-
Trinick, M.J.; Millar, C. y Hadobas, P.A. 1991. Hadobas, Formation and structure of root nodules induced on Macroptilium atropurpureum inoculated with various species of Rhizobium, Can. J. Bot. 69(7): 1520-1532.
-
Vallejos, G. 1981. Asociación de gramíneas y leguminosas tropicales. Agron. U.N. Noreste (Chaco-Argentina) 1:5-19.
-
Vincent, J.M. 1970. A Manual for the Practical Study of the Root-Nodule Bacteria. IBP Handbook No. 15, Blackwell Scientifc, Oxford.
-
Wang, T.; Romero-Martínez, J. y López-Lara, I. 2001. Rhizobium y su destacada simbiosis. En: E. Martínez-Romero y J. Martínez-Romero (eds.). Microbios. Centro de investigaciones sobre Fijación de Nitrógeno. Universidad Nacional Autónoma de México, México.