Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fave. Sección ciencias agrarias
versión impresa ISSN 1666-7719
FAVE. Secc. Cienc. agrar. vol.16 no.2 Santa Fe dic. 2017
ARTÍCULO ORIGINAL
Ruptura de la dormición y exigencias de luz para la germinación de semillas de Juglans nigra
Flores, P.1; Poggi, D.1 ; Garcia, S.1; Catraro, M.1 & Gariglio, N.2
1 Cátedra de Cultivos Intensivos. Facultad de Ciencias Agrarias (UNR). CC 14 (S2125ZAA) Zavalla, provincia de Santa Fe. Email: pflores@unr.edu.ar
2 Cátedra de Cultivos Intensivos. Facultad de Ciencias Agrarias (UNL).
Manuscrito recibido el 16 de mayo de 2017 y
aceptado para su publicación el 29 de agosto de 2017.
RESUMEN
Se evaluaron métodos para superar la dormición y determinar las necesidades de luz en la germinación de Juglans nigra. Para superar la latencia y dureza del endocarpio se realizó Estratificación en caliente (T1), Inmersión en ácido giberélico (T2) y Estratificación en frío-húmedo (T3). Para la necesidad de luz se evaluó alternancia de oscuridad/luz y oscuridad permanente. Se analizó el Porcentaje Germinación (% de G), Índice Velocidad de Germinación (IVG), Tiempo Medio Germinación Máxima (TMG), % Plántulas Normales, % Semillas sin germinar, Peso Seco Medio de plántulas (PSM) y el Índice de Germinación Relativo a la luz (GRL). En T1 no hubo germinación y en T2 irrelevante. T3 produjo diferencias altamente significativas en todas las variables analizadas, siendo el período de 4 meses de estratificación el mejor para romper la dormición. Al no ser la luz un factor determinante en la germinación, esta especie se clasificaría como fotoblástica neutra.
Palabras clave: Juglans nigra; Ruptura dormición; Estratificación; Exigencia luz.
ABSTRACT
Dormancy breakup and need for light in black walnut (Juglans nigra) Germination
The aims of this work were to evaluate methods to overcome the dormancy of Juglans nigra seeds, and to determine their light requirements for germination. To overcome dormancy and soften the endocarp, seeds were subjected to treatments of warm stratification (T1), gibberellic acid immersion (T2) and cold-moist stratification (T3). Light requirements for germination were evaluated though alternating light/dark and continuous darkness conditions. Germination percentage (%G), germination speed index (GSI), mean germination time (MGT), % normal seedlings, % non germinated seeds, mean dry weight of seedlings, and light-relative germination index were evaluated. No germination occurred in T1, and in T2 it was irrelevant. T3 presented significant differences in all the variables studied; stratification for 4 months was the best to overcome dormancy. As light is not a determining factor in germination, this species is classified as neutral photoblastic.
INTRODUCCIÓN
Los nogales se utilizan con un doble propósito, tanto para la producción de madera para carpintería fina como por sus frutos secos. La madera del nogal europeo (Juglans regia L.) y del nogal negro americano (Juglans nigra L.) son consideradas las más importantes y valiosas en el mundo (13, 57). La madera de Juglans nigra L., denominado "el nogal negro del este", es utilizada en mueblería, ebanistería, instrumentos musicales y armería. Los frutos alcanzan altos precios y tienen la ventaja de almacenarse fácilmente (24, 37, 47, 51). Por esta razón el nogal se posiciona como una especie de gran relevancia económica, con un elevado nivel industrial y tecnológico, como se demuestra en el centro de Agroforestación de la Universidad de Missouri (25, 44, 49, 53). La Hammons Products Company (26) es el procesador y proveedor más importante en el mundo de nueces de nogal negro para alimentos y usos industriales (43). En Francia, Bulgaria y Alemania, J. nigra es utilizado para la obtención de madera y como portainjerto de J. regia (35, 49). En España se inició en 1993 un programa de investigación y entre sus objetivos se encuentra el uso de cruzamientos controlados entre Juglans regia x Juglans nigra para la obtención de híbridos para madera adaptados al clima mediterráneo (1). En Argentina el principal uso del Juglans nigra es como pie de injerto del nogal europeo (Juglans regia), debido a que ofrece tolerancia al mal de la tinta (Phytopthora cinnamonii), nemátodes, Armillaria, y agalla de cuello (27). Además, induce precocidad a la variedad o copa injertada (33). En Argentina, hacia mediados de los años 90, comenzó un proceso de reconversión en el sector nogalero promovido por el INTA y los gobiernos provinciales. Los cambios tecnológicos más importantes fueron el aumento de la densidad de plantación y el reemplazo de los nogales criollos provenientes de semilla por plantas injertadas con variedades de alto valor comercial (6, 45). Ante estos hechos, disponer de plantas injertadas con variedades de carga lateral y de excelente calidad de nuez es primordial dentro del conjunto del paquete tecnológico (28). El proceso de obtener nuevas plantas injertadas demanda la disponibilidad de una importante cantidad de portainjertos, entre los que se encuentran Juglans nigra (37). Para obtener pies o portainjertos de J. nigra se siembran a campo sus semillas y cuando las plántulas alcanzan el diámetro adecuado para recibir la púa se realiza el injerto (18, 48).
Las semillas de Juglans nigra presentan dormición o latencia (8, 41, 46), lo que representa una estrategia evolutiva de las plantas para protegerse de condiciones adversas, pero en los viveros constituye un inconveniente ya que disminuye y retrasa la germinación, incrementa la desuniformidad de las plántulas, y genera ineficiencias en el proceso productivo (10, 41). El tipo de latencia que poseen es combinada, donde se asocian la latencia endógena de tipo fisiológica (8), y una latencia exógena de tipo mecánica impuesta por el endocarpio grueso y duro. Este impide el crecimiento del embrión, aún cuando permite la libre imbibición de agua (16). Existen diferentes tratamientos para provocar la ruptura de la latencia fisiológica, como la estratificación en caliente (15), los tratamientos químicos con ácido giberélico (AG) (16, 56) y la estratificación a bajas temperaturas (7, 9, 41). La efectividad de los tratamientos en la ruptura de la dormición depende del grado de dormición alcanzado por la semilla, reconociéndose tres niveles de latencia fisiológica: profunda, intermedia y no profunda (8).
En algunas especies con dormición superficial o intermedia, la inmersión de las semillas en AG ha producido una rápida germinación ahorrando el tiempo necesario que demanda la estratificación en frío (22, 50), la que constituye uno de los métodos más efectivos para superar la latencia fisiológica. La duración de la estratificación en frío será más prolongada cuando la profundidad de la latencia sea mayor. Así las semillas con latencia profunda necesitarán una estratificación más larga y en estos casos normalmente un tratamiento con AG no puede sustituir la necesidad de la estratificación en frío. En cambio, en semillas con latencia intermedia, el tratamiento con AG puede reemplazar a la estratificación en frío (41). Respecto de la latencia exógena de tipo mecánica, que representa una dificultad para la germinación, puede eliminarse mediante un período de tratamiento con "calor húmedo". Gordon y Rowe (23) recomiendan para las especies de la zona templada, remojar las semillas en agua fría a 3–5°C durante 48 horas. Luego escurrir y mezclar las semillas con un medio humedecido que retenga el agua (arena, arena y turba, o vermiculita) y almacenar a una temperatura templada estable (20–25°C, o alternante entre 20 y 30°C), volviendo a humedecer cada vez que haya signos de sequedad. Cabe señalar que el tratamiento con calor húmedo para eliminar la latencia mecánica es el mismo que se utiliza para romper la latencia morfológica (subdesarrollo del embrión).
En relación al requerimiento de luz, la mayoría de las especies arbóreas se comportan como indiferentes, germinando tanto en condiciones de luz como de oscuridad (3, 30). La necesidad de luz para la germinación puede verificarse con el índice de Germinación relativo a la Luz (36, 31). El objetivo de este trabajo fue evaluar distintos métodos para superar la dormición fisiológica y mecánica, y determinar las necesidades de luz durante la germinación.
MATERIAL Y METODOS
A todos los frutos empleados en el experimento se les eliminó previamente la pulpa por maceración y lavado a través de la utilización de tamices y se enjuagaron luego con abundante agua (19).
1).- Se realizaron tres ensayos para superar la latencia combinada exógena/endógena:
Estratificación en caliente a 21° C, durante 2 meses seguido de un preenfriado. Los frutos se llevaron a estufa a 21º C por un período de 2 meses. Posteriormente se envolvieron con papeles húmedos y se introdujeron en bolsas de polietileno negro para mantener la humedad (58). Las bolsas se colocaron en una cámara, a 5º C durante 2 meses. Como control se utilizaron frutos estratificados en frío-húmedo a 5º C durante 4 meses.
2).- Tratamientos con ácido giberélico (AG): Las semillas se remojaron en agua durante 24 horas y luego se sumergieron en soluciones de ácido giberélico con tres dosis diferentes (200; 800; y 1000 ppm) durante 12 horas. Como control se utilizaron frutos estratificados en frío- húmedo a 5º C durante 4 meses.
3).- Estratificación en frío-húmedo a 5º C. Los frutos se estratificaron envolviéndolos con papeles húmedos e introduciéndolos en bolsas de polietileno negro para mantener la humedad (58). Las bolsas se colocaron en cámara a 5º C durante 2, 3, 4 y 5 meses. El tratamiento control no recibió tratamiento de frío.
Para evaluar la influencia de la luz en la germinación del nogal negro, las semillas que se utilizaron en los 3 ensayos anteriores se dividieron en dos grupos de 400 semillas cada uno, evaluándose dos condiciones: A: 16h/8h (oscuridad/ luz) y temperaturas alternas 20/30º C (2, 12); B: oscuridad permanente con temperaturas alternas de 20º C durante 16 horas y 30º C durante 8 horas. Se analizaron las variables Porcentaje de Germinación (% G) (plántulas normales vigorosas + normales débiles), Índice de Velocidad de Germinación (IVG), Tiempo Medio de Germinación Máxima (TMG), Porcentaje de Plántulas Normales Vigorosas, Peso Seco Medio de las plántulas (PSM) e Índice de Germinación Relativo a la luz (GRL). En los primeros tres ensayos se utilizó un diseño experimental completamente aleatorizado en arreglo factorial con 8 repeticiones de 100 semillas cada una. Para la variable GRL se utilizó un diseño completamente aleatorizado con 8 repeticiones de 50 semillas cada una. Los datos se analizaron estadísticamente con el programa Infostat, realizándose el Análisis de la Variancia y la comparación de medias a través del test de Tukey con un nivel de significación de 0,05. Asimismo, se llevó a cabo la validación de cada uno de los modelos ajustados, verificando el cumplimiento de los supuestos requeridos. La Prueba de Germinación Estándar se efectuó siguiendo las especificaciones de la International Seed Testing Association (30). Las semillas se colocaron en bandejas de plástico sobre una capa de arena de 40 mm de espesor y cubiertas con 20 mm de arena húmeda sin comprimir. Cada bandeja se colocó dentro de una bolsa de plástico transparente para evitar la pérdida de humedad, y se llevaron a una cámara de germinación (Forma Científico, Modelo 3744). La fuente de luz estuvo constituida por lámparas fluorescentes con un flujo de fotones de ~23.36 μmol m-2 s-1 a una distancia de 30 cm desde la fuente de luz a las bandejas de germinación. La evaluación de las plántulas se realizó cada 7 días durante 28 días y los resultados se expresaron como Porcentaje de Plántulas Normales, donde se aplicó un criterio más estricto que los establecidos por ISTA (29) y AOSA (3), ya que sólo las plántulas totalmente libres de lesiones o defectos (Normales vigorosas) fueron consideradas como plántulas normales.
La variable de Velocidad de Germinación IVG se calculó de acuerdo a (32):
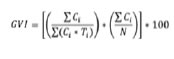
Donde:
Ci = número de semillas germinadas por día.
Ti = período (en días) desde el comienzo del ensayo.
N = Número total de semillas utilizadas en la muestra.
El tiempo medio de germinación máxima (TMG), índice que expresa el tiempo medio necesario para que ocurra el máximo de germinación, se calculó utilizando la fórmula de Edmond y Drapala (14).
![]()
Para la obtención de la variable de crecimiento Peso Seco Medio (PSM) se removieron los cotiledones de las plántulas normales con la ayuda de un bisturí; luego se secaron las plántulas en estufa durante 24 horas a 80º C y se pesaron en balanza de precisión. El peso seco obtenido se dividió por el número total de plántulas normales, expresando el resultado en mg.plántula-1 (4, 38). La variable GRL se determinó aplicando la siguiente fórmula:
GRL = GL / (GO + GL)
Donde GL= % germinación a la luz; GO= % germinación en oscuridad permanente. El índice de GRL puede alcanzar valores entre 0 (germinación sólo en oscuridad) y 1 (germinación sólo a la luz) (21).
RESULTADOS
Al evaluar la influencia de la luz en el ensayo de estratificación en caliente a 21° C, no se observó germinación. En los tratamientos con 200 ppm de AG el porcentaje de germinación fue nulo, tanto en condiciones de oscuridad permanente como con oscuridad/ luz. Para las concentraciones de 800 y 1000 ppm se obtuvo una baja germinación (<5%) sin que se observaran diferencias entre ambas dosis, aunque sí con respecto al control (Tabla 1).
Tabla 1: Efecto del Ácido Giberélico (AG) sobre la ruptura de la dormición en presencia y ausencia de luz. Datos promedios de 8 repeticiones por tratamiento. Las semillas del control fueron estratificadas en frío (5ºC) durante cuatro meses inmediatamente luego de ser cosechadas.
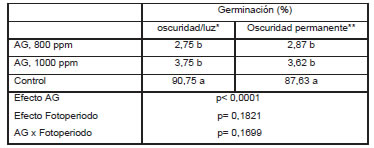
*oscuridad/luz (16/8 h) y temperaturas alternas 20/30º C; **oscuridad permanente con temperaturas alternas de 20º C durante 16 horas y 30º C durante 8 horas.
Letras diferentes en las filas y columnas indican diferencias significativas para p< 0.05
En los ensayos donde se utilizó la estratificación en frío-húmedo se produjeron diferencias altamente significativas para las variables porcentaje de germinación (F=48.32; p< 0.0001), IVG (F=88.48; p< 0.0001), TMG (F=46.52; p< 0.0001), plántulas normales (F=56.90; p< 0.0001), y Peso Seco medio de plántulas (F=15.48; p< 0.0001) en función del tiempo de estratificación. La presencia de luz sólo tuvo influencia en la variable Peso Seco Medio de plántulas (F=45.89; p< 0.0001). Las semillas estratificadas durante 2 meses en frío-húmedo a 5º C no germinaron, siendo necesario un mínimo de tres meses de estratificación para obtener una germinación en torno al 40% (Fig. 1). Al elevar el tiempo de estratificación de 3 a 4 meses se produjo un incremento del porcentaje de germinación cercano al 100%, alcanzándose los valores más elevados. A partir de este tiempo de estratificación se observó un efecto negativo de esta variable sobre la germinación del nogal negro, ya que con 5 meses el porcentaje de germinación disminuyó entre un 20 y un 30% respecto al tratamiento de 4 meses. La presencia de luz durante la germinación no afectó los resultados (Fig. 1).

Figura 1: Influencia del tiempo de estratificación en frío (5ºC) y de la presencia de luz sobre la germinación. Los datos son promedios de 8 repeticiones por tratamiento.
Letras diferentes sobre las barras indican diferencias significativas para p< 0.05
El IVG para las semillas estratificadas durante 4 meses casi triplicó los valores obtenidos para 3 meses de estratificación, y superó en un 37% al alcanzado con 5 meses de estratificación (Fig. 2). Respecto del TMG, las semillas alcanzaron el máximo de germinación en un promedio de 5 días cuando la estratificación fue de 4 meses, 9 días para un periodo de 5 meses, y este valor se elevó a 15 días cuando la estratificación duró 3 meses (Fig. 2). La presencia de luz no afectó los valores de los índices IVG y TMG (F= 3.11; p > 0,06).

Figura 2: Influencia del tiempo de estratificación a bajas temperaturas (5ºC) sobre el índice de velocidad de germinación (IVG), y el tiempo medio de germinación (TMG). Valores promedios de 8 repeticiones por tratamiento.
Letras diferentes sobre las barras indican diferencias significativas para p< 0.05
La mayor proporción de plántulas normales se obtuvo cuando las semillas fueron sometidas a 4 meses de estratificación, valores que difirieron en forma altamente significativa de los otros tratamientos (Fig. 3). El valor promedio de plántulas normales alcanzado para 4 meses de estratificación (73.56%) duplicó al obtenido para 3 (38.12%) y 5 meses (36.37%) respectivamente. El PSM de las plántulas normales fue afectado por el tiempo de estratificación y por la luz. Los valores más elevados se obtuvieron para 4 y 5 meses de estratificación en condiciones de oscuridad (653,38 y 617,50 mg. plántula-1, respectivamente) (Tabla 2).

Figura 3: Influencia del tiempo de estratificación sobre el porcentaje de plántulas normales. Datos promedios de 8 repeticiones.
Letras diferentes sobre las barras indican diferencias significativas para p< 0.05.
Tabla 2: Influencia del tiempo de estratificación y de la presencia de luz sobre el peso seco medio (PSM) de las plántulas normales. Datos promedios de 8 repeticiones por tratamiento.

*oscuridad/luz (16/8 h) y temperaturas alternas 20/30º C; **oscuridad permanente con temperaturas alternas de 20º C durante 16 horas y 30º C durante 8 horas. Letras diferentes en las filas y columnas indican diferencias significativas para p< 0.05
El índice de germinación relativo a la luz mostró los valores más bajos a los 3 meses de estratificación, incrementándose a medida que aumentaba el tiempo de estratificación, aunque las diferencias fueron sólo significativas (F= 5.11; p > 0.0155) entre los tratamientos extremos (3 y 5 meses). Los valores del Índice de GRL fueron de 0.42, 0.47 y 0.49 para 3, 4 y 5 meses de estratificación, respectivamente (Fig. 4).

Figura 4. Índice de Germinación Relativo a la Luz para 3 tiempos de estratificación. Datos de 8 repeticiones.
Letras diferentes sobre las barras indican diferencias significativas para p< 0.05.
DISCUSIÓN
La estratificación en frío-húmedo a 5ºC por un periodo de 4 meses demostró ser el mejor tratamiento para la ruptura de la dormición endógena/exógena de las semillas del nogal negro. Algunos autores determinan la profundidad de la dormición de las semillas en función del tiempo necesario de estratificación para la ruptura de la misma (8, 40). Es así como las semillas con latencia fisiológica profunda, requieren de una estratificación en frío durante al menos 3 a 4 meses, semejando las condiciones que encuentran naturalmente durante el invierno (10, 15, 16).
De acuerdo a los resultados obtenidos, las semillas de J. nigra provenientes de plantas cultivadas bajo las condiciones de la zona sur de la provincia de Santa Fe corresponderían a la categoría de semillas con dormición profunda. La profundidad de la dormición condiciona el método a utilizar para la ruptura de la misma (7). Si bien uno de los tratamientos recomendados es el uso del ácido giberélico que ha proporcionado resultados satisfactorios en Juglans nigra (56), y en otras especies como Nothofagus oblicua (roble pellín) y Nothofagus procera (raulí) (22, 50), en nuestra experiencia no fue efectivo, ya que normalmente promueve la germinación en semillas con dormición intermedia o no profunda (8). No obstante esos resultados satisfactorios, el uso de AG no constituye una práctica habitual en los viveros comerciales (16). Del mismo modo, el tratamiento de estratificación en caliente a 21° C, mencionado como exitoso en el capítulo correspondiente a Juglandáceas del Handbook of Seed Technology for Genebanks (15), en nuestro caso no logró superar la dormición de las semillas de Juglans nigra. Por otra parte, en experimentos efectuados en Coahuila, estado del noreste de México (56), con climas áridos y muy secos, precipitaciones marcadamente estacionales y prolongados períodos de sequía, las semillas presentan una dormición fisiológica intermedia. Bajo esas condiciones, los tratamientos con AG y la estratificación en frío por períodos relativamente cortos (2 meses) permiten la ruptura de la latencia fisiológica, promoviendo la germinación en la temporada de lluvias (55). Mientras que en condiciones de clima templado húmedo, como el de la localidad de Zavalla (sur de la provincia de Santa Fe), las semillas permanecen en el suelo, con una latencia profunda de origen endógeno, hasta la primavera siguiente. Por ello, es posible que las diferentes características climáticas a las que se adaptó una misma especie sean la causa de una respuesta distinta a los tratamientos de ruptura de la dormición. La estratificación en frío-húmedo no sólo influye en la ruptura de la dormición fisiológica sino que también tiene un efecto sobre el ablandamiento de la cubierta leñosa, gruesa y con fuerte sutura (latencia exógena) como poseen las semillas de nogal negro, que aunque permeable al agua y a los gases, impide el crecimiento del embrión, y por ende la germinación de la semilla (16). Por ello no es necesario someter a las semillas a un tratamiento previo para superar la latencia exógena de tipo mecánica como el de "calor húmedo", recomendado para las especies de la zona templada (23).
La evaluación del crecimiento de plántulas, como medio para analizar el vigor de las semillas es una prueba sugerida por las dos asociaciones que congregan a los técnicos de semillas a nivel mundial (AOSA – Association of Official Seed Analysts, e ISTA – International Seed Testing Association) (54). Esta evaluación se puede efectuar a través de la determinación del Peso Seco Medio de las Plántulas (4, 38). Las semillas más vigorosas proporcionan durante la germinación mayor transferencia de sustancias de sus tejidos de reserva a los del eje embrionario, originando plántulas de mayor peso (38). El Peso Seco Medio es también un indicador del vigor inicial de las plántulas en el campo (4). En el presente estudio los mayores valores de biomasa fueron los provenientes de semillas estratificadas durante 4 o 5 meses y que germinaron y crecieron inicialmente en condiciones de oscuridad. Este resultado parece contradictorio y puede atribuirse a que las plántulas cuya germinación y crecimiento inicial ocurrió en presencia de luz recibieron el estímulo de este factor ambiental para desencadenar los procesos fotomorfogénicos que les permiten a las plántulas alcanzar la autotrofia, lo que requiere de cambios metabólicos que insumen energía (20, 52).
Por ello, las plántulas expuestas a la luz presentaron un costo energético superior al de las plántulas que permanecieron en oscuridad permanente. Además, la intensidad de luz en la cámara de crecimiento fue cercana o inferior al punto de compensación de luz de especies arbóreas semejantes al nogal, como el roble melojo (Q. pyrenaica) y el alcornoque (Q. suber) que oscilan entre 31 y 19 μmoles m-2 s-1, respectivamente (42). Por ello, es de esperar que la fotosíntesis haya sido insuficiente como para compensar el costo energético en que incurrieron las plántulas expuestas a la luz. En relación a la influencia de la luz sobre la germinación, el nogal negro podría ser considerado como una especie fotoblástica neutra, tal como la mayoría de las especies arbóreas (3, 30), y como muchas especies pioneras (17, 34). El índice de Geminación Relativo a la Luz (GRL) expresa con mayor precisión las necesidades de luz sobre la germinación al comparar los resultados en el porcentaje de germinación de las semillas en presencia y en ausencia de luz (31, 36). Cuando este índice es superior a 0.75 indica que las semillas son dependientes de la luz para germinar (fotoblásticas positivas), cuando es menor a 0.25 significa que la luz es perjudicial para la germinación (fotoblásticas negativas), y con valores comprendidos entre 0.25 y 0.75 se clasifican como indiferentes a la luz (fotoblásticas neutras) (7, 21). En el caso del estudio realizado, si bien hubo diferencias significativas para los diferentes tiempos de estratificación, ninguno de los valores obtenidos excedió el rango comprendido entre 0.25 y 0.75, por lo que esta especie debería clasificarse como indiferente a la luz o fotoblástica neutra. Si bien autores como Anonymous (2) y Brinkman (12), recomiendan la germinación en presencia de luz para las semillas de J. nigra, cabe señalar que dicha sugerencia puede deberse al hecho de asegurar un adecuado desarrollo de las plántulas durante las pruebas de laboratorio a los efectos de la evaluación (5), o a la falta de información específica de dicha especie.
Los requerimientos de luz para la germinación, son una importante estrategia ecológica de las especies ya que el fotoblastismo positivo es el principal rasgo de la germinación relacionada con la formación de la reserva natural de semillas o banco de semillas del suelo (11, 17). En cambio, se considera que las especies fotoblásticas neutras, tal como el caso de las semillas de Juglans nigra, no tienen la capacidad de formar bancos de semillas (31). Sin embargo, esta afirmación está actualmente puesta en duda ya que existen otros factores ambientales y de latencia orgánica (endógena y exógena), que pueden impedir la germinación y así favorecer la creación de bancos de semillas de estas especies (31), siempre que las mismas sean capaces de conservar la viabilidad por un tiempo prolongado. Con respecto al Peso Seco Medio, esta investigación determinó que es un indicador que si bien mostró diferencias significativas entre los tratamientos, se manifestó menos sensible en comparación con otros parámetros como el porcentaje de plantas normales o el mismo porcentaje de germinación. Una de las ventajas de esta prueba es su bajo costo, ya que no se necesitan equipos especiales, ni un entrenamiento específico. Por otro lado es relativamente rápida y se independiza de la subjetividad del analista, tornándose de esta forma de gran sencillez para la reproducción de los resultados (39).
Como conclusión, el método más efectivo para romper la dormición de las semillas del nogal negro (Juglans nigra L.) fue la estratificación en frío-húmedo (5ºC) por un período de 4 meses, tratamiento con el que también se alcanzaron las mejores calidades de plántulas. La presencia de luz, la estratificación en caliente, y la aplicación externa de giberelinas no mostraron resultados favorables como para su recomendación en viveros comerciales.
1. ALETÀ, N. 2004. Current Research In Spain On Walnut For Wood Production In: Michler, C.; Pijut, P.; Van Sambeek, J.; Coggeshall, M.; Seifert, J.; Woeste, K.; Overton, R.; Ponder, F., Jr., eds. Black walnut in a new century, proceedings of the 6th Walnut Council research symposium; Gen. Tech. Rep. NC-243. St. Paul, MN: U.S. Department of Agriculture, Forest Service, North Central Research Station. 188p. [ Links ]
2. ANONYMOUS. 1948. Juglans L. Walnut. In Woody- plant Seed Manual, USDA Forest Service, Miscellaneous Publication nº 654. p. 201-204. [ Links ]
3. AOSA (Association of Official Seed Analysts). 1984. Rules for testing seeds. J. Seed Technol. 6 (2): 1-125. [ Links ]
4. AOSA (Association of Official Seed Analysts). 2002. Seed Vigor Testing Handbook. Contribution nº 32. Revised 2002. p. 105. [ Links ]
5. ARÁOZ, S., DEL LONGO, O. Y KARLIN, O. 2004. Germinación de semillas de Ziziphus mistol Grisebach II. Respuestas a diferentes temperaturas y luz. Multequina 13: 41-46. [ Links ]
6. AVANZATO, D. 2005. I Seminario Internacional de Nogalicultura en la Patagonia. Conferencia nº 1. Panorama mundial de la producción y comercialización de nueces. [ Links ]
7. BASKIN, C. C. Y BASKIN, J.M. 1998. Seeds: Ecology, Biogeography, and Evolution of Dormancy and Germination. San Diego, Academic Press. [ Links ]
8. BASKIN, J. M. Y BASKIN, C. C. 2004. A classification system for seed dormancy. Seed Science Research, 14: 1-16. [ Links ]
9. BASKIN, C. C., BASKIN, J. M., YOSHINAGA, A. y THOMPSON, K. 2005. Germination of drupelets in multi-seeded drupes of the shrub Leptecophylla tameiameiae (Ericaceae) from Hawaii: a case for deep physiological dormancy broken by high temperatures. Seed Science Research 15: 349-356. [ Links ]
10. BONNER, F. T., MCLEMORE, B. F. y BARNETT, J. P. 1974. Presowing treatment of seed to speed germination. In: Seeds of Woody Plants in the United States. (Agriculture Handbook Nº 450. Schopmeyer C.S Technical Coordinator. Forest Service, United States Department of Agriculture (USDA), Washington, D.C. 126-135. [ Links ]
11. BOWERS, J. 2000. Does Ferocactus wislizeni (Cactaceae) have a between–year seed bank? Journal of Arid Environments. 45: 197-205.
12. BRINKMAN, K.A. 1974. Juglans L. In: Seeds of Woody Plants (coord. C. S. Schopmeyer), p. 454-459. USDA- FS, AH 450, Washington, DC. [ Links ]
13. DIRR, M. A. 1998. Manual of woody landscape plants: their identification, ornamental characteristics, culture, propagation and uses, 5th edn. Stipes Publishing, Champaign, pp 500-502. [ Links ]
14. EDMOND, J. B. y DRAPALA, W. J. 1958. The effect of temperature, sand and soil, and acetone on germination of okra seed. Proceeding of the American Society for Horticultural Science. 71:728-34. [ Links ]
15. ELLIS, R. H., HONG, T. D. y ROBERTS, E. H. 1985. Handbook of Seed Technology for Genebanks. Volume II. Juglandaceae. International Board for Plant Genetic Resources, Rome, Italy. [ Links ]
16. FAO. 1991. Seed pretreatment. 8, 241-278 In: A guide to forest seed handling. Willan, R.L. (Ed.) FAO Forestry paper 20/2, Rome. [ Links ]
17. FIGUEROA, J. y VÁZQUEZ-YANES, C. 2002. Efecto de la calidad de la luz sobre la germinación de semillas en el árbol pionero tropical Heliocarpus appendiculatus (Tiliaceae). Rev. Biol. Trop. 50(1): 31-36. [ Links ]
18. FLORES, P., MOYANO, M. I. y SETA, S. 1995. Selección de la técnica de acondicionamiento más adecuada para injertos de nogal, en la localidad de Zavalla, Santa Fe, Argentina. Hort. Arg. 14 (37): 52-54. [ Links ]
19. FLORES, P.C., POGGI, D., GARCÍA, S.M., CATRARO, M. y GARIGLIO, N.F. 2013. The pulp of Juglans nigra fruit affects seed germination and root growth. Seed Technol. 35: 41–53.
20. FOLTA, K. M. 2004. Green light stimulates early stem elongation, antagonizing light-mediated growth inhibition. Plant Physiology, 135: 1407-1416. [ Links ]
21. FUNES, G., DÍAZ, S. y VENIER, P. 2009. La temperatura como principal determinante de la germinación en especies del Chaco seco de Argentina. Ecol. Austral 19(2): 1-8. [ Links ]
22. GORDON, A. G. 1979. Uso y abastecimiento de semillas forestales en chile. Doc. de trabajo № 16, FO: DP/CHI/76/003 Investigación sobre desarrollo forestal, Santiago de Chile. [ Links ]
23. GORDON, A.G. y ROWE, D. C. F. 1982. In: Handbook of seed Technology for Genebanks. Nº 3 Vol.2. Compedium of specific germination information and test recommendations. [ Links ]
24. GRUSELLE, R. y BOXUS, P. 1990. Walnut micropropagation. Acta Horticulturae 284:45-52. [ Links ]
25. HAMMONS, B. K. 1998. "World Consumption and Production Trends". International Nut Council. Hammons Products Company. p. 25-28. [ Links ]
26. HAMMONS PRODUCTS COMPANY. 2007. Black Walnuts. Nutrition Facts. Disponible en: www.black-walnuts.com/ [ Links ]
27. IANNAMICO, L., CALVO, P. y CASTRO, H. R. 2006. The behavior of ten late sprouting walnut cultivars in the Alto Valle of Rio Negro, Patagonia (Argentina). Proccedings of the V International Walnut Symposium, Sorrento. Italia. Acta Horticulturae 705: 493-498. [ Links ]
28. IANNAMICO, L. 2010. Desarrollo de la fruticultura en la zona pampeana: experiencias con cultivos alternativos. El almendro y el nogal. XXXIII Congreso Argentino de Horticultura. Rosario, Santa Fe. [ Links ]
29. ISTA (INTERNATIONAL SEED TESTING ASSOCIATION). 1999. International rules for seed testing. Seed Science and Technology 27: supplement, 333 pp. [ Links ]
30. ISTA (INTERNATIONAL SEED TESTING ASSOCIATION). 2003. International rules for seed testing. Zurich, 333pp. [ Links ]
31. JIMÉNEZ–AGUILAR, A. y FLORES, J. 2010. Effect of light on seed germination of succulent species from the southern Chihuahuan Desert: comparing germinability and relative light germination. J. PACD 12: 12-19.
32. KOTOWISKI, F. 1926. Temperature relations to germination of vegetable seeds. Proc. Amer. Soc. Hort. Sci. 23:176-184. [ Links ]
33. LEMUS, G. 1997. Propagación y variedades de nuez. Seminario: Avances tecnológicos en el cultivo del nogal. Centro de Investigación Regional La Platina. Chile. pp.169. [ Links ]
34. LI, M., LIEBERMAN, M. y LIEBERMAN, D. 1996. Seedling demography in undisturbed tropical wet forest in Costa Rica, p. 285-314. In M.D. Swaine (ed.). Ecology of tropical forest tree seedling. UNESCO, París. [ Links ]
35. MCGRANAHAN, G. H. y CATLIN, P. B. 1987. Juglans rootstocks. In: Rom R. C.; Carlson, R. F. (Eds.). Juglans rootstocks for fruit crops. p. 411-450. NY, Wiley. [ Links ]
36. MILBERG, P., ANDERSSON, L. y THOMPSON, K. 2000. Large-seeded species are less dependent on light for germination than small-seeded ones. Seed Science Research 10: 99-104. [ Links ]
37. MOORE, J. N. y BALLINGTON, R. JR. 1991. Genetic resources of temperature fruit and nut Crops 2. Ed. International Society for Horticultural Science Wageningen, the Netherlands. p. 907-950. [ Links ]
38. NAKAGAWA, J. 1994. Testes de vigor baseados na avaliação das plântulas. In: Vieira, R. D., Carvalho, N. M. (Ed.) Testes de vigor em sementes. Jaboticabal: FUNEP, p. 49-85. [ Links ]
39. NAKAGAWA, J. 1999. Testes de vigor baseados no desempenho das plântulas. In: Krzyzanoski, F.C.; Vieira, R.D.; França Neto, J.B. (Ed.). Vigor de sementes: conceitos e testes. Londrina: ABRATES, p.2.1-2.24. [ Links ]
40. NIKOLAEVA, M. G. 1977. Factors controlling the seed dormancy pattern. In: The physiology and biochemistry of seed dormancy and germination, p. 51–74. Ed A.A. Khan. New York, USA: Elsevier.
41. NIKOLAEVA, M. G. 2001. Seed dormancy classification system and its relevance to the ecology, physiology, biogeography and phylogenetic relationships of seed dormancy and germination. Botanicheskii Zhurnal, 86, 1–14 (in Russian with English summary).
42. QUERO, J. L., MARAÑÓN, T. y VILLAR, R. 2004. Tasas de fotosíntesis en plántulas de alcornoque y roble en distintos micrositios dentro del sotobosque. Almoraima, 31: 101-110. [ Links ]
43. REID, W. 1990. Eastern black walnut: potential for commercial nut producing cultivars. In: Janick, J.; Simon, J. E. (eds) Advances in new crops, Timber Press, Portland, p. 327-331. [ Links ]
44. REID, W., COGGESHALL, M. y GARRETT, G. 2007. Growing Black Walnut for Nut Production. Agroforestry in action. (ed). The University of Missouri Center for Agroforestry. 16 p. [ Links ]
45. REVIGLIO, E. O. 1997. Variedades californianas de nogal. Chilecito. La Rioja. Argentina, 1(1):1-4. [ Links ]
46. ROBERTS, E. H. 1972. Viability of seeds. Chapman and Hall, Londres. [ Links ]
47. RODRÍGUEZ, R., REVILLA, A., ALBUERNE, M. y PÉREZ, C. 1989. Walnut (Juglans spp.). In: Bajaj, Y.P.S., ed. Biotechnology in agriculture and forestry. Berlin, Heidelberg: Springer-Verlag: Trees II. 5: 99-126. [ Links ]
48. RODRÍGUEZ, R. y CASTRO, H. 1992. Desarrollo de una metodología eficiente para la injertación del nogal en Río Negro y Neuquén. Investigación Agropecuaria 38:1-12. [ Links ]
49. ROSENGARTEN, F. JR. 2004. The book of edible nut. Dover Publication, Inc. Mineola, New York. p. 239-264. [ Links ]
50. SHAFIQ, Y. 1980. Effect of gibberellic acid (GA3) and prechilling on germination % of Nothofagus obliqua (Mirb.) Oerst. and Nothofagus procera Oerst. Seeds. Indian Forester 106: 27-31. [ Links ]
51. SHIFLEY, S. R. 2004. The black walnut resource in the United States. In: Michler, C. H.; Pijut, P. M.; Van Sambeek, J.; Coggeshall, M.; Seifert, J.; Woeste, K.; Overton, R. (eds). Black walnut in a new century, Proc 6th Walnut Council Res Symp, Gen tech Rep NC-243, US Dept Agric, For Serv, North Central Res Stn, 188p. [ Links ]
52. TING, I. P. 1982. Plant Physiology. Addison-Wesley Publishing Company. Reading, Massachusetts. 642p. [ Links ]
53. TOURJEE, K. R. 1998. Missouri Eastern Black Walnut Breeding Program. School of Natural Resources, University of Missouri. Columbia, Missouri. p. 90-96. [ Links ]
54. VANZOLINI, S., DOS SANTOS ARAKI, C. A., TOSTE MANSO DA SILVA, A. C. y NAKAGAWA, J. 2007. Teste de comprimento de plântula na avaliação da qualidade fisiológica de sementes de soja. Rev. Bras. Sementes. 29, nº.2, p. 90-96. [ Links ]
55. VÁZQUEZ-YANES, C., OROZCO, A., ROJAS, M., SÁNCHEZ, M. E. y CERVANTES, V. 1997. La Reproducción de las Plantas: Semillas y Meristemos. La ciencia para todos/157. Fondo de Cultura Económica, México, D.F. 167 p. [ Links ]
56. VEGA RÍOS, J., REYES LÓPEZ, A., MATA BELTRÁN, I., ORTEGÓN PÉREZ, J. y PADRÓN CORRAL, E. 1998. Efecto de la estratificación y del ácido giberélico sobre la germinación y emergencia en nogal negro. Agraria UAAAN. 14, N° 1 y 2. [ Links ]
57. VOULGARIDIS, V. y VASSILIOU, V. G. 2005. Walnut wood and its utilisation to high value products. Acta Horticulturae 705: V International Walnut Symposium. Sorrento, Italia. [ Links ]
58. VOZZO, J. A., HALLOIN, J. M., COOPER, T. G. y POTCHEN, E. J. 1996. Use of NMR spectrocopy and magnetic resonance imaging for discriminating Juglans Nigra L. seeds. Seed Sci & Technol. 24, 457-463. [ Links ]
59. WILLIAMS, R. D. 1990. Juglans nigra L., black walnut. In: Burns, R. M.; Honkala, B. H. (eds.), Silvics of North America, vol. 2, Hardwoods. Agriculture Handbook 654, 391–399. U. S. Department of Agriculture, Forest Service, Washington, D.C., USA.














