INTRODUCCIÓN
A nivel global, las virosis de batata constituyen potencialmente la limitante de su producción de mayor relevancia, ocasionando consecuentemente, la disminución de su superficie cultivada (Loebenstein, 2015). En el mundo, se citan cerca de 30 virus de batata (Clark et al., 2012) y en nuestro país hasta el presente, han sido detectados nueve (Di Feo et al., 2000; Nome et al. 2005; Rodríguez Pardina et al., 2012a; Rodríguez Pardina et al., 2012b; Bejerman et al., 2016; Martino et al., 2017a; Martino et al., 2017b).
La propagación comercial vegetativa de la especie conduce a un incremento en la concentración de partículas virales y a su perpetuación en los tejidos vegetales, en perjuicio de los rendimientos (Loebenstein et al., 2009). Argentina no escapa a este fenómeno global, del cual las virosis son una de las principales causas. Estas patologías tuvieron aparición cíclica en nuestro país desde los ´70, en que Sweet potato vein mosaic virus (SPVMV), causal de “batata crespa”, generó severos daños en los rendimientos del cultivar cv Criolla Amarilla (Nome, 1973; Nome y Docampo, 1974). Un programa de producción y distribución de plantines libres de virus permitió la recuperación de los cultivos. Sin embargo, en la década del 80, el “enanismo clorótico” (Di Feo et al., 2000), provocado por un complejo de tres virus: Sweet potato chlorotic stunt virus (SPCSV), sinérgico con Sweet potato feathery mottle virus (SPFMV) y con otro potyvirus Sweet potato mild speckling virus (SPMSV) afectó gravemente al cv Morada INTA (Biderbost et al., 1990). Esto se debió a la discontinuidad en el empleo de plantines de sanidad controlada, única medida eficiente de control disponible hasta la fecha (Loebenstein, 2015).
Desde 2009, las virosis son responsables de severos daños en la producción, causando mermas superiores al 90%, lo que implica un grave problema social (Tolocka et al., 2012a), pues productores tradicionales abandonan el cultivo con consecuencias perjudiciales para las diferentes regiones.
La plantación de estacas de tallo (guías) o de plantines infectados es la vía más importante de diseminación de los patógenos virales de un ciclo a otro de cultivo (infección secundaria), que conlleva un incremento de la concentración de viriones en los tejidos. Las infecciones primarias ocurren por contagio entre plantas mediante vectores, en su mayoría insectos hemípteros, con aparato bucal picador-suctor, como áfidos o pulgones y aleuródidos o moscas blancas (infecciones primarias). Los virus son transmitidos de manera “no persistente” por pulgones y semipersistente o persistente por moscas blancas (Salazar, 1996; Di Feo, 2015).
El calentamiento global ha desencadenado cambios en los patosistemas y el consiguiente desplazamiento de insectos como B. tabaci, vector de geminivirus y de SPCSV, desde regiones tropicales y subtropicales hacia otras, antes consideradas templadas (Galvez et al., 2013). Observaciones efectuadas en diferentes lotes de regiones productoras de Argentina, como NEA, NOA, Región Pampeana, y Cuyo, permitieron establecer la presencia de una patología viral denominada “encrespamiento amarillo” (EA), con elevada incidencia en diversas variedades en las que ocasiona síntomas severos que podemos resumir en notable disminución del crecimiento vegetativo de la planta, distorsión de láminas foliares y marcada manifestación de clorosis. Esto conlleva mermas potenciales y significativas en los componentes de rendimiento, en lotes de producción y en ensayos experimentales y, además, afecta la calidad comercial de las batatas. El contenido de carotenos, precursores de vitamina A, se ve reducido notablemente en las raíces reservantes procedentes de plantas infectadas (López Colomba et al., 2011; Tolocka et al., 2012b), lo cual constituye un grave problema ya que, en la actualidad, se mejora el cultivo para lograr niveles mayores de dicha vitamina y se emplean, de manera creciente, variedades cuya pulpa de raíz es amarilla o anaranjada.
Los agentes causales del EA forman parte de un complejo viral de siete patógenos, seis de ellos no citados anteriormente en Argentina y que se resaltan en negrita: tres potyvirus transmitidos de manera no persistente por Myzus persicae: SPFMV (razas russet crack: RC y ordinary: O), Sweet potato virus G (SPVG), Sweet potato virus C (SPVC); el crinivirus SPCSV-WA (raza Western África) y los geminivirus Sweet potato leaf curl virus (SPLCV), Sweet potato leaf curl Georgia virus (SPLCGV-Ar) transmitidos por B. tabaci (transmisión semi-persistente en el caso del crinivirus y persistente en el de los geminivirus). Recientemente fue identificado Sweet potato symptomless virus 1 (SPSMV-1), geminivirus del género Mastrevirus. SPCSV se destaca por su efecto sinérgico en infecciones mixtas principalmente con los potyvirus. El complejo EA genera una variada y severa sintomatología (clorosis, achaparramiento, mosaico, diseños cloróticos, reducción y ampollado de la hoja, entre otros) e importantes daños en la producción y calidad comercial (López Colomba et at., 2011; Tolocka et al., 2012a; Tolocka et al., 2012b). Además de los síntomas severos, las co-infecciones entre virus causan reducción en el contenido de clorofila y, consecuentemente, en la radiación fotosintéticamente activa y el rendimiento (Wang et al., 2019).
A causa de su gran diversidad genética y la consiguiente variabilidad en sus características fenotípicas y morfológicas, la batata presenta amplia adaptabilidad y versatilidad de usos y demanda creciente, por lo que las infecciones virales adquieren relevancia como principal limitante de su producción. En los últimos años, viene adquiriendo progresiva importancia como alimento saludable y por sus potenciales usos industriales.
El objetivo de este trabajo fue determinar, experimentalmente, la influencia de la virosis actual (EA) en el rendimiento y en el contenido de clorofila de dos cultivares de batata de gran relevancia en Argentina: Arapey INIA, el de mayor distribución en todas las regiones cultivadas y Beauregard, promisorio por su alto contenido de carotenos, sus posibles aplicaciones en industria alimenticia y su demanda en el mercado externo.
MATERIALES Y MÉTODOS
Regeneración y saneamiento de dos cultivares de batata
La regeneración y saneamiento de plantas de los cultivares de batata incluidos en este estudio (Arapey INIA y Beauregard) se llevó a cabo en cuatro pasos (CIAT, 1982; Love et al., 1987). En primer lugar, se eligieron las plantas dadoras de meristemas que respondían al tipo varietal de los dos cultivares a las que, previo a la extracción de meristemas, se le efectuó control sanitario a través de las pruebas que se indican más abajo. Dichas plantas madre, fueron llevadas a termoterapia (37-38°C, 16 h de luz y 3000 lux de intensidad lumínica por tres semanas), a la que siguió el cultivo in vitro de meristemas, de yemas apicales por su mayor crecimiento potencial, bajo condiciones de asepsia adecuadas. El medio agarizado contenía sales minerales (Murashige y Skoog, 1962), vitaminas, sacarosa y auxinas. La incubación fue a 25°C, 18h de luz y 5000 lux de intensidad lumínica y a los 45 días se regeneró una planta completa (Nome y Salvadores, 1980). Antes de su micropropagación, las plantas regeneradas se sometieron a control sanitario. Para ello, se escindieron en 8-10 microestacas, y se colocaron en medio de cultivo sin hormonas, en cámara de flujo laminar. La mitad de las plantas hermanas regeneradas se transfirió a macetas para su posterior aclimatación bajo frascos de vidrio que fueron retirados gradualmente, hasta dejar a las plantas descubiertas, a los fines de proceder a su indexing para SPFMV, SPVG, SPVC, SPCSV y para geminivirus, en general. Las que no acusaron infección viral fueron macropropagadas bajo jaula anti-áfidos.
El control sanitario o indexing para los distintos virus se efectuó mediante pruebas biológicas: injerto en la indicadora Ipomoea setosa (Martinelli, 2014); pruebas serológicas: en el caso de SPFMV, SPVG y SPVC, mediante NCM-ELISA con empleo de antisueros policlonales específicos (Parent et al., 1985) y para SPCSV, mediante TAS-ELISA (Gibson et al., 1998). La presencia de geminivirus en general. fue determinada a través de PCR (Li et al., 2004; Rodríguez Pardina et al., 2012b; Martino et al., 2017a), con empleo de los oligonucleóticos degenerados universales (SPG1 y SPG2) para geminivirus de batata, que amplifican fragmentos de aproximadamente 900pb. Para ello, previamente se extrajo el ADN viral mediante empleo de NaOH y tampón Tris-ClH (Rodríguez Pardina et al., 2012b; Wang et al., 1993). El análisis de PCR para detección de geminivirus, fue realizado en plantas regeneradas del cv. Arapey INIA y Beauregard, a la sexta semana de la siembra de meristemas. La observación de los viriones en savia infectada fue realizada a través de un microscopio electrónico de transmisión (MET) JEOL JEM EX II 1220®. Se hicieron preparados dips y de “decoración” en lo que las partículas fueron cubiertas con antisueros específicos contra SPFMV (Milne y Lesemann, 1978). Este método se utilizó especialmente para la detección de SPFMV y SPVG.
Por último, las plantas saneadas fueron propagadas, partiendo de una sola planta de Arapey INIA y de Beauregard. La misma se clonó en dos plantas y a las dos semanas, una se auto-injertó usando como púa una porción de su tallo (control sano) y la otra se infectó, injertando con una púa con el complejo viral EA (Martinelli, 2014). Ambas plantas (sana e infectada con EA) fueron multiplicadas vegetativamente, mediante trozos de guías puestos a enraizar en macetas con sustrato estéril adecuado, ubicadas en jaulas con malla antiáfidos en invernadero, hasta obtener suficiente material para el ensayo experimental de campo. Tanto plantas sanas como infectadas fueron controladas sanitariamente para los virus involucrados en el complejo EA, del modo antes descripto.
Ensayo experimental de campo
Se delineó un ensayo de campo a los fines de cuantificar el efecto del EA sobre componentes de rendimiento y contenido de clorofila de las dos variedades de batata.
El experimento se llevó a cabo bajo un diseño en parcelas divididas, distribuidas en tres repeticiones de 10 plantas cada una. En el mismo fueron asignados aleatoriamente dos factores, a parcela principal: “condición sanitaria”, con dos niveles: plantas sanas e infectadas con EA y a parcela secundaria: “genotipos”, también con dos niveles: Arapey INIA y Beauregard. De este modo, se conformaron cuatro tratamientos en total, resultantes de la combinación de los niveles de los dos factores.
El suelo, de tipo franco-arcilloso, fue acondicionado dos meses previos al trasplante a través de dos pasadas de rastra de doble acción y dos de motocultivador. Para el control de malezas en preemergencia, se aplicó Linurex (Linuron) al suelo previamente regado y oreado, a razón de 85cm3 en 85m2 de superficie. Además, antes de hacer los bordos, el suelo se desinfectó con Actara (Tiametoxam), para prevenir el ataque especialmente de “moscas blancas”, en dosis de 0,5-0,7 g/10m lineales (500-700g ha-1.) con un volumen de agua de 200-300 L ha-1. Luego de realizar los bordos, de 0,30 m de altura y ubicados a 0,90 entre sí, se aplicó 1,10 kg urea en 85m2 seguido de un riego ligero (Mwanga y Fuentes, 2010).
Para preservar la condición de plantas sanas, se sembró una barrera verde (sorgo granífero) de 1,5 m de ancho en la periferia del ensayo y de 3 m, entre las parcelas sanas y las afectadas por EA. De esta manera, se pudo proteger el ensayo y minimizar el movimiento de insectos vectores (áfidos y moscas blancas) y, por ende, evitar la transmisión de virus desde las parcelas infectadas a las sanas. La barrera y el cultivo por evaluar fueron pulverizados regularmente de manera preventiva, con Confidor, (Imidacloprid), a razón de 30 g/10 L agua. Esto permitió eliminar los insectos interceptados en la barrera de sorgo (CABI. Plantwise Knowledge Bank, 2014; Muturi et al., 2007; Gibson et al., 2004; Ngailo et al., 2013).
En noviembre, se efectuó el trasplante de plantines de tres nudos a 0,30 m entre sí. Cada parcela estuvo constituida por 60 plantas. Se regó por surco, acorde a las demandas ambientales, alcanzando su requerimiento cercano a 550-660 mm en todo el ciclo del cultivo (Martí, 2014).
Contenido de clorofila
Se evaluó el contenido relativo de clorofila en hojas de batata mediante lecturas de SPAD (Hansatech CL-01), registradas con un dispositivo portátil. Dicho contenido es determinado a partir de muestras de hojas, a través de valores de absorbancia óptica a longitud de onda dual (620 y 940 nm) y se muestra en el rango de 0 a 2000 unidades. El valor SPAD refleja la concentración de clorofila en las hojas de las plantas de forma simple y rápida, sin daño de las hojas.
En este experimento, se realizaron mediciones en nueve momentos desde el trasplante, y los registros fueron: F1, F2, F3, F4, F5, F6, F7, F8 y F9, a las cinco (27/12), seis (5/1), siete (12/1), ocho (19/1), nueve (25/1), 10 (2/2), 12 (16/2), 14 (2/3) y 16 (16/3) semanas, respectivamente. Para su evaluación, se seleccionaron e identificaron, de manera aleatoria, 10 plantas por tratamiento. Durante las determinaciones, se aplicó un mismo criterio que consistió en colocar el dispositivo en la nervadura central de la tercera y cuarta hoja expandida de la guía más larga.
Para el análisis de los valores de SPAD se utilizaron modelos lineales generales mixtos. Las comparaciones de medias se realizaron mediante Test de Fisher, con un nivel de significancia del 5%. Los análisis se realizaron con el paquete estadístico Infostat (Di Rienzo et al., 2016).
Estimación de componentes de rendimiento en plantas saneadas y en plantas infectadas con EA
Al momento de la cosecha, se midieron diferentes caracteres componentes de rendimiento in situ tales como: número de guías principales (NG), peso fresco de parte aérea (PFA), área foliar de la cuarta y quinta hoja de la guía más larga (AF) mediante software Hoja INTA (Verga, 2012), número de raíces totales (NTR), peso fresco de raíces totales (PTR), número de raíces comerciales (NRC) y peso fresco de raíces comerciales (PRC). Se consideraron comerciales a las raíces que superaron los 100g de peso (Biderbost et al., 1990; Tolocka et al., 2013).
Los datos obtenidos fueron analizados estadísticamente mediante modelos lineales generales y mixtos (MLM) para establecer diferencias entre condiciones sanitarias (plantas sanas y enfermas) y genotipos (Arapey INIA y Beauregard). Las comparaciones de medias se realizaron a través de la prueba de Fisher, con nivel de significancia del 5%.
Además, para cada variable, se determinaron las disminuciones potenciales porcentuales (porcentaje de daño) mediante la siguiente fórmula: D= ∑ [(Ẋs - Xi) /Ẋs]*100 (siendo Ẋs media de la variable en plantas asintomáticas, Xi valor de la variable en planta infectada con EA).
Con el fin de dilucidar los efectos directos e indirectos de los caracteres medidos en el rendimiento de las raíces se realizó un Análisis de Sendero (Path Analysis). Para los análisis se empleó el paquete estadístico Infostat (Di Rienzo et al., 2016).
RESULTADOS Y DISCUSIONES
Regeneración de dos cultivares de batatas a partir de meristemas
Aplicación de las técnicas para la regeneración de plantas saneadas (termoterapia y cultivo “in vitro” de meristemas)
Se observó que el porcentaje de meristemas establecidos de Arapey INIA fue superior en relación con el de Beauregard (40% vs 30%), respectivamente. Beauregard exhibió elevado porcentaje de meristemas necrosados (67%) respecto a Arapey INIA (23%), lo que podría deberse principalmente a un efecto fitotóxico diferencial del hipoclorito de sodio durante la desinfección. Borges et al. (2004), encontraron diferencias en el efecto fitotóxico a diferentes concentraciones de hipoclorito de sodio, en plantas leñosas. La contaminación en Arapey INIA (37%), se debió principalmente a la presencia de bacterias y hongos.
Control sanitario de las plantas regeneradas (indexing de los virus presuntamente eliminados)
Tal como se muestra en la Figura 1, no se detectaron geminivirus en las plantas regeneradas del cv Arapey INIA ni del cv Beauregard. Sólo se observó banda en el gel de agarosa en la calle correspondiente al control positivo (planta de batata fehacientemente infectada con geminivirus).

Figura 1 Detección molecular de geminivirus de batata. Electroforesis en gel de agarosa de los fragmentos de ácido nucleico (900kb) de geminivirus, amplificados por PCR. M: marcador de peso molecular, donde la banda señalada corresponde a 1000 pares de bases (KB), 1-3: Arapey INIA, 4-5: Beauregard, -: control negativo de virus (agua) y +: control positivo de virus. Instituto de Patología Vegetal (INTA) Córdoba, 2018.
Observaciones al microscopio electrónico
En las observaciones al microscopio electrónico de los preparados dips realizados en plantas infectadas con EA, se observaron viriones filamentosos flexuosos, algunos de los cuales se decoraron con suero anti-SPFMV corroborando la presencia de este potyvirus en el complejo viral. Pudieron también, observarse otras partículas sin decorar con SPFMVas, correspondientes a SPVG y a SPCSV.
Propagación de las plantas saneadas
En Córdoba y en la mayor parte del país, los transplantes de batata, se realizan de manera estacional (octubre, noviembre y diciembre). A los fines de generar el factor “condición sanitaria” con dos niveles (plantas sanas y plantas infectadas con EA), ambas fueron mantenidas en jaulas separadas para preservar su estado sanitario.
A partir de la 4º semana de practicado el injerto, las plantas correspondientes a la condición “infectada con EA” mostraron síntomas foliares notables (aclaramiento de nervadura generalizado, punteado clorótico, mosaico intenso) (Figura 2) y comenzaron a clonarse, de manera separada, hasta lograr el número necesario para realizar el ensayo comparativo de rendimiento (120 plantas en total, 60 de cada genotipo). Esto se logró a los 45 días desde el injerto.

Figura 2 Multiplicación de plantas saneadas (A) y enfermas de EA (B) cv Beauregard, en jaulas con malla antiáfidos, mantenidas en invernadero. Presencia de síntomas foliares, bandeado nerval y aclaramiento de nervadura (flecha roja), punteado clorótico (flecha azul), mosaico con diseños cloróticos y distorsión de la lámina foliar (flecha amarilla). Instituto de Patología Vegetal (INTA) Córdoba, 2018.
Contenido de clorofila
En la Tabla 1 se observan los valores promedio, el error estándar y los valores máximo y mínimo para la variable SPAD (contenido de clorofila) en la F9 (16/03). Para Arapey INIA, el rango de variación fue diferente según condición sanitaria (valores mínimos y máximos de 16,2 y 25,4 para sanas y de 9,29 y 15,5 para enfermas). En el caso del cv Beauregard, el rango de variación se ubicó entre 14,8 y 21,6 y entre 7,8 y 15,7, para las condiciones sana y enferma, respectivamente. Se pudieron observar reducciones notables de lecturas de SPAD, en presencia de EA.

Tabla 1 Estadística descriptiva del contenido de clorofila en Arapey INIA y Beauregard para las condiciones sanitarias sana y enferma. Medias con diferentes letras son significativamente diferentes (P ≤ 0,05).
El análisis estadístico permitió establecer diferencias altamente significativas (p<0,0001) para contenido de clorofila entre condición sanitaria, genotipo y momentos de medición: con valores promedio de 19,52 en sanas y 11,45 en enfermas, 15,92 y 15,05 para Arapey INIA y Beauregard, respectivamente, mientras que, para los momentos, éstos fueron de 14,28 (F1 - F4) y 16,45 (F5 - F9). Por otra parte, no se observó interacción significativa entre condición sanitaria y genotipo para el valor de SPAD (p=0,20).
Su et al. (2009) demostraron la existencia de una correlación positiva altamente significativa entre los valores del SPAD y la concentración de clorofila en hojas de batata sana, aunque esta determinación aún no fue realizada en hojas de batata con EA. Pepó (2018) demostró la relación entre el contenido de clorofila en hojas de batata y el rendimiento del cultivo en diferentes métodos de plantación.
Los posibles efectos generados en las plantas enfermas evaluadas durante el período de fase 2 y principio de la fase final de crecimiento, se deberían a un retraso en los procesos de tuberización, además de una reducción de la actividad fotosintética. Según Zhang et al. (2020), ambos procesos se estimulan mutuamente y limitan la máxima eficiencia de la planta, afectando de manera indirecta al rendimiento. Los resultados obtenidos indicaron (datos no mostrados) que las lecturas de SPAD en hojas de plantas sanas, aumentaron de manera gradual durante el período de crecimiento desde principios de enero hasta mediados de febrero, seguido de una reducción a mediados de marzo, al final del período vegetativo. En plantas enfermas, los valores de contenido de clorofila se mantuvieron en un rango más reducido con respecto a plantas sanas durante el período evaluado, y EA ocasionó una significativa reducción de éstos. Experimentos realizados por Ananthu y Umamaheswaran (2019), han demostrado que en plantas infectadas con virus se produce una reducción significativa del contenido de clorofila. En plantas enfermas con EA, es notable el amarillamiento foliar (merma del contenido de clorofilas) que da lugar a valores de SPAD reducidos con relación a los de plantas sanas. El análisis estadístico corrobora lo expresado, arrojando diferencias significativas entre condiciones sanitarias, pero no entre genotipos con igual estado de sanidad (Tabla 1).
Estimación de componentes de rendimiento en plantas saneadas e infectadas con EA
Se analizaron los componentes del rendimiento en Arapey INIA y Beauregard para la condición sana y enferma (Tabla 2). Al considerar la misma condición sanitaria (sana y enferma con EA), en el caso de las variables relacionadas con el crecimiento vegetativo (PFA, NG y AF), ambos genotipos (Arapey INIA y Beauregard) discreparon significativamente (p<0,0001). En cambio, para caracteres vinculados directamente con rendimiento (PRT, PRC, NTR y NRC) no hubo diferencias entre cultivares (p>0,25). Las plantas sanas y enfermas de ambos genotipos exhibieron diferencias altamente significativas (p<0,0001) para todas las variables analizadas.

Tabla 2 Medias y errores estándar de caracteres componentes del rendimiento en cvs Arapey INIA y Beauregard para las condiciones sanitarias sana y enferma.
La interacción entre condición sanitaria y genotipo no fue significativa para ninguno de los caracteres analizados (ambos genotipos tuvieron igual comportamiento en presencia de la virosis, con valores de significancia p de: 0,30; 0,50; 0,59; 0,71; 0,18; 0,64 y 0,30 para PFA, NG, NRC, PRC, NTR, PTR y AF, respectivamente). Los daños estimados en caracteres componentes del rendimiento para ambos genotipos (Fig. 4) concuerdan con los determinados por López Colomba et al. (2010), en el cv Arapey INIA.
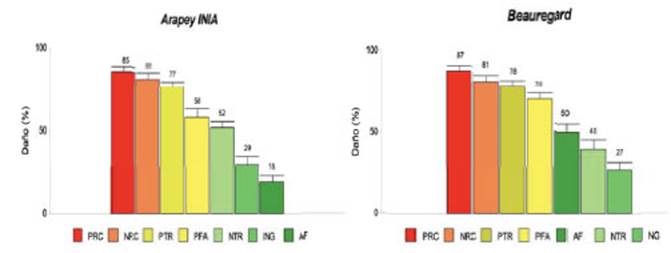
Figure 4 Porcentajes de daño (valores medios porcentuales de la variable en plantas infectadas con EA con relación a la media de las sanas) en los cvs Arapey INIA (izq.) y Beauregard (der.), respectivamente. Referencias: los valores que se muestran son los de media y el segmento sobre la barra es el error estándar.
Durante la década del 90, Biderbost et al. (1990) estimaron el porcentaje de daño, causado por “enanismo clorótico” (EC) en el cv Morada INTA, para los diferentes componentes de rendimiento. Si bien las mermas en plantas afectadas por esta enfermedad fueron significativas para todos ellos, cabe destacar que el rendimiento exhibió una disminución del 60%, mientras que en este estudio pudo establecerse que la misma resultó cercana al 90%. Una de las razones de esta diferencia podría deberse a que, mientras en el EC estaban involucradas tres especies virales, en la actualidad, al menos son siete las entidades que desencadenan la nueva virosis.
Análisis de sendero (Path Analysis)
Considerando a PRC como la variable más relevante de rendimiento, el análisis de sendero demostró que, tal como se esperaba, la misma estuvo directamente correlacionada con PTR, tanto para la condición sana como enferma, al tener en cuenta los efectos directos e indirectos (a través de las otras variables). (Para Arapey, los coeficientes (r total) fueron: r=0,98; p<0,0001 y r=0,96; p<0,0001, en plantas sanas y enfermas, respectivamente y de r=0,98; p<0,0001, en sanas y r=0,90; p<0,0001, en enfermas, para Beauregard). Al tener en cuenta sólo el efecto directo de PTR sobre PRC, en Arapey INIA, la correlación directa entre PRC y PTR fue altamente significativa, aunque mayor en plantas sanas que en enfermas (r=1; p<0,0001 vs, r=0,78; p<0,0001). Igual situación se presentó para el cv Beauregard, (r=1,04; p<0,0001, en sanas vs, r=0,80; p<0,0001, en enfermas). La asociación entre PFA, NG, AF, NRC y NTR con PRC ocurrió de manera indirecta y altamente significativa, a través de PTR, y la magnitud de esta asociación dependió de la condición sanitaria y el genotipo (Figura 5). De los efectos indirectos sobre rendimiento (PRC), el de mayor relevancia fue NRC a través de PTR, y los coeficientes de correlación fueron superiores en plantas enfermas respecto a sanas en ambos genotipos.
Cabe destacar que en el caso del “enanismo clorótico” (EC), el carácter de mayor incidencia sobre número de raíces reservantes del cv Morada INTA era NRT (Biderbost et al., 1993). En cambio, para “encrespamiento amarillo”, en Arapey INIA y en Beauregard, el efecto directo más significativo sobre PRC es el de PTR. De este modo, y tal como ocurrió para el EC, se comprueba que las variaciones en los efectos directos e indirectos de los caracteres correlacionados con el rendimiento son diferentes en plantas infectadas con EA respeto a plantas sanas.

Figura 5 Análisis de sendero (Path analysis) entre PRC y los caracteres componentes NG, AF, NRC, PTR, NTR y PFA para la condición sanitaria sana (A) y enferma (B) de los cvs Arapey INIA. (C) y (D) y Beauregard, respectivamente. Líneas continuas indican efectos directos; líneas punteadas indican efectos indirectos sobre PRC.
CONCLUSIONES
El EA causa una significativa disminución del contenido de clorofilas respecto a plantas sanas considerando ambos genotipos. Los cultivares Arapey INIA y Beauregard son similares entre sí en cuanto a contenido de clorofilas, independientemente de su condición sanitaria.
Los caracteres componentes del rendimiento sufren mermas significativas en plantas infectadas con EA de ambos genotipos, con porcentajes de daños en el peso de raíces comerciales de aproximadamente 90%. Sólo en el caso de Beauregard, no hay diferencias entre plantas sanas e infectadas con EA para NG.
El carácter de mayor incidencia directa sobre el peso de raíces comerciales es el peso total de raíces, tanto en plantas sanas como enfermas (con EA).
Existe asociación indirecta altamente significativa entre PFA, NG, AF, NRC y NTR con PRC, a través de PTR, y la magnitud de esta depende de la condición sanitaria y el genotipo.















