Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral v.11 n.2 Córdoba jul./dic. 2001
Dinámica poblacional de dos especies de anfípodos y su relación con la vegetación acuática en un microambiente de la cuenca del río Luján (Argentina)
María A Casset*, Fernando R Momo & Adonis DN Giorgi
Prog. de Invest. en Ecología Acuática, Depto. de Ciencias Básicas, Univ. Nac. de Luján, Luján, Argentina
* Prog. de Invest. en Ecología Acuática - Depto. de Cs. Básicas; Univ. Nac. de Luján; CC 221; B6700ZAB Luján, Argentina. Email: macass@mail.unlu.edu.ar
Recibido: 14 marzo 2001;
Revisado: 12 junio 2001;
Aceptado: 12 septiembre 2001
RESUMEN. Se estudió la dinámica anual de las poblaciones de dos especies de anfípodos en un microambiente de agua dulce del arroyo Las Flores, afluente del río Luján. Hyalella (Mesohyallela) curvispina es un anfípodo herbívoro que se alimenta principalmente de las algas del fitobentos; Hyalella (Mesohyalella) sp. utiliza como refugio a las plantas macrófitas acuáticas y es un carnívoro depredador de Hyalella (M.) curvispina. Las comunidades vegetales del arroyo siguen una diná mica escalonada a lo largo del año, con un máximo de perifiton en junio, de fitobentos en octubre y de macrófitas entre noviembre y febrero. H. (M.) curvispina tiene su mayor densidad (1267 individuos/ m2) y su producción secundaria más alta (2225 mg.m-2.mes-1) en coincidencia con el pico de fitobentos de octubre, con cuya abundancia se correlaciona positivamente. Hyalella (Mesohyalella) sp. presenta su abundancia máxima (7067 individuos/m2) y su mayor producción secundaria (1018 g.m-2.mes-1) en enero; ambas cantidades se correlacionan positivamente con la biomasa de macrófitas en el ambiente.
ABSTRACT. Population dynamics of two amphipod species and its relationship with the aquatic vegetation in a Luján river basin microenvironment (Argentina): The dynamics of two amphipod species in a freshwater micro-environment was studied. Samples were taken monthly, during a whole year, from Las Flores stream, a Luján river tributary. Hyalella (Mesohyalella) curvispina is a herbivore and feeds mainly on phytobenthos. Hyalella (Mesohyalella) sp. is a H. (M.) curvispina predator and uses macrophytes as a refuge. Periphyton algal biomass reaches its maximum during June, the phytobenthos biomass reaches its maximum during October, and macrophyte biomass reaches its maximum between November and February. H. (M.) curvispina shows its maximum density (1267 individuals/m2) and its highest secondary production (2225 mg.m-2.month-1) in October coinciding with the phytobenthos' peak in biomass; its density correlates positively with phytobenthos abundance. H. (M.) sp. density (7067 individuals/m2) and secondary production (1018 mg.m-2.month-1) both peak in January. H. (M.) curvispina density is positively correlated with phytobenthos biomass. H. (M.) sp. density, biomass and secondary production are all positively correlated with macrophyte biomass.
INTRODUCCIÓN
Los crustáceos anfípodos constituyen un componente importante en las comunidades bentónicas marinas y de agua dulce de todo el mundo (Thurston 1970; Klages & Gutt 1990a, 1990b). Puede encontrárselos asociados a sustratos duros, vegetación vascular acuática y algas (Muskó 1992; Poi de Neif 1992; Parsons & Matthews 1995), y juegan un importante papel en estos ecosistemas, representando en ocasiones una fracción significativa de la biomasa animal aunque su tasa de renovación no sea muy alta (Wetzel 1981). Según Margalef (1983), en los ambientes lénticos europeos los anfípodos dominantes pertenecen al género Gammarus Fabricius 1775, de origen nórdico. En América, en cambio, desde Estados Unidos y México hasta el extremo meridional, Gammarus está sustituido ecológicamente por Hyalella Smith 1874, un miembro de la familia Hyalellidae, excepto en Estados Unidos donde ambos géneros conviven en algunos ambientes.
Los anfípodos son un eslabón clave en la trama trófica. Son principalmente consumidores, pero también sirven de alimento a varias especies de peces (Muskó 1992; Giorgi et al. 1996; Giorgi & Tiraboschi 1999). Algunas especies han sido estudiadas como huéspedes intermediarios o definitivos de parásitos (Camino 1989; Laberge & Mc Laughlin 1989; Mouritsen et al. 1997). El interés por estos organismos se ha incrementado recientemente por la posibilidad de utilizarlos como bioindicadores de condiciones ambientales y de contaminación. En América del Norte, Hyalella (Hyalella) azteca Saussure 1858 es un organismo estándar en bioensayos (Borgmann et al. 1989; Ingersoll 1991; Collyard et al. 1994; Hoke et al. 1994; Hogg & Williams 1996; Chappie & Burton 1997; DeFoe & Ankley 1998; Kemble et al. 1999).
En Argentina existen estudios taxonómicos sobre Hyalella (Cavalieri 1959, 1968; Grosso & Peralta 1999) y también algunos sobre su biología (Lopreto 1982; García Gonzáles & Souto 1987), pero en general la información sobre este género es escasa. En plantas sumergidas y bentos de arroyos de la cuenca del río Luján, se han registrado anfípodos del género Hyalella que son, junto con los moluscos, los invertebrados más abundantes sobre las macrófitas (Giorgi et al. 1996). En el transcurso de varios años de trabajo en la cuenca del río Luján hemos podido observar la presencia de dos especies: Hyalella (Mesohyalella) curvispina y otra especie del mismo género y subgénero no citada anteriormente en la región; esta especie, nueva para la ciencia, está actualmente en proceso de descripción taxonómica por investigadores del Instituto Miguel Lillo de Tucumán (M Peralta, com. pers.). Los objetivos del presente trabajo son: describir la dinámica de las dos poblaciones de anfípodos, H. (M.) curvispina y H. (M.) sp., hallados en el arroyo Las Flores (cuenca del río Luján), estimar su producción secundaria y describir sus relaciones con la vegetación macrofítica.
MÉTODOS
Sitio de muestreo
El muestreo se desarrolló entre mayo de 1992 y marzo de 1993 en el arroyo Las Flores. Este arroyo recibe escasa influencia humana ya que no existen industrias ni centros urbanos importantes sobre su cuenca de drenaje y la mayoría de los terrenos que lo rodean se dedican a la cría de caballos; sus aguas son utilizadas como potables por algunos habitantes de la zona. El arroyo Las Flores presenta un curso permanente; es afluente de segundo orden del río Luján (Figura 1) y está ubicado en 59°07'O y 34°29'S, con un recorrido aproximado de 20 km. Regionalmente se lo considera un arroyo de un nivel intermedio de eutrofia (Feijoó et al. 1999; Giorgi et al. 2000). El cauce, casi léntico, presenta algunas zonas más rápidas; su ancho varía entre 0.6 y 11 m y su profundidad no excede los 2 m, aún en momentos de creciente. Registra velocidades de corriente de hasta 1 m/s dependiendo de la cantidad de lluvia caída (Gantes & Tur 1995).

Figura 1. Ubicación de la zona de muestreo (triángulo) sobre el arroyo Las Flores en la provincia de Buenos Aires.
Figure 1. Geographical location of the sampling area (triangle) on Las Flores stream, Buenos Aires province.
Las muestras se tomaron en un pequeño ambiente situado 3 km aguas abajo de las nacientes del arroyo (Figura 1); la profundidad en el sitio de muestreo varía entre 0.4 y 0.8 m, y existe allí una rica comunidad de macrófitas (Egeria densa, Ceratophyllum demersum, Rorippa nasturtium aquaticum, Lemna gibba, Potamogeton sp., Ludwiggia sp.) cuya estructuración se ve modificada con la variación de la velocidad del agua (Gantes & Tur 1995). Estas plantas influyen en el ordenamiento de la comunidad de perifiton y en el sedimento, y también en el fitobentos como fuente de alimento y refugio (Giorgi & Tiraboschi 1999).
Muestreo y tratamiento de datos
Se obtuvieron muestras mensuales de macrófitas en la orilla y el centro del arroyo, en seis sub-estaciones, tres en el remanso y tres en el rápido (Figura 2). En cada punto de muestreo se extrajo la totalidad de las macrófitas en cuadrados de 25 x 25 cm y se separaron los ejemplares de anfípodos, que fueron fijados en formol al 4%. También se midieron la biomasa de macrófitas (en g de peso seco/m2), la biomasa de perifiton y la biomasa de fitobentos (ambos en mg de Clorofila-a/m2) siguiendo el método de Aminot modificado (Wetzel 1981).
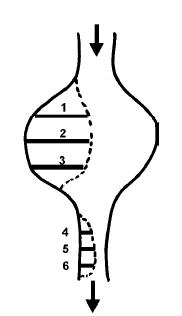
Figura 2. Esquema del muestreo en el arroyo Las Flores. El dibujo representa la forma del cauce vista en planta, las líneas de puntos delimitan las zonas con macrófitas en el remanso y el rápido, las barras numeradas representan las transectas sobre las que extrajeron las muestras, y las flechas indican la dirección del flujo del agua.
Figure 2. Sampling scheme at Las Flores stream. The figure represents the shape of the stream from above view, shaded lines show the edge of the macrophyte zone, numbered bars show the sampling transects, and arrows indicate the flow of the stream.
Bajo microscopio estereoscópico se separaron las dos especies de anfípodos, H. (M.) curvispina y H. (M.) sp, registrando su abundancia (individuos/m2). De cada muestra se tomaron diez hembras ovígeras y se contabilizó el número de huevos o embriones en cada marsupio para obtener la fecundidad (expresada como número de huevos o embriones por hembra). Luego se secaron a 60 °C hasta peso constante, registrando su biomasa (g de peso seco/m2) en el total de la muestra. La producción secundaria se calculó por el método de suma de incrementos (Downing & Rigler 1971). Se calcularon los coeficientes de correlación entre la densidad, la biomasa, la fecundidad y la producción secundaria de ambas especies de anfípodos con la biomasa de macrófitas, de fitobentos y de perifiton.
RESULTADOS
Las fracciones vegetales estudiadas mostraron una dinámica escalonada: el perifiton tuvo su máxima biomasa en junio, el fitobentos un poco más tarde, en octubre, y las macrófitas alcanzaron su máximo desarrollo entre noviembre y febrero (Figura 3). Las poblaciones de ambos taxa de anfípodos mostraron variaciones relacionadas al ciclo de las plantas (Figura 4). H. (M.) curvispina mostró su mayor abundancia en octubre, coincidentemente con la mayor biomasa de fitobentos, y su mayor biomasa total en noviembre. Por su parte, H. (M.) sp. tuvo sus máximos de densidad y biomasa en enero, coincidentemente con el mayor valor de biomasa de macrófitas en ese mismo mes. La fecundidad máxima de H. (M.) curvispina se registró en septiembre, mientras que la de H. (M.) sp. se registró en octubre (Tabla 1).
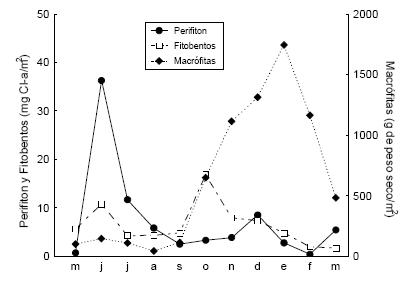
Figura 3. Variación mensual de la biomasa de perifiton, de fitobentos y de macrófitas en el arroyo Las Flores.
Figure 3. Monthly variation of periphyton, phytobenthos, and macrophyte biomass in Las Flores stream.
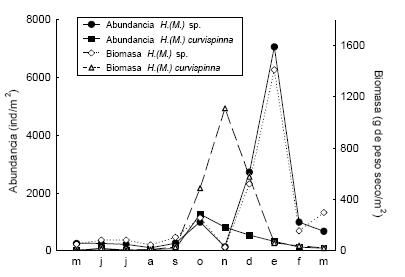
Figura 4. Dinámica poblacional de los anfípodos del arroyo Las Flores entre 1992 y 1993. Se muestra la variación mensual de la abundancia y de la biomasa de Hyalella (M.) sp. y de Hyalella (M.) curvispina.
Figure 4. Population dynamics of amphipods in Las Flores stream from 1992 to 1993. Monthly variation of the abundance and biomass of Hyalella (M.) sp. and Hyalella (M.) curvispina are shown.
Tabla 1. a) Fecundidad promedio (± EE), estimada como número de huevos por hembra, y producción secundaria (en mg.m-2.mes-1) de los anfípodos del arroyo Las Flores. b) Los valores son comparados con los de otras especies.
Table 1. a) Average fecundity (± SE), estimated as number of eggs per female, and secondary production (in mg.m-2.month-1) of amphipods from Las Flores stream. b) Values are compared with those from other species.
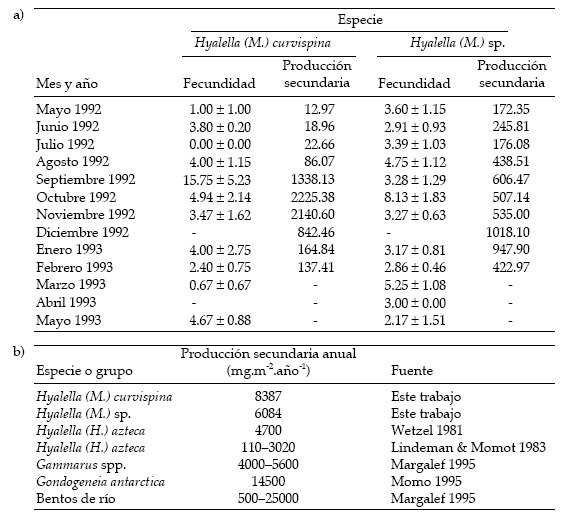
La producción secundaria mensual de H. (M.) curvispina tuvo su máximo en octubre, alcanzando un valor anual de 8387 mg.m-2.año-1 (Tabla 1). En H. (M.) sp. el máximo de producción se observó en diciembre, con un valor anual total de 6084 mg.m-2.año-1. En la Tabla 1 se incluyen, con fines comparativos, valores de producción secundaria anual correspondientes a otras especies seleccionadas, a partir de diversas fuentes bibliográficas.
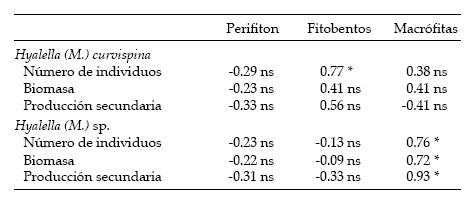
Existieron correlaciones significativas entre la abundancia de fitobentos y el número de individuos de H. (M.) curvispina, y entre la abundancia de macrófitas y la abundancia, la biomasa y la producción secundaria de H. (M.) sp. (Tabla 2). La biomasa de H. (M.) curvispina siguió a la abundancia de fitobentos, aunque con algo de retardo (Figuras 3 y 4); al correlacionar la abundancia de fitobentos de un mes dado con la biomasa de esta especie correspondiente al mes siguiente, el valor del coeficiente de correlación fue de 0.73, siendo altamente significativo (P < 0.05).
Tabla 2. Correlaciones entre la abundancia, la biomasa y la producción secundaria de los anfípodos del arroyo Las Flores y la abundancia de perifiton, de fitobentos y de macrófitas. *: P < 0.05; ns: no significativo.
Table 2. Correlations between density, biomass, and secondary production of amphipods, and periphyton, phytobenthos and macrophyte abundance at Las Flores stream. *: P < 0.05; ns: not significant.
DISCUSIÓN
Los valores significativos de las correlaciones entre las variables indican que la abundancia de macrófitas tiene una influencia importante sobre H. (M.) sp., tanto en su abundancia y biomasa como en su producción secundaria. En cambio, H. (M.) curvispina está básicamente influida por la biomasa de fitobentos, su alimento principal, pero esta influencia se manifiesta en el número de individuos. No obstante, como se mencionó más arriba, la biomasa de H. (M.) curvispina manifiesta la influencia del fitobentos, pero con un retardo aproximado de un mes.
La producción secundaria de las poblaciones aquí estudiadas está dentro del rango observado en otros ambientes bentónicos similares y es mayor que la estimada para otros anfípodos de agua dulce (Tabla 1), incluyendo los de la especie Hyalella (H.) azteca (Lindeman & Momot 1983). Algo similar ocurre con los valores de biomasa, entre los que se observan picos de más de 1000 mg/m2, mientras que Lindeman y Momot (1983), estudiando H. (H.) azteca en diversos ambientes, no encuentran valores mayores a los 700 mg/m2. Los valores de fecundidad, en los que se encuentran picos de 8 a 15 huevos por hembra según la especie, están dentro del rango hallado por France (1992) para H. (H.) azteca; este autor encuentra fecundidades comprendidas entre 5 y 32 huevos por hembra. Es importante destacar que el ambiente elegido se puede considerar bastante "benigno" para los anfípodos, ya que presenta una gran abundancia de plantas que brindan refugio contra los potenciales depredadores, constituyendo un tipo de ambiente muy representativo, estructurado en forma de pequeños remansos encadenados. Además, durante el período estudiado no hubo grandes crecientes que arrastrasen plantas y crustáceos, como se observa en ocasiones en este tipo de ambiente (Gantes & Tur 1995).
La mayor abundancia de H. (M.) curvispina coincide con el mes de mayor fecundidad; esta especie se reproduce principalmente en septiembre. Su biomasa se hace máxima algo más tarde, coincidiendo con la mayor producción secundaria mensual en octubre, de manera que esta producción secundaria está determinada sobre todo por la reproducción y el crecimiento de los juveniles nacidos en el mes anterior. El caso de H. (M.) sp. es diferente, ya que mantiene una fecundidad más pareja a lo largo del año y sus picos de biomasa y producción secundaria están retrasados respecto a su máxima fecundidad, que se da en octubre. La biomasa más alta de H. (M.) sp. se observa en el mes de enero, mientras que su máxima producción secundaria se da en diciembre; esto está indicando que, en esta especie, la producción secundaria recibe principalmente el aporte del crecimiento de los adultos.
Las correlaciones observadas entre los parámetros poblacionales de los anfípodos y la biomasa de fitobentos, de perifiton y de macrófitas, sugieren que H. (M.) curvispina depende en gran medida del fitobentos, al que utilizaría como alimento (Giorgi & Tiraboschi 1999). Esto no significa que solo se alimente de fitobentos y, de hecho, es probable que coma sedimento; sin embargo, la mayor cantidad de fitobentos aporta materia orgánica fresca al sedimento, aumentando seguramente su valor nutritivo. En cambio, H. (M.) sp., que según se pudo observar es un agresivo carnívoro y se alimenta de H. (M.) curvispina, depende más de las macrófitas a las que probablemente usa como refugio. La máxima biomasa de H. (M.) sp. está retrasada dos meses con respecto al máximo de la biomasa de su presa principal, H. (M.) curvispina, y va creciendo en coincidencia con un mayor desarrollo de las macrófitas sumergidas (principalmente Egeria densa y Ceratophyllum demersum), que le brindan un hábitat muy favorable, rápidamente colonizado. Probablemente este anfípodo se alimente entre las macrófitas de otros materiales disponibles, tales como restos de pequeños organismos herbívoros como copépodos ciclopoideos, muy abundantes en este hábitat (Momo & Casset 1996). Esto no le impide atacar frecuentemente a los individuos de H. (M.) curvispina que se alimentan sobre el fondo del arroyo (obs. pers.). Si H. (M.) curvispina fuese el único alimento de H. (M.) sp., al menos en la época primaveral, habría que suponer una eficiencia de conversión de más del 40%, más alta que algunos valores habitualmente admitidos (Wetzel 1981; Margalef 1983, 1995), así que es muy probable que H. (M.) sp. tenga disponible otro tipo de presas a lo largo del año.
Las relaciones mencionadas en el párrafo anterior se esquematizan en la Figura 5. Es muy probable que este modelo se repita a lo largo de todo el arroyo estudiado, ya que el mismo cuenta con numerosos remansos con características similares (Momo & Casset 1996).

Figura 5. Relaciones hipotéticas entre la vegetación y los anfípodos en el microambiente estudiado en el arroyo Las Flores. Las flechas representan la influencia de una variable sobre otra; sobre cada flecha se indica de qué tipo es la influencia. Cerca de los compartimentos se indican los efectos producidos en cada variable por las que la influencian.
Figure 5. Hypothetical relationships between primary producers and amphipods in the studied microenvironment in Las Flores stream. Arrows represent the influence of each variable on the other; the character of this influence is shown above each arrow. Effects on each variable are indicated near to the boxes.
AGRADECIMIENTOS
Agradecemos al Dr. Coviella por su colaboración en la preparación de la versión final del manuscrito.
BIBLIOGRAFÍA
BORGMANN, U; KM RALPH & WP NORWOOD. 1989. Toxicity test procedures for Hyalella azteca, and chronic toxicity of cadmiun and pentachlorophenol to H. azteca, Gammarus fasciatus, and Daphnia magna. Arch. Environ. Contam. Toxicol. 18(5):756–764. [ Links ]
CAMINO, NB. 1989. Limnomermis bonaerensis sp. n. (Nematoda, Mermithidae), a parasite of amphipods (Crustacea, Malacostraca) in Argentina. Revista Ibérica de Parasitología 49(3):227–231. [ Links ]
CAVALIERI, F. 1959. Una nueva especie de anfípodo de agua dulce (Crustacea: Amphipoda). Physis 21(4):278–288. [ Links ]
CAVALIERI, F. 1968. Hyalella pampeana sp. nov., una nueva especie de anfípodo de agua dulce (Gammaridea: Hyalellidae). Neotrópica 14(45):107–117. [ Links ]
CHAPPIE, DJ & GA BURTON JR. 1997. Optimization of in situ bioassays with Hyalella azteca and Chironomus tentans. Environ. Toxicol. Chem. 16(3):559–564. [ Links ]
COLLYARD, SA; GT ANKLEY; RA HOKE & T GOLDSTEIN. 1994. Influence of age on the relative sensitivity of Hyalella azteca to diazion, alkylphenol ethoxylates, copper, cadmiun and zinc. Arch. Environ. Contam. Toxicol. 26(1):110–113. [ Links ]
DEFOE, DL & GT ANKLEY. 1998. Influence of storage time on toxicity of freshwater sediments to benthic macroinvertebrates. Environ. Pollut. 99(1):123–131. [ Links ]
DOWNING, JA & FH RIGLER. 1971. A manual on methods for the assessment of secondary productivity in fresh waters. Blackwell Scientific Publications, Oxford. 500 pp. [ Links ]
FEIJOÓ, CS; ADN GIORGI; ME GARCÍA & FR MOMO. 1999. Temporal and spatial variability in streams of a Pampean basin. Hydrobiologia 394(1):41–52. [ Links ]
FRANCE, RL. 1992. Biogeographical variation in sizespecific fecundity of the amphipod Hyalella azteca. Crustaceana 62(3):240–248. [ Links ]
GANTES, HP & NM TUR. 1995. Variación temporal de la vegetación en un arroyo de llanura. Rev. Brasil. Biol. 55(2):259–266. [ Links ]
GARCÍA GONZÁLES, P & ME SOUTO. 1987. Estudio experimental sobre apareamiento y especificidad sexual en Hyalella curvispina (Amphipoda). Hidrobiología 6:1–10. [ Links ]
GIORGI, ADN; ME GARCÍA; C FEIJOÓ; WO CUEVAS & A GÓMEZ VÁZQUEZ. 2000. Estudio comparativo de los principales arroyos afluentes del río Luján (Argentina). Pp. 99–105 en: JE Péfaur (ed.). Ecología latinoamericana. Actas del III Congreso Latinoamericano de Ecología. Universidad de Los Andes, Mérida, Venezuela. [ Links ]
GIORGI, ADN; G PONCIO; F DUTWEILER; F MARTINELLI & C FEIJOÓ. 1996. Variación estacional de la abundancia de moluscos y anfípodos en un arroyo de llanura. Pp. 36–37 en: VI Jornadas Pampeanas de Ciencias Naturales, Santa Rosa, Argentina. [ Links ]
GIORGI, ADN & B TIRABOSCHI. 1999. Evaluación experimental del efecto de dos grupos de macroinvertebrados (anfípodos y gasterópodos) sobre algas epífitas. Ecología Austral 9(1):35–44. [ Links ]
GROSSO, LE & M PERALTA. 1999. Anfípodos de agua dulce sudamericanos. Revisión del género Hyallela Smith. Acta Zoológica Lilloana 45(1):79–98. [ Links ]
HOGG, ID & DD WILLIAMS. 1996. Response of stream invertebrates to a global-warming thermal regime: an ecosystem-level manipulation. Ecology 77(2):395–407. [ Links ]
HOKE, RA; GT ANKLEY; AM COTTER; T GOLDSTEIN; PA KOSIAN ET AL. 1994. Evaluation of equilibrium partitioning theory for predicting acute toxicity of field-collected sediments contaminated with DDT, DDE and DDD to the amphipod Hyalella azteca. Environ. Toxicol. Chem. 13(1):157–166. [ Links ]
INGERSOLL, C. 1991. Sediment toxicity and bioaccumulation testing. ASTM Standardization News 19(4):28–33. [ Links ]
KEMBLE, NE; FJ DWYER; CG INGERSOL; TD DAWSON & TJ NORBERG KING. 1999. Tolerance of freshwater test organisms to formulated sediments for use as control materials in whole-sediment toxicity test. Environ. Toxicol. Chem. 18(2):222–230. [ Links ]
KLAGES, M & J GUTT. 1990a. Observations on the feeding behaviour of the Antarctic Gammarid Eusirus perdentatus Chevreux, 1912 (Crustacea: Amphipoda) in aquaria. Polar Biol. 10:359–364. [ Links ]
KLAGES, M & J GUTT. 1990b. Comparative studies on the feeding behaviour of high Antarctic amphipods (Crustacea) in laboratory. Polar Biol. 11:73–79. [ Links ]
LABERGE, RJA & JD MC LAUGHLIN. 1989. Hyalella azteca (Amphipoda) as an intermediate host of the nematode Streptocara crassicauda. Can. J. Zool. 67(9):2335–2340. [ Links ]
LINDEMAN, DH & WT MOMOT. 1983. Production of the amphipod Hyalella azteca (Saussure) in a northern Ontario lake. Can. J. Zool. 61(9):2051–2059. [ Links ]
LOPRETO, E. 1982. Contribución a la bioecología del anfípodo dulceacuícola Hyalella pampeana Cavalieri. Neotrópica 28(80):97–101. [ Links ]
MARGALEF, R. 1983. Limnología. Omega, Barcelona. 1010 pp. [ Links ]
MARGALEF, R. 1995. Ecología. Omega, Barcelona. 951 pp. [ Links ]
MOMO, FR. 1995. Ciclo de vida y distribución espacial de Gondogeneia antarctica Chevreux (Crustacea, Amphipoda). Tesis Doctoral, Universidad de Buenos Aires, Argentina. 254 pp. [ Links ]
MOMO, FR & MA CASSET. 1996. Estructura de la comunidad de microcrustáceos del arroyo Las Flores (cuenca del río Luján, Buenos Aires, Argentina). Pp. 57–65 en: VI Jornadas Pampeanas de Ciencias Naturales, Santa Rosa, Argentina. [ Links ]
MOURITSEN, KN; T JENSEN & KT JENSEN. 1997. Parasites on an intertidal Corophium-bed: factors determining the phenology of microphallid trematodes in the intermediate host populations of the mudsnail Hydrobia ulvae and the amphipod Corophium volutator. Hydrobiologia 355(1):61–70. [ Links ]
MUSKÓ, IB. 1992. Amphipoda species found in Lake Balaton since 1897. Miscnea. Zool. Hung. 7:59–64. [ Links ]
PARSONS, JK & RA MATTHEWS. 1995. Analysis of the associations between macroinvertebrates and macrophytes in a freshwater pond. Northwest Science 69(4):265–275. [ Links ]
POI DE NEIF, A. 1992. Invertebrados asociados a los macrófitos sumergidos de los esteros del Iberá (Corrientes, Argentina). Ambiente Subtropical 2:45–63. [ Links ]
THURSTON, MH. 1970. Growth in Bovallia gigantea (Pfeffer) (Crustacea, Amphipoda). Pp. 269–278 en: MW Holdgate (ed). Antarctic Ecology. Academic Press, Londres, Reino Unido. [ Links ]
WETZEL, G. 1981. Limnología. Omega, Barcelona. [ Links ]














