Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral v.12 n.1 Córdoba ene./jun. 2002
TRABAJOS ORIGINALES
Comparación del efecto fitotóxico de aleloquímicos de Baccharis boliviensis (Asteraceae) en la germinación de Trichocereus pasacana (Cactaceae)
Ada Cazón1,*, Marta L de Viana1 & José C Gianello2
1 Inst. de Ecología y Ambiente Humano, Fac. de Ciencias Naturales, Univ. Nac. de Salta, Salta, Argentina
2 Depto. Química Orgánica, Universidad Nacional de San Luis, San Luis, Argentina
* INEAH; Facultad de Ciencias Naturales, Universidad Nacional de Salta; Buenos Aires 177; 4400 Salta; Argentina. Email: cazon@unsa.edu.ar
Recibido: 13 octubre 2001;
Revisado: 26 febrero 2002;
Aceptado: 25 marzo 2002
RESUMEN. El género Baccharis presenta una amplia distribución en regiones áridas del noroeste argentino. Una de las especies arbustivas de este género, Baccharis boliviensis, se asocia con diversas plantas en las comunidades vegetales del Parque Nacional Los Cardones en la Provincia de Salta. Estudios realizados sobre la distribución espacial del cardón Trichocereus pasacana con relación al espacio disponible mostraron que, a pesar de que sus semillas son abundantes bajo la copa de Baccharis boliviensis, no se observan plantas creciendo en asociación, a pesar del requerimiento de plantas nodrizas para un establecimiento exitoso del cardón. Extractos acuosos del follaje de Baccharis boliviensis, repartidos en hexano, cloroformo y acetato de etilo, inhibieron la germinación de Trichocereus pasacana. El cloroformo fue el solvente más efectivo para la extracción de los compuestos fitotóxicos. De algunas fracciones de la cromatografía en columna del extracto clorofórmico se aislaron tres flavonoides cuyas estructuras fueron determinadas por métodos espectroscópicos y TLC sobre gel de sílice. Los resultados de los bioensayos mostraron que la germinación de Trichocereus pasacana presentó una respuesta diferencial a los distintos compuestos presentes en las fracciones aisladas del extracto clorofórmico. El efecto inhibidor sólo se presentó en el extracto clorofórmico, lo que sugiere la existencia de un efecto sinérgico o aditivo de los compuestos fitotóxicos.
Palabras clave: Alelopatía; Baccharis boliviensis; Trichocereus Pasacana; Cromatografía; Inhibición; Facilitación.
ABSTRACT. Comparative phytotoxic effects of Baccharis boliviensis (Asteraceae) allelochemicals on the germination of Trichocereus pasacana (Cactaceae): The genus Baccharis has a wide distribution in the arid regions of Northwestern Argentina. One species of this genus, Baccharis boliviensis, growths in association with other plant species at Los Cardones National Park, Salta Province. Studies carried out on the spatial distribution of the cacti Trichocereus pasacana in relation to available space show that although cacti seeds are abundant beneath Baccharis boliviensis canopy, no adult plants are found growing in association with this species, in spite of the requirement of a nurse plant for a successful cacti establishment. Aqueous extracts from Baccharis boliviensis foliage extracted with hexane, chloroform and ethyl acetate inhibited Trichocereus pasacana germination. Chloroform was the most effective solvent for extracting the phytotoxic compounds. From this extract we isolated three flavonoids whose structures were determined by spectroscopic methods and TLC in silica gel. The germination bioassay showed that Trichocereus pasacana had a differential response to the compounds from the tested extracts. The inhibitory effect was only detected in the chloroformic extract, which suggests a synergistic effect.
Keywords: Allelopaty; Baccharis boliviensis; Trichocereus pasacana; Chromatography; Inhibition; Facilitation.
INTRODUCCIÓN
Muchas plantas producen metabolitos secundarios que influyen en los procesos de germinación y crecimiento de otras plantas (Heisey 1990). Este fenómeno es parte de la alelopatía, un proceso que consiste en la liberación al ambiente de metabolitos secundarios producidos por plantas y microorganismos capaces de afectar los procesos biológicos de otros organismos (Seigler 1996). La alelopatía tiene, por lo tanto, relevancia ecológica y puede ser responsable de cambios en la composición de especies en las comunidades vegetales. La alelopatía puede ser también un factor importante en la regulación de la estructura de las comunidades vegetales y de la velocidad de crecimiento de las plantas en condiciones naturales (Wardle et al. 1996). Esta función alelopática ha sido atribuida a varios flavonoides, estructuras fenólicas y terpenoides (Whittaker & Feeny 1971; Cazón et al. 2000).
El género Baccharis (Asteraceae) agrupa aproximadamente a 400 especies, principalmente de origen americano. En el noroeste argentino, Baccharis boliviensis presenta una amplia distribución en las Provincias Fitogeográficas del Monte, Puna y Prepuna (Cabrera 1976; de Viana et al. 1989). Se han realizado numerosos estudios acerca de la composición química de distintas especies del género (Gianello & Giordano 1984; Bohlmann et al. 1985; Jarvis et al. 1991; Hudson & Stiling 1997), los que han revelado la presencia de numerosos metabolitos secundarios como diterpenoides y flavonoides. En el caso de Baccharis boliviensis, se ha informado la presencia de ent-clerodanos, diterpenos (Zdero et al. 1989) y ácido ferrúlico que inhibe la germinación de Trichocereus pasacana (Cazón et al. 2000).
Estudios realizados sobre la distribución espacial del cardón (Trichocereus pasacana, Cactaceae) en relación con las especies arbustivas asociadas y con el banco de semillas, indican la existencia de un patrón diferencial en la abundancia tanto de las semillas como de las plantas adultas. Para el éxito en la germinación y establecimiento, esta cactácea columnar necesita de una relación de facilitación provista por la copa de algunas especies como Larrea divaricata, Aphyllocladus spartioides y Prosopis ferox. Sin embargo, existen otras especies arbustivas como Baccharis boliviensis, Plectrocarpa rougesii, Verbena sp. y Senna crassiramea, entre otras, bajo cuyas copas se han detectado semillas de cardón a pesar de que su abundancia como renuevos o adultos es muy baja (de Viana 1995, 1996-7, 1999; de Viana et al. 2001). Esto sugiere la posibilidad de que exista alguna relación alelopática entre algunos de estos arbustos y Trichocereus pasacana, en particular con Baccharis boliviensis, que produce ácido ferrúlico cuyo efecto inhibidor de la germinación del cardón ya ha sido reportado (Cazón et al. 2000).
El objetivo del presente trabajo es realizar un estudio comparativo del efecto alelopático del extracto clorofórmico y sus componentes, aislados de la parte aérea de Baccharis boliviensis, sobre la germinación de Trichocereus pasacana, contribuyendo al conocimiento de las interacciones de inhibición o facilitación entre el cardón y algunos arbustos asociados.
MÉTODOS
Se trabajó con la parte aérea (tallos, hojas y capítulos) de Baccharis boliviensis recolectados en el Parque Nacional Los Cardones (25°03'– 25°23'S; 65°51'–66°05'O) en junio de 1997. El material vegetal (375 g) se procesó siguiendo los métodos descriptos en Cazón et al. (2000). Este procedimiento permitió aislar del extracto clorofórmico al ácido ferrúlico, entre otros compuestos. Se continuó analizando las fracciones obtenidas de la columna cromatográfica, lo que permitió separar las siguientes fracciones luego de purificar en columna de Sephadex LH20 con un flujo lento de metanol: 12/17 (12.39 mg sólido blanco), 10 (7.5 mg sólido amarillo) y la 6/9 (0.4 mg sólido amarillo), como resultado de repetidas cromatografías de la fracción 31/32. La identificación de los compuestos aislados se basó en espectros 1-H RMN corridos en CDCl3 a 200 MHz con un espectrómetro Bruker AC-200. Estos estudios se realizaron en el Departamento de Química Orgánica de la Universidad Nacional de San Luis.
El efecto del extracto clorofórmico y de los metabolitos aislados de ese extracto sobre la germinación de semillas de Trichocereus pasacana se evaluó con un bioensayo en cámara de cultivo con fotoperíodo de 12 h de luz, a 25–28 °C, siguiendo un diseño completamente al azar, con cuatro repeticiones de 40 semillas por tratamiento. Las semillas fueron colocadas en cajas de Petri de 10 cm de diámetro sobre arena esterilizada embebida con 1.25 mL de solución de los metabolitos, preparada con una concentración de 4 mg/10 mL de cloroformo. Los controles se prepararon embebiendo el sustrato con el solvente puro (con el objeto de descartar posibles efectos inhibidores) y con agua destilada. Todos los tratamientos se regaron diariamente con agua destilada y se registró la germinación de las semillas. Al final del bioensayo (30 días) se registró la longitud de la radícula y del talluelo. Los resultados del número máximo de germinaciones, la velocidad de germinación (indicador más sensible del efecto fitotóxico) y la longitud de la radícula y del talluelo (Ahmed & Wardle 1994) se analizaron con un Análisis de Varianza.
RESULTADOS
Los análisis espectroscópicos permitieron identificar algunos metabolitos secundarios causantes del efecto fitotóxico como flavonoides (Figura 1). El espectro UV-Visible en metanol del metabolito presente en la fracción 12-17 (12.30 mg) mostró absorciones con máximo a 280 y 352 nm. El espectro 1-H RMN (CDCl3) mostró los siguientes corrimientos (expresados en ppm a partir de TMS y los valores de las constantes de acoplamiento en Hz): -OH11.48 (s), H2 7.9 (s)H2´ 7.85(s), H6 6.8 (d,3), H5´ 7.05(d,9), -OCH3 4.15(s,3H), 4.05(s,3H), -OCH3 4 (s,3H) y 3.95 (s,3H). El espectro de masa mostró los siguientes iones: 302, 285, 192, 167. Este compuesto es una flavanona, el 7-Oeriodictiol. Su presencia se confirmó por EM usando el compuesto triacetilado.
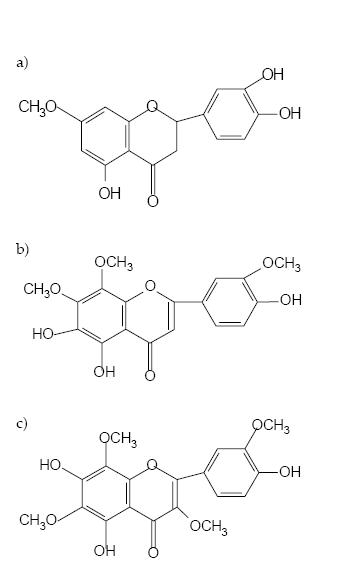
Figura 1. Flavonoides aislados del extracto clorofórmico de Baccharis boliviensis del Parque Nacional Los Cardones: flavanona (a), flavona (b) y flavonol (c).
Figure 1. Flavonoids isolated from the chloroformic extract of Baccharis boliviensis from Los Cardones National Park: flavanone (a), flavone (b), and flavonol (c).
El espectro UV-Visible en metanol de la fracción 10 (7.5 mg) mostró absorciones con máximo a 278 y 348 nm. El espectro 1-H RMN (CDCl3) mostró los siguientes corrimientos (expresados en ppm a partir de TMS y los valores de las constantes de acoplamiento en Hz): H2´ 7.78 (d,3), H6´ 7.7 (d,3), H5´ 7.0 (d,9), -OCH3 4.0 (s,3H), 3.98 (s,3H), 3.97 (s,3H) y 3.85 (s,3H). El espectro de masa mostró los siguientes iones: 390, 375, 357, 347, 197, 164, 151 y 135. Este compuesto corresponde a un flavonol que tiene un pico base a m/z 375, encontrado en Gutierrezia microcephala (Roitman & James 1985).
El espectro UV-Visible en metanol del metabolito presente en la fracción 6/9 (0.4 mg) mostró absorciones con máximo a 280 y 342 nm. El espectro 1-H RMN (CDCl3) mostró los siguientes corrimientos (expresados en ppm a partir de TMS y los valores de las constantes de acoplamiento en Hz): H6´ 7.55 (d,9), H2´ 7.45 (d,3), H5´ 7.0 (d,9), H3 6.6 (s), -OCH3 4.0 (s,3H), 3.98 (s,3H) y 3.95 (s,3H). El espectro de masa mostró los siguientes iones: 360, 345, 317, 197 y 169. Este compuesto se identificó como mejoranina (Voirin et al. 1984). Se realizó la acetilación de esta flavona, obteniendo un compuesto diacetilado que por EM dio un ion M+444.
El porcentaje de germinación de las semillas fue bajo en todos los tratamientos del bioensayo (Tabla 1). Esto podría estar relacionado con la longevidad de las semillas de Trichocereus pasacana, dado que la misma es, en promedio, de cinco años, y su viabilidad disminuye con el transcurso del tiempo (de Viana 1995, 1999). Sin embargo, se hace el supuesto que el efecto de pérdida de viabilidad es homogéneo en el lote de semillas empleadas que pertenecieron a la cosecha realizada en 1999.
Tabla 1. Porcentaje y velocidad de germinación (número acumulativo de semillas / día) , longitud de la radícula (cm) y de las plántulas (cm) de Trichocereus pasacana expuestos a distintos tratamientos. Los valores son promedios ± EE, con el número de plantas medidas (entre paréntesis).
Table 1. Percentage and speed of germination (cumulative number of seeds / day), root length (cm), and shoot length (cm) of Trichocereus pasacana exposed to different treatments. Values are means ± SE, with number of measured plants (in parentheses).
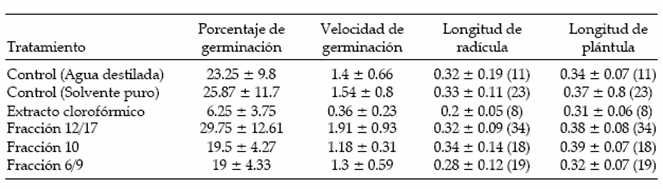
El bioensayo mostró diferencias significativas en el número de semillas germinadas (F = 2.6; P = 0.06), en el porcentaje de germinación (F = 2.6; P = 0.01) y en las longitudes de radículas (F = 1.9; P = 0.09) y de plántulas (F = 2.8; P = 0.02), no así en la velocidad de germinación (F = 1.9; P = 0.14). Existieron diferencias significativas en el porcentaje de germinación entre el extracto clorofórmico y la fracción 12/17 y entre el extracto clorofórmico y la fracción 6/9 con los demás tratamientos en la longitud de radículas y de plántulas (Tabla 1). No se detectaron diferencias significativas entre los otros tratamientos (Tabla 1 y Figura 2). El análisis comparativo del efecto fitotóxico se evidencia en el extracto clorofórmico que inhibió la germinación y el crecimiento de las plántulas, mientras que la fracción 12/17 presentó un efecto estimulante.

Figura 2. Número acumulativo de semillas germinadas de Trichocereus pasacana expuestas a distintos tratamientos.
Figure 2. Cumulative number of Trichocereus pasacana seeds exposed to different treatments.
DISCUSIÓN
Los resultados muestran que Trichocereus pasacana presentó una respuesta diferencial a los distintos tratamientos probados. Es más frecuente que la alelopatía resulte de la actividad sinérgica de un número de compuestos o metabolitos que de la de un simple aleloquímico (Williamson 1990). Es interesante destacar que el efecto inhibidor sólo se presentó en el extracto clorofórmico, lo que puede deberse a un efecto sinérgico de los compuestos contenidos en este extracto. De los compuestos aislados anteriormente, el único que presentó efecto inhibidor es el ácido ferrúlico (Cazón et al. 2000). Los compuestos aislados en este trabajo, una flavanona (el 7-O-eriodictiol), una flavona (la mejoranina) y un flavonol (el 5,7,3-trihidroxi-6,8,3´, 4´tetrametoxi flavona), no presentaron efecto inhibidor. La flavanona presentó un efecto facilitador o estimulante tanto de la germinación como del crecimiento de las plántulas de Trichocereus pasacana.
En la actualidad se conocen más de 2000 flavonoides. Ellos pueden encontrarse como glicósidos solubles en agua y localizados en la savia. El esqueleto C15 de la aglicona aparece en varias clases estructurales de acuerdo al estado de oxidación del anillo central: hidroxilado, metoxilado y acilado con ácidos alifáticos y aromáticos (Strack 1997). Se ha propuesto que los flavonoides tienen altos coeficientes de absorción en el UV pero excelente transmitancia en la región activa del espectro. Por ello funcionan como filtros, protegiendo sitios sensibles contra la incidencia de la radiación UV-Visible (Cadwell et al. 1983).
La lluvia tiene el potencial para transferir los compuestos alelopáticos solubles en agua desde las hojas al suelo y esta acción es la que con la maceración acuosa se trata de simular en este trabajo. Esta técnica ha sido criticada por muchos autores porque es difícil establecer las concentraciones de aleloquímicos en condiciones de campo e imitarlas en condiciones experimentales (Ahmed & Wardle 1994). Sin embargo, es una forma de acercarnos a lo que sucede en la naturaleza. La parte más difícil de los estudios de alelopatía es, sin duda, conocer en qué cantidad se producen y liberan los metabolitos secundarios, qué sucede con ellos una vez que llegan al sustrato, qué modificaciones sufren en él por efecto de la microbiota, la humedad, el pH y la temperatura (entre otros), y si los cambios los convierten en compuestos más activos o les hacen perder su bioactividad (Heisey 1996). Todos estos interrogantes hacen que el estudio de la alelopatía sea un proceso complejo y difícil de abordar y, por lo tanto, que requiera de trabajo interdisciplinario.
Este tipo de trabajo nos lleva a reflexionar acerca de la importancia de probar tanto los extractos crudos como los compuestos aislados, ya que las conclusiones pueden ser diferentes tomando cada compuesto aislado. Los resultados de esta investigación sugieren que estos compuestos podrían ser desarrollados como herbicidas naturales o bien como estimulantes del crecimiento. Estos productos naturales tendrían más ventajas sobre los sintéticos, sumado a su mayor selectividad y actividad, su persistencia y su reducida acumulación en el ambiente (Heisey 1990). Su estudio en laboratorio permitiría obtener compuestos con estructura modificada, con mayor actividad herbicida o estimulante.
AGRADECIMIENTOS
Agradecemos la colaboración técnica de F. Serapio y al Consejo de Investigación de la Universidad Nacional de Salta, Argentina, por el apoyo económico brindado a esta investigación.
BIBLIOGRAFÍA
AHMED, M & DA WARDLE. 1994. Allelopathic potential of vegetative and flowering ragort (Senecio jacobea L.) plants against associated pasture species. Plant Soil 164:61–68. [ Links ]
BOHLMANN, F; S BANERJEE; J JAKUPOVIC; M GRENZ; L MISRA ET AL. 1985. Clerodane and labdane diterpenoids from Baccharis species. Phytochemistry 24:511–515. [ Links ]
CABRERA, AL. 1976. Regiones fitogeográficas argentinas. Pp. 1–85 en: Enciclopedia argentina de agricultura y jardinería. Tomo II. Fascículo 1. Acmé, Buenos Aires. [ Links ]
CADWELL, NM; R ROBBERECHT & SD FLINT. 1983. Internal filters: prospects for UV-acclimation in higher plants. Physiol. Plantarum 58:445–450. [ Links ]
CAZÓN, AV; ML DE VIANA & JC GIANELLO. 2000. Identificación de un compuesto alelopático de Baccharis boliviensis (Asteraceae) y su efecto en la germinación de Trichocereus pasacana (Cactaceae). Rev. Biol. Trop. 48: 47–51 [ Links ]
GIANELLO, JC & OS GIORDANO. 1984. Examen químico en seis especies del género Baccharis. Rev. Lat. Quim. 15:84–86. [ Links ]
HEISEY, RM. 1990. Allelopathic and herbicidal effects of extracts from tree of heaven (Ailanthus altissima). Am. J. Bot. 77:662–670. [ Links ]
HEISEY, RM. 1996. Identification of an allelopathic compound from Ailanthus altissima (Simaroubaceae) and characterization of its herbicidal activity. Am. J. Bot. 83:192–200. [ Links ]
HUDSON, EE & P STILING. 1997. Exploitative competition strongly affects the herbivorous insect community on Baccharis halimifolia. Oikos 79:521–528. [ Links ]
JARVIS, BB; N MOKHTARI-REJALI; EP SCHENKEL; CS BARROS & NI MATZENBACHER. 1991. Trichothecene mycotoxins from Brazilian Baccharis species. Phytochemistry 30:789–797. [ Links ]
ROITMAN, J & LF JAMES. 1985. Chemistry of toxic range plants highly oxygenated flavonol methyl ethers from Gutierrezia microcephala. Phytochemistry 24:835–845. [ Links ]
SEIGLER, DS. 1996. Chemistry and mechanisms of allelopathic interactions. Agron. J. 88:876–885. [ Links ]
STRACK, D. 1997. Phenolic Metabolism. Pp. 388–416 en: PM Dey & DB Harborne (eds). Plant biochemistry. Academic Press. [ Links ]
DE VIANA, M; N ACRECHE; P ORTEGA & M SALUSSO. 1989. Los Cardones: comunidades vegetales del Valle de Tin Tin. Publicaciones del Museo de Ciencias Naturales. Serie Conocer para Preservar Nº11. Universidad Nacional de Salta. Salta, Argentina. [ Links ]
DE VIANA, ML. 1995. Distribución del cardón (Trichocereus pasacana): ¿asociación positiva o dispersión? Tesis Doctoral. Universidad Nacional de Córdoba. Córdoba, Argentina. 76 pp. [ Links ]
DE VIANA, ML. 1996-7. Distribución del cardón en relación al espacio disponible y al banco de semillas. Rev. Biol. Trop. 44-45:95–103. [ Links ]
DE VIANA, ML. 1999. Seed production and seed bank of Trichocereus pasacana (Cactaceae) in northwestern Argentina. Trop. Ecol. 40:79–84. [ Links ]
DE VIANA, ML; S SUHRING & B MANLY. 2001. Application of randomization methods to study the association of Trichocereus pasacana (Cactaceae) with potential nurse plants. Plant Ecol. 156:193–197. [ Links ]
VOIRIN, B; J FVRE-BONVIN; V INDRA & AG RAMACHANDRAN NAIR. 1984. Structural revision of the flavone majoranin from Majorana hortensis. Phytochemistry 23:2973–2975. [ Links ]
WARDLE, DA; KS NICHOLSON & A RAHMAN. 1996. Use of a comparative approach to identify allelopathic potential and relationship between allelopathy bioassays and competition experiments for ten grassland and plant species. J. Chem. Ecol. 22:933–948. [ Links ]
WHITTAKER, RH & PP FEENY. 1971. Allelochemics: chemical interactions between species. Science 171:757–770. [ Links ]
WILLIAMSON, GB. 1990. Allelopathy, Koch's postulates and the neck riddle. Pp. 143–162 en: JB Grace & D Tilman (eds). Perspectives in plant competition. Academic Press. San Diego, EEUU. [ Links ]
ZDERO, C; F BOHLMANN; JC SOLOMON; RM KING & H ROBINSON. 1989. Ent-clerodanes and other constituents from Bolivian Baccharis species. Phytochemistry 28:531–542. [ Links ]














