Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral v.12 n.2 Córdoba jul./dic. 2002
TRABAJOS ORIGINALES
Gremios de manejo como indicadores de las condiciones del ambiente: un estudio de caso con aves y perturbaciones del hábitat en el Monte central, Argentina
Fernando A Milesi1,2,*, Luis Marone2,3, Javier Lopez de Casenave1,2, Víctor R Cueto1,2 & Eduardo T Mezquida2,4
1 Ecodes, Departamento de Ecología, Genética y Evolución, FCEyN, Universidad de Buenos Aires, Ciudad Universitaria, Buenos Aires, Argentina
2 Ecodes, Unidad de Fisiología y Ecofisiología Vegetal, IADIZA, Mendoza, Argentina
3 Centro de Estudios Avanzados en Ecología y Biodiversidad (CASEB), Santiago, Chile
4 Dirección actual: P. Alameda de Osuna 74 1º C, 28042 Madrid, España
* Ecodes, Depto. de Ecología, Genética y Evolución; FCEyN, UBA; Piso 4, Pab. 2, C. Universitaria; C1428EHA Buenos Aires, Argentina. Email: fermilesi@bg.fcen.uba.ar
Recibido: 13 septiembre 2001;
Revisado: 14 febrero 2002;
Aceptado: 20 febrero 2002
RESUMEN. Diferentes agrupamientos supra-específicos (e.g., gremios, grupos funcionales) son usados como herramientas de manejo para obtener indicadores simples o económicos del estado de los recursos o de la "salud" de las comunidades locales. Una de las propuestas es usar "gremios de manejo", que agrupan a las especies que tienen la misma respuesta a las perturbaciones de su ambiente. De acuerdo a la técnica a priori propuesta para formarlos, clasificamos las especies de aves del desierto del Monte central (Reserva de la Biosfera de Ñacuñán, Argentina) en gremios tróficos y de nidificación, utilizando datos propios, haciendo énfasis en el uso de microhábitats. Caracterizamos la estructura de la vegetación y estimamos la riqueza de especies de aves y la densidad de cada gremio en hábitats de bosque abierto de algarrobo protegidos ("control") y hábitats bajo dos de las perturbaciones más habituales en este sistema: incendio y pastoreo. Ambas perturbaciones estuvieron asociadas con cambios estructurales importantes y duraderos, en especial el incendio, reduciendo los valores de cobertura de los estratos de gramíneas y leñosas. El número de especies de aves siguió el mismo patrón. Las densidades de solo algunos de los gremios tróficos y de nidificación variaron entre condiciones de manera similar a la estructura de la vegetación. La obtención de gremios de manejo a partir de agrupar a las especies por su uso de recursos es una hipótesis pasible de ser puesta a prueba, y en nuestro caso la respuesta consistente ante la perturbación apareció sólo en aquellos casos triviales donde se afectaron drásticamente recursos esenciales para esas aves por definición (e.g., si no hay arbustos no hay aves que se alimentan en los arbustos). El agrupamiento a posteriori de especies que efectivamente respondan de manera similar a un impacto parece ser una herramienta útil, pero no está libre de problemas (circularidad, extrapolación a condiciones distintas, razonamiento plausible pero falaz). Además, en estos casos donde solo se asocian variables igualmente observables, es más fácil y directo medir el recurso perturbado que al indicador, por lo que éste se vuelve innecesario.
Palabras clave: Aves; Fuego; Gremios de manejo; Indicadores; Pastoreo; Perturbaciones; Monte.
ABSTRACT. Management guilds as indicators of environmental conditions: a case study with birds and habitat disturbances in the central Monte desert, Argentina: Different supra-specific groupings (e.g., guilds, functional groups) are used as management tools to obtain simple or economical indicators of the state of resources or "health" of local communities. One proposed approach was to use "management guilds", grouping those species that respond in a similar manner to the impacts in their environment. According to the a priori proposed technique, we classified the species of birds at the central Monte Desert (Biosphere Reserve of Ñacuñán, Argentina) into foraging and nesting guilds, using our own local data of diet, foraging behavior and nesting substrate, emphasizing microhabitat use. We estimated the richness of the bird assemblage, the density of each guild and the structure of the vegetation (cover of vegetation strata) in protected open forest ("control") habitats and in habitats affected by the two most common disturbances in this system: fire and grazing. Both perturbations were associated with long-standing important changes in the structure of vegetation, particularly the fire: a reduction of the cover of grasses and woody plants. The number of bird species followed the same trend than the structure of vegetation, but the densities of only some of the foraging and nesting guilds were correlated with these modifications. Obtaining management guilds by grouping species according to the common use of resources is a plausible hypothesis, but not a property established by definition. For example, granivores did not present an homogeneous intra-guild response, and the only guilds that showed a consistent outcome to these disturbances were those whose resources, by definition, were drastically altered (e.g., if there are no shrubs, the birds that forage searching in the shrubs disappear). The a posteriori grouping of species that respond in a similar way to the disturbance may produce a useful tool, but not without problems (circularity, unknown extrapolative power, plausible but fallacious reasoning). In these cases, in which two observable variables are been associated, it is easier and more direct to measure the affected resource rather than the indicator, being the latter unnecessary.
Keywords: Birds; Disturbances; Fire; Grazing; Indicators; Management guilds; Monte.
INTRODUCCIÓN
El uso de los gremios como instrumentos de predicción, evaluación o como medidas subrogadas del estado de los recursos (i.e., como indicadores) ha sido propuesto para el estudio de ambientes sujetos a perturbaciones humanas, para el monitoreo de ambientes administrados y como sustento de decisiones de manejo y conservación (Johnson 1981; Severinghaus 1981; Short & Burnham 1982; Verner 1984; Block et al. 1986; Roberts 1987). No obstante, el enfoque ha sido criticado, especialmente en relación con la aptitud de los gremios como herramientas de evaluación y con la manera en que se los utiliza (Landres 1983; Degraaf & Chadwick 1984; Verner 1984; Block et al. 1986; Fry et al. 1986; Hawkins & MacMahon 1989; Simberloff & Dayan 1991; Morrison et al. 1992; Gitay & Noble 1997). A pesar de las críticas, las aproximaciones basadas en el uso de gremios fueron adoptadas por agencias gubernamentales y se utilizan actualmente en la evaluación, el manejo y el monitoreo (e.g., Easton & Martin 1998; Rodewald& Smith 1998; Shankar Raman et al. 1998), demostrando el fuerte interés por lograr indicadores económicos de la "salud" de las comunidades locales con fines prácticos (Chase et al. 2000; Lindenmayer et al. 2000).
Tratando de evitar los problemas inherentes al concepto de gremio (véase Jaksic 1981; Hawkins & MacMahon 1989; Simberloff & Dayan 1991; Gitay & Noble 1997; Wilson 1999) y para diferenciarse de otros usos que él mismo critica, Verner (1984) definió a los gremios de manejo ("management guilds") como aquellos grupos de especies que tienen la misma respuesta a los impactos de su ambiente. Según esta definición, los gremios de manejo deberían quedar determinados por la respuesta a posteriori de las especies a alguna perturbación. Sin embargo, las técnicas usadas para formar los grupos (e.g., Severinghaus 1981; Short & Burnham 1982; Verner 1984; Roberts 1987) suelen no involucrar estudios locales de impacto–respuesta ni análisis de los mecanismos subyacentes a las modificaciones producidas por las perturbaciones, sino agremiaciones clásicas a priori (Wiens 1989), basadas en el conocimiento del uso de los recursos o ciertas porciones del espacio por parte de los organismos. A partir de esos datos se presupone, basándose en una serie de conceptos implícitos vinculados a la teoría de la competencia (e.g., recurso limitante, compensación intragremial, estado de equilibrio), que los grupos formados son buenos indicadores de la "calidad del hábitat" para los organismos considerados o del estado de sus recursos (Verner 1984; Easton & Martin 1998).
En el ámbito de los estudios de aves, donde este enfoque se originó y suele aplicarse, las recomendaciones para obtener gremios de manejo incluyen la elección de criterios de clasificación funcional que tengan especialmente en cuenta los estratos vegetales o las porciones del hábitat requeridos para alimentarse y reproducirse (Short & Burnham 1982; Verner 1984; Roberts 1987; Easton & Martin 1998; Rodewald & Smith 1998). Esto se fundamenta en la estrecha relación entre las aves, la estructura de la vegetación y los recursos asociados (e.g., Brush & Stiles 1986; Holmes & Recher 1986; Holmes 1990). Además, la interpretación de ciertas perturbaciones humanas como modificaciones en el número y la cobertura de los estratos de vegetación es relativamente sencilla y frecuente (e.g., Bock & Webb 1984; Bock& Bock 1999; Canterbury et al. 2000).
En la porción central del desierto del Monte –y, en general, en las zonas áridas y semiáridas – las perturbaciones típicas del ambiente son los incendios y el pastoreo. Éstos suelen tener un impacto muy marcado tanto en la estructura como en el funcionamiento de los ecosistemas (ver las revisiones de Christensen 1985, Bock et al. 1993 y Fleischner 1994). En particular, la respuesta de las aves a estas perturbaciones ha sido estudiada en detalle en varios sistemas (e.g., Bock & Webb 1984; Marone 1990; Fitzgerald & Tanner 1992; Bock et al. 1993; Herkert 1994; Bock & Bock 1999; Connelly et al. 2000; Davis et al. 2000; Brawn et al. 2001; Gonnet 2001). Algunos estudios previos en zonas áridas y semiáridas de Argentina sugieren que algunas aves son sensibles a la simplificación estructural del hábitat (Capurro & Bucher 1982; Capurro 1985; Marone 1990; Marone et al. 1997; Gonnet 2001) y, por lo tanto, que podrían verse afectadas por las modificaciones producidas por estas perturbaciones. De esta manera, las aves de esta zona parecen aptas para ser utilizadas como indicadoras del estado de sus recursos o de las perturbaciones, en especial a través del reconocimiento de gremios de manejo.
Durante más de una década hemos estudiado las relaciones de las aves con su hábitat en el Monte central, en particular en la Reserva de la Biosfera de Ñacuñán, con el interés de revelar sus requisitos ambientales y así inferir sus respuestas a modificaciones del hábitat (Marone 1990, 1991; Lopez de Casenave & Marone 1996; Marone et al. 1997). En este trabajo presentamos datos de riqueza y densidad de gremios de aves en parcelas bajo distintas condiciones conocidas de incendio y pastoreo, en relación con las diferencias en la cobertura de estratos de la vegetación. Usando los criterios recomendados para obtener gremios de manejo, tomamos a este como un estudio de caso para discutir la técnica de agrupamiento de las especies y la aptitud de los gremios de manejo y agrupaciones similares como indicadores o herramientas de monitoreo.
MÉTODOS
Área de estudio y diseño de muestreo
El estudio se llevó a cabo en el área de la Reserva de la Biósfera de Ñacuñán (34°03'S; 67°54'O), ubicada en la porción central del desierto del Monte, en la provincia de Mendoza, Argentina (para detalles sobre el área de estudio, ver Lopez de Casenave 2001). El ambiente predominante de la reserva es el bosque abierto de algarrobos (algarrobal), formado por una matriz de arbustos altos (fundamentalmente jarillas, Larrea divaricata) con árboles dispersos (algarrobos, Prosopis flexuosa, y chañares, Geoffroea decorticans; las autoridades de los nombres científicos pueden consultarse en Roig 1980). También están presentes otros arbustos altos (>1 m de altura) como el atamisque (Capparis atamisquea), el piquillín (Condalia microphylla) y la zampa (Atriplex lampa), y algunos arbustos bajos (Lycium spp., Verbena aspera y Acantholippia seriphioides). En las zonas no perturbadas la cobertura de gramíneas es importante, generalmente de 30–50% (Pappophorum spp., Trichloris sp., Setaria sp., Digitaria sp., Sporobolus sp., Aristida spp.). Las dicotiledóneas herbáceas presentan una cobertura muy variable entre años, usualmente menor que la de las gramíneas (Marone 1990).
Para estudiar la respuesta de las aves a las perturbaciones, realizamos comparaciones entre el algarrobal no perturbado de Ñacuñán (de aquí en adelante "control") y cuatro condiciones de hábitats perturbados a menos de 3 km de distancia: dos de pastoreo moderado (P1 y P2) y dos en recuperación tras un incendio (Q1 y Q2). La primera condición de pastoreo (P1) es la de un campo ganadero en los alrededores de la reserva, donde se desarrolla ganadería extensiva de bovinos para cría. La segunda (P2) es una zona de aproximadamente 300 ha, dentro de la reserva, donde se ha mantenido una carga ganadera baja (10–12 equivalentes vaca) en pastoreo continuo desde principios de la década de 1980 (C Stassi, IADIZA, com. pers.). Las condiciones luego de la acción del fuego corresponden a dos etapas de recuperación de un sitio incendiado dentro de la Reserva, a 3 años (Q1) y 8 años (Q2) de ocurrido el incendio. La respuesta inmediata de las aves al incendio ya ha sido informada (Marone 1990).
Muestreos de vegetación y de aves
Caracterizamos los efectos de la perturbación a través de la modificación de la cobertura de los diferentes estratos de vegetación (i.e., árboles, arbustos altos, arbustos bajos, gramíneas, hierbas dicotiledóneas y suelo desnudo) en cada una de las condiciones establecidas. La cobertura fue medida en Q1 en primavera de 1986, y en P1 y el control correspondiente a estas condiciones (CA, algarrobal no perturbado) en invierno de 1988, sobre 20 (Q1 y CA) o 10 (P1) líneas de 40 m de largo dispuestas al azar, a lo largo de las cuales se registraron los contactos de la vegetación sobre una vara perpendicular al suelo en 20 puntos por línea (interceptación puntual; ver Marone 1990). Los muestreos en Q2, P2 y en el control correspondiente (CB) se efectuaron entre invierno de 1993 y verano de 1996-1997 sobre 10 líneas de 25 m, dispuestas al azar, en las cuales se registraron los intervalos de la línea ocupados por cada planta (interceptación lineal; Canfield 1941). En todos los casos, cada línea de muestreo fue considerada una réplica.
La riqueza de los ensambles y la abundancia de las especies de aves en cada condición se estimaron en transectas de faja, de 200 m de largo y de ancho variable, en las mismas zonas donde se midió la vegetación. Este método es una variante del propuesto por Conner & Dickson (1980) en la cual se usan fajas de distinto ancho (en este caso 50, 70 o 100 m) de acuerdo a la detectabilidad de cada especie. Solo las aves que usaban efectivamente el sitio fueron registradas (i.e., no se incluyeron aquellas que atravesaban volando las transectas). Cada una de las transectas fue recorrida al menos cuatro veces en cada ocasión de muestreo, en días consecutivos, dentro de las 4 h posteriores al amanecer. Las recorridas de una misma transecta se promediaron para obtener la densidad para cada especie por transecta en cada ocasión de muestreo. En P1 y Q1 se hicieron muestreos durante la primavera de 1988 y el verano de 1988-1989 (2 transectas × 2 estaciones = 4 réplicas en cada caso; los datos de Q1 fueron recalculados a partir de Marone 1990). Para la condición control correspondiente a estos muestreos (CQ1P1) se muestrearon cuatro transectas en las mismas fechas (4 transectas× 2 estaciones = 8 réplicas). En P2 los muestreos se hicieron en la primavera de 1995 y el verano de 1995-1996 (4 transectas × 2 estaciones = 8 réplicas). Su control (CP2) fue muestreado en las mismas fechas con el mismo esquema (total = 8 réplicas). Finalmente, en Q2 se hicieron muestreos en el verano de 1993-1994 (dos transectas) y la primavera de 1994 (cuatro transectas; en total 6 réplicas), mientras que el control correspondiente (CQ2) se muestreó en las mismas fechas (tres transectas en el verano y cuatro en la primavera; en total 7 réplicas). La riqueza de aves se estimó como el número de especies registradas en cada transecta, con excepción de las aves rapaces.
Respuestas gremiales
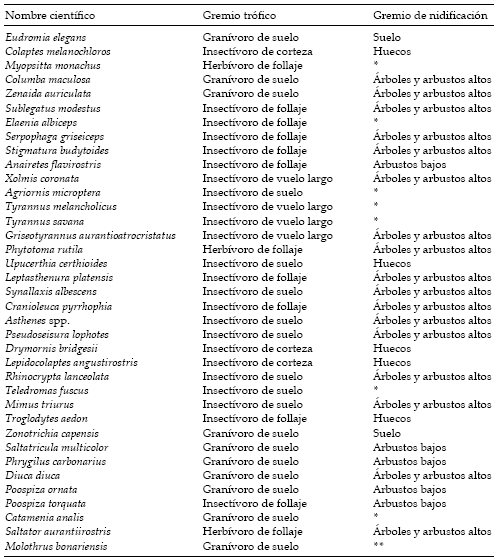
De acuerdo a la propuesta de Verner (1984) para obtener gremios de manejo, así como a la de otras con objetivos similares (e.g., Severinghaus 1981; Short & Burnham 1982; Roberts 1987), se formaron grupos tomando en cuenta las zonas del hábitat utilizadas por las aves para alimentarse y para nidificar enÑacuñán. La composición específica de los gremios se presenta en el Apéndice.
La agremiación de las aves según su lugar de alimentación se basó en los gremios tróficos de Marone (1992), modificándola de acuerdo a observaciones detalladas realizadas entre 1993 y 2000 (Lopez de Casenave 2001), ya que el microhábitat utilizado es una parte fundamental de dicha clasificación. Los gremios tróficos fueron: 1) granívoros de suelo: aquellos que se alimentan fundamentalmente de semillas del suelo o de plantas herbáceas a baja altura, 2) insectívoros de suelo: se alimentan de insectos en el suelo, 3) insectívoros de follaje: se alimentan de insectos en el follaje de árboles y arbustos, 4) herbívoros de follaje: se alimentan de hojas y frutos de árboles y arbustos, 5) insectívoros de vuelo largo: desde perchas y con vuelos largos atrapan insectos en el aire o en el suelo, y 6) insectívoros de corteza: se alimentan de insectos que viven bajo la corteza de leñosas. Para cumplir estrictamente con la recomendación de la aproximación de gremios de manejo de agrupar a las especies solo por el microhábitat utilizado, evaluamos los resultados para el gremio de aves que usan el suelo para alimentarse (juntando a los granívoros de suelo y los insectívoros de suelo), y para el gremio de aquellas que usan el follaje (insectívoros de follaje + herbívoros de follaje). Dado que los resultados son muy similares (el gremio del suelo muestra el mismo patrón que los insectívoros de suelo, y el gremio del follaje el mismo que los insectívoros de follaje) y que uno de nuestros objetivos es presentar las densidades de las aves del Monte en parcelas perturbadas, presentamos los datos desagregados, de acuerdo a los esquemas de agremiación de aves usuales.
El mismo conjunto de especies se dividió en gremios de nidificación, de acuerdo al tipo de vegetación y altura en que ubican sus nidos: 1) nidificantes en árboles y arbustos altos: nidifican en leñosas grandes a más de 1.5 m de altura; 2) en arbustos bajos: en arbustos a menos de 1.5 m u ocasionalmente a baja altura en plantas más altas; 3) en huecos: en huecos en árboles; 4) en suelo: en el suelo, generalmente entre gramíneas. Fueron excluidas de este análisis las especies que nunca fueron vistas nidificando en el algarrobal de Ñacuñán (en general visitantes invernales u ocasionales) y a los parásitos de nido (ver Apéndice). La asignación de cada especie de ave a los gremios de nidificación se basó, en su mayoría, en los datos obtenidos durante cuatro temporadas reproductivas (1995-1996 a 1998-1999) en la Reserva de Ñacuñán (Mezquida 2000, 2001a, 2001b, 2002; Mezquida & Marone 2000, 2001).
Análisis estadísticos
Tanto en el caso de la cobertura vegetal como de la riqueza y densidad de aves, las comparaciones se hicieron entre cada condición de perturbación y el algarrobal control correspondiente a la misma fecha. Dado que los datos de cada condición establecida corresponden a un único sitio de estudio no elegido al azar (ya que solo hay una parcela incendiada y una pastoreada dentro de la Reserva), la interpretación de los resultados debería limitarse a los casos estudiados (i.e., no son estrictamente aplicables a otras áreas). Para evaluar si existen diferencias significativas en la estructura de la vegetación entre cada una de las condiciones y su control, se hicieron pruebas de comparación de promedios mediante el estadístico t' (Zar 1996). Para comparar la riqueza de la comunidad de aves y la densidad de los distintos gremios entre los sitios perturbados y su control se utilizó la prueba de Mann-Whitney (Zar 1996).
RESULTADOS
Diferencias en la estructura de la vegetación
Los valores de cobertura de cada uno de los estratos de los sitios control (exceptuando al de gramíneas) fueron muy similares entre sí a pesar de que fueron obtenidos en distintos años y con distintas técnicas (Figura 1). Las perturbaciones estudiadas (incendio y pastoreo) estuvieron asociadas con diferencias estructurales importantes. Éstas consistieron principalmente en una mayor cobertura de suelo expuesto y, en algunos casos, de hierbas dicotiledóneas, en detrimento de los demás estratos, en particular el graminoso (Figura 1). Estas diferencias siempre fueron más marcadas para el caso del sitio incendiado que para los ambientes pastoreados. Por lo tanto, de acuerdo a las variaciones en la estructura vegetal, podría considerarse al incendio como una perturbación fuerte y al pastoreo como una perturbación moderada. En el caso de P1, laúnica diferencia significativa con el algarrobal control se observó en el estrato de gramíneas, pero en P2, con pastoreo continuo durante al menos 15 años, también se observaron diferencias en los otros estratos (Figura 1).
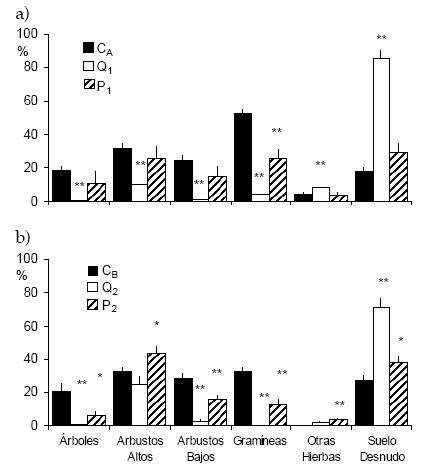
Figura 1. Cobertura promedio (+ EE) de los distintos estratos de vegetación en hábitats perturbados y no perturbados (control) en el Monte central, obtenida con el método de interceptación puntual (a) y de interceptación lineal (b). Los valores suman más de 100 porque algunos estratos se superponen parcialmente entre sí. Q corresponde a los sitios incendiados, P a los pastoreados y C a los controles (véase el texto para una descripción de las condiciones de cada hábitat). Se indican los estratos cuya cobertura es estadísticamente diferente de la del control correspondiente (Prueba de t'; *: P < 0.05; **: P < 0.01).
Figure 1. Mean cover (+ SE) of each vegetation stratum in perturbed and non-perturbed (control) habitats in the central Monte, sampled by point intercept technique (a) and line intercept technique (b). Values exceed 100 because vegetation strata may be partially overlapped. Q is used for burned habitats, P for those with grazing, and C for controls (see text for a description of the conditions of each habitat). Those strata whose cover differs statistically from its control are shown (t' test; *: P < 0.05; **: P < 0.01).
Diferencias en las aves
La riqueza y la densidad de aves en los ambientes no perturbados (control) también fueron semejantes en los distintos años estudiados (Tabla 1 y Figura 2), con excepción de una leve disminución de la abundancia de los insectívoros y una disminución más evidente de los gremios de nidificación en suelo y en huecos, en ambos casos en 1994–1996 (controles de Q2 y P2) respecto a 1988-1989 (controles de Q1 y P1; Figura 3).
Tabla 1. Riqueza específica (promedio ± EE, con el tamaño muestral entre paréntesis) del ensamble de aves en hábitats perturbados y no perturbados (control) en el Monte central. Q corresponde a los sitios incendiados y P a los pastoreados (véase el texto para una descripción de las condiciones de cada hábitat). Se indican las diferencias estadísticas entre los valores de cada ambiente perturbado y su control correspondiente (Prueba U de Mann–Whitney).
Table 1. Species richness (mean ± SE, with sample size between parentheses) of the bird assemblage in perturbed and non-perturbed (control) habitats in the central Monte. Q is used for burned habitats and P for those with grazing (see text for a description of the conditions of each habitat). Statistical differences between the values of each perturbed habitat and its control are shown (Mann–Whitney U test).

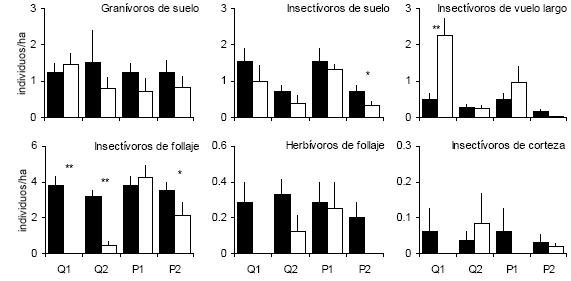
Figura 2. Densidad promedio (+ EE) de los gremios tróficos de aves en hábitats perturbados (barras blancas) y no perturbados (control, barras negras) en el Monte central. Los códigos de los hábitats son los mismos que en la Tabla 1. Se indican los casos en los que la densidad en el ambiente perturbado fue estadísticamente diferente de su control correspondiente (Prueba U de Mann–Whitney; *: P < 0.05; **: P < 0.01).
Figure 2. Mean density (+ SE) of bird foraging guilds in perturbed (open bars) and non-perturbed (control, black bars) habitats in the central Monte. Habitat codes are the same as in Table 1. Those cases in which the density in the perturbed habitat differed statistically from its control are shown. (Mann–Whitney U test; *: P < 0.05; **: P < 0.01).

Figura 3. Densidad promedio (+ EE) de los gremios de nidificación de aves en hábitats perturbados (barras blancas) y no perturbados (control, barras negras) en el Monte central. Los códigos de los hábitats son los mismos que en la Tabla 1. Se indican los casos en los que la densidad en el ambiente perturbado fue estadísticamente diferente de su control correspondiente (Prueba U de Mann–Whitney; *: P < 0.05; **: P < 0.01).
Figure 3. Mean density (+ SE) of bird nesting guilds in perturbed (open bars) and non-perturbed (control, black bars) habitats in the central Monte. Habitat codes are the same as in Table 1. Those cases in which the density in the perturbed habitat differed statistically from its control are shown. (Mann–Whitney U test; *:
P < 0.05; **: P < 0.01).
El número de especies de aves mostró una variación frente a las perturbaciones consistente con la de la estructura de la vegetación. En todos los casos los ambientes alterados presentaron menores riquezas de aves (Tabla 1). Esta disminución resultó más importante en los ambientes incendiados que en los pastoreados, siguiendo el patrón detectado en la reducción de la cobertura de las plantas perennes (leñosas y gramíneas): Q1≡ Q2< P2< P1 ≡ Control.
Considerando la agremiación trófica (Figura 2), la densidad de los insectívoros de follaje siguió el mismo patrón que la estructura de la vegetación, con reducciones muy importantes en los hábitats incendiados, leve en P2 y sin diferencias significativas en P1. Los insectívoros de vuelo largo aumentaron su abundancia en Q1, el ambiente recientemente incendiado, mientras que los insectívoros de suelo siempre fueron algo menos abundantes en los ambientes perturbados, si bien esa diferencia solo resultó significativa en P2. Los herbívoros de follaje estuvieron ausentes de Q1 y P2 y tuvieron menor abundancia en Q2, aunque estas diferencias no resultaron estadísticamente significativas. Los insectívoros de corteza estuvieron ausentes de Q1 y P1. Es posible que las bajas densidades, usuales en estos dos últimos gremios (en todos los casos evaluados fue menor a 0.63 individuos/ha), impidan detectar estadísticamente las diferencias. Finalmente, la densidad de los granívoros de suelo tampoco fue significativamente diferente a la de los controles.
En el caso de la agremiación por sitio de nidificación (Figura 3), en las aves que utilizan arbustos bajos se observó la misma tendencia que la estructura de la vegetación: disminución marcada de su densidad en los ambientes incendiados y menor (no significativa) en los pastoreados. Las que nidifican en árboles y arbustos altos solo mostraron una disminución significativa en P2. Las aves que nidifican en huecos no fueron observadas en Q1, mientras que las de suelo aumentaron significativamente su densidad en los ambientes incendiados.
DISCUSIÓN
Diferencias en los hábitats perturbados
Las parcelas que sufrieron las perturbaciones estudiadas –incendio y pastoreo– presentaron diferencias importantes en la estructura de la vegetación. Las diferencias en la cobertura de los distintos estratos de la vegetación permanecieron al menos hasta una década después de ocurrido el incendio, aún tratándose de zonas protegidas de posteriores actividades humanas. Las diferencias en las parcelas bajo uso ganadero fueron más leves, aunque en el sitio con pastoreo continuo dentro de la reserva se pudieron observar algunas modificaciones en la cobertura de otros estratos además del de gramíneas, posiblemente debido a una disminución en el establecimiento o supervivencia de nuevas plantas leñosas. Es importante tener en cuenta que los niveles de pastoreo en los sitios estudiados han sido leves o moderados, por lo que las diferencias podrían ser más marcadas en otras áreas más explotadas de la región, en particular sobre la dinámica poblacional de las gramíneas (Guevara et al. 1996).
Las diferencias en la estructura de la vegetación estuvieron estrechamente correlacionadas con la disminución de la riqueza local de las aves en hábitats incendiados y sujetos a pastoreo. En todos los casos, los ambientes alterados presentaron menor cobertura de leñosas y gramíneas y menor riqueza de aves, siendo más afectado el ambiente incendiado que los pastoreados. Las asociaciones observadas sugieren un efecto importante de las perturbaciones más habituales en la región, resultado que debería ser tenido especialmente en cuenta en programas de conservación de aves en el Monte central. Este efecto sobre las aves se da, posiblemente, a través de al menos uno de los siguientes mecanismos: la pérdida o modificación de los microhábitats utilizados para alimentarse (incluyendo la calidad y cantidad de alimento), de los microhábitats relacionados con el riesgo de depredación (de adultos o de nidadas), de los sitios aptos para nidificar, o bien la variación en las claves ambientales que señalarían a las aves la disponibilidad de alimento (Hutto 1985; Marone et al. 1997).
Algunas de las respuestas observadas al nivel gremial invitan a pensar que estos gremios pueden ser útiles como indicadores de condiciones ambientales en el área de estudio. Sin embargo, a continuación desarrollamos algunos aspectos conflictivos que conspiran contra esta interpretación.
Asignación de las especies a los gremios de manejo
El agrupamiento de las especies en los gremios de manejo suele estar más o menos basado en el uso que éstas hacen de uno o pocos recursos (como es el caso de los gremios tradicionales). Si la agremiación está basada en el uso de los recursos y no en la variable que los define como gremios de manejo (i.e., que muestren la misma respuesta a las perturbaciones), esa respuesta semejante de sus miembros es una hipótesis (o predicción) pasible de ser puesta a prueba y no una propiedad que debe considerarse establecida por definición. Las especies podrían no mostrar la misma respuesta aún cuando dependan de los mismos recursos, ya sea porque la perturbación puede afectar un recurso común aunque no igualmente condicionante para todas las especies componentes del gremio, o bien porque éstas pueden diferir en otros aspectos además de los recursos considerados para la agremiación (Block et al. 1986; Landres et al. 1988; Simberloff & Dayan 1991; Hockin et al. 1992; Morrison et al. 1992; Caro & O'Doherty 1999). Incluso, según los mismos principios teóricos que justifican el uso de gremios basados en el uso de recursos, deberían esperarse correlaciones negativas entre las densidades de las especies de un mismo gremio por exclusión competitiva, como respuesta evolutiva al uso de los mismos recursos limitantes (Landres et al. 1988; Lindenmayer et al. 2000; gremios alfa sensu Wilson 1999). Usando cualquiera de estos razonamientos se espera que las especies no respondan homogéneamente. Sin la homogeneidad de respuestas intragremiales se pierde la capacidad de extrapolar la respuesta gremial a las especies que lo forman o la respuesta de una especie a la de todo su gremio ("guild-indicator approach", criticada por Verner 1984).
En nuestro estudio, por ejemplo, las aves granívoras de suelo mantuvieron densidades similares entre las condiciones evaluadas. Esto sugiere –a primera vista– que no responden ante estas perturbaciones o que sus recursos no se vieron alterados (al menos como para alcanzar un umbral de respuesta). Pero tal vez el supuesto de uniformidad entre las especies del grupo no es válido y sus especies son afectadas de distinta manera por las diferentes condiciones del hábitat (Bock et al. 1993; Canterbury et al. 2000; Lindenmayer et al. 2000), siendo la aparente estabilidad resultado de respuestas especie-específicas dispares entre sus especies componentes. Si bien nuestro estudio no fue diseñado específicamente para explorar las respuestas al nivel de especie, una observación de nuestros datos muestra que algunas especies del gremio (Phrygilus carbonarius, Poospiza ornata, Saltatricula multicolor) desaparecieron o redujeron sus densidades en los sitios alterados, mientras que otras (Zenaida auriculata, Molothrus bonariensis, Zonotrichia capensis) respondieron en forma inversa. Otras, incluso, no mostraron una respuesta consistente (e.g., Diuca diuca, Columba maculosa), por lo que, si se evaluara solo esta respuesta, se las podría considerar desacopladas de los recursos afectados por estas perturbaciones. Gonnet (2001) ya ha reportado respuestas especie-específicas de las aves granívoras ante el pastoreo en esta zona. Así, el resultado evaluado a través de la respuesta gremial es inconsistente, pues no puede distinguirse entre la ausencia de efecto y la compensación de las diferentes respuestas especie- específicas.
Como se observa, puede ser inapropiado utilizar el uso de los recursos como base para la agremiación en el caso de gremios de manejo, porque la "misma respuesta" de las especies no está garantizada, incluso con un profundo conocimiento previo de la dieta, el comportamiento de alimentación y la nidificación locales de las aves y con una agremiación que haceénfasis en las asociaciones con el hábitat. Aumentar el número de recursos considerados o el grado de detalle en cada uno para lograr grupos de especies todavía más similares no parecen ser soluciones, ya que entonces sería más difícil que las especies formen grupos (Mannan et al. 1984). Inevitablemente, dicha agremiación debe descansar sobre la observación de que las especies constituyentes tengan efectivamente una misma respuesta a las perturbaciones. Como desarrollaremos enseguida, aún así podría no haber garantías de que los gremios de manejo constituyan indicadores válidos de las condiciones ambientales para su supervivencia.
Los gremios de manejo como indicadores
Los grupos de especies formados teniendo en cuenta directamente las respuestas a las perturbaciones parecen ser más adecuados como indicadores que los gremios tradicionales basados en el uso de los recursos. Estas clasificaciones, en general, se realizan comparando la abundancia de las especies entre sitios donde se conoce la perturbación ocurrida y sitios "control" (e.g., Szaro 1986; Canterbury et al. 2000; Chase et al. 2000). Podría haber cierta circularidad en el procedimiento, ya que debe conocerse la respuesta del grupo a una perturbación para elegir o confirmar el agrupamiento y luego poder usarlo en la predicción del efecto de esa perturbación (Verner 1984; Landres et al. 1988). Sin embargo, la circularidad puede evitarse en buena medida si los resultados del primer estudio se usan como hipótesis a poner a prueba con nuevos datos (e.g., en otros lugares o momentos, o frente a perturbaciones ligeramente diferentes). En el caso en que los resultados coincidieran, entonces se postularían "reglas de manejo" (e.g., si la especie o el gremio X disminuye, la perturbación es efectiva y, por tanto, habrá que actuar para mitigar su efecto).
La confianza en esas "reglas de manejo" depende, sin embargo, tanto del apoyo empírico que reciban como de la validez lógica del razonamiento empleado para generarlas. En el establecimiento de una relación impacto- respuesta se usan razonamientos inductivos (como cuando, para justificarla, se aumenta el número de observaciones en las que una perturbación provoca un determinado efecto). También se usan otros tipos de razonamiento, por ejemplo aquellos en los que se establece una relación de causalidad suficiente (Williams 1997) entre la perturbación y el gremio de manejo; por ejemplo: "siempre que se verifica una perturbación (causa) entonces disminuirá la abundancia de un grupo de especies (efecto)". Dada esa premisa, a partir de la observación de que esas especies se han hecho escasas, se concluye que la perturbación ha sido efectiva. Desafortunadamente, ni el razonamiento inductivo ni el que concluye acerca de la modificación en el estado del ambiente (perturbación, causa) al detectar un cambio en el indicador (abundancia del gremio, efecto), aseguran la obtención de una conclusión verdadera partiendo de premisas verdaderas (Bunge 2000). Se trata de razonamientos plausibles pero falaces. En el último caso (la falacia de afirmar el consecuente) se ve claramente que el efecto podría haberse producido por otras causas además de la invocada.
La falacia de afirmación del consecuente sólo puede ser evitada cuando se eliminan las alternativas que podrían llevar al mismo efecto (i.e, cuando la relación es de causalidad necesaria, donde la ley establece que si no hay causa entonces no puede haber efecto, por lo que siempre que se verifica el efecto se concluye la causa; Williams 1997). Esto puede lograrse restringiendo la generalidad de la ley para que dejen de ser válidas otras causas alternativas. Sin embargo, para los gremios de manejo de vertebrados esto no parece sencillo, especialmente debido a la escala y a la complejidad de los sistemas (Bock & Webb 1984). Otra manera de conseguirlo es investigar los mecanismos subyacentes a las correlaciones perturbación–respuesta (Marone & Bunge 1998; Bunge 2000), pero es claro que los costos (especialmente en tiempo) necesarios para alcanzar este conocimiento profundo son mucho mayores que los que están dispuestos a invertirse para obtener una herramienta simple, rápida y barata como se pretende para un indicador en manejo.
Otro aspecto relacionado con la utilidad de los gremios de manejo como indicadores tiene que ver con las características de aquello que intentan subrogar. Al usarse como indicador, la abundancia de un gremio de manejo se postula como "hipótesis indicadora", con el objeto de asociar observables con inobservables interesantes (Mahner & Bunge 1997). Por caso, ciertos signos vitales fáciles de medir (e.g., el ritmo cardíaco, la presión sanguínea) son "indicadores de salud" cuyos valores permiten al médico evaluar hipótesis acerca de procesos patológicos no evidentes. Del mismo modo, si se verifica una modificación en la abundancia de un gremio de manejo, entonces se infiere una perturbación que la está afectando directa o indirectamente (y que podría afectar a otros organismos). Se la utiliza, entonces, como una medida de la "salud" o "calidad" del hábitat.
En nuestro estudio, el gremio que siguió más estrechamente los cambios en la cobertura de la vegetación y en la riqueza general de aves (disminución marcada en los sitios incendiados y más leve en los pastoreados) fue el de los insectívoros de follaje, que desapareció o redujo drásticamente su densidad en los sitios que quedaron prácticamente sin árboles y arbustos debido a estas perturbaciones. Ahora bien, esto resulta bastante trivial, dado que el criterio de agrupamiento de estas aves se basa precisamente en que se alimentan recorriendo las ramas de árboles y arbustos, ahora ausentes. Así, solo estamos asociando dos variables observables entre sí, lo que no responde al espíritu de las "hipótesis indicadoras". De hecho, sería más conveniente monitorear directamente el nivel del recurso requerido por los organismos y afectado por la perturbación (Landres et al. 1988; Kremen 1992; Caro& O'Doherty 1999) o evaluar la estructura de la vegetación, probablemente más correlacionados tanto con la perturbación como con las aves (Canterbury et al. 2000; Lindenmayer et al. 2000). En nuestro caso, en el que deseamos detectar una posible perturbación que reduce la "calidad" del hábitat, una vez establecida la relación entre la cobertura de las leñosas y los insectívoros de follaje sería más económico y confiable (¡y menos variable!) estimar la cobertura de leñosas que la de las aves afectadas.
De esta manera, la respuesta gremial consistente ante la perturbación, y por lo tanto la posible agrupación de organismos que responden de la misma manera, podría aparecer sólo en aquellos casos obvios, donde se afectan drásticamente recursos esenciales (por definición de los grupos) para esas aves. En estos casos, es más fácil y directo medir el recurso perturbado que al indicador, por lo que éste se vuelve innecesario.
A partir de nuestro análisis resulta evidente que el éxito del uso de gremios para el monitoreo de un ensamble es altamente dependiente del criterio de agremiación elegido, de cuán necesario o condicionante es ese recurso o componente del hábitat para el grupo de organismos estudiado y de la relación entre cada tipo e intensidad particular de perturbación y ese recurso. Si bien las aves (y otros vertebrados) cumplen con muchos criterios como para ser objetivo o blanco de los planes de conservación, suelen ser una pobre elección como indicadores de la calidad de sus recursos, del ambiente en general o de la presencia de perturbaciones (Feinsinger 2001). En conclusión, debido a los problemas teóricos y prácticos planteados, la utilización de gremios de manejo o gremios–indicadores de aves no parece ser el mejor método de análisis para las etapas previas y posteriores al establecimiento de los programas de manejo.
Apéndice. Especies presentes en los muestreos analizados y gremios establecidos. El orden y los nombres de las especies están de acuerdo a Monroe & Sibley (1993), excepto para Serpophaga griseiceps (para quien se sigue el criterio en Mezquida & Marone 2000 y Lopez de Casenave 2001). *: no se registraron nidos en el algarrobal de Ñacuñán (en general, visitantes invernales u ocasionales); **: parásito de nido.
Appendix. Species found in the analyzed samples, and foraging and nesting guilds established. Ordination and species names follow Monroe & Sibley (1993), except for Serpophaga griseiceps (which follows criteria in Mezquida & Marone 2000 and Lopez de Casenave 2001). *: nests not detected in the algarrobal of Ñacuñán (usually winter or occasional visitors); **: nest parasite.
AGRADECIMIENTOS
A ME Horno por su colaboración durante el trabajo de campo y a R González del Solar por su valioso aporte durante la revisión de una versión anterior de este manuscrito. ETM agradece al Programa MUTIS del Instituto de Cooperación Iberoamericana (ICI). A lo largo de los años, el trabajo fue parcialmente financiado por MaB-UNESCO, Association for Field Ornithologists, Sigma Xi, CONICET, PROCINA-MACN, Asociación Ornitológica del Plata y FONCYT (PICT BID 01-03187). Contribución Nº 16 del Grupo de Investigación en Ecología de Comunidades de Desierto (Ecodes) de IADIZA y FCEyN (UBA).
BIBLIOGRAFÍA
1. BLOCK, WM; LA BRENNAN & RJ GUTIÉRREZ. 1986. The use of guilds and guild-indicator species for assessing habitat suitability. Pp. 109–113 en: J Verner; ML Morrison & CJ Ralphs (eds). Wildlife 2000. Modeling habitat relationships of terrestrial vertebrates. University of Wisconsin Press. Madison, EEUU. [ Links ]
2. BOCK, CE & JH BOCK. 1999. Response of winter birds to drought and short-duration grazing in southeastern Arizona. Conserv. Biol. 13:1117–1123. [ Links ]
3. BOCK, CE; VA SAAB; TD RICH & DS DOBKIN. 1993. Effects of livestock grazing on Neotropical migratory landbirds in western North America. Pp. 296–309 en: DM Finch & PW Stangel (eds). Status and management of Neotropical migratory birds. Gen. Tech. Rep. RM-229. USDA Forest Service. Fort Collins, EEUU. [ Links ]
4. BOCK, CE & B WEBB. 1984. Birds as grazing indicator species in Southeastern Arizona. J. Wildlife Manage. 48:1045–1049. [ Links ]
5. BRAWN, JD; SK ROBINSON & FR THOMPSON, III. 2001. The role of disturbance in the ecology and conservation of birds. Annu. Rev. Ecol. Syst. 32:251–276. [ Links ]
6. BRUSH, T & EW STILES. 1986. Using food abundance to predict habitat use by birds. Pp. 57–63 en: J Verner; ML Morrison & CJ Ralphs (eds). Wildlife 2000. Modeling habitat relationships of terrestrial vertebrates. University of Wisconsin Press. Madison, EEUU. [ Links ]
7. BUNGE, M. 2000. Physicians ignore philosophy at their risk –and ours. Facta Philosophica 1:133–144. [ Links ]
8. CANFIELD, RH. 1941. Application of the line interception method in sampling range vegetation. J. Forest. 39:388–394. [ Links ]
9. CANTERBURY, GE; TE MARTIN; DR PETIT; LJ PETIT & DF BRADFORD. 2000. Bird communities and habitat as ecological indicators of forest condition in regional monitoring. Conserv. Biol. 14:544–558. [ Links ]
10. CAPURRO, HA. 1985. Ecología de las comunidades de aves granívoras en el bosque chaqueño occidental. Tesis de doctorado, Universidad Nacional de Córdoba. Córdoba, Argentina. [ Links ]
11. CAPURRO, HA & EH BUCHER. 1982. Poblaciones de aves granívoras y disponibilidad de semillas en el bosque chaqueño de Chamical. Ecosur 9:117–131. [ Links ]
12. CARO, TM & G O'DOHERTY. 1999. On the use of surrogate species in Conservation Biology. Conserv. Biol. 13:805–814. [ Links ]
13. CHASE, MK; WB KRISTAN, III; AJ LYNAM; MV PRICE & JT ROTENBERRY. 2000. Single species as indicators of species richness and composition in California coastal sage scrub birds and small mammals. Conserv. Biol. 14:474–487. [ Links ]
14. CHRISTENSEN, NL. 1985. Shrubland fire regimes and their evolutionary consequences. Pp. 85–100 en: STA Pickett & PS White (eds). The ecology of natural disturbance and patch dynamics. Academic Press. Orlando, EEUU. [ Links ]
15. CONNELLY, JW; KP REESE; RA FISCHER & WL WAKKINEN. 2000. Response of a sagegrouse breeding population to fire in southeastern Idaho. Wildlife Soc. B. 28:90–96. [ Links ]
16. CONNER, RN & JG DICKSON. 1980. Strip transect sampling and analysis for avian habitat studies. Wildlife Soc. B. 8:4–10. [ Links ]
17. DAVIS, MA; DW PETERSON; PB REICH; M CROZIER; T QUERY ET AL. 2000. Restoring savanna using fire: impact on the breeding bird community. Restor. Ecol. 8:30–40. [ Links ]
18. DEGRAAF, RM & NL CHADWICK. 1984. Habitat classification: a comparison using avian species and guilds. Environ. Manage. 8:511–518. [ Links ]
19. EASTON, WE & K MARTIN. 1998. The effect of vegetation management on breeding bird communities in British Columbia. Ecol. Appl. 8:1092–1103. [ Links ]
20. FEINSINGER, P. 2001. Designing field studies for biodiversity conservation. The Nature Conservancy e Island Press. Washington DC, EEUU. [ Links ]
21. FITZGERALD, SM & GW TANNER. 1992. Avian community response to fire and mechanical shrub control in south Florida. J. Range Manage. 45:396–400. [ Links ]
22. FLEISCHNER, TL. 1994. Ecological costs of livestock grazing in western North America. Conserv. Biol. 8:629–644. [ Links ]
23. FRY, ME; RJ RISSER; HA STUBBS & JP LEIGHTON. 1986. Species selection for habitat-evaluation procedures. Pp. 105–108 en: J Verner; ML Morrison & CJ Ralphs (eds). Wildlife 2000. Modeling habitat relationships of terrestrial vertebrates. University of Wisconsin Press. Madison, EEUU. [ Links ]
24. GITAY, H & IR NOBLE. 1997. What are functional types and how should we seek them. Pp. 3–19 en: TM Smith; HH Shugart & FI Woodward (eds). Plant functional types. Their relevance to ecosystem properties and global change. Cambridge University Press. Cambridge, Reino Unido. [ Links ]
25. GONNET, JM. 2001. Influence of cattle grazing on population density and species richness of granivorous birds (Emberizidae) in the arid plain of the Monte, Argentina. J. Arid Environ. 48:569–579. [ Links ]
26. GUEVARA, JC; OR ESTÉVEZ, CR STASI & AS MONGE. 1996. Botanical composition of the seasonal diet of cattle in the rangelands of the Monte Desert of Mendoza, Argentina. J. Range Manage. 32:387–394. [ Links ]
27. HAWKINS, CP & JA MACMAHON. 1989. Guilds: the multiple meanings of a concept. Annu. Rev. Entomol. 34:423–451. [ Links ]
28. HERKERT, JR. 1994. Breeding bird communities of midwestern prairie fragments: the effects of prescribed burning and habitat-area. Nat. Area. J. 14:128–135. [ Links ]
29. HOCKIN, D; M OUNSTED; M GORMAN; D HILL; V KELLER& MA BARKER. 1992. Examination of the effects of disturbance on birds with reference to its importance in ecological assessment. J. Environ. Manage. 36:253–286. [ Links ]
30. HOLMES, RT. 1990. Food resource availability and use in forest bird communities: a comparative view and critique. Pp. 387–393 en: A Keast (ed.). Biogeography and ecology of forest bird communities. SPB Academic Publishing bv. The Hague, Países Bajos. [ Links ]
31. HOLMES, RT & HF RECHER. 1986. Determinants of guild structure in forest bird communities: an intercontinental comparison. Condor 88:427–439. [ Links ]
32. HUTTO, RL. 1985. Habitat selection by nonbreeding, migratory land birds. Pp. 455–476 en: ML Cody (ed.). Habitat selection in birds. Academic Press. Orlando, EEUU. [ Links ]
33. JAKSIC, FM. 1981. Abuse and misuse of the term "guild" in ecological studies. Oikos 37:397–400. [ Links ]
34. JOHNSON, RA. 1981. Application of the guild concept to environmental impact analysis of terrestrial vegetation. J. Environ. Manage. 13:205–222. [ Links ]
35. KREMEN, C. 1992. Assessing the indicator properties of species assemblages for natural areas monitoring. Ecol. Appl. 2:203–217. [ Links ]
36. LANDRES, PB. 1983. Use of the guild concept in environmental impact assessment. Environ. Manage. 7:393–398. [ Links ]
37. LANDRES, PB; J VERNER & JW THOMAS. 1988. Ecological uses of vertebrate indicator species: a critique. Conserv. Biol. 2:316–328. [ Links ]
38. LINDENMAYER, DB; CR MARGULES & DB BOTKIN. 2000. Indicators of biodiversity for ecologically sustainable forest management. Conserv. Biol. 14:941–950. [ Links ]
39. LOPEZ DE CASENAVE, J. 2001. Estructura gremial y organización de un ensamble de aves del desierto del Monte. Tesis de doctorado, Universidad de Buenos Aires. Buenos Aires, Argentina. [ Links ]
40. LOPEZ DE CASENAVE, J & L MARONE. 1996. Efectos de la riqueza y de la equitatividad sobre los valores de diversidad en comunidades de aves. Ecología 10:447–455. [ Links ]
41. MAHNER, M & M BUNGE. 1997. Foundations of biophilosophy. Springer Verlag. Berlín, Alemania. [ Links ]
42. MANNAN, RW; ML MORRISON & EC MESLOW. 1984. Comment: the use of guilds in forest bird management. Wildlife Soc. B. 12:426–430. [ Links ]
43. MARONE, L. 1990. Modifications of local and regional bird diversity after a fire in the Monte Desert, Argentina. Rev. Chil. Hist. Nat. 63:187–195. [ Links ]
44. MARONE, L. 1991. Habitat features affecting bird species distribution in the Monte desert, Argentina. Ecología Austral 1:77–86. [ Links ]
45. MARONE, L. 1992. Seasonal and year-to-year fluctuations of bird populations and guilds in the Monte desert, Argentina. J. Field Ornithol. 63:294–308. [ Links ]
46. MARONE, L & M BUNGE. 1998. La explicación en ecología. Boletín de la Asociación Argentina de Ecología 7:35–37. [ Links ]
47. MARONE, L; J LOPEZ DE CASENAVE & VR CUETO. 1997. Patterns of habitat selection by wintering and breeding granivorous birds in the central Monte desert, Argentina. Rev. Chil. Hist. Nat. 70:73–81. [ Links ]
48. MEZQUIDA, ET. 2000. Ecología reproductiva de un ensamble de aves del desierto del Monte central, Argentina. Tesis de doctorado, Univ. Autónoma. Madrid, España. [ Links ]
49. MEZQUIDA, ET. 2001a. Aspects of the breeding biology of the Crested Gallito. Wilson Bull. 113:104–108. [ Links ]
50. MEZQUIDA, ET. 2001b. La reproducción de algunas especies de Dendrocolaptidae y Furnariidae en el desierto del Monte central, Argentina. Hornero 16:23–30. [ Links ]
51. MEZQUIDA, ET. 2002. Nidificación de ocho especies de Tyrannidae en la Reserva de Ñacuñán, Mendoza, Argentina. Hornero 17:31–40. [ Links ]
52. MEZQUIDA, ET & L MARONE. 2000. Breeding biology of Gray-crowned Tyrannulet in the Monte desert, Argentina. Condor 102:205–210. [ Links ]
53. MEZQUIDA, ET & L MARONE. 2001. Factors affecting nesting success of a bird assembly in the central Monte Desert, Argentina. J. Avian Biol. 32:287–296. [ Links ]
54. MONROE, BL, JR & CG SIBLEY. 1993. A world checklist of birds. Yale University Press. New Haven, EEUU. [ Links ]
55. MORRISON, ML; BG MARCOT & RW MANNAM. 1992. Wildlife-habitat relationships: concepts and applications. University of Wisconsin Press. Madison, EEUU. [ Links ]
56. ROBERTS, TH. 1987. Construction of guilds for habitats assessment. Environ. Manage. 11:473–477. [ Links ]
57. RODEWALD, PG & KG SMITH. 1998. Short-term effects of understory and overstory management on breeding birds in Arkansas oak-hickory forests. J. Wildlife Manage. 62:1411–1417. [ Links ]
58. ROIG, FA. 1980. Flora de la Reserva Ecológica de Ñacuñán. Cuaderno Técnico 3-80. Inst. Arg. de Invest. de las Zonas Áridas (CONICET). Mendoza, Argentina. [ Links ]
59. SEVERINGHAUS, WD. 1981. Guild theory development as a mechanism for assessing environmental impact. Environ. Manage. 5:187–190. [ Links ]
60. SHANKAR RAMAN, TR; GS RAWAT & AJT JOHNSINGH. 1998. Recovery of tropical rainforest avifauna in relation to vegetation succesion following shifting cultivation in Mizoram, northeastern India. J. Appl. Ecol. 35:214–231. [ Links ]
61. SHORT, HL & KP BURNHAM. 1982. Technique for structuring wildlife guilds to evaluate impacts on wildlife communities. Special Sci. Rep. Wildlife 244. USDI Fish and Wildlife Service. Washington DC, EEUU. [ Links ]
62. SIMBERLOFF, D & T DAYAN. 1991. The guild concept and the structure of ecological communities. Annu. Rev. Ecol. Syst. 22:115–143. [ Links ]
63. SZARO, RC. 1986. Guild management: an evaluation of avian guilds as a predictive tool. Environ. Manage. 10:681–688. [ Links ]
64. VERNER, J. 1984. The guild concept applied to management of bird populations. Environ. Manage. 8:1–14. [ Links ]
65. WIENS, JA. 1989. The ecology of bird communities. Volume 1. Foundations and patterns. Cambridge University Press. Cambridge, Reino Unido. [ Links ]
66. WILLIAMS, BK. 1997. Logic and science in wildlife biology. J. Wildlife Manage. 61:1007–1015. [ Links ]
67. WILSON, JB. 1999. Guilds, functional types and ecological groups. Oikos 86:507–522. [ Links ]
68. ZAR, JH. 1996. Biostatistical analysis. 3ra edn. Prentice Hall. Upper Saddle River, EEUU. [ Links ]














