Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral v.13 n.1 Córdoba ene./jun. 2003
TRABAJOS ORIGINALES
Biología reproductiva y crecimiento de Pimelodus clarias maculatus (Lac. 1803) (Pisces, Pimelodidae) en la zona de influencia del embalse Yacyretá
Patricia Araya, Lourdes Hirt* & Silvia Flores
Facultad de Ciencias Exactas, Químicas y Naturales. Universidad Nacional de Misiones, Argentina
* Fac. Cs. Exactas, Químicas y Naturales. Univ. Nac. de Misiones. Felix de Azara 1552. 3300. Posadas. Misiones. Argentina. Email: lourdes@fceqyn.unam.edu.ar
Recibido: 3 junio 2002;
Revisado: 26 septiembre 2002;
Versión final: 24 octubre 2002;
Aceptado: 26 noviembre 2002
RESUMEN. Se analiza la dinámica reproductiva y el crecimiento de Pimelodus clarias maculatus (Lac. 1803) en la zona de influencia del embalse de Yacyretá, río Paraná, Argentina. Esta especie tiene una relativa importancia económica y es de frecuente captura en el río Paraná. Los individuos se obtuvieron de la pesca experimental realizada con redes agalleras de diferente apertura de malla entre 1990 y 1997. Se reconocieron tres estadíos de desarrollo gonadal: previtelogénesis, vitelogénesis y postdesove. El período reproductivo se extendió de agosto a marzo; la máxima actividad gonadal se registró entre octubre y marzo, coincidiendo con las crecidas anuales del río por encima de los 3 m. Existió una correlación positiva entre la relación gonadosomática, el nivel hidrométrico y la temperatura. El desove no fue continuo y el desarrollo de los ovocitos fue de tipo sincrónico en más de dos grupos. La longitud de la primera madurez fue de 190 mm de longitud estándar. La fecundidad absoluta promedio fue de 97000 ovocitos por hembra. Mediante el estudio de las espinas dorsales se registró un rango de edades de uno a siete años. La clase de edad más frecuente fue la de cuatro años en machos y la de cinco años en hembras. Las hembras de tres, cuatro y cinco años tuvieron una longitud estándar promedio mayor que la de los machos. El valor de la constante b de la relación longitud-peso fue menor a 3, indicando un crecimiento alométrico negativo en ambos sexos.
Palabras claves: Reproducción; Represa; Edad; Crecimiento.
ABSTRACT. Reproductive biology and growth of Pimelodus clarias maculatus (Lac. 1803) (Pisces, Pimelodidae) in the influence area of Yacyretá dam. We analyzed growth and reproductive dynamics of Pimelodus clarias maculatus (Lac. 1803) in the influence area of Yacyretá dam, Paraná River, Argentina. This species is of a relative economic importance and is frequently captured in this river. Samples were collected between 1990 and 1997 from experimental fisheries using gill nets of different mesh sizes. Three different gonadal stages were recognized: pre-vitellogenesis, vitellogenesis and post-spawning. The reproductive period spanned from August to March. Maximum gonadal activity was recorded from October to March, in coincidence with the annual maximum hydrometric level (over 3 m). We observed a positive correlation between the gonadal somatic and both hydrometric level and temperature. Spawning was not continuous and ovocyte development was synchronic in more than two groups of ovocites. Standard length at first maturity was 190 mm. Absolute mean fecundity was 97000 ovocytes per female. Ages 1 to 7 were recognized using growth marks of dorsal spines. The most frequent age was 4 for males and 5 for females. Mean standard length at ages 3, 4 and 5 was greater for females. The b parameter of the length-weight relationship was less than 3, suggesting a negative allometric growth for both sexes.
Keywords: Reproduction; Dam; Age; Growth.
INTRODUCCIÓN
La dinámica del río Paraná en el tramo de las provincias de Misiones y Corrientes (Argentina) se ha visto modificada por la construcción y funcionamiento de la represa de Yacyretá. Es un hecho común a todos los embalses la alteración de la estructura de las comunidades de peces, con una proliferación de las especies sedentarias y una reducción o eliminación de las especies migradoras. La notable disminución de la abundancia de algunas especies de carácidos y pimelódidos en los segmentos superiores de la cuenca superior del río Paraná es un claro ejemplo de este fenómeno (Agostinho 1995). El cambio en la estructura de las comunidades de peces podría tener como causa principal el impedimento que representa la represa para el acceso a las áreas de desove y cría temprana. Además, se ha visto que la desaparición de las áreas estacionalmente inundables, originadas por las fluctuaciones naturales del nivel fluviométrico, modifica la diversidad y abundancia de la fauna acuática. Los peces que habitan los grandes ríos poseen diversas estrategias reproductivas para adaptarse a condiciones ambientales cambiantes y a niveles hídricos que fluctúan rápidamente (Welcomme 1992).
Pimelodus clarias maculatus (bagre amarillo) es una especie importante en la economía pesquera de la cuenca del Plata, de frecuente captura (Bonetto et al. 1965; Baiz et al. 1968; Oldani & Oliveros 1984; Del Barco & Panattieri 1986) y de una amplia distribución geográfica (Mac Donagh 1934; Ringuelet et al. 1967; Bonetto et al. 1969, 1970). Es apreciada por la calidad de su carne y es apta para cultivo, ya que se adapta a condiciones de cautiverio (Parma de Croux 1996). Estudios sobre la reproducción y el crecimiento de esta especie fueron realizados en Argentina (Bonetto et al. 1963; Cordiviola de Yuan & Pignalberi 1967; Pignalberi 1968; Pignalberi & Cordiviola de Yuan 1976) y en Brasil (Godinho et al. 1974; Fenerich et al. 1975), aunque en el área de estudio el tema no registra antecedentes. El bagre amarillo se caracteriza por realizar migraciones reproductivas (Bonetto et al. 1963; Godoy 1967), siendo abundante en las zonas de embalses si los mismos tienen largos tramos lóticos aguas arriba o grandes tributarios para desovar (Agostinho et al., en prensa). Este estudio tiene por objeto contribuir al conocimiento de la dinámica reproductiva y el crecimiento de Pimelodus clarias maculatus en el área de influencia del embalse de Yacyretá.
MÉTODOS
La represa hidroeléctrica de Yacyretá está localizada sobre el río Paraná, al norte de la provincia de Corrientes (27º28'S; 56º44'O), en el inicio de su tramo potámico. Es una represa de llanura, caracterizada por un corto tiempo de residencia del agua (aproximadamente 10 días). La superficie del embalse es de aproximadamente 1140 km2 a cota 76 m.s.n.m., con un volumen estimado de 6000 hm3, profundidad promedio de 14 m y profundidad máxima de 23 m.
Los datos utilizados provienen de la pesca experimental realizada en el río Alto Paraná, Misiones, en el marco del convenio Entidad Binacional Yacyretá-Programa de Estudios Limnológicos Regionales (Facultad de Cs. Exactas, Químicas y Naturales, Univ. Nacional de Misiones). Los períodos de estudio fueron abril 1990-marzo 1991, mayo 1993-marzo 1994, mayo 1994-marzo 1995 y febrero 1996-diciembre 1997, con estaciones de muestreo en la desembocadura del arroyo Yabebiry (progresiva km 1625, 27°18'S; 55°35'O), en las cercanías del destacamento Nemesio Parma de la Prefectura Naval Argentina (progresiva km 1570, 27°20'S; 56°02'O) y en Puerto Valle (progresiva km 1510, 27°36'S; 56°23'O) (Figura 1). Los muestreos fueron de frecuencia mensual. Para las capturas se utilizaron redes de espera de 40, 50, 60, 70, 80, 120, 140 y 160 mm de malla estirada (nudos opuestos), que permanecieron caladas durante 48 h en las estaciones consideradas. Se realizaron recorridos cada 8 h. En todas las estaciones de muestreo se midieron la temperatura subsuperficial del agua con termómetro manual y la transparencia con disco de Secchi. Los datos se promediaron para cada mes del año, desde 1990 hasta 1997 (n = 6). Los registros diarios del nivel hidrométrico del río fueron obtenidos de la Prefectura Naval Argentina (Puerto Posadas), promediándose para cada mes del año durante todo el período de estudio.

Figura 1. Ubicación geográfica del área de estudio y las estaciones de muestreo sobre el río Paraná, en la zona de influencia del embalse Yacyretá al norte de la provincia de Corrientes. 1: Arroyo Yabebiry, 2: Nemesio Parma, 3: Puerto Valle.
Figure 1. Geographic location of the study area and sampling stations along Paraná River, in the influence area of Yacyretá dam, northern Corrientes Province. 1: Yabebiry Stream, 2: Nemesio Parma, 3: Puerto Valle.
De cada individuo se registró la longitud estándar (en mm) y el peso total (en g). Una vez determinado el sexo se extrajeron las gónadas femeninas, que fueron fijadas en formol al 10% para su posterior análisis en laboratorio. Se removió la espina de la aleta dorsal para el estudio de edad, sobre la base de submuestras de individuos de las distintas clases de longitud estándar. Una vez limpias y secas, se realizaron cortes transversales al eje de la espina con una sierra de joyería. La interpretación de las marcas de crecimiento se hizo bajo microscopio estereoscópico, utilizando los tres primeros cortes cercanos a la base, dado que resultaron ser los mejores para la lectura, al distinguirse más nítidamente los anillos de crecimiento. Cuando los resultados no fueron semejantes en al menos dos lecturas, el individuo no se consideró en el análisis. Se utilizó el coeficiente de variación de las longitudes estándar promedio de cada clase de edad para determinar la solidez del método empleado en la interpretación de las marcas de crecimiento. A fin de comparar las longitudes promedio entre sexos y por edad, se utilizó la Prueba de t para dos muestras no pareadas.
Para la determinación microscópica de los estadíos gonadales, se realizaron cortes de 7 micrómetros de espesor, los que fueron teñidos siguiendo la técnica convencional de hematoxilina eosina y la coloración tricrómica de Masson para la diferenciación de las membranas ovocitarias. La maduración gonadal se estableció mediante análisis histológicos. Se calculó la relación gonadosomática promedio mensual de cada estadío, como la relación porcentual entre el peso gonadal y el peso total. Con estos datos se realizaron correlaciones con el nivel hidrométrico, la transparencia y temperatura del agua.
Se estableció el tipo de desove a partir del análisis de histogramas de frecuencia resultantes de la medición del diámetro de 50 ovocitos provenientes de cada individuo hembra.
Se estimó, según el método gravimétrico, la fecundidad absoluta de 15 hembras maduras (estadío IV, vitelogénesis avanzada) de los distintos muestreos realizados. Se contaron los ovocitos vitelogénicos con diámetro mayor a 360 micrómetros obtenidos a partir de una submuestra de 30 mg de la zona anterior, media y posterior de cada ovario maduro. Se llevó a cabo un Análisis de Correlación entre la fecundidad absoluta y la longitud estándar, el peso total y el peso gonadal.
Se obtuvo la talla de la primera madurez de hembras, agrupando en intervalos de talla a los individuos jóvenes inmaduros y a los individuos maduros y desovados.
Se determinó la relación longitud-peso para machos y hembras por separado y en conjunto mediante la ecuación PT =a.LSb, donde PT es el peso total (en g), LS es la longitud estándar (en mm), y a y b son constantes que se estimaron por regresión lineal previa transformación logarítmica (Ricker 1975). Se compararon las curvas entre sexos empleando un Análisis de Covarianza para determinar la significación de las diferencias en los parámetros a y b. Éste último fue evaluado mediante la prueba de paralelismo incluida en el Análisis de Covarianza.
RESULTADOS Y DISCUSIÓN
Ciclo reproductivo
En el ciclo reproductivo de Pimelodus clarias maculatus se identificaron los estadíos gonadales de previtelogénesis, vitelogénesis y postdesove. Coincidiendo con observaciones realizadas por Godinho et al. (1974), las células fueron clasificadas en ovogonias y ovocitos I, II, III y IV. A continuación se describen los estadíos de previtelogénesis (I-II) y de vitelogénesis (III-IV) y en la siguiente sección el estadío de postdesove.
Estadío I (Inmaduro).- Las ovogonias fueron las células más abundantes de este estadío, si bien aparecen en todos los estadíos gonadales. Se presentaron en grupos y con escasa afinidad por los colorantes ácidos. El diámetro promedio de estas células fue de 8.56 micrómetros, caracterizándose por tener un nucleolo central y prominente. Cuando las ovogonias comienzan la profase I de la división meiótica se denominan ovocitos y varían en su aspecto por las transformaciones nucleares, nucleolares y citoplasmáticas (Carrillo & Zanuy 1981). Se observaron lamelas con ovocitos de tipo I de diámetro promedio de 13.37 micrómetros (n=50 ovocitos). Éstos presentaron citoplasma basófilo y núcleo con grandes nucleolos (hasta seis por célula), cuyo diámetro promedio fue de 2.6 micrómetros (n=50).
Estadío II (Reposo).- Los ovocitos denominados de tipo II fueron los más frecuentes. Poseen núcleo grande con nucleolos que al principio del desarrollo ovocitario fueron centrales y luego periféricos. El citoplasma presentó afinidad por la hematoxilina y en él se observó el corpúsculo de Balbiani, que según De Vlaming (1983) sería el centro formador de organelas. Aportes similares fueron realizados por Alexandrino et al. (1985) para Prochilodus scrofa. En esta etapa se reconoce la capa granulosa en formación (Figura 2A y 2B).
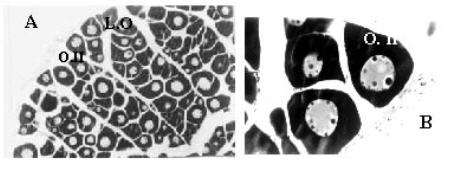

Figura 2. Estadíos microscópicos de desarrollo gonadal de Pimelodus clarias maculatus de la zona de influencia del embalse Yacyretá. (A) Previtelogénesis. 100x. (B) Previtelogénesis. 200x. (C) Vitelogénesis. 100x. (D) Membrana ovocitaria. 400x. (E) Postdesove. 200x. (F) Postdesove. 200x. L.O: lamelas ovulígeras, O.II: ovocito II, IV: ovocito IV, GV: gránulos de vitelo, F.R: folículo en reabsorción, C.F: cé lulas foliculares.
Figure 2. Microscopic stage of gonad development for Pimelodus clarias maculatus in the influence area of Yacyretá dam. (A) Pre-vitellogenesis. 100x. (B) Pre-vitellogenesis. 200x. (C) Vitellogenesis. 100x. (D) Ovocytary layer. 400x. (E) Post-spawning. 200x. (F) Post-spawning. 200x. L.O: ovocytary lamellae, O.II: ovocyte II, IV: ovocyte IV, GV: yolk vesicles, F.R: follicular reabsortion, C.F: follicular cells.
En los estadíos de previtelogénesis la distribución de diámetro de los ovocitos fue unimodal, con un diámetro promedio (± DE) de 189 ± 54.6 micrómetros (n=350 ovocitos) (Figura 3). La relación gonadosomática promedio (± DE) fue de 1.28 ± 0.48 (n=50) (Figura 4).
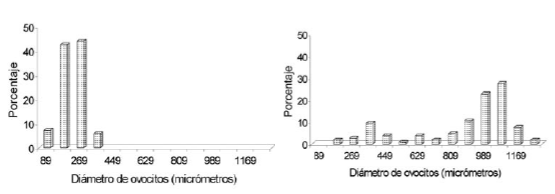

Figura 3. Distribución de diámetros ovocitarios de Pimelodus clarias maculatus de la zona de influencia del embalse Yacyretá, en los estadíos de previtelogénesis, vitelogénesis y postdesove.
Figure 3. Distribution of ovocyte diameter for Pimelodus clarias maculatus in the influence area of Yacyretá dam, in the pre-vitellogenesis, vitellogenesis, and post-spawning stages.

Figura 4. Relación gonadosomática promedio (+ DE) de Pimelodus clarias maculatus de la zona de influencia del embalse Yacyretá, en los estadíos de previtelogénesis, vitelogénesis y postdesove.
Figure 4. Mean (+ SD) gonad somatic relationship for Pimelodus clarias maculatus in the influence area of Yacyretá dam, in the pre-vitellogenesis, vitellogenesis, and post-spawning stages.
Estadío III (Vitelogénesis incipiente).- Si bien son más frecuentes los ovocitos de tipo III, en las lamelas ovulígeras se observaron ovogonias y ovocitos I y II. Los ovocitos III pueden ser identificados por la presencia de pequeñas vesículas denominadas corticales o vitelínicas en la periferia del citoplasma, las que serían sintetizadas por el propio ovocito a partir del cuerpo de Balbiani (Bun Ug & Idler 1983). Por un proceso de vitelogénesis exógena, el citoplasma es ocupado progresivamente por gránulos proteínicos, al principio de pequeño tamaño, aumentando progresivamente y extendiéndose luego hacia el centro del citoplasma hasta llenarlo completamente. No se observaron las vesículas lipídicas características de la fase del desarrollo ovocitario denominado por Vazzoler (1996) como vitelogénesis lipídica.
Estadío IV (Vitelogénesis avanzada).- En este estadío se producen las mayores transformaciones visibles en las estructuras ovocitarias propiamente dichas y en las membranas y capas que constituyen el folículo (Cotrina & Christiansen 1994). Se observaron con mayor frecuencia ovocitos IV, caracterizados por gránulos de vitelo de 2-5 micrómetros de diámetro. La membrana pellúcida fue poco evidente, midiendo en promedio 1 micrómetro de espesor; no se observaron las estriaciones radiales características citadas por Nagahama (1983). Estos datos coinciden con lo informado por Godinho et al. (1974) para esta especie y por Bazzoli & Rizzo (1990) para otras especies de teleósteos. La capa folicular estuvo constituida por un estrato de células pequeñas y alargadas. Entre la pellúcida y la capa folicular se observó una gruesa membrana o capa acelular característica de la mayoría de los Siluriformes, cuyo espesor varió entre 4-5 micrómetros (Figura 2C y 2D). Las células de este estadío variaron entre 90-1260 micrómetros de diámetro. Fueron clasificadas en previtelogénicas y vitelogénicas, estas últimas con un diámetro superior a los 360 micrómetros, con un promedio (± DE) de 891 ± 187 micrómetros (Figura 3). Estos valores son similares a los observados por Vazzoler (1996) en el bagre amarillo en el Alto Paraná, en Brasil. La relación gonadosomática promedio (± DE) fue 5.45 ± 3.18 micrómetros (n = 30), valores superiores a los encontrados por Vazzoler (1996) para este estadío (Figura 4).
Estadíos de postdesove
Se reconocieron dos etapas: desovado IV y desovado II, considerando como criterios la presencia de ovocitos maduros residuales, de células en etapas iniciales de maduración y de diferentes estructuras resultantes del desove.
Desovado IV (Parcialmente desovado).- Las estructuras presentes con mayor frecuencia son los ovocitos IV remanentes del desove, folículos vacíos, ovocitos III y IV en diferentes grados de atresia y regresión. Se destacan grandes espacios vacíos, en ocasiones ocupados por restos sanguinolentos. La túnica ovárica alcanza mayor espesor que en los estadíos anteriores, midiendo 10 micrómetros en promedio (n=30) (Figura 2E).
Desovado II.- El proceso de atresia es casi total, aunque permanecen pequeños folículos en reabsorción. En las lamelas ovulígeras se observaron abundantes ovocitos I, II y ovogonias (Figura 2F).
La distribución ovocitaria para el estadío de postdesove fue bimodal, observándose un aumento en el porcentaje de los ovocitos previtelogénicos y una considerable disminución de los vitelogénicos (Figura 3). La relación gonadosomática promedio (± DE) fue de 2.05 ± 1.47 micrómetros (n = 30) (Figura 4).
Modalidad del desove
El mecanismo de desarrollo ovocitario para esta especie se caracterizó como sincrónico en más de dos grupos. En un ovario maduro se observaron ovocitos de reserva y vitelogénicos; éstos se desarrollan sincrónicamente y a medida que alcanzan la maduración son desovados (Vazzoler 1996). Según estas características, el desove, que ocurre entre agosto y marzo, responde al tipo parcelado, es decir que en cada período son eliminados más de dos lotes de ovocitos maduros (Figura 3). Observaciones similares sobre el tipo de desove fueron hechas por Bazzoli et al. (1997), quienes constataron además que la especie presenta en la represa Furnas (Brasil) actividad reproductiva todo el año.
El desove prolongado y parcelado a lo largo de un ciclo reproductivo anual podría ser una estrategia de esta especie para asegurar la supervivencia de huevos y larvas cuando hay variaciones importantes en las condiciones ambientales físicas, químicas y biológicas; tal sería el caso de ambientes que han pasado de lóticos a lénticos como consecuencia de la construcción de una represa.
Primera madurez
Se observó que el 50% de la población de hembras se encontraba en actividad gonadal a partir de los 190 mm de longitud estándar. A partir de los 250 mm ya el 100% de las hembras tenía características de madurez (Figura 5). Fenerich et al. (1975) determinaron que la primera madurez de Pimelodus clarias maculatus se producía entre 180-190 mm de longitud total, en tanto que Agostinho et al. (en prensa) la estimaron en 195 mm y Braga (2000) en 278 mm. Según Nikolski (1963); Stearns & Crandall (1984) y Wootton (1991), la longitud de la primera madurez de una especie presenta variaciones que estarían relacionadas con factores exógenos como la disponibilidad de alimento y endógenos como la constitución genética y la tasa de crecimiento.

Figura 5. Distribución de frecuencias de la longitud de primera madurez de Pimelodus clarias maculatus de la zona de influencia del embalse Yacyretá.
Figure 5. Frequency distribution of the standard length at first maturity for Pimelodus clarias maculatus in the influence area of Yacyretá dam.
Relación gonadosomática promedio
La relación gonadosomática promedio mensual de mayo, junio y julio fue baja, observándose un aumento a partir de agosto, indicando el momento en que se inicia el desarrollo gonadal, el cual se extendió hasta marzo (Figura 6). Estos datos coinciden con las observaciones realizadas por Hirt & Roa (1980). Se registraron dos momentos de máxima actividad gonadal en los meses de octubre y marzo (6.5% y 6.2%, respectivamente), en coincidencia con épocas de crecidas del río por encima de los 3 m y bajos valores de transparencia.


Figura 6. Variación temporal de la relación gonadosomática promedio mensual de Pimelodus clarias maculatus y la transparencia arriba), la temperatura (centro) y el nivel hidrométrico (abajo) en la zona de influencia del embalse Yacyretá.
Figure 6. Temporal variation in mean monthly gonad somatic relationship for Pimelodus clarias maculatus, and transparency (above), temperature (center), and hydrometric level below) in the influence area of Yacyretá
La correlación de la relación gonadosomática promedio fue negativa con la transparencia (r = -0.10) y positiva con la temperatura y el nivel hidrométrico (r = 0.29 y r = 0.50, respectivamente), pero los valores no fueron significativos. Los mayores valores de relación gonadosomática promedio coincidieron con el aumento de temperatura y nivel hidrométrico (Figura 6). Basile-Martins et al. (1975) verificaron para la misma especie que los estadíos de maduración de los ovarios presentan correlación positiva con la incidencia de lluvias y que el estímulo para el desove está dado por el aumento del nivel hidrométrico. Otros factores que condicionan el desove son las crecientes, las temperaturas elevadas (Azevedo 1972) y el fotoperíodo (Colares de Melo 1989).
Fecundidad
La fecundidad absoluta varió entre 46800-203478 ovocitos, siendo el promedio (± DE) de 97000 ± 45846 ovocitos por hembra (n = 15), valor ligeramente mayor al hallado por Agostinho et al. (en prensa). La correlación entre la fecundidad absoluta y el peso gonadal fue positiva (r = 0.71). No se observó correlación entre la fecundidad absoluta y la longitud estándar y el peso total (r = 0.06, n = 15, P > 0.05; r = 0.38, n = 15, P > 0.05; respectivamente) (Figura 7).


Figura 7. Relación entre la fecundidad y el peso de las gónadas (A), el peso total (B) y la longitud estándar (C) de Pimelodus clarias maculatus de la zona de influencia del embalse Yacyretá.
Figure 7. Relationship between fecundity and gonad weight (A), total weight (B), and standard length (C) for Pimelodus clarias maculatus in the influence area of Yacyretá dam.
Edad y crecimiento
En un corte de espina dorsal se distingue una zona central, el núcleo, rodeada por una banda clara y brillante y otra oscura que, en conjunto, indican un año de vida (Figura 8). Tal como lo describieran Cordiviola de Yuan & Pignalberi (1967), estas bandas aumentan en número en relación con la edad y cuando son numerosas se estrechan y dificultan la lectura. Se realizaron lecturas en 350 individuos, de las cuales el 25% fue descartada por la interpretación dudosa de las marcas de crecimiento. Según Fagade (1974) y Sparre et al. (1990), en peces tropicales y subtropicales la dificultad en la determinación de la edad en estructuras duras se debe a las escasas fluctuaciones ambientales entre invierno y primavera de variables tales como temperatura, fotoperíodo y disponibilidad de alimento, las que son consideradas determinantes en la época de formación del anillo anual. Los valores de los coeficientes de variación de la longitud estándar (Tabla 1), en términos generales, fueron inferiores al 20%, disminuyendo con el aumento de la edad en ambos sexos. Estos resultados demostrarían que la lectura de la edad en la espina dorsal es un método confiable. Fenerich et al. (1975), trabajando en ríos del estado de San Pablo (Brasil), comprobaron que en Pimelodus clarias maculatus el anillo de crecimiento se forma en invierno. Es probable que este patrón se repita en nuestra área de estudio, pero para comprobarlo será necesario contar con otro estudio, ya que con los datos disponibles no fue posible obtener un resultado satisfactorio.

Figura 8. Corte transversal de la espina dorsal de un individuo de Pimelodus clarias maculatus de 5 años de edad. Cada número identifica una clase de edad.
Figure 8. Transversal section of the dorsal spine of a 5-years old individual of Pimelodus clarias maculatus. The numbers identify each age class.
Tabla 1. Longitud estándar promedio (± DE) por edad y sexo de Pimelodus clarias maculatus de la zona de influencia del embalse Yacyretá. Se muestra el resultado de la Prueba de t para dos muestras no pareadas y su nivel de significancia.
Table 1. Mean standard length (± SD) per age and sex for Pimelodus clarias maculatus in the influence area of Yacyretá dam. Results of the non-paired t-test and significance levels are also shown.

En la distribución de frecuencia por edad y sexo (Figura 9) se registró un rango de clases de uno a siete años, con una mayor proporción de individuos de cuatro y cinco años para machos y hembras, respectivamente. El escaso número de individuos de edades menores probablemente se debe a la selectividad del arte de pesca.

Figura 9. Estructura de edades de ambos sexos de Pimelodus clarias maculatus de la zona de influencia del embalse Yacyretá.
Figure 9. Age structure for both sexes of Pimelodus clarias maculatus in the influence area of Yacyretá dam.
En la Tabla 1 se presentan las longitudes estándar promedio registradas para cada clase de edad, discriminadas por sexo. Las hembras de edad 2, 3 y 4 alcanzan longitudes estándar promedio mayores que los machos (P < 0.05). Nomura et al. (1972) también registraron en Pimelodus clarias maculatus que, a una misma edad, las hembras eran mayores que los machos.
La relación longitud–peso obtenida muestra que en machos y hembras el valor del coeficiente b es inferior a 3 (Tabla 2). Al comparar los valores de b mediante el Análisis de Covarianza no se encontraron diferencias estadísticamente significativas entre sexos (F = 0.881, g.l. = 1, P = 0.348). Resultó, por lo tanto, una única ecuación: PT = 4.27E-0.5 . LS2.85 (Figura 10). El parámetro b es particular para cada especie, generalmente constante y tiende a alcanzar valores próximos a 3. Este parámetro puede variar dentro de una misma especie, dependiendo del sexo, maduración gonadal, peso y grado de repleción estomacal (Le Cren 1951; Rossi-Wongtschowski et al. 1982; Royce 1984). El crecimiento alométrico negativo observado en este trabajo difiere del isométrico registrado por Vignes et al. (1981) en el río de la Plata y por Bechara et al. (1999) en el río Paraná aguas abajo de la represa de Yacyretá.
Tabla 2. Parámetros de la relación longitud-peso en Pimelodus clarias maculatus de la zona de influencia del embalse Yacyretá. IC: intervalo de confianza del 95%, r: Coeficiente de Correlación de Pearson.
Table 2. Parameter values of the length-weight relationship for Pimelodus clarias maculatus in the influence area of Yacyretá dam. IC: 95% confidence interval, r: Pearson Correlation Coefficient.


Figura 10. Relación entre la longitud estándar y el peso total de Pimelodus clarias maculatus de la zona de influencia del embalse Yacyretá.
Figure 10. Length-weight relationship for Pimelodus clarias maculatus in the influence area of Yacyretá dam.
Conclusiones
El ciclo reproductivo de Pimelodus clarias maculatus es prolongado, extendiéndose de agosto a marzo. Los valores mayores de la relación gonadosomática promedio coincidieron con el aumento de la temperatura y del nivel hidrométrico. A partir de 190 mm de longitud estándar, el 50% de la población de hembras se encontraba en actividad reproductiva (evidenciada por la presencia de ovocitos vitelogénicos, folículos vacíos y en regresión), representando la longitud de primera madurez. La fecundidad absoluta mostró correlación positiva con el peso gonadal. El mecanismo de desarrollo ovocitario fue de tipo sincrónico en más de dos grupos. La modalidad de desove responde al tipo parcelado. Se reconoció un rango de clases de edad de 1 a 7 años. La espina de la aleta dorsal es una estructura recomendable para la interpretación de las marcas de crecimiento que permite identificar la edad. El crecimiento de Pimelodus clarias maculatus fue alométrico negativo en ambos sexos.
AGRADECIMIENTOS
A la Entidad Binacional de Yacyretá por contribuir con fondos para el financiamiento, a los muestreadores de campo, a los técnicos de laboratorio y a todos los que colaboraron para la realización de este trabajo.
BIBLIOGRAFÍA
AGOSTINHO, AA. 1995. Considerações sobre atuação do setor elétrico na preservação da fauna aquática e dos recursos pesqueiros. Cuaderno 4, Estudos e levantamentos, Seminário sobre fauna aquática e o setor elétrico brasileiro. COMASE/ELETROBRAS/MME. [ Links ]
AGOSTINHO, AA; LC GOMES; IH SUZUKI & HF FERREIRA JULIO, JR. En prensa. Migratory fishes of the Upper Paraná River Basin, Brazil. En: J Carolsfeld, B Harvey, A Baer & C Roos (eds). Migratory fish of South America: biology, social importance and xconservation status. World Fisheries Trust. [ Links ]
ALEXANDRINO, AC; MT PHAN & EFG PINHEIRO. 1985. Caracterização macroscópica e microscópica das gônadas do curimbatá, Prochilodus scrofa (Steindachner, 1881) durante o ciclo reprodutivo. Bolm. Zool. Univ. Sao Paulo 9:159-175. [ Links ]
AZEVEDO, P. 1972. Principais peixes das aguas interiores de São Paulo, hábitos de vida. Pp. 109-112 en: CIBPU (eds). Poluição e piscicultura. CIBPU, Facultade de Saude Pública da USP, Instituto de Pesca. São Paulo. [ Links ]
BAIZ, M; E CABRERA & C CANDIA. 1968. Alimentación natural del bagre amarillo (Pimelodus clarias maculatus) de la zona de Punta Lara (Río de La Plata). Doc. Tec. N° 44, FAO CARPAS. Río de Janeiro. [ Links ]
BASILE-MARTINS, MA; HM GODINHO; NA FENERICH & JM BRAMLEY BARKER. 1975. Influencia de fatores abióticos sobre a maturação dos ovarios de Pimelodus maculatus Lac. 1803 (Pisces, Siluroidei). B. Inst. Pesca 4:1-28. [ Links ]
BAZZOLI, N; LCV CANGUSSU; E RIZZO & GB SANTOS. 1997. Reproduction and spawn of mandis Pimelodus maculatus and Iheringichthys labrosus (Pisces, Pimelodidae) in Furnas, Marimbondo and Itumbiara reservoirs. Bios 5:7-15. [ Links ]
BAZZOLI, N & E RIZZO. 1990. A comparative cytological and cytochemical study of the oogenesis in ten Brazilian teleost fish species. Eur. Arch. Biol. 101:39-410. [ Links ]
BECHARA, JA; S SANCHEZ; JP ROUX; JC TERRAES & CF QUINTANA. 1999. Variaciones del factor de condición relativo de la ictiofauna del río Paraná aguas debajo de la represa Yacyretá, Argentina. Rev. Ict. 7:75-89 [ Links ]
BONETTO, A; E CORDIVIOLA; CL PIGNALBERI & O OLIVEROS. 1969. Ciclos hidrológicos del río Paraná y las poblaciones de peces continentales en las cuencas temporarias de su valle de inundación. Physis 29:213-223. [ Links ]
BONETTO, A; E CORDIVIOLA; CL PIGNALBERI & O OLIVEROS. 1970. Nuevos aportes al conocimiento de las poblaciones ícticas en cuencas temporarias del valle de inundación del Paraná medio. Acta Zool. Lilloana 27:136-153. [ Links ]
BONETTO, A; C PIGNALBERI & E CORDIVIOLA. 1963. Ecología alimentaria del amarillo y moncholo Pimelodus clarias maculatus (Bloch) y Pimelodus albicans (Valenciannes) Pisces, Pimelodidae. Physis 24:88-93. [ Links ]
BONETTO, A; CL PIGNALBERI & E CORDIVIOLA. 1965. Contribución al conocimiento de las poblaciones de peces de las lagunas isleñas en el Paraná Medio. Pp. 131-144 en: Anais do II Congreso Latinoamericano de Zoología. Vol. 2. Sao Paulo. [ Links ]
BRAGA, FM DE S. 2000. Biología e pesca de Pimelodus maculatus (Siluriformes, Pimelodidae), no reservatório de Volta Grande, Rio Grande (MG-SP). Acta Limnol. Bras. 12:1-14. [ Links ]
BUN UG, T & RD IDLER. 1983. Yolk formation and differentiation in teleost fishes. Pp. 373-397 en: WS Hoar; DJ Randall & EM Donaldson (eds). Fish physiology. Vol. IXA. Academic Press. Londres. [ Links ]
CARRILLO, M& S ZANUY. 1981. Fisiología de la reproducción. Inducción a la puesta en los teleósteos. Centro Latinoamericano de Aquicultura e Instituto de Acuicultura de Torre de la Sal. São Paulo y Castellón. [ Links ]
COLARES DE MELO, JS. 1989. Influência do fotoperiodo sobre a maturação ovariana de mandí Pimelodus maculatus Lacèpede, 1803. B. Tec. CEPTA, Pirassununga 2:13-18. [ Links ]
CORDIVIOLA DE YUAN, E & C PIGNALBERI. 1967. Edad y crecimiento del amarillo (Pimelodus clarias maculatus) y moncholo (Pimelodus albicans). Comunicación, CONICET-Ministerio de Agricultura y Ganadería de la Prov. de Santa Fé. Pp. 67-76. [ Links ]
COTRINA, CP & HE CHRISTIANSEN. 1994. El comportamiento reproductivo del besugo (Pagrus pagrus) en el ecosistema costero bonaerense. Rev. Invest. Pesq. 9:25-58. [ Links ]
DEL BARCO, D & A PANATTIERI. 1986. Variaciones de la densidad de peces en el Paraná Medio en relación con factores ambientales. Rev. Asoc. Cienc. Nat. Lit. 17:127-136. [ Links ]
DE VLAMING, VL. 1983. Oocyte development patterns and hormonal involvements among teleost. Pp. 176-99 en: JC Rankin; TJ Pitcher & RT Duggan (eds). Control processes in fish physiology. Croom Helm. Londres y Camberra. [ Links ]
FAGADE, SO. 1974. Age determination in Tilapia melanotheron (Ruppel) in the Lagos Lagoon, Lagos, Nigeria. Pp. 7-17 en: TB Bagenal (ed). The ageing of fish. The Freshwater Biological Association. Surrey. [ Links ]
FENERICH, NA; MY NARAHARA & HM GODINHO. 1975. Curva de crescimento de e primeira maturação sexual do mandí, Pimelodus maculatus, Lac. 1803 Pisces Siluroidei. Bol. Inst. Pesca, Santos 4:1. [ Links ]
GODINHO, HM; S FERRI; LO MEDEIROS & JMB BARKER. 1974. Morphological changes in the ovary of Pimelodus maculatus Làcepede, 1803 (Pisces, Siluroidei) related to the reproductive cycle. Rev. Brasil. Biol. 34:581-588. [ Links ]
GODOY, MP. 1967. Des anos de obsevaçöes sebre periodicidade magratória de peixes do Rio Mogi Guassu. Rev. Brasil. Biol. 27:1-12. [ Links ]
HIRT, L & B ROA. 1980. Reseña sobre biología de la reproducción en peces. Convenio Universidad Nacional de Misiones-Ministerio de Asuntos Agrarios. Posadas. [ Links ]
LE CREN, ED. 1951. The legth-weigth relationship and seasonal cycle in gonad weight and condition in the perch Perca fluviatilis. J. Anim. Ecol. 20:201-219. [ Links ]
MAC DONAGH, EJ. 1934. Nuevos conceptos sobre la distribución geográfica de los peces argentinos. Rev. Brasil. Biol. 30:583-593. [ Links ]
NAGAHAMA, V. 1983. The functional morphology of teleost gonads. Pp. 223-264 en: WS Hoar; DJ Randall & EM Donaldson (eds). Fish physiology. Vol. IXA. Academic Press. Londres. [ Links ]
NOMURA, H; R POZZI & A MANREZ. 1972. Caracteres merísticos e dados biológicos sôbre o mandi-amarelo, Pimelodus clarias maculatus (Bloch, 1782), do rio Mogi Guaçu (Pisces, Pimelodidae). Rev. Brasil. Biol. 32:1-14. [ Links ]
OLDANI, N & O OLIVEROS. 1984. Estudios limnológicos en una sección transversal del tramo medio del río Paraná. XII: Dinámica temporal de peces de importancia económica. Rev. Asoc. Cienc. Nat. Lit. 15:175-183. [ Links ]
PARMA DE CROUX, M. 1996. Crecimiento de juveniles de Pimelodus clarias maculatus (Pisces, Pimelodidae) en condiciones experimentales. Efecto del fotoperíodo. Rev. Asoc. Cienc. Nat. Lit. 27:95-102. [ Links ]
PIGNALBERI, C. 1968. Observaciones sobre gónadas de algunas especies de peces del Paraná medio. Acta Zool. Lilloana 23:163-171. [ Links ]
PIGNALBERI, C & E CORDIVIOLA DE YUAN. 1976. Poblaciones de peces del Río Paraná. III: Pimelodus clarias maculatus (Bloch, 1782) (Pisces Pimelodidae). Rev. Asoc. Cienc. Nat. Lit. 7:163-184. [ Links ]
RICKER, WE. 1975. Computation and interpretation of biological statistics of fish population. Departament of the Environment Fisheries and Marine Service. Ottawa. [ Links ]
RINGUELET, R; R ARAMBURU & A ALONSO DE ARAMBURU. 1967. Los peces argentinos de agua dulce. Comisión de Investigaciones Científicas de la provincia de Buenos Aires. La Plata. [ Links ]
ROSSI-WONGTSCHOWSKI, C; E VAZZOLER & F BRAGA. 1982. Estudos sobre estrutura, ciclo de vida e comportamento de Sardinella brasiliensis (Steindachner, 1879). Bol. Inst. Oceanogr., Sao Paulo 3:57-76. [ Links ]
ROYCE, W. 1984. Intoduction to the practice of fishery science. Academic Press. Orlando. [ Links ]
SPARRE, P; E URSIN & S VENEMA. 1990. Introducción a la evaluación de stocks de peces tropicales. Parte 1. Doc. Téc. de Pesca 306.1, FAO. Roma. [ Links ]
VAZZOLER, AE. 1996. Biologia da reprodução de peixes de teleósteos: teoria e prática. Nupelia. Maringá [ Links ].
VIGNES, I; C UBEDA & L DRAGO. 1981. Contribución para el estudio biológico y estadístico del bagre amarillo (Pimelodus clarias maculatus Lacepede, 1803) del río de La Plata (Pisces, Pimelodidae). Physis 39:33-46. [ Links ]
WELCOMME, L. 1992. Pesca Fluvial. Doc. Téc. de Pesca 262, FAO. Roma. [ Links ]














