Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral v.14 n.1 Córdoba ene./jun. 2004
TRABAJOS ORIGINALES
La importancia de los tejidos no epidérmicos en el microanálisis de la dieta de herbívoros
Lorena Sepúlveda Palma*, Alicia Pelliza & Marcela Manacorda
Instituto Nacional de Tecnología Agropecuaria (INTA), Estación Experimental Agropecuaria Bariloche, San Carlos de Bariloche, Río Negro, Argentina
*INTA, Estación Experimental Agropecuaria Bariloche, CC 277, (R8400AMC) San Carlos de Bariloche, Río Negro, Argentina. Email: asbriller@bariloche.inta.gov.ar
Recibido: 24 de febrero de 2003;
Fin de arbitraje: 29 de abril de 2003;
Revisión recibida: 23 de mayo de 2003;
Versión final recibida: 28 de julio de 2003;
Aceptado: 29 de julio de 2003
RESUMEN. Habitualmente solo se consideran los tejidos epidérmicos en el análisis microhistológico de la dieta de herbívoros. Con el objetivo de comprobar si la consideración de tejidos no epidérmicos identificables mejora los análisis dietarios en ambientes áridos, trabajamos con 10 mezclas integradas con pesos conocidos de gramíneas, arbustos, graminoides e hierbas. Censamos cinco preparados microscópicos a 100 aumentos, registrando todos los fragmentos presentes: identificados (epidérmicos y no epidérmicos) y no identificados. Evaluamos los resultados por su similitud con el peso. Confirmamos nuestra hipótesis de que el hecho de considerar los fragmentos no epidérmicos identificables mejora los resultados del análisis microhistológico, permitiendo obtener información más representativa de la dieta de los diferentes herbívoros.
Palabras clave: Microhistología; Zonas áridas; Plantas xerófilas; Cuantificación.
ABSTRACT. The importance of non epidermal tissues in microanalysis of herbivorous diet: Generally in the microhistological analysis of the diet of herbivores, only epidermal tissues are considered. We worked with ten mixtures that contained a known weight of grasses, bushes, forbs and graminoids, to evaluate if considering identifiable non-epidermal tissues improves the results of diet analysis in arid environments. We made a census of 5 slides at 100 magnification for each mixture, recording all fragments: identifiable (epidermal and non-epidermal) and unidentifiable. We evaluated the results according to the similarity with the composition of the mixture by weight. We confirmed our hypothesis that if identifiable non-epidermal fragments are considered the results of microhistological analysis are improved, getting a more representative information of the diet.
Keywords: Microhistology; Arid zones; Xerophytic plants; Quantification.
INTRODUCCIÓN
Para lograr el manejo sostenible de los pastizales sometidos a ganadería extensiva es importante el conocimiento de la composición de la dieta de los herbívoros silvestres y domésticos, la cual se puede estimar mediante diferentes técnicas, entre ellas el método microhistológico, que consiste en el análisis microscópico de los restos no digeridos de las plantas consumidas. Tanto para contenidos estomacales (e.g., Baungartner & Martin 1939) como para heces (e.g., Dusi 1949), esta identificación se basa en el reconocimiento de la epidermis vegetal (principalmente foliar), tejido rico en caracteres constantes para cada taxón y protegido por la cutícula de los efectos de la digestión. Baungartner & Martin (1939) consideraron útiles también a los frutos por la presencia de caracteres distintivos encontrados en los elementos de los tejidos conductores. Algunos tejidos no epidérmicos que resisten el proceso digestivo, como el esclerénquima y algunos tipos de parénquima, también pueden producir restos identificables útiles en el análisis de la dieta (Pelliza 1993; Lindström et al. 1998), mientras que la madera, que resiste el proceso digestivo, no es identificable sin la presencia de cortes transversales y longitudinales (Johnson et al. 1983; Pelliza 1993).
Prescindiendo del error debido al efecto de la digestión diferencial, en numerosos trabajos se utilizaron muestras no digeridas para evaluar las dificultades de la cuantificación de ítems dietarios a través del método microhistológico (Sparks & Malechek 1968; Westoby et al. 1976; Havstad & Donart 1978; Holechek & Gross 1982; Barker 1986; Norbury 1988). Westoby et al. (1976) señalaron que los principales errores del método se deben a la gran proporción de fragmentos no identificables. Varios autores asociaron los errores a la variación entre especies y estados de madurez, tanto con respecto al número de fragmentos por unidad de volumen como a la posibilidad de identificarlos (Westoby et al. 1976; Havstad & Donart 1978; Barker 1986; Norbury 1988). En ninguno de estos trabajos se consideraron los fragmentos no epidérmicos.
Sobre la base de la afirmación de Storr (1961) y Heady & Van Dyne (1965) acerca de que la relación entre superficie y peso no es constante entre plantas ni entre estados fenológicos, Sparks & Malechek (1968) recomendaron ajustar la técnica cuando hay indicios de la ingestión de elementos distintos de láminas foliares de gramíneas y hierbas en activo crecimiento. La subestimación de tallos de arbustos en mezclas manuales (Westoby et al. 1976) y en dietas de composición conocida (Holechek & Valdez 1985) confirman la necesidad de estos ajustes. Westoby et al. (1976) concluyeron que cuando los animales ramonean en zonas desérticas se obtienen datos de pobre calidad, debido a la alta proporción de tejidos no identificados y a su variación entre plantas. Las zonas áridas se caracterizan por la presencia de plantas xerófilas (arbustos perennes resistentes a la sequía, áfilos o con hojas pequeñas y especializadas), plantas suculentas, plantas efímeras y plantas con raíces profundas (Solbrig & Orians 1977). La economía del agua se logra no solo por adaptaciones en la morfología externa, sino también por modificaciones de la estructura interna, como el aumento del tejido mecánico o la presencia de células más pequeñas y de paredes más gruesas (Mangum Shields 1950; Pyykkö 1966).
En el análisis de muestras fecales, la mayoría de los investigadores registran la presencia de tejidos no epidérmicos solo cuando están asociados a la epidermis. En cambio, otros identifican también fragmentos integrados solo por tejidos no epidérmicos (Satakopan 1972; Pelliza 1993; Lindström et al. 1998). El presente trabajo se propone mejorar la determinación de la composición de la dieta de herbívoros de zonas áridas mediante la consideración de fragmentos no epidérmicos identificables cuando se utiliza la técnica microhistológica descripta inicialmente por Baungartner & Martin (1939).
MÉTODOS
Trabajamos con 10 mezclas manuales desconocidas para el observador (Tabla 1), en una simulación de los tipos dietarios definidos por Pelliza et al. (1997) y Pelliza et al. (2001) a partir de las dietas de distintos herbívoros domésticos y silvestres. Seleccionamos hojas, tallos tiernos, flores y frutos de las plantas propuestas, los secamos en estufa y los molimos en un molino eléctrico con malla de 1 mm. Con porciones de peso conocido integramos las mezclas que tratamos con la misma técnica aplicada a las muestras fecales: lavado con alcohol etílico al 70% y con agua hirviente, aclaración con lavandina comercial y coloración con safranina. Montamos el material en gelatina glicerina, con cubreobjetos de 24x40 mm con una densidad homogénea de partículas que garantiza la presencia de al menos una partícula identificable en cualquier campo microscópico definido a 125 aumentos (Holechek & Vavra 1981).
Tabla 1. Composición botánica (% en peso seco) de las 10 mezclas utilizadas. Las plantas indicadas con un asterisco contienen una gran proporción de tejidos no epidérmicos identificables.
Table 1. Botanical composition (percent of dry weight) of the 10 mixtures used. Asterisks indicate plants that contain a high proportion of non-identifiable epidermal tissues.


De cada mezcla censamos cinco preparados microscópicos a 100 aumentos, para lo que utilizamos como guía una grilla transparente adherida al portaobjetos. Registramos todos los fragmentos presentes, tanto los epidérmicos como los no epidérmicos, identificables o no. Consideramos como epidérmicos los fragmentos que presentaban ambos tipos de tejidos.
Algunos ejemplos de esclerénquima previamente estudiados por otros autores (Schwabe 1950; Pyykkö 1966; Sánchez & Caro 1974; Ezcurra 1985; Constance 1988; Ragonese 1990; Lindström et al. 1998), que identificamos en este trabajo, fueron: fibras celulósicas paralelas entre sí en Ephedra spp., fibras lignificadas paralelas entre sí en Chuquiraga sp. y en Cassia aphylla, fibras cruzadas en distintos ángulos en el endocarpo leñoso de Mulinum spp. (Figura 1) y de Prosopis spp., tejido mecánico que caracteriza la hoja de Nassauvia spp. y que observamos en forma de un casquete que se ramifica formando una red hacia la lámina foliar (Figura 2) en Nassauvia glomerulosa. Además, consideramos otros caracteres no epidérmicos como la presencia de cristales en las nervaduras de Trifolium repens (Figura 3), de aerénquima en la médula astericiforme de Juncus arcticus (Barros 1969) y las características de las vainas que rodean los haces vasculares en Sporobolus rigens (Méndez 1994).
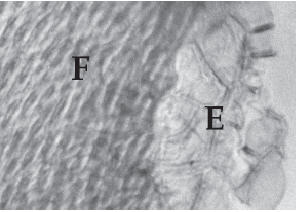
Figura 1. Microfotografía (100x; ajuste aproximado por el uso de escáner: 233x) del fruto de Mulinum spinosum. F: fibras del endocarpio; E: epidermis.
Figure 1. Photomicrograph (100x; scanner used 233x) of Mulinum spinosum fruit. F: endocarp fibres; E: epidermis.

Figura 2. Microfotografía (100x; ajuste aproximado por el uso de escáner: 71x) de la hoja de Nassauvia glomerulosa, observándose tejido mecánico y epidermis con bases de pelos. F: fibras; P: base de pelos.
Figure 2. Photomicrograph (100x; scanner used 71x) of Nassauvia glomerulosa leaf showing mechanic tissue and epidermis. F: fibres; P: base of naps.

Figura 3. Microfotografía (100x; ajuste aproximado por el uso de escáner: 200x) de la hoja de Trifolium repens, observándose tejido epidérmico (E) y nervadura (N) con cristales (C).
Figure 3. Photomicrograph (100x; scanner used 200x) of Trifoluim repens leaf showing epidermal tissue (E) and nervure (N) with crystals (C).
En cada preparado calculamos el porcentaje correspondiente a cada planta de dos formas: considerando los fragmentos no epidérmicos y no teniéndolos en cuenta. Los valores obtenidos fueron comparados con la composición composición en peso real de cada mezcla a través de un índice de similitud:
![]()
donde W es la suma de los valores mínimos comunes entre a y b, a es la suma de los porcentajes en peso de las plantas en la mezcla, y b es la suma de los porcentajes de las plantas observados en la mezcla (Bray & Curtis 1957, citado en Washington 1984). Aplicamos un Análisis de Varianza a los valores del índice obtenidos para cada mezcla, considerando los preparados microscópicos como réplicas.
RESULTADOS
Identificamos tejidos no epidérmicos en 20 de las 28 plantas presentes en las 10 mezclas. La mayoría de las gramíneas perennes, una gramínea anual y una hierba no presentaron fragmentos de tejidos no epidérmicos identificables (Tabla 1).
La figura 4 muestra que cuando no se consideran los tejidos no epidérmicos aumenta el porcentaje de fragmentos no identificados. Este efecto fue muy reducido solo en las mezclas 2 y 5, con altos porcentajes de gramíneas perennes (Tabla 1), que no aportaron tejidos no epidérmicos identificables.
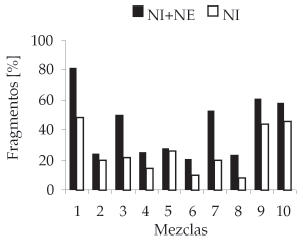
Figura 4. Porcentaje de cada muestra correspondiente a fragmentos no identificados (NI) y a fragmentos no identificado más fragmentos no epidérmicos (NI + NE).
Figure 4. Percentage of each mixture corresponding to unidentifiable fragments (NI) and unidentifiable fragments plus non-epidermal fragments (NI + NE).
La figura 5 presenta los valores del índice de similitud comparando la composición en peso de cada mezcla con la estimación realizada a través del censo, considerando la información de los fragmentos no epidérmicos y no considerándola. El Análisis de Varianza realizado entre estos valores del índice de similitud evidenció diferencias significativas en 8 de las 10 mezclas (Tabla 2).
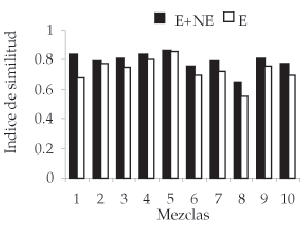
Figura 5. Similitud entre los valores obtenidos y el peso para cada mezcla considerando solo fragmentos epidérmicos (E) y fragmentos epidérmicos más no epidérmicos (E + NE). *: P < 0.05.
Figure 5. Similarity between the obtained values and the weight, for each mixture, considering only epidermal fragments (E) and epidermal plus nonepidermal fragments (E + NE). *: P < 0.05.
Tabla 2. Análisis de Varianza de los valores del índice de similitud entre la composición en peso real de cada mezcla y las dos estimaciones realizadas a través del censo: considerando solo fragmentos epidérmicos y considerando fragmentos epidérmicos más no epidérmicos.
Table 2. Variance Analysis of similarity values between actual weight composition of each mixture and the estimations obtained with the census: considering only epidermal fragments and epidermal plus non-epidermal fragments.


DISCUSIÓN
La característica más obvia de las hojas xeromórficas es la reducción de la superficie, y por ende, del cociente superficie/volumen (Mangum Shields 1950). Por lo tanto, la variación de dicho cociente afecta los resultados de los análisis que solo consideren tejidos epidérmicos. Otro de los caracteres ligados al xeromorfismo es un fuerte desarrollo del tejido mecánico (Ragonese 1990), que observamos en forma de fibras y esclereidas en las muestras fecales (Pelliza 1993) procedentes de la Patagonia y el Monte (Cabrera 1976).
Dado que los fragmentos no epidérmicos tienen menos caracteres identificatorios que los epidérmicos, destacamos la importancia de realizar una observación exhaustiva de la muestra antes de comenzar la cuantificación. Mediante el barrido de los preparados se puede definir la presencia de una planta por un conjunto de caracteres, epidérmicos y no epidérmicos, para luego contar los fragmentos. Para los estudios de dieta de herbívoros es importante que se complemente el trabajo de laboratorio con el de campo, ya que es fundamental el conocimiento de la disponibilidad y el estado fenológico de la especie en cuestión.
Concluimos que, en ambientes áridos y semiáridos como los patagónicos, deben considerarse los tejidos no epidérmicos, ya que ignorarlos implica la subestimación o la falta de detección de frutos, flores, tallos y hojas de plantas xeromórficas, que constituyen una importante fuente de alimento pero que presentan escasa proporción de tejidos epidérmicos. Coincidimos con Westoby et al. (1976) en que es necesario balancear la exactitud y la riqueza de la información. En consecuencia, proponemos considerar los tejidos no epidérmicos para no disminuir o ignorar la importancia del consumo de ciertas plantas. Así se obtendrían resultados más representativos de la dieta de los diferentes herbívoros, lo cual podría influir en la toma de decisiones cuando se intenta un manejo sustentable.
AGRADECIMIENTOS
Nuestro profundo agradecimiento a G. Bonvissuto, L. Borrelli y N. Bonino por la lectura crítica del manuscrito y a L. Cohen, S. García y D. Sbriller por su colaboración.
BIBLIOGRAFÍA
BARKER, RD. 1986. An investigation into the accuracy of herbivore diet analysis. Aust. Wildlife Res. 13:559-568. [ Links ]
BARROS, M. 1969. Juncaceae. Pp. 109-137 en: M Correa (ed.). Flora patagónica. Typhaceae a Orchidaceae. Vol. 8. Parte 2. INTA. [ Links ]
BAUNGARTNER, LL & AC MARTIN. 1939. Plant histology as an aid in squirrel food-habit studies. J. Wildlife Manage. 3:266-268. [ Links ]
BRAY, JR & JT CURTIS. 1957. An ordination of the upland forest communities of Southern Wisconsin. Ecol. Monogr. 27:325-349. [ Links ]
CABRERA, AL. 1976. Regiones fitogeográficas argentinas. Pp. 1-85 en: Enciclopedia argentina de agricultura y jardinería. Tomo 2. Fascículo 1. ACME. [ Links ]
CONSTANCE, L. 1988. Umbelliferae. Pp. 357-357 en: M Correa (ed.). Flora patagónica. Oxalidaceae a Cornaceae. Vol. 8. Parte 5. INTA. [ Links ]
DUSI, JL. 1949. Methods for determination of food habits by plant microtechniques and histology and their application to cottontail rabbit food habits. J. Wildlife Manage 13:295-299. [ Links ]
EZCURRA, C. 1985. Revisión del género Chuquiraga (Compositae-Mutisieae). Darwiniana 26:219-284. [ Links ]
HAVSTAD, RM & GB DONART. 1978. The microhistological technique: testing two central assumptions in South-Central New Mexico. J. Range Manage. 31:469-470. [ Links ]
HEADY, HF & GM VAN DYNE. 1965. Prediction of weigth composition from point samples on clipped herbage. J. Range Manage. 18:144-148. [ Links ]
HOLECHEK, JL & BD GROSS. 1982. Evaluation of different calculation procedures for microhistological analysis. J. Range Manage. 35:721-723. [ Links ]
HOLECHEK, JL & R VALDEZ. 1985. Magnification and shrub stemmy material influences on fecal analysis accurancy. J. Range Manage. 38:350-352. [ Links ]
HOLECHEK, JL & M VAVRA. 1981. The effect of slide and frequency observation numbers on the precision of microhistological analysis. J. Range Manage. 34:337-338. [ Links ]
JOHNSON, MK; H WOFFORD & HA PEARSON. 1983. Microhistological techniques for food habits analyses. Research Paper SO-199, USDA Forest Service, Southern Forest Experimental Station. [ Links ]
LINDSTRÖM, LI; MB MUJICA & LF HERNANDEZ. 1998. Descripción microhistológica de dicotiledóneas y gimnospermas del sur del distrito del Caldén. Rev. Arg. Prod. Anim. 18:117-128. [ Links ]
MANGUM SHIELDS, L. 1950. Leaf xeromorphy as related to physiological and structural influences. Bot. Rev. 16:399-447. [ Links ]
MENDEZ, E. 1994. Novedades en el género Sporobolus (Gramineae). Bol. Soc. Arg. Bot. 30:13-19. [ Links ]
NORBURY, GL. 1988. Microscopic analysis of herbivore diets - A problem and a solution. Aust. Wildlife Res. 15:51-57. [ Links ]
PELLIZA, A. 1993. Acerca de la microhistología. Comunicación Técnica 32. INTA-EEA Bariloche. [ Links ]
PELLIZA, A; P WILLEMS; V NAKAMATSU & A MANERO. 1997. Atlas dietario de herbívoros patagónicos. PRODESAR-INTA-GTZ. [ Links ]
PELLIZA, A; P WILLEMS & M MANACORDA. 2001. Dietary structural types of polygastric herbivores at different environments and seasons. J. Range Manage. 54:330-337. [ Links ]
PYYKKÖ, M. 1966. The leaf anatomy of East Patagonian xeromorphic plants. Ann. Bot. Fenn. 3:453-622. [ Links ]
RAGONESE, AM. 1990. Caracteres xeromorfos foliares de Nassauvia lagascae (compositae). Darwiniana 30:1-10. [ Links ]
SÁNCHEZ, E & J CARO. 1974. Anatomía caulinar de las especies de Ephedra de la flora argentina, E. breana Phil. y E. Ochreata. Darwiniana 18:511-519. [ Links ]
SATAKOPAN, S. 1972. Key to identification of plant remains in animal dropping. J. Bombay Nat. Hist. Soc. 69:139-150. [ Links ]
SCHWABE, H. 1950. Estudio anatómico de las especies áfilas del género Cassia en la Argentina. Darwiniana 9:173-187. [ Links ]
SOLBRIG, OT & GH ORIANS. 1977. The adaptative characteristics of desert plants. A cost/benefit analysis of photosynthesis leads to predictions about the types and distribution of desert plants. Am. Sci. 65:412-421. [ Links ]
SPARKS, DR & JC MALECHEK. 1968. Estimating percentage dry weight in diets using a microscopic technique. J. Range Manage. 21:264- 265. [ Links ]
STORR, GM. 1961. Microscopic analysis of faeces, a technique for ascertaining the diet of herbivorous mammals. Aust. J. Biol. Sci. 14:157-164. [ Links ]
WASHINGTON, HG. 1984. Diversity, biotic and similarity indices. Commenwealth Scientific and Industrial Research Organization 18:653-694. [ Links ]
WESTOBY, M; GR ROST & JA WEIS. 1976. Problems with estimating herbivore diets by microscopically identifying plant fragments from stomachs. J. Mammal. 57:167-172. [ Links ]














