Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Ecología austral
On-line version ISSN 1667-782X
Ecol. austral vol.16 no.1 Córdoba Jan./June 2006
TRABAJOS ORIGINALES
Variación estacional en la dieta del conejo silvestre europeo (Oryctolagus cuniculus) en la región andina de Neuquén, Argentina
Never Bonino* & Laura Borrelli
Est. Exp. Agropecuaria Bariloche, Inst. Nac. de Tecnología Agropecuaria, Bariloche, Río Negro, Argentina
* Estación Experimental Agropecuaria Bariloche, Inst. Nacional de Tecnología Agropecuaria, C.C. 277, 8400, Bariloche, Prov. Río Negro, Argentina. Email: nbonino@bariloche.inta.gov.ar
Recibido: 2 de noviembre de 2005;
Fin de arbitraje: 6 de enero de 2006;
Revisión recibida: 11 de enero de 2006;
Aceptado: 10 de marzo de 2006
RESUMEN. Se determinó la composición botánica y la variación estacional de la dieta del conejo silvestre europeo en la región andina de Neuquén, Argentina, a través del análisis microhistológico de heces. Las gramíneas constituyeron la base principal de la dieta prácticamente en todas lasépocas del año, siendo Poa pratensis y Festuca pallescens las principales especies consumidas. Las graminoides le siguieron en orden de importancia con Juncus balticus y Carex gayana como losítems alimenticios de mayor importancia. Las hierbas apenas se destacaron en la dieta primaveroestival así como las especies arbustivas y arbóreas en la dieta invernal. Según nuestros resultados, el conejo se comportó como un herbívoro principalmente consumidor de pastos. Los mallines (vegas) constituyeron el área principal de alimentación, aunque con variaciones espaciales de uso según la época del año.
Palabras clave: Análisis microhistológico; Diversidad trófica; Especies exóticas; Patagonia
ABSTRACT. Seasonal variation in the diet of the European wild rabbit (Oryctolagus cuniculus) in the Andean region of Neuquén, Argentina: Botanical composition and seasonal variation of the diet of European wild rabbit were determined. The study was carried out in the Andean region of Neuquén province, Argentina, where fresh samples from at least 15 individuals were collected at every season; the samples were analyzed individually using a microhistological method. Grasses represented the main basis of the diet at all seasons of the year; Poa pratensis and Festuca pallescens were the most consumed species. Graminoids were the second most important group, with Juncus balticus and Carex gayana as major nutritional items. Forbs had moderate participation in the spring and summer diets whereas shrubs and arboreal species were relatively important in the winter diet only. According to our results, the rabbit proved to be a mainly grazing herbivore and the "mallines" (wet meadows) were the main feeding areas, although the use of space varied according to the seasons of the year.
Keywords: Exotic species; Microhistological analysis; Patagonia; Trophic diversity
INTRODUCCIÓN
El conejo silvestre europeo Oryctolagus cuniculus (Linnaeus 1758) es una especie nativa de la parte sudoccidental de Europa y septentrional de África y ha sido introducida en distintas regiones del mundo tales como Australia, Nueva Zelanda y Sudamérica (Flux 1994). En este último continente, el conejo se encuentra sólo en Chile y Argentina. En nuestro país el conejo se encuentra actualmente presente en las provincias de Tierra del Fuego, Santa Cruz y, principalmente, en Neuquén y Mendoza donde se encuentra en una fase activa de dispersión geográfica (Bonino & Gader 1987; Bonino & Soriguer 2004).
Entre sus requerimientos de hábitat se encuentran las áreas abiertas, cubiertas de pasto corto (tipo "césped") y provistas de adecuada disponibilidad de refugios (cuevas, arbustos, troncos caídos, roquedales, etc.) (Williams et al. 1995). Por esta razón, en Patagonia los lugares preferidos por el conejo para su establecimiento son los sectores circundantes a los mallines (praderas herbáceas), generalmente sobrepastoreados por el ganado (Bonino & Amaya 1985).
El único antecedente de estudio de la dieta del conejo en el país es de Amaya & Bonino (1981) y fue realizado a fines del verano en áreas de claro del Parque Nacional Tierra del Fuego. Dado que se trata de un herbívoro exótico, es de suma importancia conocer el uso que los conejos hacen de los recursos vegetales como una aproximación al conocimiento o evaluación del posible impacto sobre la vegetaci ón nativa y a la posible interacción competitiva con otros herbívoros silvestres y domésticos. Con el fin de contribuir al conocimiento de dichos aspectos tróficos, el objetivo de este trabajo fue determinar la composición botánica de la dieta de O. cuniculus y la existencia de variaciones entre las estaciones del año.
MATERIALES Y MÉTODOS
El estudio se realizó en una zona ubicada al norte del lago Ñorquinco y al oeste del lago Nompehuén (39º07'S;71º18'O), en la región cordillerana de la provincia de Neuquén, Argentina. El área se caracteriza por su relieve montañoso cuya altura varía entre 1000 y 1750 msnm; las precipitaciones fluctúan entre 1600 y 1800 mm anuales y ocurren principalmente desde mediados de otoño a mediados de primavera; por esta razón el área presenta un marcado exceso de humedad en los meses de invierno y un déficit hídrico en la época estival. La temperatura media anual es inferior a 10°C, siendo la del mes más caluroso (enero) de 17.5°C, y la del mes más frío (julio) de 3.3°C (Barros et al. 1983; Ayesa et al. 1999).
Desde el punto de vista fitogeográfico el área se ubica en el Distrito del Pehuén de la Provincia Subantártica (Cabrera 1971). El tipo principal de vegetación en el sitio de estudio es un bosque abierto, caducifolio, compuesto principalmente por ñire (Nothofagus antarctica), muchas veces formando mosaicos con mallines o con pequeños sectores ocupados por pastizales de Festuca pallescens y/o Stipa spp. Se denominan mallines a las praderas herbáceas que generalmente ocupan los fondos de los valles y reciben aguas de escorrentía superficial o subsuperficial. Estas praderas constituyen las formaciones vegetales de mayor importancia forrajera del área (Boelke 1957; Ayesa et al. 1999). La parte central de los mallines, que permanece anegada durante la época de lluvias (invierno), está dominada por plantas ciperáceas (Carex gayana, C. subantarctica, Eleocharis albibracteata) y juncáceas (Juncus balticus). Los bordes de los mallines suelen ser más secos y allí predomina F. pallescens acompañada por Poa pratensis, ambas gramíneas. Los mallines del área suelen presentar en su periferia arbustales compuestos principalmente por Berberis buxifolia (Ayesa et al. 1999).
El muestreo se realizó colectando al azar heces frescas de 15 bosteaderos en cada estación del año 2001. Para ello se ubicaron bosteaderos situados junto a las madrigueras que los conejos construyen, por lo general, entre los arbustos adyacentes a los mallines. Con el fin de asegurarse que cada muestra correspondía a bosteaderos de diferentes individuos, se muestrearon bosteaderos ubicados a una distancia de, al menos, 50 m de distancia entre sí. Las muestras fueron analizadas individualmente por medio del análisis microhistológico (Williams 1969; Latour & Sbriller 1981; Holechek 1982) y la identificación de los fragmentos se realizó a nivel específico, cuando fue posible, agrupándose los mismos en las siguientes categorías: Gramíneas, Graminoides (Juncaceae y Ciperaceae), Hierbas, Arbustos y Árboles. El resultado de la lectura microscópica se expresó en forma de porcentajes de frecuencia relativa (Holechek & Gross 1982).
Para la presentación de los resultados, no así para los análisis estadísticos, se tuvieron en cuenta sólo aquellas especies que presentaron un porcentaje mayor al 10% en al menos una de las épocas del año; el resto de las especies se agruparon dentro de la categoría correspondiente. Se caracterizó a la dieta para cada época del año a través del promedio de cada ítem dietario con su correspondiente error estándar (n = 15 individuos). Para detectar variaciones estacionales en el consumo de cada especie vegetal se empleó el test de Kruskal-Wallis y comparaciones de a pares a un nivel de significancia del 5% (Siegel 1986).
La diversidad de ítems alimenticios en la dieta promedio de cada estación se estimó utilizando el índice de Shannon (Washington 1984). Igualmente se calculó la similitud de las dietas entre estaciones empleándose el índice de Bray Curtis modificado por Rosemburg (Mc Innis et al. 1990).
RESULTADOS
En las 60 muestras analizadas (15 individuos por cuatro estaciones) se identificó a nivel de género y/o especie, un total de 54 ítems vegetales en la dieta del conejo. Sin embargo, sólo seis especies presentaron un porcentaje superior al 10% en al menos una de las épocas del año (Tabla 1).
Tabla 1. Porcentajes promedio (± ES) de las principales especies vegetales en la dieta del conejo europeo para cada época del año y promedio total. Letras distintas indican diferencias significativas (P < 0.05) entre estaciones para cada ítem vegetal.
Table 1. Average percentages (± SE) of main vegetal species in the European rabbit diet for each season and total average. Different letters indicate significant differences (P < 0.05) among seasons for each vegetal item.

Considerando el promedio anual (Figura 1), la dieta del conejo europeo consistió principalmente de gramíneas (46%) seguidas por las graminoides (28%) y los arbustos (11%), mientras que el grupo de árboles y hierbas no superaron el 10%.
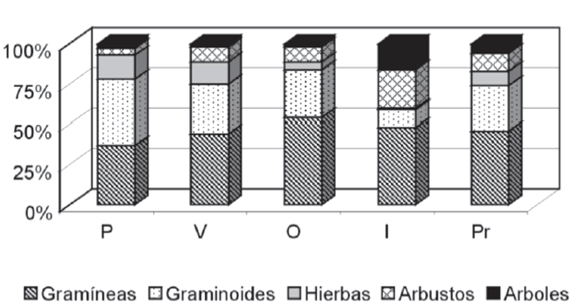
Figura 1. Participación de los distintos grupos vegetales en la dieta estacional del conejo silvestre europeo (P = primavera, V = verano, O = otoño, I = invierno, Pr = promedio).
Figure 1. Participation of the different vegetal groups in the seasonal diet of the European wild rabbit (P = spring, V = summer, O = autumn, I = winter, Pr = average).
Si tenemos en cuenta la dieta por estaciones (Tabla 1), vemos que en verano, otoño y primavera, el 75% o más de la dieta estuvo compuesta por gramíneas y graminoides, siendo las primeras el grupo principal, excepto en primavera donde se da la relación inversa. De las gramíneas consumidas las de mayor contribución fueron P. pratensis y F. pallescens y entre las graminoides sobresalieron C. gayana y J. balticus. En primavera y verano las hierbas tuvieron una participación relativamente mayor en la dieta (15% y 14% respectivamente), mientras que en el otoño e invierno no superaron el 5%. En este caso se destacaron las participaciones de Senecio triodon en primavera y de Medicago lupulina en verano. En cada una de las épocas mencionadas en primer término, el consumode arbustos no superó el 10%, mientras que el de especies arbóreas no alcanzó el 3%.
En invierno, las gramíneas también fueron el componente más importante de la dieta (48%), mientras que las graminoides (11%) disminuyeron su participación en favor del grupo de arbustos (24%) y de árboles (16%). La contribuci ón de las hierbas fue escasa. En el caso de las gramíneas y graminoides, las principales especies consumidas fueron las mismas que en las otras épocas del año, mientras que en el grupo de los arbustos se destacó claramente B. buxifolia y en el de los árboles N. antarctica (Tabla 1). Esta diferencia entre la dieta de invierno con la de las restantes épocas del año se vio reflejada en los respectivos índices de similitud (Tabla 2), donde los valores más bajos corresponden a los pares conformados por el invierno con el otoño, primavera y verano, respectivamente. Por otra parte, la dieta de verano mostró la mayor diversidad de especies vegetales seguida, en orden decreciente, por las dietas de primavera, otoño e invierno (Tabla 2).
Tabla 2. Índices promedios de similitud (%) entre las dietas estacionales y diversidad trófica promedio para cada estación del año en la dieta del conejo europeo.
Table 2. Average similarity indexes (%) among seasonal diets and average trophic diversity for each season of the year in the European rabbit diet.

DISCUSIÓN
La dieta del conejo estuvo basada fundamentalmente en el consumo de gramíneas y graminoides. La tendencia de esta especie exótica al consumo prioritario de estos grupos vegetales (cuando estas plantas están disponibles) también fue observada en Tierra del Fuego (Amaya & Bonino 1981) así como en otros lugares del mundo, tal es el caso de Australia (Myers & Poole 1963), España (Soriguer 1988), Francia (Chapuis 1990), Holanda (Wallage-Drees & Michielsen 1989), Inglaterra (Williams et al. 1974; Bhadresa 1977), Irlanda (Wolfe et al. 1996; Siobhan et al. 1996), Portugal (Marques & Mathias 2001) y República Checa (Homolka 1987).
Los restantes grupos vegetales se destacaron en la dieta del conejo según la época del año; el mayor consumo de hierbas en primavera y verano fue coincidente con la época de mayor oferta de dichas plantas en la Patagonia (Siffredi & Sarmiento 1982). Por otra parte, el uso destacado de especies arbustivas y arbóreas en el invierno se explicaría por la reducida disponibilidad de los restantes grupos vegetales en esta época del año (Ayesa et al. 1999) y por cuestiones de acceso a plantas, especialmente de la parte central de los mallines, como veremos más adelante.
A excepción de las hierbas, todos los grupos vegetales tuvieron una participación más o menos destacada en la dieta de invierno, lo cual explicaría la baja similitud de ésta con las dietas de primavera, verano y otoño, respectivamente. Por otra parte, la evolución de la diversidad trófica a lo largo del año se debería básicamente a la participación diferencial del grupo de las hierbas (14 especies en verano, 12 en primavera, nueve en otoño y seis en invierno).
En este estudio, el área principal de alimentación de los conejos fue el mallín y el ambiente circundante, aunque con variaciones espaciales de uso según la época del año. Durante la época más seca del año (desde mediados de primavera a mediados de otoño) los mallines del área de estudio no se encontraban anegados, por lo tanto los conejos pudieron utilizar dichos ambientes sin restricciones. Esto se reflejó en la dieta de dichas épocas del año que estuvo compuesta por proporciones similares de gramíneas y graminoides que crecen tanto en parte central de los mallines (C. gayana, J. balticus, P. pratensis) como en su periferia (F. pallescens) (Boelke 1957). En cambio en invierno (época fría y de precipitaciones), el acceso a los mallines estuvo restringido por el anegamiento de los mismos, habitual en esta época del año (Marcolín et al. 1978). Esto, sumado a la escasez de alimento propia del invierno, hizo que los conejos utilizaran preferentemente gramíneas (F. pallescens y P. pratensis) que predominan en los bordes de los mallines, por lo general, más secos y recurrieran al ramoneo de arbustos y árboles de áreas adyacentes. Estas formaciones vegetales, y especialmente los arbustales, brindan una buena cobertura de refugio a los conejos que, habitualmente, construyen allí sus madrigueras (Gibb & Morgan Williams 1994; Myers et al. 1994; Rogers et al. 1994; Thompson & King 1994). Este comportamiento ramoneador durante el invierno también podría deberse, en parte, a la nieve que se acumula con frecuencia en esta época impidiendo el acceso de los conejos al estrato herbáceo.
Considerando que los mallines son los ambientes de mayor productividad forrajera del área de estudio y de la parte occidental de la Patagonia en general (Boelke 1957; Ayesa et al. 1999) y que la densidad de conejos puede superar los 70 individuos/ha de mallín (Bonino, obs. pers.), es muy probable que, en algunas áreas, se plantee un solapamiento con el ganado doméstico por el uso de los recursos forrajeros.
Además, el pastoreo del conejo podría afectar negativamente la regeneración de algunas especies vegetales, como ha ocurrido en otras regiones del mundo (Armstrong 1982; Leigh et al. 1989; Auld 1990). Por estos motivos, consideramos que sería sumamente importante realizar estudios sistemáticos sobre el conejo, tendientes a determinar la carga de individuos en distintas áreas de la Patagonia, el grado de interacción trófica con los herbívoros silvestres y domésticos y el impacto de esta especie exótica sobre la fauna y flora nativas.
AGRADECIMIENTOS
Al Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) por el apoyo financiero. A A. Sbriller por el apoyo de laboratorio y en la identificación de las plantas. A los revisores anónimos por sus valiosos comentarios que permitieron mejorar el manuscrito.
BIBLIOGRAFÍA
AMAYA, J & N BONINO. 1981. El conejo silvestre europeo (Oryctolagus cuniculus) en Tierra del Fuego. IDIA 388:14-31. [ Links ]
ARMSTRONG, P. 1982. Rabbit (Oryctolagus cuniculus) on islands: a case study of successful colonization. J. Biogeog. 9:353-362. [ Links ]
AULD, TD. 1990. Regeneration in populations of the arid zone plants Acacia carnie and A. oswaldii. Proceedings of the Ecological Society of Australia 16:267-272. [ Links ]
AYESA, J; D BARRIOS; G BECKER; D BRAN; F LETOURNEAU ET AL. 1999. Evaluación de los recursos naturales renovables del área Pulmarí y recomendaciones orientativas para su aprovechamiento sustentable. INTA EEA Bariloche. Comunicación Técnica RN 54. 131 p. [ Links ]
BARROS, V; V CORDON; C MOYANO; R MENDEZ; J FORQUERA ET AL. 1983. Cartas de precipitación de la zona oeste de Río Negro y Neuquén. Universidad Nacional del Comahue, Fac. de Agronomía. Cinco Saltos, Neuquén. [ Links ]
BHADRESA, R. 1977. Food preferences of rabbits Oryctolagus cuniculus L. at Holkham sand dunes, Norfolk. J. Appl. Ecol. 14:287-291. [ Links ]
BOELKE, O. 1957. Comunidades herbáceas del norte de Patagonia y sus relaciones con la ganadería. Rev. Inv. Agr. 11:1-97. [ Links ]
BONINO, N & J AMAYA. 1985. Distribución geográfica, perjuicios y control del conejo silvestre europeo Oryctolagus cuniculus (L) en la República Argentina. IDIA 432:2550. [ Links ]
BONINO, N & R GADER. 1987. Expansión del conejo silvestre europeo (Oryctolagus cuniculus) en la Rep. Argentina y perspectivas futuras. An. Mus. Hist. Nat. 18:157-162. [ Links ]
BONINO, N & R SORIGUER. 2004. Distribución actual y dispersión del conejo europeo (Oryctolagus cuniculus) en Mendoza (Argentina). Mastozoología Neotropical 11(2):237-241. [ Links ]
CABRERA, A. 1971. Fitogeografía de la República Argentina. Bol. Soc. Arg. Bot. 14:1-42. [ Links ]
CHAPUIS, JL. 1990. Comparison of the diets of two sympatric lagomorphs, Lepus europaeus (Pallas) and Oryctolagus cuniculus (L.) in an agroecosystem of the Ile-de-France. Z. Säugetierk. 55:176-185. [ Links ]
FLUX, JEC. 1994. World distribution. Pp. 8-21 in: HV Thompson & CM King (eds.). The European rabbits, the history and biology of an successful colonizer. Oxford University Press. New York. 245 pp. [ Links ]
GIBB, JA & J MORGAN WILLIAMS. 1994. The rabbit in New Zealand. Pp. 158-204 in: HV Thompson & CM King (eds.). The European rabbits, the history and biology of an successful colonizer. Oxford University Press. New York. 245 pp. [ Links ]
HOLECHEK, JL. 1982. Sample preparation techniques for microhistological analysis. J. Range Manage. 35:541-542. [ Links ]
HOLECHEK, JL & B GROSS. 1982. Evaluation of different calculation procedures for microhistological analysis. J. Range Manage. 35:721-723. [ Links ]
HOMOLKA, M. 1987. A comparison of the trophic niches of Lepus europaeus and Oryctolagus cuniculus. Folia Zool. 36:307-317. [ Links ]
LATOUR, MC & A SBRILLER. 1981. Clave para la determinación de la dieta de herbívoros en el Noroeste de la Patagonia. Rev. Inv. Agrop. 16(1):109-157. [ Links ]
LEIGH, JH; DH WOOD; MD HOLGATE; AV SLEE & MG STANGER. 1989. Effects of rabbits and kangaroo grazing on two semi-arid grassland communities in central-western New South Wales. Aust. J. Ecol. 13:67-92. [ Links ]
MARCOLÍN, A; G DURAÑONA; R ORTIZ; E SOURROUILLE & G LARRAMA. 1978. Caracterización de mallines en un área del sudeste de Río Negro. INTA EEA Bariloche, Comunicación Técnica RN 29. 15 pp. [ Links ]
MARQUES, C & ML MATHIAS. 2001. The diet of the European wild rabbit, Oryctolagus cuniculus (L.), on different coastal habitats of Central Portugal. Mammalia 65(4):437-449. [ Links ]
MC INNIS, ML; LL LARSON & M VAVRA. 1990. Classifying herbivore diets using hierarchical cluster analysis. J. Range Manage. 43(3):271-274. [ Links ]
MYERS, K; I PARER; D WOOD & BD COOKE. 1994. Pp. 108-157 in: HV Thompson & CM King (eds.). The European rabbits, the history and biology of an successful colonizer. Oxford University Press, New York. 245 pp. [ Links ]
MYERS, K & WE POOLE. 1963. A study of the biology of the wild rabbit, Oryctolagus cuniculus (L.) in confined populations. IV. The effect of rabbit grazing on sown pastures. J. Ecol. 51:435-451. [ Links ]
ROGERS, PM; CP ARTHUR & RC SORIGUER. 1994. The rabbit in continental Europe. Pp. 22-63 in: HV Thompson & CM King (eds.). The European rabbits, the history and biology of an successful colonizer. Oxford University Press. New York. 245 pp. [ Links ]
SIEGEL, S. 1986. Estadística no paramétrica. Ed. Trillas. México. 344 p. [ Links ]
SIFFREDI, G & A SARMIENTO. 1982. Efecto del tamaño y número de las muestras para estimar la productividad de las hierbas en una estepa arbustiva patagónica. INTA Bariloche, Memoria Técnica 6:127-131. [ Links ]
SIOBHAN, GD; JS FAIRLEY & G O'DONNELL. 1996. Food of rabbits Oryctolagus cuniculus on upland grasslands in Connemara. Biology & Environment-Proceedings of the Royal Irish Academy 96B(2):69-75. [ Links ]
SORIGUER, RC. 1988. Alimentación del conejo (Oryctolagus cuniculus L. 1758) en Doñana, SO, España. Doñana Acta Vert. 15:141-150. [ Links ]
THOMPSON, HV & CM KING. 1994. The European rabbits, the history and biology of an successful colonizer. Oxford University Press. New York. 245 pp. [ Links ]
WALLAGE-DREES, M & N MICHIELSEN. 1989. The influence of food supply on the population dynamics of rabbits, Oryctolagus cuniculus (L.), in a Dutch dune area. Z. Säugetierk. 54:304-323. [ Links ]
WASHINGTON, HG. 1984. Diversity, biotic and similarity indices. Rev. Water Res. 18(6):653-694. [ Links ]
WILLIAMS, OB. 1969. An improved technique for identification of plant fragments in herbivore feces. J. Range Manage. 21:264-265. [ Links ]
WILLIAMS, K; I PARER; B COMAN; J BURLEY & M BRAYSHER. 1995. Managing Vertebrate Pests: Rabbits. Australian Government Publishing Service. Canberra, Australia. 284 pp. [ Links ]
WILLIAMS, OB; TC WELLS & DA WELLS. 1974. Grazing management of Woodwaltonfoten: seasonal changes in the diet of the cattle and rabbits. J. Appl. Ecol. 11:499-516. [ Links ]
WOLFE, A; J WHELAN & TJ HAYDEN. 1996. Dietary overlap between the Irish mountain hare Lepus timidus hibernicus and the rabbit Oryctolagus cuniculus on coastal grassland. Biology & Environment-Proceedings of the Royal Irish Academy 96B(2):89-95. [ Links ]














