Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral v.18 n.2 Córdoba mayo/ago. 2008
TRABAJOS ORIGINALES
Interacción entre calidad de restos vegetales, descomposición y fertilidad del suelo en el desierto del Monte de Argentina
Laura Noe* & Adriana Abril
Microbiología Agrícola, Facultad de Ciencias Agropecuarias, Universidad Nacional de Córdoba, Argentina.
* Microbiología Agrícola. Facultad de Ciencias Agropecuarias. Universidad Nacional de Córdoba. CC509. (5000) Córdoba. Argentina. Email: lauranoe@agro.uncor.edu.ar
Recibido: 14 de diciembre de 2007;
Fin de arbitraje: 29 de enero de 2008;
Revisión recibida: 23 de abril de 2008;
Aceptado: 21 de mayo de 2008
RESUMEN. Aunque existe abundante información sobre la relación entre los procesos de descomposición y la calidad de restos vegetales en los desiertos, poco se conoce acerca del efecto integrado de ambos factores sobre la fertilidad del suelo. Nosotros evaluamos durante un año, en el desierto del Monte (Mendoza, Argentina): a) la calidad química y biológica de los restos vegetales de dos especies leñosas (Prosopis flexuosa y Larrea divaricata) colectados en dos eventos de caída (verano y otoño), b) la dinámica de descomposición (pérdida de peso y variación en los componentes químicos) en jaulas con malla de 1 cm, y c) los cambios en la fertilidad del suelo subyacente (bajo la jaula). La calidad de los restos fue muy diferente entre fechas de recolección (verano: más celulosa, fenoles y N soluble; otoño: más C soluble) y entre especies (P. flexuosa: más fibras, N total y soluble y menos fenoles), sin embargo la dinámica de descomposición fue muy semejante entre especies. Contrariamente, la calidad de los restos (específicamente el contenido de compuestos solubles) parece afectar la magnitud de los cambios en la fertilidad del suelo subyacente. La gran disminución de microorganismos edáficos bajo L. divaricata probablemente se deba a la mayor exposición del suelo a la insolación del verano. Se concluye que durante el primer año, el proceso de descomposición está escasamente regulado por la calidad de los restos y que las variaciones detectadas responden mayoritariamente a las condiciones climáticas del Monte.
Palabras clave: Prosopis spp; Larrea spp; Lignina; Tasa de descomposición; Ácidos húmicos; Microorganismos edáficos; Celulolíticos; Nitrificadores.
ABSTRACT. Litter quality, decomposition process and soil fertility relationships in the Monte desert (Argentina): Although there is abundant information on decomposition processes and litter quality in deserts, little is known about the integrated effect of both factors on soil fertility. We evaluated, in the Monte desert (Mendoza, Argentina), during one year: a) the chemical and biological quality of litter of two woody species (Prosopis flexuosa and Larrea divaricata) collected after two litter fall events (summer and autumn), b) the decomposition dynamics (weight loss and chemical compound variations) in cages of 1 cm mesh, and c) the changes in fertility of the underlying soil (beneath the cage). Litter quality differed between falling dates (summer: more cellulose, phenols and soluble N; autumn: more soluble C) and between species (P. flexuosa: more fiber, total and soluble N and less phenols), while decomposition dynamics was similar between species. In contrast, litter quality (specifically, soluble compound contents) seems to affect the magnitude of changes in the underlying soil fertility. The important decrease in soil microorganisms under L. divaricata is probably due to the high soil exposure to summer insolation. It is concluded that, during the first year, the decomposition process is weakly regulated by litter quality and that the variations detected responded mainly to the Monte climatic conditions.
Keywords: Prosopis spp; Larrea spp; Lignin; Decomposition rate; Humic acids; Soil microorganisms; Cellulolytics; Nitrifiers.
INTRODUCCIÓN
La descomposición de los restos vegetales es un proceso clave en los ecosistemas debido a que influye sobre la construcción de la materia orgánica del suelo y la liberación de nutrientes para las plantas (Prescott 2005). Debido a ello, la dinámica de la descomposición ha sido extensamente analizada en diferentes ecosistemas (Vitousek et al. 1994; Carrera et al. 2005; Torres et al. 2005). Muchos de los estudios de descomposición analizan la relación existente entre las características químicas de los restos vegetales y la pérdida de peso del material en descomposición, siendo menos los trabajos que evalúan el efecto de la interacción de la calidad de los restos y la velocidad de descomposición sobre las características químicas y biológicas del suelo subyacente (Sariyildiz & Anderson 2003; Semmartin 2006).
Además de la calidad química de los restos, la tasa de descomposición está regulada por el clima, la biodiversidad de las comunidades microbianas, la degradación fisicoquímica (particularmente por radiación UV) y la cantidad y frecuencia de deposición de restos vegetales (Carrera et al. 2005; Prescott 2005; Austin & Vivanco 2006; Gallo et al. 2006). Este ultimo aspecto cobra especial relevancia en la región árida central de Argentina, donde existen al menos dos eventos anuales de deposición de restos de similar magnitud: uno en verano provocado por fuertes tormentas y otro en otoño como respuesta a la sequía (Álvarez et al., datos no publicados).
Generalmente, las metodologías experimentales utilizadas en los estudios de descomposición son "ecológicamente poco realistas" (Hoorens et al. 2004) debido a que las condiciones ambientales y los materiales suelen ser muy manipulados (e.g., camas de descomposición, bolsas de malla muy finas, material lavado, secado y molido, etc.), lo cual modifica fuertemente las características químicas y biológicas de los restos. De esta manera, muchos resultados de velocidad de descomposición son poco representativos del proceso en condiciones naturales (Prescott 2005). Además, para poder tener una aproximación a estudios ecológicamente realistas en regiones con mas de un evento anual de caída de hojas (como la región árida central de Argentina) se deben respetar las condiciones ambientales y aplicar modelos de "acumulación de caída discreta" (Olson 1963) que permitan evaluar el efecto de la incorporación de nuevo material aportado en diferentes fechas a lo largo del año.
En este trabajo se analiza el efecto de la calidad de los restos vegetales de plantas leñosas sobre los procesos de descomposición y la fertilidad del suelo subyacente, simulando las condiciones ecológicas de la región del Monte Central de Argentina en relación con el momento y el lugar de caída de los restos. La evaluación se realizó a través de: a) la caracterización química y biológica del material caído de las dos especies leñosas dominantes (Larrea divaricata y Prosopis flexuosa), b) las variaciones de la cantidad y calidad de los restos a lo largo de un año de descomposición, y c) las modificaciones en la fertilidad del suelo subyacente al final del año de descomposición.
Como en los ambientes áridos los procesos de descomposición son muy lentos debido a que las condiciones climáticas no favorecen la actividad microbiana (Bucher et al. 2003; Torres et al. 2005), se espera que en el desierto del Monte la calidad de los restos tenga un rol secundario en la regulación de la tasa de descomposición y los cambios en la fertilidad del suelo subyacente, si se lo compara con la importancia de la disponibilidad de agua y la alta insolación.
MATERIALES Y MÉTODOS
Área de estudio
El área de estudio fue la Reserva de la Biosfera de Ñacuñán (34°03' S y 67°58' W), de 12800 ha, ubicada en el departamento Santa Rosa, Mendoza (Argentina), creada en 1972 como Reserva Forestal, que en 1986 pasó a formar parte de la Red MAB-UNESCO con el objetivo de proteger las especies nativas y la conservación del suelo de la ecoregión del Monte Central (Claver & Roig-Juñent 2001).
La reserva está ubicada en una vasta llanura a 540 m sobre el nivel del mar, en la unidad de las "travesías y bolsones", que ocupa una extensa región del W de Argentina. Los suelos son profundos y arenosos, de origen eólico e hídrico, de pH neutro a ligeramente alcalino y moderada salinidad. El clima es templado y seco con una temperatura media anual de 15.6 °C. El régimen de precipitaciones es estival (noviembre-marzo), con un promedio anual de 329 mm (período 1972-1998), con déficit hídrico en todos los meses del año y marcada variación interanual (Claver & Roig-Juñent 2001). La flora es típica del desierto del Monte, caracterizada por un extenso arbustal dominado por Larrea spp., con ejemplares aislados de Prosopis spp. El estrato herbáceo se compone de gramíneas de crecimiento estival, como Pappophorum caespitosum y Digitaria californica (Marone et al. 2000; Claver & Roig-Juñet 2001). El trabajo se realizó en un área (18 ha) de bosque abierto de Prosopis flexuosa (3-5 m de altura), incluido dentro de una matriz de Larrea divaricata (1-2 m de altura) (Villagra & Villalba 2001). La cobertura de L. divaricata es de alrededor de 60%, la de P. flexuosa 10% y 15% de área expuesta (observación personal), con una productividad primaria anual aérea de aproximadamente 425 gm-2 para P. flexuosa y 200 gm-2 para L. divaricada (Álvarez et al., datos no publicados).
Diseño experimental
Se realizó un experimento de descomposición de un año de duración, en el que se evaluó la dinámica de descomposición de restos vegetales de Prosopis flexuosa y Larrea divaricata caídos durante el verano y el otoño. El material a incubar (hojas, ramas, frutos, etc.) acumulado bajo la canopia de las especies leñosas dominantes (P. flexuosa, especie arbórea caducifolia y L. divaricada, especie arbustiva perenne) se colectó en dos fechas: a fines del verano (I1) y a fines del otoño (I2) del año 2005. La recolección bajo P. flexuosa se realizó mediante trampas de tela de 1 x 1 m, sujetas por cuatro estacas a 30 cm del suelo. Para la recolección de restos de L. divaricata se utilizaron trampas cónicas de tela (30 x 30 cm) sostenidas por una estructura metálica.
El material se incubó en jaulas metálicas de 50 x 50 x 10 cm (unidades experimentales), divididas en cuatro sectores de 25 x 25 cm, cuyas base, tapa y paredes divisoras se cubrieron con mallas de 0.1 cm a fin de evitar el ingreso, la pérdida o el traspaso de restos vegetales entre los sectores de la jaula. Las paredes laterales se cubrieron con malla de 1 cm para no excluir la fauna, (Bucher et al. 2003; Prescott 2005) y no alterar el intercambio natural de aire y humedad. Inmediatamente después de la recolección de verano (I1), se colocaron 25 g de restos vegetales en cada uno de los sectores de las jaulas, se cerraron con precintos plásticos y se apoyaron sobre el suelo bajo las leñosas correspondientes. El diseño fue de cuatro repeticiones (individuos seleccionados al azar) por cada especie leñosa: P. flexuosa (Pf) y L. divaricata (Ld).
Diseño de muestreo
El muestreo de material inicial (I1y I2) colectado en las trampas consistió en cuatro muestras de 25 g cada una tomadas al azar. Los muestreos del material en descomposición se realizaron a intervalos de tres meses durante un año en concordancia con las cuatro estaciones climáticas: a) otoño: entre colocación de jaulas y los tres meses; b) invierno: entre los tres y seis meses; c) primavera: entre los seis y nueve meses y d) verano: entre los nueve y 12 meses. Cada muestra consistió en todo el material remanente de uno de los cuatro sectores de las jaulas. En otoño, la extracción coincidió con la segunda recolección de restos vegetales (I2), por lo que se agregaron 35 g en Pf y 13 g en Ld en los tres sectores restantes de cada jaula. El distinto peso de restos colocado en las jaulas en otoño se debió a que se respetó la proporción de material colectado en las trampas bajo cada especie de leñosa. A diferencia del material del verano (que fue muy semejante entre especies), en otoño la cantidad de restos de Prosopis fue 63% mayor que los de Larrea. Además, cabe mencionar que el material colectado de Prosopis presentaba en verano aproximadamente 25% de hoja y 60% de tallos, mientras que en otoño era 85% de hojas y 5% de tallos. Similarmente, el material de verano de Larrea tenía mayor proporción de tallos que el de otoño (50% vs. 5%).
Los muestreos de suelo (suelo superficial 0-20 cm) se realizaron en el momento de colocación de las jaulas de descomposición (inicial) y al finalizar el ensayo (1 año). Las muestras iniciales se colectaron a escasa distancia de las jaulas y las muestras al año se tomaron bajo las jaulas. Las muestras de suelo y de restos vegetales se conservaron: frescas, en heladera (4-5 °C) para las determinaciones biológicas, y secas y molidas (con molinillo eléctrico) para las determinaciones químicas.
Determinaciones
En los restos vegetales se determinaron los siguientes parámetros químicos: a) contenido de humedad mediante peso seco en estufa (60 °C), b) contenido N total con micro Kjeldahl y colorimetría, c) fibras insolubles (celulosa + lignina) por el método gravimétrico enzimático (Asp et al. 1983), d) lignina, separando la celulosa a partir de las fibras insolubles por lavado con ácido sulfúrico (72%) (Van Soest & Robertson 1980), y e) concentración de compuestos solubles previa extracción con agua a 80 °C (Robertson et al. 1999). Dentro de los compuestos solubles se determinó: C soluble por digestión húmeda de Walkley & Black (Nelson & Sommers 1982), N soluble mediante micro Kjeldahl y fenoles solubles por el método de Folin-Denis (Anderson & Ingram 1989).
La caracterización microbiológica de los restos vegetales se realizó mediante el análisis de la abundancia de grupos funcionales de microorganismos en medios selectivos específicos. Los grupos analizados fueron: nitrificadores (base mineral más sulfato de amonio), amonificadores (base mineral más asparagina) y celulolíticos (base mineral más papel de filtro) por el método del Número Más Probable y fijadores de N2 (medio general sin N) por cultivo en placa (Döbereiner 1995; Lorch et al. 1995).
En las muestras de suelo se determinó: a) contenido de materia orgánica (MO) por digestión húmeda de Walkley & Black (Nelson & Sommers 1982); b) N total mediante micro Kjeldahl y colorimetría; c) nitrato por colorimetría (Keeney & Nelson 1982); d) sustancias húmicas (SH) y ácidos fúlvicos (AF) según Adani et al. (2006); e) ácidos húmicos (AH) como diferencia entre SH y AF; f) materia orgánica biodisponible (MOB) como diferencia entre MO y SH; g) abundancia de grupos funcionales de microorganismos, con la misma metodología mencionada para restos vegetales, y h) actividad heterótrofa total (respiración del suelo), mediante captación de CO2 en álcali (NaOH 0.2 N) en muestras incubadas 7 días bajo condiciones estandarizadas de laboratorio (Alef 1995). Durante todo el año de estudio se registraron los datos de precipitaciones de la Estación Meteorológica de la Reserva Ñacuñán.
Cálculos
Se realizaron los siguientes cálculos:
1) Ajuste por "acumulación de caída discreta" (L): los valores de concentración de cada parámetro en otoño fueron corregidos mediante un cálculo de ajuste entre el material remanente a los tres meses de descomposición y el material colectado en otoño (I2) en relación al peso del material agregado (Olson 1963).
![]()
Donde L: concentración ajustada (%); X1: concentración (%) del parámetro del material remanente a los tres meses de descomposición; P1: peso seco (g) del material remanente a los tres meses de descomposición; X2: concentración (%) del parámetro del material agregado (I2); P2: peso seco (g) del material agregado a fines de otoño (I2); y Pt: peso total (g) del material a descomponer (P1+ P2).
2) Tasa de descomposición (k): mediante la variación en el peso seco del material remanente, según la ecuación de Olson (1963).
![]()
Donde Xt: peso seco (g) de los restos vegetales al tiempo t y X0: peso seco (g) del material inicial. Para el cálculo de la k anual se consideró como X0 a la suma de I1 + I2 y para las k estacionales los pesos remanentes de cada periodo.
3) Tiempo de permanencia del material vegetal: calculado mediante la inversa de la tasa de descomposición (Singh 1996).
4) La cantidad neta de compuestos químicos en el material inicial y final: mediante la transformación de la concentración del compuesto por el peso del material. Se consideró material inicial a la suma de los materiales I1 y I2, y como final el material remanente a los 12 meses de descomposición

Donde CN: cantidad neta del compuesto químico (g); Q1: concentración del compuesto químico (%); y P1: peso seco de material (g).
Análisis estadístico
Los restos vegetales iniciales (I1 y I2) fueron comparados estadísticamente entre fechas de recolección y especies mediante prueba de t (P<0.05). Además, se realizó un análisis multivariado de componentes principales (PCA) con todas las variables químicas y biológicas de los restos vegetales de ambas especies y épocas de recolección.
Los datos del material en descomposición fueron analizados mediante ANOVA (previa verificación de los supuestos de homogeneidad de varianzas por test de Bartlett y normalidad por test de Kolmogorov-Smirnov). Se comparó el material inicial (I1) y el ajuste L con las diferentes fechas de muestreo (test de LSD, P<0.05). No se consideraron de manera independiente los restos I2 debido a que están incorporados en el cálculo de ajuste L.
Para establecer el período de mayor descomposición, los pesos de los restos vegetales de fechas consecutivas fueron analizados de a pares mediante prueba de t (P<0.05). Los datos de suelo inicial y al año también se compararon mediante prueba de t (P<0.05).
RESULTADOS
Calidad de los restos vegetales
El análisis multivariado (PCA) de las características químicas de los restos vegetales distribuyó la variación de los datos en dos componentes principales significativos, los cuales explicaron 99.69% de la varianza total de los datos (Figura 1). El factor 1 (91.66% de la varianza total) discriminó los restos según la época de recolección y fue principalmente explicado por el contenido de fibras (celulosa y lignina), el C soluble y el contenido de N total. El factor 2 (8.03% de la varianza) discriminó las dos especies analizadas.

Figura 1. Análisis de componentes principales (PCA) de las características químicas y biológicas de los restos vegetales de verano y otoño de las dos especies de leñosas. Símbolos llenos: restos de verano; símbolos vacíos: restos de otoño; cuadrados: Prosopis flexuosa; triángulos: Larrea divaricata.
Figure 1. Principal component analysis (PCA) of chemical and biological properties. Solid symbols: summer litter; empty symbols: autumn litter; squares: Prosopis flexuosa; triangles: Larrea divaricata.
Los restos colectados en las dos épocas fueron significativamente diferentes en la mayoría de los parámetros. En verano (I1) el contenido de humedad, de fenoles y la abundancia de nitrificadores fueron mayores en ambas especies, mientras que el contenido de celulosa fue mayor sólo en Pf y el contenido de N soluble fue mayor sólo en Ld (Tabla 1). En los restos colectados en otoño (I2) el contenido de C soluble fue mayor en ambas especies, mientras que la abundancia de celulolíticos fue mayor sólo en Ld (Tabla 1).
Tabla 1. Características químicas y biológicas de los restos vegetales iniciales y en descomposición de las especies de leñosas analizadas. Pf: Prosopis flexuosa; Ld: Larrea divaricata; I1: restos de verano; I2: restos de otoño; L: valores ajustados entre los de otoño y el material I2. *: diferencias significativas entre fechas de recolección; : diferencias significativas entre especies de los restos colectados (prueba de t, P>0.05). Letras diferentes indican diferencias significativas entre I1, L y fechas de muestreos de material en descomposición. Test de LSD (P<0.05).
Table 1. Chemical and biological characteristics in fresh and decomposing litter of the woody species. Pf: Prosopis flexuosa; Ld: Larrea divaricata; I1: summer litter; I2: autumn litter; L: fitted values between autumn and I2 litter weight. *: significant differences between harvest dates; : significant differences between woody species (t test, P>0.05). Letters indicate significant differences among I1, L and seasons. LSD tests (P<0.05).
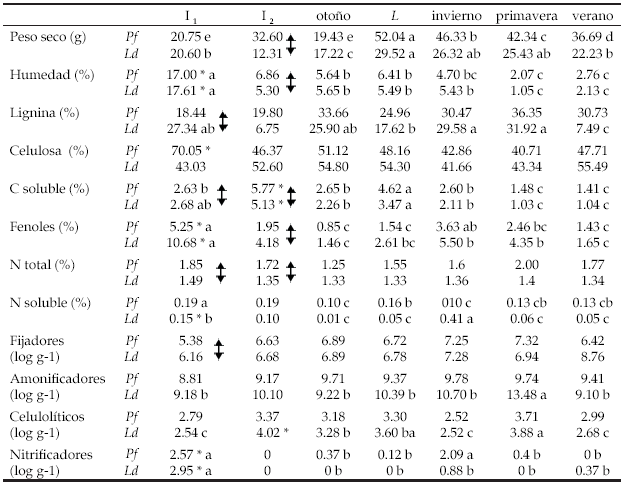
La composición química de los restos vegetales mostró numerosas diferencias significativas entre especies. En Pf, fue mayor el contenido de N soluble en ambas épocas de recolección, mientras que el contenido de celulosa fue mayor sólo en I1 y la humedad, la lignina y el N total fueron mayores sólo en I2 (Tabla 1). Los restos de Ld presentaron mayor contenido de fenoles en ambas fechas de recolección. Las poblaciones microbianas entre las dos especies de leñosas fueron semejantes, solo en Ld fue mayor la abundancia de amonificadores en I1 (Tabla 1).
La estructura porcentual de los grupos funcionales microbianos presentes en los restos vegetales fue constante entre especies y épocas. El grupo más abundante fue el de amonificadores (rango: 44.06-48.56%) seguido por fijadores (rango: 27.52-34.59%) y celulolíticos (rango: 12.20 - 19.32 %), mientras que los nitrificadores fueron los menos abundantes (rango: 0-14.17%) (Figura 2).

Figura 2. Abundancia relativa (%) de los grupos funcionales de microorganismos en los restos vegetales de Prosopis flexuosa y Larrea divaricata colectados en verano (I1), otoño (I2) y al final de un año de descomposición.
Figure 2. Relative abundance (%) of microbial functional groups in litter of Prosopis flexuosa and Larrea divaricata, collected in summer (I1), autumn (I2) and after one year of decomposition.
Descomposición de los restos vegetales
Las precipitaciones registradas durante el año de estudio fueron 376 mm, ligeramente superior a la media histórica. En todas las estaciones se produjeron lluvias, registrándose los valores más altos en verano y otoño y los menores en invierno (Figura 3).

Figura 3. Variación estacional del peso seco remanente de los restos vegetales de Prosopis flexuosa y Larrea divaricata en relación al peso total de los restos (verano más otoño), y las precipitaciones en el área de estudio. L: valores ajustados entre el peso remanente a los tres meses y el agregado en otoño.
Figure 3. Seasonal variations in the dry weigh of remaining litter of Prosopis flexuosa and Larrea divaricata, in relation to total litter dry weight (summer plus autumn) and rainfall in the study area. L: fitted values between the autumn and the added litter weight.
A lo largo del año de descomposición, los restos vegetales de ambas especies analizadas perdieron un bajo porcentaje de su peso seco (Pf=31.24%, Ld=32.43%) (Tabla 1, Figura 3), presentando una k anual muy similar: Pf=-0.41 y Ld=-0.46. Sin embargo, la dinámica de descomposición fue muy diferente entre especies. Los restos de Pf fueron perdiendo significativamente peso en todos los períodos analizados, aunque la mayor pérdida se detectó en verano (k=-0.57) y la menor en otoño (k=-0.26).
Contrariamente, en Ld la mayor pérdida de peso se registró en otoño (k=-0.71) y la menor en primavera (k=-0.14) (Tabla 1 y Figura 3). El tiempo de permanencia de los restos sobre el suelo fue muy similar entre especies: 2.41 años para Pf y 2.16 años para Ld.
Las características químicas del material en descomposición de Pf y Ld mostraron poca variación a lo largo del año. En otoño (después de tres meses de descomposición), sólo el contenido de humedad, de fenoles y el N soluble fueron significativamente menores al material I1. Después del agregado del material I2, sólo el contenido de C soluble en ambas especies y el N soluble en Pf fueron mayores en la concentración ajustada (L) en relación con los valores de otoño (Tabla 1).
El material en descomposición del invierno presentó diferencias significativas de pequeña magnitud en los parámetros químicos respecto al valor L: menor contenido de C soluble en ambas especies; mayor contenido de lignina y N soluble en Ld; y menor contenido de N soluble en Pf (Tabla 1). En primavera, ambas especies presentaron los valores más bajos en contenido de humedad y C soluble, mientras que solo en Ld el N soluble disminuyó en relación al invierno. En verano, la composición química del material remanente fue muy similar a la de primavera, excepto que en Ld disminuyó significativamente el contenido de lignina (Tabla 1).
La abundancia de grupos funcionales microbianos varió a lo largo del tiempo de descomposición. En Pf en invierno, los organismos nitrificadores fueron significativamente más, mientras que en Ld los celulolíticos fueron más abundantes en otoño y primavera y los amonificadores más abundantes solo en primavera (Tabla 1). La estructura porcentual de los grupos funcionales microbianos después de un año de descomposición fue diferente a la del material inicial. En ambas especies disminuyó la proporción de amonificadores y aumentó la de nitrificadores (Figura 2).
Características del suelo subyacente
Los cambios en el suelo bajo los restos vegetales después del año de descomposición fueron muy diferentes según las especies. Si bien en ambas especies aumentó el contenido de nitratos y MOB y disminuyó la abundancia de organismos nitrificadores y fijadores, bajo Ld también disminuyeron la humedad, la emisión de CO2 y la abundancia de amonificadores y celulolíticos (Figura 4).
Figura 4. Variación anual de las características químicas y biológicas del suelo y la cantidad neta de componentes químicos de los restos vegetales de Prosopis flexuosa (izquierda) y Larrea divaricata (derecha). s: suelo, rv: restos vegetales, SH: sustancia húmicas, NS: nitrógeno soluble, CS: carbono soluble y MOB: materia orgánica biodisponible. Barras indican ES.
Figure 4. Annual variation of soil chemical and biological characteristics and net amount of chemical components of Prosopis flexuosa (left) and Larrea divaricata (right) decomposing litter. s: soil, rv: litter, SH: humic substances, NS: soluble N, CS: soluble C; MOB: bioavailable organic matter. Bars indicate SE.
La estructura porcentual de los grupos funcionales microbianos en el suelo subyacente no mostró variaciones después del año de descomposición. Los organismos amonificadores siempre fueron dominantes (rango: 33.26-40.57%) seguidos por los celulolíticos (rango: 26.12-30.22%), y fijadores (rango: 19.25-24.18%), mientras que los nitrificadores (rango: 8.60-17.80%) fueron los menos abundantes (Figura 5).

Figura 5. Abundancia relativa (%) de los grupos funcionales de microorganismos del suelo, inicial y al año de descomposición, presentes en los restos vegetales de Prosopis flexuosa y Larrea divaricata.
Figure 5. Relative abundance (%) of soil microbial functional groups, at the start and one year after decomposition, present in Prosopis flexuosa and Larrea divaricata litter.
DISCUSIÓN
Calidad de los restos vegetales
Las diferencias detectadas en la calidad de los restos vegetales entre época de recolección y especie de leñosa se deban probablemente a las causas que provocan la caída de material y a las características propias de cada especie. Se conoce que en esta región del Monte, las fuertes tormentas de verano (viento y granizo) desprenden ramas completas (Álvarez et al., datos no publicados), lo que explica la mayor proporción de celulosa encontrada en Pf. Contrariamente, en otoño la caída de restos vegetales se produce debido a la sequía (Álvarez et al., dato no publicados), por lo que el material tiene escaso contenido de humedad. Además, el mayor contenido de C soluble en otoño puede deberse a que los restos se componen casi exclusivamente de hojas.
Las diferencias en el contenido de lignina entre las especies se justifica por la presencia de raquis lignificados en los restos de Pf colectados en otoño, mientras que el mayor contenido de fenoles en Ld es una característica ampliamente conocida de las especies de Larrea (Mabry et al. 1979; Carrera et al. 2005). Por otra parte, el mayor contenido de N en los restos de Pf en otoño podría tener relación con la escasa translocación de N que se produce previo a la defoliación de Prosopis spp. (Bucher et al. 2003). En general, la calidad química de los restos de ambas especies observada en este trabajo es coincidente con valores obtenidos por Carrera et al. (2005) en hojas senescentes de L. divaricata en la región sur del Monte argentino y con rangos mencionados por Reyes-Reyes et al. (2003) y Bucher et al. (2003) para otras especies de Prosopis.
La presencia de gran cantidad de microorganismos en el material recolectado de ambas especies y épocas es un claro indicador de que en los restos vegetales permanecen las poblaciones que viven sobre la superficie de las hojas vivas (filosfera) (Abril et al. 2005). Se considera que los microorganismos filosféricos son los responsables de iniciar los procesos de descomposición hasta que el material es recolonizado por los microorganismos del suelo (Jensen 1974; Torres et al. 2005).
Nuestra observación de bacterias en los restos vegetales recién caídos se contrapone con la afirmación de que en ambientes con alta insolación, la pérdida de peso de los restos sin contacto con el suelo se debe a procesos foto-químicos particularmente rayos UV (Austin & Vivanco 2006). Sin embargo, es consistente con los resultados variables y poco contundentes del efecto de los rayos UV sobre la descomposición revisados por Hoorens et al. (2004).
Las variaciones en la abundancia de microorganismos entre las dos fechas de recolección tienen estrecha relación con el clima y las características fisiológicas de cada grupo funcional microbiano. Por ejemplo, los bajos valores de nitrificadores en otoño coinciden con el menor contenido de humedad de los restos y la alta sensibilidad de los nitrificadores a las condiciones de sequía (Abril 2003; Torres et al. 2005). Con el mismo criterio, los altos valores de celulolíticos en otoño indicarían presencia de esporas y no microorganismos funcionales. Es bien conocido que los vientos secos con suelo en suspensión depositan gran cantidad de esporas sobre las hojas (Abril et al. 2005), lo que es coincidente con las condiciones climáticas de otoño en Ñacuñán (Estrella et al. 2001).
La presencia de microorganismos en los restos recién caídos está muy relacionada con la manipulación hecha comúnmente con el material que se coloca a descomponer. No cabe duda de que en el material lavado, secado, molido y conservado durante muchos meses no se mantienen las poblaciones microbianas originales, por lo que los resultados pueden diferir de los obtenidos en condiciones naturales (Prescott 2005).
Calidad de los restos y descomposición
Nuestros resultados indican que la diferente composición química de los restos vegetales no afecta la tasa de descomposición anual. Esta observación difiere de lo encontrado por Carrera et al. (2005) en la región sur del Monte, que tal vez pueda ser atribuido a las condiciones diferenciales en que fueron realizados ambos ensayos, ya que dichos resultados de fueron obtenidos por incubaciones en laboratorio (15% de humedad y 22 °C de temperatura) y las de este trabajo en condiciones de campo. Esta diferencia confirma nuestra idea de que, en el desierto del Monte el elemento clave que determina la velocidad de descomposición anual es la humedad del material remanente y en menor medida la calidad inicial de los restos (Fioretto et al 2005).
Contrariamente, la tasa de descomposición estacional parece estar más influenciada por las características químicas del material inicial, ya que no concuerdan con las fases de descomposición mencionadas para otros ambientes. Generalmente, se acepta que en todo proceso de descomposición existe una primera fase con altos valores de k correspondiente a la degradación de compuestos solubles del citoplasma celular (sustancias lábiles), y una segunda fase de menor pendiente en la que se degradan compuestos ligno-celulósicos de la pared celular (sustancias recalcitrantes) (Paul & Clark 1996; Vaieretti et al. 2005). Nuestros resultados muestran que los restos de Pf de verano que poseen mayor contenido de fibras, presentan la mayor k al final del año de descomposición (verano), mientras que los restos menos lignificados de Ld tienen una k más alta al comienzo del proceso de descomposición (otoño).
Según Santos et al. (1984), y Whitford et al. (1986), la tasa de descomposición en los desiertos responde principalmente a la cantidad de humedad acumulada más que a la suma total de agua caída. Estos autores consideran que, debido a las altas temperaturas y alta evaporación, el mantillo sólo acumula humedad si los eventos de lluvia son mayores a 25 mm. En Ñacuñán, durante el año de descomposición analizado, solo se registraron cuatro eventos mayores a 25 mm (de los 28 totales), distribuidos dos en otoño y dos en verano. Los primeros eventos serían los responsables del lavado de los compuestos solubles de los restos, mientras que los últimos probablemente inicien la descomposición de las moléculas recalcitrantes (Bernhard-Reversat et al. 2003; Cleveland et al. 2006).
Aunque la tasa de descomposición anual en Ñacuñán es semejante a las reportadas en otros ambientes áridos del mundo (entre -0.35 y -0.10) (Scholes & Walker 1993; Gholz et al. 2000) es muy diferente a la observada por Torres et al. (2005) en el Chaco árido (0.95). Posiblemente, esto se deba a que aunque los restos tienen características químicas semejantes, Ñacuñán, a diferencia del Chaco, tiene escasas precipitaciones en épocas de alta insolación, lo que favorece la desecación del material en descomposición durante la época de mayor actividad biológica (Estrella et al. 2001).
Esta apreciación también justifica la falta de efecto de la calidad de los restos sobre la dinámica microbiana del material en descomposición. A diferencia del Chaco árido, en Ñacuñán, durante el primer año de descomposición no se aprecian cambios en las comunidades microbianas, lo que estaría indicando que no se desencadena la segunda fase del proceso de descomposición. Desde el punto de vista microbiano, en la primera fase de descomposición predominan las comunidades de rápido crecimiento y altamente competitivas que incluyen a los grupos funcionales de amonificadores, fijadores de N y hongos sacarolíticos, mientras que en la segunda predominan poblaciones de crecimiento lento como los celulolíticos y nitrificadores (Paul & Clark 1996; Moller et al. 1999; Torres et al. 2005).
En coincidencia con los valores de la tasa de descomposición y la dinámica microbiana, las variaciones en los compuestos químicos a lo largo del proceso de descomposición tampoco mostraron cambios asociados a las características de los restos vegetales. Las escasas variaciones detectadas se relacionan con la pérdida de compuestos solubles (C, N y fenoles). Según Cleveland et al. (2006) las pérdidas de C soluble durante el proceso de descomposición pueden deberse a dos mecanismos principales: lixiviación y respiración microbiana. Las pérdidas de C soluble en Nacuñán se deberían principalmente al metabolismo microbiano ya que se produjeron de manera independiente de los eventos de lluvia. Posiblemente, el C soluble del material remanente fue el sustrato que mantuvo a las poblaciones microbianas en fase de latencia ya que no se degradó la lignina ni la celulosa (Ibrahima et al. 1995; Dilly & Munch 1996). Contrariamente, las pérdidas de fenoles y N soluble coinciden con los períodos de mayores precipitaciones, indicando que podrían deberse a procesos de lavado y lixiviación (Ibrahima et al. 1995; Bernhard-Reversat et al. 2003; Gallo et al.2006).
La inalterabilidad de los contenidos de lignina y celulosa en las dos especies analizadas es otra evidencia de que los procesos microbianos están muy deprimidos durante el primer año de descomposición. Nuestros resultados podrían indicar que la descomposición de las fibras comienza a partir de los 10 meses, debido a que en Pf se observó una tendencia a perder lignina y celulosa en el último período
Calidad de los restos y fertilidad del suelo
A diferencia de la dinámica de la descomposición, la calidad de los restos vegetales del Monte afecta de manera diferencial la fertilidad del suelo subyacente. Aunque muchos de los parámetros de fertilidad que se modifican son los mismos en ambas especies (contenido de nitratos, MOB y abundancia de microorganismos), la mayor cantidad de parámetros que disminuyen en Ld y la mayor magnitud de los aumentos en Pf estarían indicando un efecto combinado entre la calidad de los restos vegetales y las condiciones climáticas. Por ejemplo, el alto contenido de N soluble y la mayor cobertura de canopia de P. flexuosa provocan un mayor aumento de nitratos y una menor disminución de microorganismos. Es bien conocido que en los desiertos la alta insolación estival deseca el suelo superficial y detiene la actividad microbiana (Abril & Noé 2007; Conant et al. 2004), por lo que la sombra de los árboles cobra especial relevancia en la conservación de la humedad y la moderación de la temperatura. Estos aspectos quedan claramente evidenciados en nuestros resultados de menor humedad y respiración edáfica bajo Ld.
Que las modificaciones en la fertilidad del suelo se expresen solo en la fracción soluble del C y del N (MOB y nitratos) es consistente con el hecho de que luego de un año no se desencadena la descomposición de los compuestos ligno-celulósicos. Debido a su rol en la síntesis de ácidos húmicos, los compuestos ligno-celulósicos son los principales responsables de los cambios en la cantidad y calidad de C del suelo (Eichhorn & Hüttermann 1999). Asimismo, nosotros no detectamos aumento en las sustancias húmicas del suelo a pesar de que se observó lavado de fenoles desde los restos en descomposición. Esto podría deberse a que las condiciones climáticas del Monte no favorecen los procesos de humificación (Robertson & Paul 2000; Reyes-Reyes et al. 2003).
En síntesis, nuestros resultados confirman la predicción que en el Monte la tasa de descomposición está escasamente regulada por la calidad de los restos vegetales y que las variaciones en los componentes químicos responden principalmente a las condiciones climáticas. Por tal motivo, si bien este estudio constituye una contribución al conocimiento de los procesos biológicos en ambientes de desierto, no permite generalizar un patrón de descomposición y retorno de nutrientes debido a que son resultados de sólo un año y, por lo tanto, no incluyen la alta variabilidad climática interanual del Monte.
AGRADECIMIENTOS
Este trabajo fue financiado por la Agencia Córdoba Ciencia mediante beca a LBN y la Agencia de Promoción Científica y Técnica, a través del PICTR 2002 00200.
BIBLIOGRAFÍA
ABRIL, A. 2003. ¿Son los microorganismos edáficos buenos indicadores de impacto productivo en los ecosistemas? Ecología Austral 13:195-204. [ Links ]
ABRIL, A & L NOÉ. 2007. Soil C sink and CO2 flux in a marginal dry forest of western Argentina. Pp. 191-202 en: Verne, NC (Ed.). Forest Ecology Research Horizons. Nova Science Publishers, Inc. NY. [ Links ]
ABRIL, AB; PA TORRES & EH BUCHER. 2005. The importance of phyllosphere microbial populations in nitrogen cycling in the Chaco semiarid woodland. J. Trop. Ecol. 21:1-5. [ Links ]
ADANI, F; P GENEVINI; F TAMBONE & E MONTONERI. 2006. Compost effect on soil humic acid: a NMR study. Chemosphere 65:1414-1418. [ Links ]
ALEF, K. 1995. Soil respiration. Pp. 214-219 en: Alef, K & P Nannipieri (Eds.). Methods in Applied Soil Microbiology and Biochemistry. Academic Press, London. [ Links ]
ANDERSON, JM & JS INGRAM. 1989. Tropical Soil Biology and Fertility, a Handbook of Methods. Commonwealth Agriculture Bureau. Wallingford, UK. [ Links ]
ASP, NG; JG CLAES; H HALLMER & M SILJESTROM. 1983. Rapid enzymatic assay of insoluble and soluble dietary fiber. J. Agric. Food. Chem. 31:76-482. [ Links ]
AUSTIN, AT & L VIVANCO. 2006. Plant litter decomposition in a semi-arid ecosystem controlled by photodegradation. Nature 442:555-558. [ Links ]
BERNHARD-REVERSAT, F; G MAIN; K HOLL; J LOUMETO & J NGAO. 2003. Fast disappearance of de water-soluble phenolic fraction in eucalypt leaf litter during laboratory and field experiments. Appl. Soil Ecol. 23:273-278. [ Links ]
BUCHER, EH; PA TORRES & A ABRIL. 2003. Litter quality and litter removal by the native fauna in the Chaco woodland of Argentina. J. Trop. Ecol. 19:337-341. [ Links ]
CARRERA, A; DN VARGAS; MV CAMPANELLA; MB BERTILLER: CL SAIN ET AL. 2005. Soil nitrogen in relation to quality and decomposability of plant litter in the Patagonian Monte, Argentina. Plant Ecol. 181:139-151. [ Links ]
CLAVER, S & SA ROIG-JUÑENT (Eds.). 2001. El desierto del Monte: La Reserva de Biosfera de Ñacuñán. Mendoza: IADIZA-MAB-UNESCO. 226 pp. [ Links ]
CLEVELAND, CC; SC REED & AR TOWSEND. 2006. Nutrient regulation of organic matter decomposition in a tropical rain forest. Ecology 87:492-503. [ Links ]
CONANT, RT; P DALLA-BETTA; CC KLOPATEK & JM KLOPATEK. 2004. Controls on soil respiration in semiarid soils. Soil Biol. Biochem. 36:945-951. [ Links ]
DILLY, O & JC MUNCH. 1996. Microbial biomass content, basal respiration and enzyme activities during the course of decomposition of leaf litter in a black alder (Alnus glutinosa (L.) Gaertn.) forest. Soil Biol. Biochem. 28:1073-1081. [ Links ]
DÖBEREINER, J. 1995. Isolation and identification of aerobic nitrogen fixing bacteria from soil and plants. Pp. 134-141 en: Alef, K & P Nannipieri (Eds.). Methods in Applied Soil Microbiology and Biochemistry. Academic Press, London. [ Links ]
EICHHORN, J & A HÜTTERMANN. 1999. Mechanisms of humus dynamics and nitrogen mineralization. Pp. 278-315 en: Rastin, N & J Bauhus (Eds.). Going underground-ecological studies in forest soils. Research Signpost, India. [ Links ]
ESTRELLA, H; J BOSHOVEN & M TOGNELLI. 2001. Características del clima regional y de la Reserva de Ñacuñán, Pp. 25-31 en: Claver, S & SA Roig-Juñent (Eds.). El desierto del Monte: La Reserva de Biosfera de Ñacuñán. Mendoza: IADIZA-MAB-UNESCO. [ Links ]
FIORETTO, A; C DI NARDO; S PAPA & A FUGGI. 2005. Lignin and cellulose degradation and nitrogen dynamics during decomposition of three leaf litter species in a Mediterranean ecosystem. Soil Biol. Biochem. 37:1083-1091. [ Links ]
GALLO, ME; RL SINSABAUGH & SE CABANISS. 2006. The role of ultraviolet radiation in letter decomposition in arid ecosystems. Appl. Soil Ecol. 34:82-91. [ Links ]
GHOLZ, HL; DA WEDIN; SM SMITHERMAN; ME HARMON & WJ PARTON. 2000. Long-term dynamics of pine and hardwood litter in contrasting environments: toward a global model of decomposition. Glob. Change Biol. 6:751-765. [ Links ]
HOORENS, B; R AERTS & M STROETENGA. 2004. Elevated UV-B radiation has no effect on litter quality and decomposition of two dune grassland species: evidence from a long-term field experiment. Glob. Change Biol. 10:200-208. [ Links ]
IBRAHIMA, A; R JOFFRE & D GILLON. 1995. Changes in litter during the initial leaching phase: an experiment on the leaf litter of Mediterranean species. Soil Biol. Biochem. 27:931-939. [ Links ]
JENSEN, V. 1974. Decomposition of angiosperm tree leaf litter. Pp. 69-104 en: Dickinson, GH & GJ Pugh (Eds.). Biology of Plant Litter Decomposition. Academic Press. London. [ Links ]
KEENEY, D & D NELSON. 1982. Nitrogen inorganic forms. Pp. 643-698 en: Page, AL; R Miller & D Keeney (Eds.). Methods of Soil Analysis. Chemical and Microbiological properties. Vol 2. American Society of Agronomy and Soil Science. Madison, WI. [ Links ]
LORCH, HJ; G BENCKIESER & JC OTTOW. 1995. Basic methods for counting microorganisms in soil and water. Pp. 146-161 en: Alef, K & P Nannipieri (Eds.). Methods in Applied Soil Microbiology and Biochemistry. Academic Press, London. [ Links ]
MABRY, TJ; JH HUNZIKER & DR DIFEO (Eds.). 1979. Creosete Bush, Biology and Chemistry of Larrea in New World Desert. Dowden Hutchinson & Ross Inc. Texas. [ Links ]
MARONE, L; ME HORNO & R GONZÁLEZ DEL SOLAR. 2000. Post-dispersal fate of seeds in the Monte desert of Argentina: patterns of germination in successive wet and dry years. J. Ecol. 88:940-949. [ Links ]
MOLLER, J; M MILLER & A KJOLLER.1999. Fungal-bacterial interaction on beech leaves: influence on decomposition and dissolved organic carbon quality. Soil. Biol. Biochem. 31:367-374. [ Links ]
NELSON DW & LE SOMMERS. 1982. Total carbon, organic carbon and organic mater. Pp. 539-580 en Page, AL; RH Miller & DR Keeney (Eds.). Methods of Soils Analysis. II. Chemical and Microbiological Properties. Soil Science Society of America. Madison, Wisconsin. [ Links ]
OLSON, J. 1963. Energy storage and the balance of producers and decomposers in ecological systems. Ecology 44:322-331. [ Links ]
PRESCOTT, CE. 2005. Do rates of litter decomposition tell us anything we really need to know? Forest Ecol. Manage. 220:66-74. [ Links ]
REYES-REYES, BG; E ZAMORA-VILLAFRANCO; ML REYES-REYES; JT FRIAS-FERNANDEZ; V OLALDE-PORTUGAL ET AL. 2003. Decomposition of leaves of huisache (Acacia tortuoso) and mesquite (Prosopis spp.) in soil of the central highlands of Mexico. Plant Soil 256:359-370. [ Links ]
ROBERTSON, GP & EA PAUL. 2000. Decomposition and soil organic matter dynamics Pp. 104-116 en: Sala, OE; RB Jackson; HA Mooney & RW Howarth (Eds.). Methods in Ecosystem Science. Springer-Verlag, New York. [ Links ]
ROBERTSON, GP; DC COLEMAN; CS BLEDSOE & P SOLLINS (Eds). 1999. Standard Soil Methods for Long-term Ecological Research. Oxford University Press, New York. [ Links ]
SANTOS, PF; NZ ELKINS; Y STEINBERGER & WG WHITFORD. 1984. A comparison of surface and buried Larrea tridentate leaf litter decomposition in North American hot deserts. Ecology 65:278-284. [ Links ]
SARIYILDIZ, T & JM ANDERSON. 2003. Interactions between litter quality, decomposition and soil fertility: a laboratory study. Soil Biol. Biochem. 35:391-399. [ Links ]
SCHOLES, RJ & BH WALKER (Eds). 1993. An African Savanna. Cambridge. UK. [ Links ]
SEMMARTIN, M. 2006. Dinámica de la descomposición y la mineralización neta del nitrógeno y del fósforo de heces de vacunos en pastoreo sobre un pastizal templado. Rev. Arg. Prod. Animal 26:193-202. [ Links ]
SINGH, B. 1996. Influence of forest litter on reclamation of semiarid sodic soil. Arid Soil Res. Rehabil. 10:201-211. [ Links ]
TORRES, PA; AB ABRIL & EH BUCHER. 2005. Microbial succession in litter decomposition in the Semi-arid Chaco woodland. Soil Biol. Biochem. 37:49-54. [ Links ]
VAIERETTI, MV; N PEREZ-HARGUINDEGY; DE GURVICH; AM CINGOLANI & M CABIDO. 2005. Decomposition dynamics and physico-chemical leaf quality of abundaba species in a montane woodland in central Argentina. Plant. Soil. 278:223-234. [ Links ]
VAN SOEST, PJ & JB ROBERTSON. 1980. Systems of analysis for evaluating fibrous feeds. Pp. 49-60 en Pidgen, WJ; CC Balch & M Graham (Eds.). Standardization of Analytical Methodology for Feeds. Int. Develop. Center and Int. Union Nutr. Sci. Ottawa, Canada. [ Links ]
VILLAGRA, PE & R VILLALBA. 2001. Estructura poblacional del algarrobal de la reserva de Ñacuñán. Pp. 71-75 en: Claver, S & SA Roig-Juñent (Eds.). El Desierto del Monte: La Reserva de Biosfera de Ñacuñán. IADIZA-MAB-UNESCO. Mendoza, Argentina. [ Links ]
VITOUSEK, P; D TURNER; W PARTON & R SANFORD. 1994. Litter decomposition on the Mauna Loa environmental matrix, Hawaii: patterns, mechanisms and models. Ecology 75:418-429. [ Links ]
WHITFORD, WG; Y STEINBERGER; W MACKAY, LW PARKER; D FRECKMAN ET AL. 1986. Rainfall and decomposition in the Chihuahua desert. Oecología 68:512-515. [ Links ]














