Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral v.20 n.1 Córdoba ene./abr. 2010
COMUNICACIÓNES BREVES
Grupos metabólicos microbianos de la laguna Mar Chiquita (Córdoba, Argentina) y su implicancia en el ciclado de nutrientes
Adriana Abril*, Laura Noe & Carolina Merlo
Microbiología Agrícola. Facultad de Ciencias Agropecuarias. Universidad Nacional de Córdoba.
Microbiología Agrícola. Facultad de Ciencias Agropecuarias. Universidad Nacional de Córdoba. C.C. 509. (5000) Córdoba. Email: aabril@agro.unc.edu.ar.
Recibido: 15 de mayo de 2009;
Fin de arbitraje: 7 de septiembre de 2009;
Revisión recibida: 11 de enero de 2010;
Aceptado: 20 de marzo de 2010
RESUMEN. Las poblaciones microbianas de ambientes salinos están adaptadas fisiológicamente a condiciones extremas de salinidad y escasez de oxígeno, y son las principales responsables del retorno de elementos químicos a la atmósfera en este tipo de sistemas. La laguna Mar Chiquita es un extenso lago salado de la provincia de Córdoba (Argentina), que ha sido muy poco explorado, en particular en sus aspectos microbiológicos. En este trabajo se presenta una primera aproximación al conocimiento de sus comunidades microbianas y se analizan las eventuales interacciones entre los diferentes metabolismos microbianos y las condiciones ambientales de la laguna. En muestras de agua y sedimentos de sitios costeros y aguas abiertas a distinta profundidad, se analizaron las características físicas y químicas y la abundancia de los grupos metabólicos microbianos involucrados en la degradación de compuestos orgánicos y en el ciclado de nitrógeno, hierro y azufre. La laguna presentó una comunidad microbiana abundante, en la que se observaron todos los grupos analizados, si bien los oxidadores de amonio fueron escasos. Las diferencias en abundancia y distribución de los diferentes grupos metabólicos podrían explicarse mediante los factores que regulan las disponibilidad de oxígeno y los aportes de carbono orgánico alóctono y autóctono. La reducción del sulfato parece ser un metabolismo preponderante, probablemente debido a la concentración elevada de sulfato en el agua y a la reducida capacidad de disolver oxígeno del agua salada. La presencia de organismos aeróbicos en ambientes con alta salinidad respondería a la interacción con organismos fotótrofos oxigénicos (cianobacterias). Por último, el metabolismo del nitrógeno parece ser muy conservador debido a la cantidad elevada de microorganismos fijadores y a la escasa abundancia de nitrato-reductores.
Palabras clave: Lago salado; Ecología microbiana; Hierro; Azufre; Sedimentos.
ABSTRACT. Microbial metabolic groups in Mar Chiquita lake (Córdoba, Argentina) and nutrient cycling implications: The microbial populations of saline environments are physiologically adapted to extreme conditions of salinity and oxygen shortage, and are major responsibles of chemical element returns to the atmosphere in salt water ecosystems. The Mar Chiquita lake, an extensive saline lake of the province of Córdoba, Argentina (Provincial Reserve and Ramsar Site), has been scarcely explored, particularly in its microbiological aspects. Here we present a first approach to the knowledge of its microbial communities and other environmental parameters. We collected water and sediment samples from the coast and open waters of different depth, and evaluated chemical and physical parameters and abundance of microbial metabolic groups involved in the degradation of organic compounds and nutrient release. The results showed an abundant bacterial community constituted by heterotrophic microorganisms with aerobic respiration and fermentation, and by amonifiers, nitrate-reducers, nitrogen fixers, hydrogen sulphide-oxidisers, sulfate-reducers, and iron-oxidisers. The ammonium-oxidisers were less abundant. The abundance of different metabolic groups responded to factors associated with oxygen availability and both allochthonous and autochthonous organic carbon availability. Similarly to other saline lakes of the world, our results suggest that in this lake: (1) sulfate reduction would be the most important metabolism, (2) the presence of aerobic organisms in high salinity environments would respond to the interaction with oxygenic phototrophic organisms (cianobacteria); and (3) nitrogen metabolism is very conservative due to the high abundance of fixers and the scarcity of nitrate-reducer microorganisms.
Keywords: Saline lake; Microbial metabolic groups; Iron; Sulphur; Sediments.
INTRODUCCIÓN
La laguna Mar Chiquita, en el noreste de la provincia de Córdoba, es el mayor lago de Argentina y el quinto lago salino del mundo. Junto con los Bañados del Río Dulce constituye un humedal enorme, de gran riqueza en biodiversidad. Fue declarado Reserva Provincial de uso múltiple, y ha sido incluida como sitio Ramsar en el año 2000 (Bucher 2006). Aunque constituye uno de los ecosistemas más extensos y particulares de la Argentina, sólo se conocen los aspectos geomorfológicos y químicos del agua y los sedimentos (Durigneux 1978; Martínez et al. 1994; Martínez 1995; Piovano et al. 2004) y la biodiversidad animal (Bucher 1992; Reati et al. 1997; Papeschi et al. 2000; Haro et al. 2001; Sagretti & Bistoni 2001; Gleiser et al. 2002; Torres & Mangeaud 2006). En cambio, los estudios sobre sus comunidades microbianas se limitan a un estudio pionero de carácter taxonómico de la costa de la localidad de Miramar (Seckt 1945) y a otro sobre cianobacterias (Reati et al. 1997).
Las bacterias desempeñan un papel central en la transformación de la materia y en el flujo de energía en los ecosistemas acuáticos ya que participan en el intercambio de elementos químicos en las fases suelo-agua y agua-atmósfera (Fenchel et al. 1998). El agua de los lagos salados presenta concentraciones y tipos de sales singulares, por lo que grupos microbianos de estos ambientes poseen adaptaciones para tolerarlas. Una de las más interesantes y difundida es el uso de vías metabólicas anaeróbicas a causa de la baja disponibilidad de oxígeno provocada por la salinidad (Hammer 1986; Hurlbert 1993; Ingvorsen & Brandt 2002). Los primeros estudios microbiológicos en lagos salados, realizados en el Mar Muerto, mostraron que los procariotas controlan en mayor medida que los eucariotas el flujo de energía y los ciclos biogeoquímicos en estos sistemas, incluyendo la producción primaria y los procesos de descomposición (Hammer 1986; Ingvorsen & Brandt 2002).
Este trabajo constituye una primera descripción de los grupos metabólicos microbianos. Evaluamos la abundancia de los grupos metabólicos microbianos cultivables relacionados con la degradación de la materia orgánica y el ciclado del nitrógeno, hierro y azufre. En particular, analizamos su relación con la composición química del agua y con los sedimentos en aguas abiertas y aguas costeras de la laguna.
MATERIALES Y MÉTODOS
La laguna Mar Chiquita es el colector final de una cuenca endorreica alimentada por los ríos Primero y Segundo, provenientes de las sierras de Córdoba, y por el río Dulce, que se origina en la sierra de Aconquija, Tucumán. Conforma una depresión de muy poca profundidad ubicada en medio de una llanura sedimentaria. Se estima que la profundidad máxima es de 9 a 10 m, y que sólo se alcanza en áreas muy reducidas, lo cual dificulta la navegación (Bucher 2006). La superficie de la laguna ha oscilado mucho según los registros disponibles, y la salinidad del agua varía en función de los cambios de volumen: entre 250 g/L en la década de 1970 a 25 g/L en 2003, cuando alcanzó la máxima superficie registrada (700000 ha) (Bucher 2006).
La información presentada en este trabajo se analizó a partir de material recolectado en un viaje de estudios batimétricos en aguas abiertas de la laguna en diciembre de 2002 y de muestras tomadas en aguas costeras, en la misma fecha. Las muestras colectadas en aguas abiertas provinieron de una transecta con orientación sur-norte desde la localidad de Miramar (30°54'55" S y 62°40'46" W) hasta la desembocadura del Río Dulce (30°18'10" S y 62°32'34" W). Cada sitio de muestreo fue georeferenciado y se registró su profundidad. El agua se muestreó en los primeros 20 cm de profundidad, y en cada sitio también se tomó una muestra de sedimento. Las muestras de aguas costeras se tomaron en el extremo NO de la laguna (30°27'17" S y 63°20'15" W), en una antigua desembocadura del brazo occidental del río Dulce (Bucher 2006). Los sitios se agruparon según su características en: costa de arena, costa de fango, profundidad escasa (1 a 2 m), intermedia (3 a 4 m) y máxima (8 m). Excepto para las profundidades escasa e intermedia (n=3), el resto de los sitios contó con una sola repetición, por lo cual no se presenta una comparación estadística de la información. El agua se muestreó con un recipiente de vidrio estéril de 1 L de capacidad, y el sedimento (1 kg, aproximadamente) mediante una draga.
Los parámetros químicos evaluados en el agua fueron pH, turbidez, salinidad y contenido de nitrato, amonio y fosfato (USEPA 1999), y en los sedimentos se evaluó textura, materia orgánica (Nelson & Sommers 1982), nitrógeno (microKjeldhal) y fósforo (Olsen & Sommers 1982). La determinación de los grupos de microorganismos se realizó mediante cultivo en medios preparados con el agua de la laguna (reemplazando las bases minerales y el agua) para representar las condiciones naturales (Jonkers & Abed 2003). Se analizó la abundancia de: (a) heterótrofos aeróbicos y fermentadores, por recuento en agar nutritivo con condiciones aeróbicas y anaeróbicas respectivamente; (b) fijadores de nitrógeno en medio sólido sin nitrógeno (Döbereiner 1995); (c) amonificadores en medio líquido con asparagina; (d) oxidadores de amonio en medio líquido con sulfato de amonio; (e) nitrato-reductores en medio líquido con nitrato de potasio (Lorch et al. 1995); (f) oxidadores de sulfuro en medio líquido con sulfato de sodio; y (g) sulfato-reductores y oxidadores de hierro en medio líquido con sulfato de potasio y hierro (clavo) (Lorch et al. 1995). La abundancia de microorganismos se expresó como el log10 del número de bacterias por gramo de sedimento o por mililitro de agua. Los oxidadores de sulfuro, los sulfato-reductores y los oxidadores del hierro se estimaron para todos los sitios excepto para los sedimentos de los sitios de costa.
Se estimó la estructura de la comunidad microbiana mediante la proporción de cada grupo funcional en relación al total de los grupos analizados. Se realizó un análisis de correlación entre la abundancia de los grupos microbianos y los parámetros químicos del agua y sedimentos mediante una prueba de Pearson.
RESULTADOS
Características del agua
El agua de la laguna presentó un pH similar entre sitios, pero mostró diferencias en la concentración de nutrientes y la salinidad, que resultaron mayores en los sitios costeros que en los sitios de aguas abiertas (Tabla 1).
Tabla 1. Características químicas del agua superficial (0 a 20 cm) y sedimentos de la Laguna Mar Chiquita. Costa de arena, costa de fango y aguas abiertas de escasa profundidad (1 a 2 m); profundidad intermedia (3 a 4 m), y de máxima profundidad (8 m). CV: coeficiente de variación. Los valores de profundidad escasa e intermedia representan el promedio ± 1 desvío estándar (n=3), mientras que el resto presentan el valor de una única muestra.
Table 1. Surface water (0-20 cm) and sediments chemical characteristics of the Mar Chiquita lake. Sand coast, mud coast, open waters of scarce depth (1-2 m), open waters of intermediate depth (3-4 m), and open waters of the highest depth (8 m). CV: variation coefficient. Scarce depth and highest depth values are average and ± 1 standard deviation (n=3) and the rest of the sites show the value of a single sample.
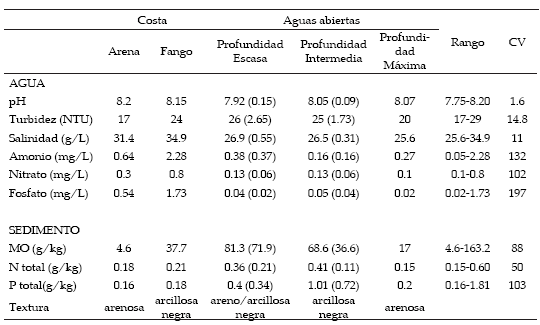
La abundancia de cada grupo metabólico varió mucho entre sitios (Figura 1a), en particular los nitrato-reductores (CV>150%). No se detectó la presencia de oxidadores de amonio en ninguna de las muestras analizadas. La mayoría de las poblaciones microbianas difirió entre los sitios costeros y los de aguas abiertas, y también entre los dos sitios costeros analizados. La costa de arena presentó altos valores de oxidadores de sulfuro (5.04 log/ml), muy escasos nitrato-reductores (0.04 log/ml), y ausencia de sulfato-reductores. Mientras tanto, la costa de fango presentó una gran abundancia de sulfato-reductores (1.32 log/ml) y de nitrato-reductores (4.43 log/ml), y muy bajos de oxidadores de sulfuro (0.68 log/ml). En cambio, las muestras de aguas abiertas presentaron una abundancia similar de microorganismos heterótrofos (aerobios y fermentadores), aunque variaron en el resto de las poblaciones sin relación con la profundidad de la laguna. Por ejemplo, en la máxima profundidad los nitrato-reductores fueron muy escasos (0.06 log/ml), mientras que los amonificadores presentaron el máximo valor (7.15 log/ml). Se detectaron correlaciones positivas significativas (P<0.05) entre la abundancia de heterótrofos aeróbicos, fermentadores y los nitrato-reductores con la salinidad y el contenido de los tres nutrientes analizados.

Figura 1. Abundancia relativa (%) de los grupos metabólicos microbianos en: (a) el agua superficial (0 a 20 cm), y (b) los sedimentos de la laguna Mar Chiquita. Los sitios corresponden a la costa (arena y fango) y a aguas abiertas de distinta profundidad (escasa, intermedia y máxima). El análisis de sedimentos solo se realizó para los sitios de aguas abiertas.
Figure 1. Microbial group relative abundance (%) in (a) surface water (0-20 cm), and (b) sediments of the Mar Chiquita lake. Sites correspond to coastal (sand and mud) and open waters of varying depth (scarce, intermediate and maximum). Sediments analyses were only performed for open waters sites.
La estructura de la comunidad difirió notablemente entre sitios. En la costa de arena dominaron los oxidadores de sulfuro (30.4%), mientras que en las aguas abiertas de profundidad máxima y escasa dominaron los amonificadores (36.9% y 43.9%, respectivamente). En la costa de fango los nitrato-reductores fueron co-dominantes con los fijadores de nitrógeno (31.7% y 31.4%, respectivamente), y en las aguas abiertas de profundidad intermedia dominaron de manera ligera los heterótrofos aeróbicos (25%). Los oxidadores de hierro fueron muy importantes en todos los sitios, excepto en las aguas abiertas de profundidad máxima (3.7%) (Figura 1a).
Características de los sedimentos
La textura de los sedimentos fue arenosa o fango negro arcilloso, y la composición química fue muy variable entre sitios, en especial el contenido de materia orgánica (Tabla 1). En concordancia, la abundancia de las poblaciones también fue muy heterogénea, con coeficientes de variación mayores a los del agua, en particular los nitrato-reductores y los oxidadores de sulfuro (Tabla 1).
De manera similar al agua, la abundancia de cada grupo metabólico difirió entre la costa y las aguas abiertas. Los oxidadores de amonio solo se detectaron en los sitios de costa, y difirieron entre ambos sitios: 2.14 y 0.39 log/ml para las costas de arena y de fango, respectivamente. También todos los grupos difirieron entre los dos sitios de costa, y fueron, en general, más abundantes en la de arena que en la de fango, a excepción de los amonificadores (7.3 vs. 10.0 log/ml) y los nitrato-reductores (0.0 vs. 4.48 log/ml). En los sitios de aguas abiertas, los sulfato-reductores sólo se detectaron en los sedimentos negro-arcillosos. La salinidad se correlacionó de manera positiva con la abundancia de amonificadores (r=0.952, P=0.0001) y con la de nitrato-reductores (r=0.79, P=0.01).
En los tres sitios de aguas abiertas, los oxidadores de hierro fueron dominantes (entre 24.2% y 27.5%), y la proporción de amonificadores y fijadores de nitrógeno fue constante. Por el contrario, los sulfato-reductores aumentaron y los heterótrofos de respiración aeróbica disminuyeron hacia los sitios de mayor profundidad (Figura 1b).
DISCUSIÓN
Este trabajo sugiere que la composición química del agua y de los sedimentos de la laguna Mar Chiquita es similar a la documentada en otros lagos salados del mundo (Hammer 1986) y a los escasos antecedentes locales (Reati et al. 1997; Bucher 2006), y que la variación de la abundancia de los microorganismos en el agua y en los sedimentos podría estar relacionada a diferencias en las características ecológicas entre los sitios analizados.
Por ejemplo, la cantidad similar de microorganismos heterótrofos sugiere la presencia de compuestos orgánicos biodisponibles en todos los sectores de la laguna. El origen de estos compuestos podría ser diferente según los sectores analizados: en las zonas costeras podrían provenir de la productividad del epibentos, ya que se observaron grandes masas de cianobacterias y epibentos púrpura de bacterias fotótrofas anoxigénica (Dzyuban 2003). En los sitios cercanos a la desembocadura del Río Dulce, podrían ser de origen alóctono, ya que el río Dulce arrastra gran cantidad de biomasa vegetal en descomposición proveniente de la zona de los pastizales inundables (Menghi 2006; Farjala et al. 2009). Por último, en las aguas abiertas podrían provenir de la actividad del fitoplancton (Overmann et al. 1996). A su vez, las correlaciones obtenidas entre la salinidad y los microorganismos heterótrofos anaeróbicos sugieren que existiría una menor disponibilidad de oxígeno en los sitios con mayor salinidad, si bien esta mayor salinidad parece no afectar negativamente a los heterótrofos aeróbicos de la zona de costa de arena, tal vez debido a que el oleaje aumenta la oxigenación del agua (Bucher 2006).
La abundancia de microorganismos fijadores de nitrógeno en todos los sitios sugiere que la laguna Mar Chiquita es un importante sistema captador de nitrógeno atmosférico. Si bien es conocida la importancia de los organismos fotótrofos (cianobacterias y bacterias fotótrofas) como fijadores de nitrógeno en ambientes acuáticos (Steppe & Paerl 2005), no existe información sobre los fijadores heterótrofos como los analizados en este trabajo. La presencia de gran cantidad de amonificadores en agua y sedimentos se debería a que son muy diversos y, en consecuencia, poco afectados por los factores ambientales (Vitousek et al. 2002). Por el contrario, el hecho que no se detectaron organismos oxidadores de amonio en la mayoría de los sitios respondería a que estos organismos son poco diversos y poco competitivos (Tamegai et al. 2007).
La gran variación en los organismos nitrato-reductores coincide con las variaciones en las condiciones ambientales de la laguna. Los valores más elevados en el agua y los sedimentos de la zona costera con fango arcilloso-negro sugieren que en ese sitio se conjugarían los tres factores clave para la actividad de los nitrato-reductores: la disponibilidad de nitratos (indicada por la abundancia de oxidadores de amonio), la escasez de oxígeno, y la presencia de compuestos orgánicos biodisponibles [ambos indicados por la abundancia de microorganismos fermentadores (Rabalais 2002; Bernnot & Dodds 2005; Tamegai et al. 2007)].
En coincidencia con otros autores (Kosolapov et al. 2003; Vetriani et al. 2003; Kondo & Butani 2007; Reese et al. 2008), nuestras observaciones sugieren que el ciclo del azufre es muy importante en lagos con alta concentración de sulfatos [18 a 30% de sus sales son sulfato (Bucher 2006)]. La gran abundancia de oxidadores de sulfuro en las aguas superficiales y de sulfato-reductores en los sedimentos coincide con lo observado por Vetriani et al. (2003) en el Mar Muerto. Una de las características de la actividad de las sulfato-reductoras en ambientes salinos es que gran parte del sulfuro de hidrógeno producido no llega a la atmósfera porque sigue alguno de estos tres caminos: se precipita como monosulfuro de hierro (lo cual se corresponde con los fangos negros untuosos), es re-oxidado en las aguas superficiales por las bacterias oxidadoras de sulfuros, o bien es utilizado como dador de protones por las bacterias fotótrofas anoxigénicas. Algunos autores mencionan que esta relación entre bacterias sulfato-reductoras y fotótrofas del azufre puede llegar a considerarse un mutualismo debido a la complementación metabólica estrecha que existe entre ellas (Reese et al. 2008). Estos procesos podrían estar sucediendo en la laguna Mar Chiquita debido a que es muy difícil que se perciban emanaciones de sulfuro de hidrógeno en el espejo de agua, pero sí en el fango expuesto al aire (Bucher 2006).
La presencia de oxidadores de hierro en los sedimentos es coincidente con la detección de otros organismos aeróbicos en zonas presumiblemente pobres en oxígeno. Esta situación se relacionaría con las condiciones de escasez de oxígeno que se pueden producir en las zonas fóticas (a escasa profundidad) que se registran en los lagos salados. Esto permite el desarrollo de cianobacterias que producen oxígeno durante la fase luminosa, que es utilizado por microorganismos aeróbicos en la fase oscura (Fourçans et al. 2004).
En síntesis, nuestros resultados sugieren que: (1) la reducción del sulfato sería el metabolismo preponderante en Mar Chiquita debido a la concentración elevada de sulfato en el agua y a la reducida capacidad de disolver oxígeno del agua salada, (2) la presencia de organismos aeróbicos en ambientes de mayor salinidad respondería a la interacción con organismos fotótrofos oxigénicos (cianobacterias), y (3) el metabolismo del nitrógeno sugiere que la laguna es un reservorio importante de nitrógeno debido a la elevada abundancia de microorganismos fijadores y a la escasa abundancia de nitrato-reductores.
AGRADECIMIENTOS
Los autores agradecen al equipo de investigación del Laboratorio de Hidráulica de la Universidad Nacional de Córdoba por la recolección de las muestras de aguas abiertas y al US Fish and Wildlife Service por el apoyo económico.
BIBLIOGRAFÍA
BERNOT, MJ & WK DODDS. 2005. Nitrogen retention, removal and saturation in lotic ecosystems. Ecosystems, 8:442-453. [ Links ]
BUCHER, EH. 1992. Population and conservation status of Flamingos in Mar Chiquita, Córdoba, Argentina. Colonial Waterbirds, 15:179-184. [ Links ]
BUCHER, EH (ed.). 2006. Bañados del Río Dulce y Laguna Mar Chiquita (Córdoba, Argentina). Academia Nacional de Ciencias. Córdoba, Argentina. 342 pp. [ Links ]
DÖBEREINER, J. 1995. Isolation and identification of aerobic nitrogen fixing bacteria from soil and plants. Pp. 134-141 en: Alef, K & P Nannipieri (eds.). Methods in Applied Soil Microbiology and Biochemistry. Academic Press, London. [ Links ]
DURIGNEUX, J. 1978. Composición química de las aguas y barros de la laguna Mar Chiquita en la provincia de Córdoba. Miscelánea, Academia Nacional de Ciencias (Córdoba, Argentina), 59:3-12. [ Links ]
DZYUBAN, AN. 2003. Bacteriobenthos of the upper Volga reservoirs as a characteristic of their environmental state. Water Resour., 30:680-688. [ Links ]
FARJALLA, V; C MARINHO; B FARIA; A AMADO; F ESTEVES; ET AL. 2009. Synergy of fresh and accumulated organic matter to bacterial growth. Microb. Ecol., 57:657-666. [ Links ]
FENCHEL, T; GM KING & TH BLACKBURN. 1998. Bacterial Biogeochemistry: the Ecophysiology of Mineral Cycling. Academic Press. San Diego. CA. 307 pp. [ Links ]
FOURÇANS, A; T GARCÍA DE OTEYZA; A WIELAND; A SOLÉ; E DIESTRA; ET AL. 2004. Characterization of functional bacterial groups in a hypersaline microbial mat community (Salins-de-Giraud, Camargue, France). FEMS Microbiol. Ecol., 51:55-70. [ Links ]
GLEISER, RM; G SCHELOTTO & DE GORLA. 2002. Spatial pattern of abundance of the mosquito, Ochlerotatus albifasciatus, in relation to habitat characteristics. Med. Vet. Entomol., 16:364-371. [ Links ]
HAMMER, UT. 1986. Saline Lake Ecosystems of the World. Dr. W Junk Publishers, Boston (USA). 620 pp. [ Links ]
HARO, JG; MA BISTONI & M GUTIÉRREZ. 2001. Ecología alimentaria del bagre blanco Pimelodus albicans (Val.) (Pisces, Pimelodidae) en la cuenca de Mar Chiquita (Córdoba, Argentina). Boletín Academia Nacional de Ciencias (Córdoba, Argentina), 66:235-239. [ Links ]
HASEGAWA, T & T OKINO. 2004. Seasonal variation of denitrification rate in lake Suwa sediment. Limnology, 5:33-39. [ Links ]
HURLBERT, SH (ed.). 1993. Saline Lakes V. Proceedings of Fifth Symposium on Inland Saline Lakes. Developments in Hydrobiology 84. Kluwer, Dordrecht. 335 pp. [ Links ]
INGVORSEN, K & KK BRANDT. 2002. Anaerobic microbiology and sulfur cycling in hypersaline sediments with special reference to Great Salt Lake. Pp 387-398 en: Wallace Gwynn, J (ed.). Great Salt Lake. An overview of change. Utah Geological Survey. Salt Lake City. USA. [ Links ]
JONKERS, H & R ABED. 2003. Identification of aerobic heterotrophic bacteria from photic zone of a hypersaline microbial mat. Aquat. Microb. Ecol., 30:127-133. [ Links ]
JUDD, KE; BC CRUMP & GW KLING. 2006. Variation in dissolved organic matter controls bacterial production and community composition. Ecology, 87:2068-2079. [ Links ]
KONDO, R & J BUTANI. 2007. Comparison of the diversity of sulfate-reduncing bacterial communities in the water column and the surface sediment of a japanese meromitic lake. Limnology, 8:131-141. [ Links ]
KOSOLAPOV, DB; DY ROGOZIN; IA GLADCHENKO; AI KOPYLOV & EE ZAKHAROVA. 2003. Microbial sulfate reduction in a brackish meromictic steppe lake. Aquat. Ecol., 37:215-226. [ Links ]
LORCH, H J; G BENCKIESER & JC OTTOW. 1995. Basic methods for counting microorganisms in soil and water. Pp. 146-161 en: Alef, K & P Nannipieri (eds.). Methods in Applied Soil Microbiology and Biochemistry. Academic Press, London. [ Links ]
MARTÍNEZ, DE; MA GÓMEZ PERAL & J MAGGI. 1994. Caracterización geoquímica y sedimentológica de los fangos de la laguna Mar Chiquita, provincia de Córdoba: aplicación del análisis multivariante. Revista de la Asociación Geológica Argentina, 49:26-38. [ Links ]
MARTÍNEZ, DE. 1995. Changes in the ionic composition of a saline lake, Mar Chiquita, province of Córdoba, Argentina. Int. J. Salt Lake Res., 4:25-44. [ Links ]
MARTINEZ-ALONSO, M; J MIR; P CAUMETTE; N GAJU; R GUERRERO; ET AL. 2004. Distribution of phototrophic population and primary production in a microbial mat from the Ebro Delta, Spain. Int. Microbiol., 7:19-25. [ Links ]
MENGHI, M. 2006. Vegetación. Pp. 173-190 en: Bucher RH (ed.). Bañados del Río Dulce y Laguna Mar Chiquita (Córdoba, Argentina). Academia Nacional de Ciencias. Córdoba, Argentina. [ Links ]
NELSON, DW & LE SOMMERS. 1982. Total carbon, organic carbon and organic mater. Pp 539-580 en: Page, AL; RH Miller & DR Keeney (eds.). Methods of Soils Analysis. Chemical and Microbiological Properties. American Society of Agronomy and Soil Science. Madison, WI. USA. [ Links ]
OLSEN, SR & LE SOMMERS. 1982. Phosphorus. Pp. 403-430 en: Page, AL; RH Miller & DR Keeney (eds.). Methods of Soil Analysis. II. Chemical and Microbiological Properties. American Society of Agronomy and Soil Science. Madison, WI. USA. [ Links ]
OVERMANN, J; JT BEATTI & KJ HALL. 1996. Purple sulphur bacteria control the growth of aerobic heterotrophic bacterioplankton in a meromitic salt lake. Appl. Environ. Microbiol., 62:3251-3258. [ Links ]
PAPESCHI, AG; RG COHEN; XI PASTORINO & F AMAT. 2000. Cytogenetic proof that the brine shrimp Artemia franciscana (Crustacea, Branchiopoda) is found in Argentina. Hereditas, 133:159-166. [ Links ]
PIOVANO, EL; FE LARIZATTI; D FAVARO; SM OLIVEIRA; SR DAMATTO; ET AL. 2004. Geochemical response of a closed-lake basin to 20th century recurring droughts/wet intervals in the subtropical Pampean plains of South America. J. Limnol., 63:21-32. [ Links ]
RABALAIS, NN. 2002. Nitrogen in aquatic ecosystems. Ambio, 31:102-112. [ Links ]
REATI, GJ; M FLORÍN; GJ FERNÁNDEZ & C MONTES. 1997. The laguna Mar Chiquita (Córdoba, Argentina): A little known, secularly fluctuating, saline Lake. Int. J. Salt Lake Res., 5:187-219. [ Links ]
REESE, BK; MA ANDERSON & C AMRHEIN. 2008. Hydrogen sulfide production and volatilization in a polymictic eutrophic saline lake, Salton Sea, California. Sci.Total Envir., 406:205-218. [ Links ]
SAGRETTI, L & MA BISTONI. 2001. Alimentación de Odontesthes bonariensis en la laguna salada de Mar Chiquita (Córdoba, Argentina). Gayana, 65:37-42. [ Links ]
SECKT, H. 1945. Estudios hidrobiológios hechos en la Mar Chiquita. Boletín de la Academia Nacional de Ciencias, 37:279-309. [ Links ]
STEPPE, TF & HW PAERL. 2005. Nitrogenase activity and nifH expression in a marine intertidal microbial mat. Microb. Ecol., 49:226-235. [ Links ]
TAMEGAI, H; R AOKI; S ARAKAWA & C KATO. 2007. Molecular analysis of the nitrogen cycle in deep-sea microorganisms from the Nonkai trough genes for nitrification and denitrification from deep-sea environmental DNA. Extremophiles, 11:269-275. [ Links ]
TORRES, R & A MANGEAUD. 2006. Factors affecting the nesting success of the Cattle Egret (Bubulcus ibis) in Laguna Mar Chiquita, Central Argentina. Ornitologia Neotropical, 17:63-71. [ Links ]
USEPA. 1999. Methods of Chemical Analysis of Water and Wastes. Environmental Protection Agency. Center for Environmental Research Information, Cincinati, OH. USA. [ Links ]
VETRIANI, C; H TRAN & L KERKHOF. 2003. Fingerprinting microbial assemblages from the oxic/anoxic chemocline of the Black Sea. Appl. Environ. Microbiol., 69:6481-6488. [ Links ]
VITOUSEK, PM; S HÄTTENSCHWILERS; L OLANDER & S ALLISON. 2002. Nitrogen and nature. Ambio, 31:97-101. [ Links ]














