Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral vol.20 no.2 Córdoba mayo/ago. 2010
SECCIÓN ESPECIAL
Chascomús: estructura y funcionamiento de una laguna pampeana turbia
Nadia Diovisalvi1, Gustavo Berasain2, Fernando Unrein1, Darío Colautti3, Paulina Fermani1, María E Llames1, Ana M Torremorell1, Leonardo Lagomarsino1, Gonzalo Pérez1, Roberto Escaray1, José Bustingorry1, Marcela Ferraro1 y Horacio E Zagarese1 *
1. Laboratorio de Ecología y Fotobiología Acuática, Instituto de Investigaciones Biotecnológicas-Instituto Tecnológico de Chascomús (IIB-INTECH), Chascomús, Provincia de Buenos Aires, Argentina.
2. Estación Hidrobiológica de Chascomús, Dirección Provincial de Pesca, Ministerio de Asuntos Agrarios de la Provincia de Buenos Aires, Chascomús, Provincia de Buenos Aires, Argentina.
3. Ecología y Producción Pesquera, Instituto de Investigaciones Biotecnológicas-Instituto Tecnológico de Chascomús (IIB-INTECH), Chascomús, Provincia de Buenos Aires, Argentina.
*Laboratorio de Ecología y Fotobiología Acuática, Instituto de Investigaciones Biotecnológicas- Instituto Tecnológico de Chascomús (IIB-INTECH), C.C. 164, (7130) Chascomús, Provincia de Buenos Aires, Argentina. Email: zagarese@intech.gov.ar.
Recibido: 30 de noviembre de 2009;
Fin de arbitraje: 1 de abril de 2010;
Revisión recibida: 7 de mayo de 2010;
Aceptado: 8 de mayo de 2010
RESUMEN. La laguna Chascomús es un típico lago somero, eutrófico y turbio de la Pampa Deprimida. Se encuentra permanentemente mezclada y presenta un grado elevado de homogeneidad espacial. La alternancia entre períodos de déficit y de exceso de agua, característica de la región, determina que la laguna sufra ciclos periódicos de sequía e inundación. Las primeras crónicas indican que a principios del siglo XX la laguna era turbia y que las primeras matas de vegetación habrían aparecido después de las inundaciones de 1913 y 1914. Hacia mediados del siglo XX, Chascomús se encontraba en un estado de aguas claras y colonizada de manera profusa por macrófitas. En ese momento, aproximadamente 60% de la biomasa de peces correspondía al pejerrey (Odontesthes bonariensis). En las últimas décadas, esta condición se modificó y en la actualidad la laguna está estabilizada en un estado turbio en el que la producción primaria fitoplanctónica es muy alta y se encuentra limitada por luz. La biomasa de fitoplancton representa el 75% del carbono de la columna de agua y predominan las cianobacterias nanoplanctónicas. Estudios de campo y experimentos en mesocosmos indican que la transparencia del agua está controlada por la cantidad de radiación incidente a través de una retroalimentación negativa con la producción primaria. La biomasa fitoplanctónica elevada se mantiene debido a la ausencia de un control efectivo por parte del zooplancton herbívoro. Como resultado de la presión de depredación que ejerce la comunidad actual de peces, la composición del zooplancton no presenta filtradores eficientes (e.g., Daphnia y otros cladóceros de gran tamaño). En la actualidad el pejerrey representa un porcentaje muy bajo de la biomasa total de peces (0.04%), mientras que los micrófagos omnívoros, como el sabalito (Cyphocharax voga), son dominantes. La dominancia del sabalito no sólo explicaría la baja abundancia del zooplancton, sino que al mismo tiempo contribuiría a evitar o retardar la consolidación del material sedimentado.
Palabras clave: Estados alternativos; Turbidez; Limitación por luz; Planctivoría; Contenido de carbono.
ABSTRACT. Chascomús: structure and functioning of a turbid pampean shallow lake: Laguna Chascomús is an eutrophic, turbid, shallow lake typical of the Pampa region of Argentina. This shallow lake is permanently mixed and displays a high degree of spatial homogeneity. The cyclical periods of excess and shortage of rain, characteristic of this area, result in periodic drying and flooding events. According to newspaper articles published during the first half of the XX century, the lake was originally turbid. The first patches of rooted vegetation appeared after the 1913 y 1914 floods. During most part of the XX century the lake remained in a "clear", vegetated state. During this period the dominant fish species was the silverside (pejerrey), Odontesthes bonariensis, which accounted for over 60% of the total fish catches (in biomass). Instead, by the end of the latest century the lake shifted to a turbid state that persisted until present. Currently, the phytoplankton primary production is limited by light and its values are among the highest ones reported for natural aquatic systems. In light limited systems, the transparency may be expected to be controlled by the amount of incident light, through a negative feedback loop with primary production. These predictions have been confirmed, both in mesocosm experiments and "in situ". The phytoplankton biomass, dominated by nanoplanktonic cyanobacteria accounts for 75% of the total amount of carbon in the water column. The equilibrium predicted by the light limitation theory could not hold if the model assumptions were violated. This situation could happen if the phytoplankton biomass were controlled by herbivore zooplankton. However, such a control of primary producer by herbivores seems to be precluded due to the absence of large-sized zooplankton grazers, presumably due to the composition of the fish assemblage. In contrast to earlier reports of the 1960, the proportion of pejerrey biomass is presently quite low (0.04%) and the community is dominated by omnivore microphagous, such as the sabalito (Cyphocharax voga). The dominance of sabalito could not only explain the composition of the zooplankton community, but it also could contribute to prevent or delay the consolidation of sediments.
Keywords: Alternative states; Turbidity; Light limitation; Planktivory; Carbon content.
INTRODUCCIÓN
Las lagunas son los ecosistemas acuáticos dominantes de la región pampeana. Aunque pueden ocupar extensiones grandes (>1000 ha), por lo general son lagos someros cuya profundidad media no excede los 3 m. Algunas lagunas son cuerpos de agua permanentes, mientras que otras tienen carácter temporario. En general, se caracterizan por un alto grado de trofismo natural, agravado por impactos antrópicos, tales como cambios en el uso de suelos, desarrollo urbano y obras de regulación (canales, compuertas) (Chornomaz et al. 2002; Maizels et al. 2003; Rennella & Quirós 2006). Las lagunas son elementos distintivos del paisaje pampeano y están muy asociadas a las economías regionales a través de su explotación como recursos turísticos, recreativos y pesqueros.
La estructura y el funcionamiento de los lagos someros son muy diferentes a los de los lagos profundos, que hasta no hace mucho tiempo fueron el objeto de estudio principal de la limnología tradicional. En particular, los lagos someros son ambientes muy dinámicos que pueden alternar entre diferentes estados de equilibrio. La clasificación más simplificada reconoce dos estados extremos: un estado de aguas claras (o vegetado) en el que la masa de agua está dominada por macrófitas, y un estado de aguas turbias caracterizado por un abundante desarrollo de fitoplancton y un escaso desarrollo de vegetación (Scheffer 1998; Scheffer & Jeppesen 2007). Algunas lagunas se estabilizan en uno u otro estado durante períodos largos de tiempo, mientras que otras alternan entre ellos de manera periódica.
Los lagos someros son sumamente sensibles a las variaciones climáticas debido a su escasa profundidad (Jeppesen et al. 1998). El funcionamiento de las lagunas pampeanas está gobernado -en gran medida- por las características climáticas e hidrológicas (Quirós et al. 2002a; Torremorell et al. 2007) que condicionan el desarrollo de las comunidades acuáticas, por lo cual afectan la diversidad, los ciclos de abundancia y reproducción, la producción primaria y las tasas de respiración y descomposición (Vymazal 1994; Hessen & Tranvik 1998; Sahagian & Melack 1998).
La laguna Chascomús es un exponente claro de las grandes lagunas pampeanas y una de las más estudiadas. Una recopilación bibliográfica reciente (Berasain & Velasco 2009) reúne por lo menos 92 trabajos, entre publicaciones, informes técnicos y congresos", en los que el nombre de la laguna está explícitamente incluido como parte del título. En este trabajo, nuestro objetivo no fue realizar una revisión exhaustiva de la bibliografía sino proporcionar una descripción actualizada de la estructura y funcionamiento de la laguna Chascomús. Consideramos que, en lo esencial, esta descripción puede ser aplicable a otras lagunas turbias pampeanas. Comenzamos describiendo las características generales de la región y la cuenca, y la evolución histórica de la laguna desde finales del siglo XIX, sobre la base de documentos históricos y publicaciones científicas. Más adelante describimos con mayor detalle la estructura y el funcionamiento durante las últimas dos décadas en las que la laguna se ha estabilizado en un estado de "aguas turbias".
Breve descripción y reseña histórica
La Región Pampeana comprende una llanura extensa que abarca el centro-este de la República Argentina (33°-39° S, 57°-66° O) y cubre una superficie de 500000 km2. El paisaje se caracteriza por la ausencia de accidentes geográficos de importancia y una muy escasa pendiente (0.05% en promedio) (Dangavs et al. 1996). El clima de la región es templado húmedo (Köppen 1931), con una temperatura media anual que varía entre los 17 °C en el norte y los 14 °C en el sur. Una de las características de la región es la alternancia entre períodos de sequía o déficit de agua y períodos de exceso de agua o inundación (Vervoorst 1967), lo que combinado con su geomorfología permite que en las zonas más deprimidas de la planicie se desarrolle un importante sistema de humedales y lagunas (Iriondo 1989).
Las lagunas Encadenadas del río Salado son un ejemplo de sistemas de humedales (Figura 1), cuya cuenca cubre un área de 801 km2, en el noreste de la provincia de Buenos Aires (Dangavs et al. 1996). La formación de las cubetas que alojan a las lagunas Encadenadas ha sido el resultado de la acción fluvial, el lavado y retroceso de pendiente, y la acción eólica (deflación). Todos estos procesos han actuado a partir del Pleistoceno alto sobre el valle del curso fluvial primitivo. La alternancia de períodos secos y húmedos facilitó la acción eólica durante las etapas de mayor aridez, lo que amplió de forma progresiva el valle primitivo hasta transformarlo en cubeta (Dangavs et al. 1996).

Figura 1. Localización geográfica de la laguna Chascomús. a) Argentina y provincia de Buenos Aires. b) Cuenca del río Salado. c) Sistema de las lagunas encadenadas del río Salado. d) Laguna Chascomús indicando los tres puntos de muestreo rutinario.
Figure 1. Geographic location of laguna Chascomús. a) Argentina and Buenos Aires Province. b) Río Salado watershed. c) The chained lake system of Salado River. d) Laguna Chascomús showing the three routine sampling sites.
El sistema de las Encadenadas incluye siete lagunas: Vitel (1305 ha), Chascomús (3014 ha), Adela/Manantiales (2098 ha), del Burro (1070 ha), La Tablilla (1674 ha), Chis-Chis (1481 ha) y Las Barrancas (885 ha). Las lagunas se conectan por arroyos de extensión escasa (Figura 1) (Fernández Cirelli & Miretzky 2002) y desaguan en el río Salado. Sin embargo, debido a la poca pendiente general de la cuenca, las crecidas del río pueden ocasionar una inversión del sentido del flujo, lo cual provoca el ingreso de agua desde el Salado hacia el sistema de las encadenadas (Chornomaz et al. 2002; Maizels et al. 2003). Tomando como base la cota IGM de 6.53 m, la laguna Chascomús (35°36´ S, 58°02´ O) ocupa un área de 3000 ha y tiene una profundidad media de 1.53 m (Dangavs 1976). Debido a la morfología de la cubeta, cuando el espejo de agua excede la cota IGM de 8 m.s.n.m. (momento en el cual la profundidad media es de 3.3 m) la laguna desborda y anega los terrenos circundantes.
La precipitación promedio del área es 800 mm/año (Quirós & Drago 1999). Sin embargo, la variabilidad interanual de las precipitaciones puede ser significativa, lo cual puede afectar de manera importante el ciclo hidrológico. Los registros históricos recientes indican que Chascomús se secó completamente en 1910 y que experimentó notables descensos de nivel en los años 1916, 1924, 1929/30, 1937, 1944, 1957, 1962, 1970, 1973, 1978, 1996 y 2008/2009. Por otra parte, Chascomús desbordó la mayoría de sus barrancas y produjo anegamientos importantes en los años 1900, 1914, 1940, 1958, 1963, 1978, 1980, 1985 y 1993, 2001 y 2002.
La mayoría de las lagunas pampeanas son poco profundas y no se estratifican térmicamente, excepto por períodos muy cortos de tiempo (Quirós et al. 2002 a y b). Son cuerpos de agua eutróficos debido a que se sitúan en drenajes fértiles que de manera natural aportan grandes cargas de nutrientes. A este aporte natural debe sumarse la acción antrópica, que en épocas recientes ha incrementando sustancialmente esas cargas (Quirós et al. 2002b). Esta región ha sido utilizada para pastoreo del ganado a lo largo de los últimos cuatro siglos, y durante el siglo XX (y en particular durante la última década) la agricultura ha aumentado de manera significativa (Vervoorst 1967; Soriano 1992; Binimelis et al. 2009). Las consecuencias más evidentes de la acción antrópica son la fragmentación del paisaje pampeano (Ghersa et al. 2002) y el aporte de fertilizantes (nutrientes) y plaguicidas.
De acuerdo con la teoría de estados de equilibrios alternativos (Scheffer et al. 2001), cuando la disponibilidad de nutrientes es relativamente baja las lagunas tienden a estabilizarse en un estado de aguas claras. Pero a medida que la carga de nutrientes aumenta, las lagunas se estabilizan en un estado de aguas turbias. Sobre la base de crónicas de viajeros desde fines de los siglos XVIII y XIX (Vervoorst 1967), se ha sugerido que las lagunas pampeanas se encontraban originalmente en un estado de aguas claras con abundante desarrollo de vegetación (Quirós 1995; Quirós et al. 2002a). Desde ese entonces, las lagunas habrían experimentado un proceso de eutrofización creciente (Quirós & Drago 1999), lo que determinó que hoy en día, la mayoría de las lagunas se presenten en un estado turbio.
Si bien es cierto que la lagunas pampeanas han sufrido un impacto creciente de actividades humanas, incluyendo la agricultura, descargas urbanas e industriales, y el emplazamiento de estructuras de control de inundaciones (canales, compuertas, empalizadas) (Chornomaz et al. 2002; Quirós et al. 2002a y b; Maizels et al. 2003), los antecedentes publicados sobre la evolución de la vegetación en la laguna Chascomús no concuerdan con la interpretación histórica propuesta por Quirós y colaboradores. Las primeras referencias sobre la vegetación acuática aparecen en diferentes artículos publicados en el diario El Argentino (Chascomús). En un número del año 1942 se comenta que antiguamente en la laguna Chascomús no había vegetación y que recién después de las inundaciones de 1913 y 1914 aparecieron las primeras matas extendiéndose luego a todas las lagunas de la zona. La colonización de la laguna por macrófitas se extendió durante la mayor parte del siglo XX. El primer trabajo científico sobre la laguna Chascomús (Cordini 1938) señala que "la laguna Chascomús en la actualidad se encuentra seriamente invadida por vegetación acuática (Scirpus y Potamogeton)". Poco después, Ringuelet (1942) realizó una zonación de la laguna sobre la base del tipo de macrófitas dominante, y distinguió entre emergentes (Scirpus californicus), flotantes (Azolla y Lemnáceas) y sumergidas (Potamogeton). Las descripciones de la vegetación se sucedieron a lo largo de todo el siglo XX (Olivier 1959; Thorton et al. 1982; Dangavs et al. 1996).
Al contrario de las preferencias europeas actuales, en la Argentina de mediados de siglo XX, la vegetación acuática era considerada una maleza que dificultaba la pesca y las actividades náuticas. A principios de 1943, la Dirección de Agricultura y Ganadería inició trabajos de limpieza de la vegetación utilizando gran cantidad de peones y maquinaria. El diario El Argentino destaca que en el mes de mayo de 1943 ya se podía apreciar el cambio del paisaje y el mejoramiento de la navegación. Sin embargo, a fines de 1958 en una nota aparecida en el periódico del Ministerio de Asuntos Agrarios se comenta que el método mecánico de control de las hidrófitas resultaba completamente ineficaz, por lo que se había comenzado a evaluar la posibilidad de utilizar métodos químicos (2,4-D, 2,4,5-T, Dalapon, Kuron, Arsenito de Sodio, etc.) para el control de hidrófitas invasoras.
Los cambios que ha sufrido la laguna Chascomús durante los siglos XIX y XX también han quedado documentados en las crónicas de uno de sus recursos económicos más importantes: la pesca del pejerrey. A partir del año 1873, el Municipio comenzó a concesionar la explotación de la laguna para que se realice pesca comercial, con el fin de abastecer de pescado a la población y enviar el excedente a los mercados de La Plata y Buenos Aires. En el año 1889, las lagunas cercanas a Chascomús se encontraban con poblaciones abundantes de pejerreyes. En dicho año, las siete lagunas produjeron 100 canastos en un día. El 14 de abril de 1891 se obtuvieron 1060 kg de pescado. En marzo de 1893 se obtuvieron 96440 kg de pejerrey de las lagunas Encadenadas de Chascomús. Más tarde, a las actividades de pesca comercial se les sumó la pesca deportiva, que tuvo su apogeo hacia mediados del siglo pasado. El primer trabajo científico sobre la ictiofauna de Chascomús (Cordini 1938) hace referencia a la elevada producción de peces de la laguna. Unos años más tarde, Ringuelet (1942) confeccionó la primera lista sistemática de peces de la laguna. En la década de 1960, el pejerrey continuaba siendo la especie dominante, y representaba 60% de la biomasa total de peces estimada como CPUEp (captura por unidad de esfuerzo pesquero) (Alaimo & Freyre 1969). Sin embargo, a partir de entonces su biomasa ha disminuido de forma notable. En la década del 1980, Maroñas (1984) advirtió sobre un cambio global en el funcionamiento del sistema, tendencia que se mantuvo hasta el año 2000, cuando el pejerrey sólo representaba 10% de la biomasa ictícola (Berasain et al. 2005). Esta disminución no se debió tanto a la merma de abundancia sino a una gran reducción del tamaño individual, lo que determina que su calidad pesquera resulte muy pobre. La disminución de la biomasa de pejerrey ha sido compensada por un aumento de otras especies, pero sin interés comercial o deportivo, tales como el porteñito y el sabalito.
Estructura y funcionamiento actual de la laguna chascomús
Las cargas altas de nutrientes, la morfometría de la cubeta, la exposición al viento y la variación estacional del flujo de energía solar son elementos clave que condicionan y modulan el funcionamiento y el metabolismo global de la laguna. Las concentraciones de nutrientes, que se encuentran entre las más altas documentadas para ambientes acuáticos continentales (Reynolds 2006; Llames et al. 2009), y la escasa profundidad, determinan condiciones eutróficas. Con la excepción de períodos ocasionales de estratificación, cuya duración no supera unas pocas horas por día, la laguna se encuentra en mezcla permanente, que puede inferirse a partir de la homogeneidad térmica de la columna de agua.
En distintos períodos, durante los años 2006-2008, obtuvimos registros continuos de la estructura térmica de la columna de agua con una periodicidad horaria (descripción de la metodología en Tabla 1). El análisis de estos registros mostró que las temperaturas de superficie son, por lo general, algo inferiores (0.5-1 ºC) a los valores de media agua y de fondo, lo cual sugiere, en primer lugar, que el calor es homogeneizado rápidamente en la columna de agua; en segundo lugar, sugiere que la superficie tiende a enfriarse, probablemente como consecuencia de la evaporación. Sólo una fracción pequeña de los datos muestra valores de temperatura superficiales superiores (hasta 4 ºC) a los de media agua y fondo, pero esta situación sólo se mantiene durante lapsos breves (horas). La estructura térmica de una pequeña laguna vegetada cercana a Chascomús (El Triunfo) es muy distinta. En El Triunfo se observa un patrón diurno de estratificación y homogenización nocturna que se repite todos los días del año. En principio, se podría suponer que el estado de mezcla vertical de Chascomús se debe en buena medida a la ausencia casi completa de macrófitas. Sin embargo, probablemente debido al gran tamaño de la laguna, la homogeneidad térmica también fuera observada por Cordini (1938) en momentos en que la laguna se encontraba vegetada. En la actualidad, Chascomús también presenta un grado elevado de homogeneidad espacial. Torremorell et al. (2007) mostraron que los valores de clorofila, fósforo y seston, entre otras variables, tomadas en tres estaciones distanciadas entre sí por más de 2 km (Figura 1), resultaron idénticos y variaron de manera sincrónica durante tres años.
Tabla 1. Resumen de las metodologías utilizadas para estimar la distribución de carbono en la columna de agua, período muestreado y referencia bibliográfica.
Table 1. Summary of the methods used to estimate carbon distribution in the water column, the sampling periods and the corresponding bibliographic reference.


El conjunto de características que acabamos de mencionar determinan que la producción primaria fitoplanctónica se encuentre limitada principalmente por el flujo de energía solar incidente (Torremorell et al. 2009), y de manera secundaria por los diferentes regímenes de mezcla que modulan la respuesta fotosintética (Hubble & Harper 2001). En un sistema turbio como la laguna Chascomús, la mezcla favorece la disponibilidad de nutrientes, contrarresta el efecto de sombreado que soportan las algas y afecta la relación entre las respuestas cinéticas de la fotosíntesis y la fotoinhibición (Neale et al. 2003).
La transparencia de un ambiente acuático rico en nutrientes y en constante mezcla depende fundamentalmente de la disponibilidad de luz. En teoría, cuando la cantidad promedio de luz excede el punto de compensación, la producción primaria neta resulta positiva y la biomasa fitoplanctónica aumenta. Este aumento de la biomasa fitoplanctónica produce una disminución de la transparencia, y en consecuencia, la cantidad de luz disponible disminuye. La teoría predice que este mecanismo de retroalimentación negativa debería dar como resultado un estado de equilibrio de la transparencia en función del flujo de radiación incidente. Las predicciones teóricas han sido estudiadas en laboratorio por medio de quemostatos [i.e., sistemas de cultivo continuo de algas (Huisman et al. 2002)]. Los estudios de Huisman y colaboradores confirmaron las predicciones de la teoría al utilizar comunidades planctónicas muy simplificadas que sólo incluían una o dos especies de algas. Resulta evidente que las condiciones de una laguna natural son muy diferentes de las estudiadas por Huisman y colaboradores. En primer lugar, las comunidades planctónicas naturales son mucho más complejas e incluyen diferentes niveles tróficos. En tales condiciones, el desarrollo de poblaciones de zooplancton herbívoro podría controlar a la comunidad de algas y evitar que la biomasa de éstas se aproxime al equilibrio predicho bajo los supuestos de la limitación por luz. En segundo lugar, la intensidad de radiación solar nunca es constante, sino que varía tanto en función de factores astronómicos (traslación y rotación de la Tierra, responsables de la variabilidad periódica estacional y diaria), como atmosféricos (principalmente la nubosidad, que aporta un componente estocástico de variabilidad). Esta variabilidad natural del flujo de radiación solar también podría impedir que la transparencia del agua alcance el equilibrio.
Para comprobar si las predicciones de la teoría resultaban aplicables a comunidades planctónicas más complejas, llevamos a cabo experimentos en mesocosmos (Llames et al. 2009). Para ello, utilizamos 12 tanques de 3000 L de capacidad llenados con agua de la laguna Chascomús. Para manipular el flujo de radiación solar se cubrieron los tanques con mallas de densidad óptica neutra que sólo modifican la cantidad de radiación pero no afectan la composición espectral. Se ensayaron 4 tratamientos, los cuales recibieron 25, 50, 75 y 100% de la radiación solar incidente. Los resultados obtenidos probaron ser consistentes con la teoría; es decir, a mayor flujo de radiación correspondieron mayor cantidad de material particulado y menor transparencia. Estas observaciones sugieren que la comunidad de herbívoros presente en la laguna Chascomús es incapaz de controlar a los productores primarios. Como se verá más adelante, es muy probable que la depredación de los peces planctívoros sea un factor determinante para mantener este estado de situación.
Para evaluar el efecto de la variabilidad de la radiación solar analizamos los cambios en la transparencia del agua en relación con la radiación incidente, mediante un muestreo semanal de la laguna Chascomús de tres años de duración (Torremorell et al. 2007). Este análisis mostró que a pesar de la gran variabilidad de la radiación incidente, la transparencia varía de manera inversa con la irradiancia incidente, sin que se observe un desfasaje temporal (Figura 2). Si bien la transparencia del agua muestra, en general, una dependencia clara con la radiación solar incidente, la resuspensión causada por vientos fuertes puede interferir con ese patrón. La relación directa entre seston y radiación solar incidente que se observa en días relativamente calmos (velocidades de viento <10 km/h) se debilita en días más ventosos (Figura 3). En el último caso, es probable que gran parte de las partículas que contribuyen a la turbidez no estén siendo generadas o destruidas en función de la disponibilidad de luz, sino que resulten de la resuspensión de sedimento. Este proceso no está gobernado por la luz, sino que depende muy probablemente de la velocidad del viento y de la cantidad de material sedimentado no consolidado. La transparencia del agua medida como disco de Secchi, varía en la actualidad entre 5 y 20 cm, en franco contraste con las observaciones de Cordini (Cordini 1938), quien realizó observaciones de hasta 1.10 m en días calmos.

Figura 2. a) Evolución de la transparencia normalizada por la profundidad (disco de Secchi/Zmax). La línea continua representa la fluencia diaria de PAR promediada durante los siete días anteriores a cada fecha de muestreo. b) Evolución de la cantidad de seston (estimado como el peso seco de los sólidos totales suspendidos). La línea continua, como en (a). Modificada de Torremorell et al. (2007) con permiso.
Figure 2. a) Evolution of depth normalized water transparency (Secchi depth reading/Zmax). The solid line represents the daily PAR fluence, averaged over the seven days prior to each sampling date. b) The evolution of the amount of seston (estimated as total suspended solids dry weight). Solid line, same as in (a). Modified from Torremorell el al. (2007) with permission.
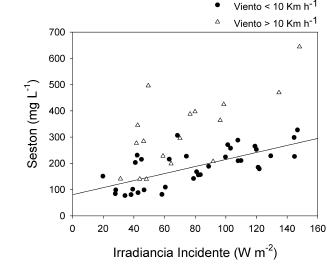
Figura 3. Relación entre la cantidad de seston y la irradiancia incidente. Los círculos llenos corresponden a días con velocidades de viento menores a 10 km/h; los triángulos vacíos, a días más ventosos.
Figure 3. Relationship between the amount of seston and incident irradiance. Solid circles correspond to days with wind speed lower than 10 km/h; empty triangles, to windier days.
Un requisito importante para permitir una adaptación rápida de la transparencia a las condiciones de radiación variables es que las velocidades a las que se genera y destruye el material particulado sean muy altas. En efecto, los valores de producción primaria fitoplanctónica (2835 g C.m-2.año-1) se encuentran entre los más altos reportados en la bibliografía (Torremorell et al. 2009). Mantener tasas de producción primaria fitoplanctónica altas requiere la presencia constante de una gran biomasa de autótrofos. La biomasa total de la comunidad autotrófica corresponde a 83.5 mg C/L, es decir, 75% del carbono total (110.9 mg C/L) en la columna de agua (Figura 4a). En la laguna Chascomús, la abundancia del fitoplancton >2 µm oscila entre 2.1x105 y 6.2x105 individuos/mL (Torremorell et al. 2009). La composición está dominada por cianobacterias, clorofitas y diatomeas. Las especies más conspicuas son Aphanocapsa delicatissima, acompañadas por otras cianobacterias filamentosas como Planktolyngbya contorta y P. limnetica, pequeñas chlorococcales (e.g., Monoraphidium spp. y Scendesmus spp.) y la diatomea Synedra berolinensis. La abundancia de las algas picoplanctónicas (<2 µm) también es muy elevada, entre 2x106 y 2x107 células/mL. Estos valores se encuentran dentro de los más elevados registrados hasta el momento para ambientes naturales (Callieri 2007). Sin embargo, a pesar de su gran abundancia, las picoalgas representan en promedio sólo 1.4% de la biomasa fitoplanctónica total (Figura 4b).

Figura 4. a) Composición de la materia orgánica en la columna de agua de la laguna Chascomús. Los datos corresponden al valor medio de muestreos realizados durante los últimos 5 años (ver Tabla 1). b) Distribución de la biomasa del fitoplancton por categorías de tamaño. c) Composición de la biomasa de peces, correspondientes a la media de 5 campañas de muestreo realizado con "ranio" entre 2004 y 2006. El item "Otros" corresponde a: Rhamdia quelen (Bagre sapo), Pimelodella laticeps (Bagre cantor), Oligosarcus jenynsii (Dientudo), Platanichthys platana (Mandufia), Astyanax sp. (Mojarra) y Hoplias malabaricus (Tararira).
Figure 4. a) Organic matter composition in the water column of laguna Chascomús. Average values over the last five years (see Table 1). b) Proportion of phytoplanktonic biomass by size categories. c) Fish biomass composition. Average values of five campaigns performed with "ranio" between 2004 and 2006. The item "Otros" includes: Rhamdia quelen (Bagre sapo), Pimelodella laticeps (Bagre cantor), Oligosarcus jenynsii (Dientudo), Platanichthys platana (Mandufia), Astyanax sp. (Mojarra) y Hoplias malabaricus (Tararira).
Para mantener una biomasa de autótrofos alta durante todo el año, es necesario que el zooplancton herbívoro jamás consiga desarrollar poblaciones importantes que pudieran controlar al fitoplancton. De hecho, a pesar de la gran abundancia de microorganismos heterotróficos, su contribución relativa a la biomasa planctónica es muy baja. El conjunto de bacterias, flagelados, ciliados, rotíferos y crustáceos constituyen en promedio 2.2 mg C/L, lo que equivale a 2% del carbono en la columna de agua (Figura 4a). Además de la baja proporción de la biomasa representada por los heterótrofos, su composición se caracteriza por la ausencia de filtradores eficientes [i.e., dáfnidos y otros cladóceros de gran tamaño (Maizels et al. 2003)]. En Chascomús, el zooplancton está dominado por rotíferos (Brachionus caudatus, B. havanaensis, Keratella Americana, K. tropica y Pompholyx sp.) y por el copépodo ciclopoideo depredador, Acanthocyclops robustus. Los copépodos calanoideos (Notodiaptomus incompositus) y los cladóceros (Bosmina longirostris) son mucho menos abundantes. Los rotíferos pueden alcanzar densidades muy altas, particularmente hacia fines del verano (1500 individuos/L), pero en términos de biomasa, representan un porcentaje muy pequeño (~0.01% de la biomasa algal total).
La comunidad zooplanctónica actual contrasta con las descripciones de Cordini (1938), quien señala que a fines de la década de 1930, cuando la laguna se encontraba vegetada y la comunidad de peces estaba dominada por el pejerrey, hasta el 80% del volumen del zooplancton estaba representado por los crustáceos Bosmina, Boeckella gracilis (ausente en la actualidad), Diaptomus incompositus, Ceriodaphnia, Diaphanosoma y Moina. Cordini no menciona la presencia de ciclopoideos ni rotíferos, por lo que puede inferirse que su número era muy inferior al actual. Sin dudas la comunidad de peces desempeña un papel muy importante en el control del zooplancton herbívoro, particularmente impidiendo que se desarrollen poblaciones de cladóceros de mayor tamaño (Hrbácek 1962; Brooks & Dodson 1965). De hecho, la exclusión de peces en experimentos realizados en mesocosmos con agua de la laguna Chascomús produjo un aumento de varios órdenes de magnitud en la abundancia de cladóceros al cabo de pocas semanas (Llames et al. 2009).
En la actualidad, la biomasa promedio de peces capturados con ranio es de 158 kg/ha de peso fresco, lo que corresponde a 0.7% del carbono en la columna de agua (Figura 4a). El 81% (128.9 kg/ha) corresponde al sabalito (Cyphocharax voga), 13% (20.8 kg/ha) al porteñito (Parapimelodus valenciennesi) y 2.7% (4.3 kg/ha) a la carpa o Cyprinus carpio (Figura 4c). En claro contraste con la situación observada a mediados del siglo XX, el pejerrey (Odontesthes bonariensis) sólo aporta 0.04% (0.06 kg/ha) a la biomasa total de peces. Como es sabido, los artes de pesca son altamente selectivos. Por ejemplo, los porcentajes de composición de biomasa estimados sobre la base de muestreos con trampas (Colautti 1998), los más representativos de la zona costera, es la siguiente: sabalito: 37%, porteñito: 29%, vieja de río Hypostomus commersoni: 20% y pejerrey: 4%. No obstante en lo esencial, ambos métodos (ranio y trampa) muestran que (i) las especies más abundantes son sabalito y porteñito, (ii) gran parte de la biomasa corresponde a micrófagos, con alta representación de omnívoros, capaces de alimentarse directamente de algas, zooplancton y materia orgánica particulada suspendida o sedimentada, (iii) la representación de zooplanctívoros más estrictos, tales como el pejerrey, es escasa y (iv) la representación de piscívoros de gran porte, tales como la tararira y el pejerrey 4+, también es baja.
Quirós et al. (2002b) han sugerido que a medida que las lagunas son más turbias, la importancia relativa de los piscívoros disminuye, mientras que la biomasa de los planctívoros filtradores, como el sabalito, adquiere relevancia. La forma de alimentación del pejerrey y el sabalito difieren en varios aspectos. En primer lugar, el pejerrey muestra un cambio ontogenético en su dieta: mientras que los individuos más jóvenes son zooplanctívoros, los individuos de mayor edad se vuelven ictiófagos y, con frecuencia, caníbales. En segundo lugar, mientras que el pejerrey es un zooplanctívoro más estricto y "visual", el sabalito es un micrófago "filtrador" (Boveri 2009). En experiencias de mesocosmos, Boveri (2009) señala que el sabalito es capaz de alimentarse del perifiton de las paredes de los tanques experimentales. Por otra parte, observaciones realizadas en acuarios muestran que el sabalito adopta una postura vertical mientras succiona el material sedimentado en el fondo (Berasain, observación personal). De hecho, el contenido estomacal del sabalito suele estar compuesto por una diversidad mucho mayor de presas, incluyendo perifiton, fitoplancton, zooplancton y material orgánico sedimentado (Grosman & Sanzano 2003). Es probable que la gran abundancia de peces que se alimentan del bentos contribuya también a evitar o retardar la consolidación del material sedimentado (Scheffer et al. 2003).
La dominancia de peces zooplanctívoros, pero con capacidad de utilizar a los productores primarios como fuente directa de alimento, probablemente les permite mantener biomasas mayores que si se tratase de una trama trófica más lineal, en la que el zooplancton fuera su alimento principal. Esto podría explicar la existencia de un control fuerte de los peces sobre el zooplancton, lo que permite que el fitoplancton se encuentre en equilibrio con la radiación incidente.
En este trabajo hemos presentado una crónica de los principales cambios que, desde el punto de vista limnológico, ha sufrido la laguna Chascomús a lo largo del último siglo. El estado actual corresponde al de una laguna turbia. Esto contrasta con la condición que presentaba a principios y mediados de siglo XX. Es probable que la evolución observada de la laguna haya sido favorecida, al menos en parte, por el impacto antrópico creciente. El aumento de la turbidez ha sido coincidente con un cambio en la composición de la comunidad de peces. La predominancia actual de peces planctívoros filtradores condiciona de manera importante la estructura de la comunidad planctónica. Como resultado, se observa la ausencia de especies de zooplancton capaces de controlar la enorme biomasa algal la que, en última instancia, es responsable de la elevada turbidez de la laguna.
AGRADECIMIENTOS
Este trabajo fue financiado por la Agencia Nacional de Promoción Científica y Tecnológica (PICT 25325), el CONICET (PIP 01301), el Proyecto PROBA (Programa "Luis Santaló" CSIC - CONICET) y la Universidad Nacional de General San Martín (SA06/017; SC08/043).
REFERENCIAS
ALAIMO, S & LR FREYRE. 1969. Resultados sobre la estimación de la numerosidad de peces en la laguna Chascomús (Provincia de Buenos Aires). Physis, 29(78):197-212. [ Links ]
APHA. 1998. Standard Methods for the Examination of Water and Wastewater. American Public Health Association. Washington. [ Links ]
BERASAIN, GE & F ARGEMI. 2006. Estudio de las lagunas Encadenadas de Chascomús (Pdo. de Chascomús). Campaña de relevamientos limnológicos e ictiológicos. Subsecretaría de Actividades Pesqueras, MAA Prov. Bs. As. Informe Técnico nº 82:1-22. [ Links ]
BERASAIN, GE; DC COLAUTTI; M REMES LENICOV & CA VELASCO. 2005. Variaciones estacionales e históricas de las especies ícticas de la laguna Chascomús. Biol. Acuát., 22:47-58. [ Links ]
BERASAIN, GE & CA VELASCO. 2009. Bibliografía limnológica de la laguna Chascomús. Pp. 1-13. [ Links ]
BINIMELIS, R; W PENGUE & I MONTERROSO. 2009. «Transgenic treadmill»: Responses to the emergence and spread of glyphosate-resistant johnsongrass in Argentina. Geoforum, 40 (4):623-633. [ Links ]
BØRSHEIN, KY & G BRATBAK. 1987. Cell volume to cell carbon conversion factors for a bacterivorous Monas sp. enriched from seawater. Mar. Ecol. Prog. Ser., 36:171-175. [ Links ]
BOTTRELL, HH; A DUNCAN; ZM GLIWICZ; E GRYGIEREK; A HERZIG ET AL. 1976. A review of some problems in zooplankton production studies. Norw. J. Zool., 24:419-456. [ Links ]
BOVERI, M. 2009. Interacciones tróficas en el ecosistema de las lagunas pampeanas: estudios experimentales en mesocosmos. Tesis doctoral, Escuela Para Graduados Ing. Agr. Alberto Soriano, Facultad de Agronomía, Universidad de Buenos Aires. Buenos Aires. Argentina. [ Links ]
BROOKS, JL & SL DODSON. 1965. Predation, body size, and composition of plankton. Science, 150:28-35. [ Links ]
CALLIERI, C. 2007. Picophytoplankton in Freshwater Ecosystems: The Importance of Small-Sized Phototrophs. Freshwater Reviews, 1(1):1-28. [ Links ]
CHORNOMAZ, EM; ME ETCHEPARE; RV ESCARAY; JF BUSTINGORRY & VH CONZONNO. 2002. Efectos de la inundación ocurrida durante el año 2001 sobre la laguna de Chascomús (Pcia. de Buenos Aires) Pp. 53-59 en: Fernández Cirelli, A & G Chalar Marquisá (eds.). El agua en Iberoamérica. De la limnología a la gestión en Sudamérica. Buenos Aires: CYTED XVII, CETA - Centro de estudios Transdiciplinrios del Agua, Facultad de Ciencias Veterinarias. [ Links ]
COLAUTTI, DC. 1998. Sobre la utilización de trampas para peces en las lagunas pampásicas. Revista de Ictiología, 6(1/2):17-23. [ Links ]
CORDINI, R. 1938. La laguna de Chascomus -Prov. de Buenos Aires-. Contribución a su conocimiento limnológico. Ministerio de Agricultura de la Nación. Rca. Argentina. [ Links ]
DANGAVS, NV. 1976. Descripción sistemática de los parámetros morfométricos considerados en las lagunas pampásicas. Limnobios, 1(2):35-59. [ Links ]
DANGAVS, NV; AM BLASI & DO MERLO. 1996. Geolimnología de la laguna Chascomús, Provincia de Buenos Aires, Argentina. Revista Mus. La PLata (NS), Geología, XI(113):167-195. [ Links ]
FERNÁNDEZ CIRELLI, A & P MIRETZKY. 2002. Lagos poco profundos de la Pampa Argentina. Relación con aguas subterráneas someras. Pp. 43-52 en: Fernández Cirelli, A & G Chalar Marquisá (eds.). El agua en Iberoamérica. De la limnología a la gestión en Sudamérica. Buenos Aires: CYTED XVII, CETA - Centro de estudios Transdiciplinarios del Agua, Facultad de Ciencias Veterinarias. [ Links ]
GHERSA, CM; DO FERRARO; M OMACINI; MA MARTÝNEZ-GHERSA; S PERELMAN; ET AL. 2002. Farm and landscape level variables as indicators of sustainable land-use in the Argentine Inland-Pampa. Agric. Ecosyst. Environ., 93(1-3):279-293. [ Links ]
GROSMAN, F & P SANZANO. 2003. ¿El pejerrey puede causar cambios estructurales en un ecosistema? Biol. Acuát., 20:37-44. [ Links ]
HESSEN, DO & LJ TRANVIK (eds). 1998. Aquatic Humic Substances - Ecology and Biogeochemistry: Ecological Studies. Series 33. Springer. New York. [ Links ]
HRBÁCEK, J. 1962. Species composition and the amount of the zooplankton in relation to the fish stock. Rozpr. CSAV, Ser. Mat. Nat. Sci., 72(10):1-117. [ Links ]
HUBBLE, DS & DM HARPER. 2001. Impact of light regimen and self-shading by algal cells on primary productivity in the water column of a shallow tropical lake (Lake Naivasha, Kenya). Lakes and Reservoirs: Res. Manage., 6(2):143-150. [ Links ]
HUISMAN, J; HCP MATTHIJS; PM VISSER; H BALKE; CAM SIGON; ET AL. 2002. Principles of the light-limited chemostat: Theory and ecological applications. Antonie van Leeuwenhoek, 81(1-4):117-133. [ Links ]
IRIONDO, MH. 1989. Quaternary lakes of Argentina. Paleogeogr. Paleoclimateol. Paleoecol., 70:81-88. [ Links ]
JEPPESEN, E; M SONDERGAARD; JP JENSEN; E MORTENSEN; AM HANSEN; ET AL. 1998. Cascading trophic interactions from fish to bacteria and nutrients after reduced sewage loading: An 18-year study of a shallow hypertrophic lake. Ecosystems, 1(3):250-267. [ Links ]
KÖPPEN, W. 1931. Grundiss der Klimakunde. Vol. 12. Berlin: Walter de Gruyter. [ Links ]
LLAMES, ME; L LAGOMARSINO; N DIOVISALVI; P FERMANI; AM TORREMORELL; ET AL. 2009. The effects of different degrees of light availability in shallow, turbid waters: a mesocosm study. J. Plankton Res., 31(12):1517-1529. [ Links ]
MAIZELS, P; E ETCHEPARE; E CHORNOMAZ; J BUSTINGORRY; R ESCARAY; ET AL. 2003. Parámetros abióticos y biomasa plantónica en la Laguna Chascomús (Pcia de Buenos Aires). Período de inundación 2002. Biol. Acuát., 20:6-11. [ Links ]
MAROÑAS, ME. 1984. Relevamiento pesquero de cuencas naturales. Informe final de pasantía otorgada por la Comisión de Investigaciones Científicas del a Provincia de Buenos Aires. [ Links ]
MASSANA, R; JM GASOL; K BJØRNSEN; N BLACKBURN; A HAGSTRÖM; ET AL. 1997. Measurement of bacterial size via image analysis of epifluorescence preparations: description of an inexpensive system and solutions to some of the most common problems. Scientia Marina, 61(3):397-407. [ Links ]
NEALE, PJ; EW HELBLING & HE ZAGARESE. 2003. Modulation of UV exposure and effects by vertical mixing and advection. Pp. 107-134 en: Helbling WE & HE Zagarese (eds.). UV effects in aquatic organisms and ecosystems. Cambridge, UK: The Royal Society of Chemistry. [ Links ]
OLIVIER, SR. 1959. Sequias, inundaciones y aprovechamiento de las lagunas bonaerenses, con especial referencia al desarrollo futuro de la piscicultura. Agro. Publicación Técnica, 1(2). Pp. 94. [ Links ]
PORTER, KG & YS FEIG. 1980. The use of DAPI for identifying and counting aquatic microflora. Limnol. Oceanogr., 25(5):943-948. [ Links ]
QUIRÓS, R. 1995. The effects of fish assemblage composition on lake water quality. Lake and Reservoir Manage., 11:291-298. [ Links ]
QUIRÓS, R & E DRAGO. 1999. The environmental state of Argentinean lakes: An overview. Lakes and Reservoirs: Res. and Manage., 4:55-64. [ Links ]
QUIRÓS, R; AM RENNELLA; MB BOVERI; JJ ROSSO & A SOSNOVSKY. 2002a. Factores que afectan la estructura y el funcionamiento de las lagunas pampeanas. Ecología Austral, 12:175-185. [ Links ]
QUIRÓS, R; JJ ROSSO; A RENNELLA; A SOSNOVSKY & M BOVERI. 2002b. Análisis del estado trófico de las lagunas pampeanas (Argentina). Interciencia, 27(11):584-591. [ Links ]
RENNELLA, AM & R QUIRÓS. 2006. The effects of hydrology on plankton biomass in shallow lakes of the Pampa Plain. Hydrobiologia, 556(1):181-191. [ Links ]
REYNOLDS, CS. 2006. The ecology of freshwater phytoplankton. Cambridge: Cambridge University Press. [ Links ]
RINGUELET, RA. 1942. Ecología alimentaria del pejerrey (Odontesthes bonariensis) con notas limnológicas sobre la laguna de Chascomús. Rev. Fac. Cs. Nat. Mus. La Plata (ns) II, Secc. Zool., 17:427-461. [ Links ]
SAHAGIAN, D & J MELACK (eds). 1998. Global Wetland Distribution and Functional Characterisation: Trace Gases and the Hydrologic Cycle. Report from the Joint GAIM, BAHC, IGBP-DIS, IGAC, and LUCC Workshop, Santa Barbara, CA, USA. IGBP Report. [ Links ]
SCHEFFER, M. 1998. Ecology of shallow lakes. Chapman & Hall. London. [ Links ]
SCHEFFER, M & E JEPPESEN. 2007. Regime shifts in shallow lakes. Ecosystems, 10(1):1-3. [ Links ]
SCHEFFER, M; R PORTIELJE & L ZAMBRANO. 2003. Fish facilitate wave resuspension of sediment. Limnol. Oceanogr., 48(5):1920-1926. [ Links ]
SCHEFFER, M; D STRAILE; EH VAN NES & H HOSPER. 2001. Climatic warming causes regime shifts in lake food webs. Limnol. Oceanogr., 46(7):1780-1783. [ Links ]
SHARP, JH. 1993. Procedures subgroup report. Mar. Chem., 41:37-49. [ Links ]
SIMON, M & F AZAM. 1989. Protein content and protein synthesis rates of planktonic marine bacteria. Mar. Ecol. Prog. Ser., 51:201-213. [ Links ]
SORIANO, A. 1992. Río de la Plata grasslands. Natural grasslands, 367-407. [ Links ]
SUN, J & D LIU. 2003. Geometric models for calculating cell biovolume and surface area for phytoplankton. J. Plankton Res., 25(11):1331-1346. [ Links ]
THORTON, R; NV DANGAVS; D FREGGIARIO; A STELSIK; C GARCÍA; ET AL. 1982. Los ambientes lagunares de la provincia de Buenos Aires. Documento relativo a su conocimiento y manejo.CIC. La Plata, Argentina. [ Links ]
TORREMORELL, A; J BUSTIGORRY; R ESCARAY & HE ZAGARESE. 2007. Seasonal dynamics of a large, shallow lake, laguna Chascomús: the role of light limitation and other physical variables. Limnologica, 37(1):100-108. [ Links ]
TORREMORELL, A; ME LLAMES; GL PÉREZ; R ESCARAY; J BUSTINGORRY; ET AL. 2009. Annual patterns of phytoplankton density and primary production in a large, shallow lake: the central role of light. Freshwat. Biol., 54:437-449. [ Links ]
UTERMÖHL, H. 1958. Zur Vervollkommung der quantitativen phytoplankton-methodik. Mitt Int. Ver. Limnol., 9:1-38. [ Links ]
VERVOORST, FB. 1967. Las comunidades vegetales de la Depresión del Salado (Provincia de Buenos Aires). En: La vegetación de la República Argentina. Serie Fitogeográfica 7. Buenos Aires: Instituto Nacional de Tecnología Agropecuaria. [ Links ]
VYMAZAL, J. 1994. Algae and element cycling in wetlands. CRC Press. Florida, USA. [ Links ]
WETZEL, RG & GE LIKENS. 2000. Limnological analyses. Springer. New York. [ Links ]
WORDEN, A. 2004. Assessing the dynamics and ecology of marine picophytoplankton: the importance of the eukaryotic component. Limnol. Oceanogr., 49:168-179. [ Links ]














