Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral vol.20 no.2 Córdoba mayo/ago. 2010
SECCIÓN ESPECIAL
Características limnológicas de un sistema ácido: Río Agrio-Lago Caviahue, Provincia del Neuquén, Argentina
Fernando Luis Pedrozo*, Mónica Mabel Díaz, Pedro Félix Temporetti, Gustavo Daniel Baffico & Sara Guadalupe Beamud
INIBIOMA-U. N. Comahue. San Carlos de Bariloche, Río Negro, Argentina.
INIBIOMA-U. N. Comahue. Quintral 1250, (8400) San Carlos de Bariloche, Río Negro, Argentina. Email: fpedrozo@crub.uncoma.edu.ar.
Recibido: 18 de diciembre de 2009;
Fin de arbitraje: 2 de abril de 2010;
Revisión recibida: 6 de abril de 2010;
Aceptado: 9 de abril de 2010
RESUMEN. Durante un período de 10 años se estudió el sistema Río Agrio-Lago Caviahue, que constituye un caso único en Sudamérica por sus aguas de extrema acidez (pH<4). La acidez se origina en las efusiones magmáticas del volcán Copahue que alimentan al Río Agrio Superior. El sistema hídrico se neutraliza luego de recorrer una extensión de 50 km (Río Agrio Inferior). Esta situación define un gradiente natural de acidez, concentración y transporte de nutrientes y metales, el cual se expresa en una baja diversidad, tanto del plancton lacustre como del epiliton lótico. El pH bajo permite que se mantengan en disolución la mayoría de los elementos presentes, condicionando ambientes con alto contenido de metales y de fósforo en su tramo superior. A diferencia de otros lagos andinos de la Patagonia, el Lago Caviahue experimenta variaciones de pH y conductividad por cortos períodos, situación que es controlada por la actividad magmática. El sedimento lacustre es rico en materia orgánica la cual controla la disponibilidad del fósforo. Las condiciones extremas del lago, la disponibilidad de amonio y de carbono inorgánico y orgánico disueltos sostienen una alta densidad planctónica, representada en particular por Keratococcus raphidioides. El reemplazo de especies algales (sucesión estacional) no ocurre en el lago y los pequeños cambios observados están relacionados con la geoquímica de la cuenca. La biomasa epilítica exhibe una fuerte zonación vinculada al cambio de pH. El desarrollo algal conspicuo está compuesto en su mayoría por algas verdes filamentosas. (e.g., Ulothrix spp.).
Palabras clave: Ambiente extremo; Algas acidófilas; Nutrientes; Sedimentos.
ABSTRACT. Limnology of an acidic system: Agrio River-Caviahue Lake, Province of Neuquén, Argentina: The Río Agrio-Lago Caviahue system which constitutes a unique case in South America of waters of extreme acidity (pH<4), has been studied during the last 10 years. The high acidity is originated by the magmatic effusions of the Volcano Copahue which feeds the sources of the Río Agrio. The water system neutralizes after crossing an extension of 50 km. This situation defines a natural gradient of acidity, concentration and transport of nutrients and metals. The system shows low species diversity in the lacustrine plankton as well as in the stream epilithon. The low pH allows the dissolution of the majority of the present elements, determining environments rich in metals and phosphorus. Unlike other Andean lakes of the Patagonia, the Lake Caviahue experiments short periods of variations in pH and conductivity, situation that is controlled by the volcanic activity. The sediments of the lake are rich in organic matter (OM) being the OM who controls the phosphorus availability.The extreme conditions of the lake, the ammonium and dissolved inorganic and organic carbon concentrations maintain a high planktonic density, mainly represented by Keratococcus raphidioides. The replacement of algal species (seasonal succession) not occurs in this lake and the small changes observed are related to the geochemistry of the basin. The epilithic biomass along the Río Agrio Inferior exhibits a strong distribution linked to the changes in pH. The conspicuous algae developments are mainly composed by filamentous green algae (e.g., Ulothrix spp.).
Keywords: Extreme environment; Acidophilic algae; Nutrients; Sediments.
INTRODUCCIÓN
El fenómeno de acidificación de los cuerpos de agua tiene al menos tres orígenes (Geller et al. 1998): 1) por el aporte de ácido sulfúrico y ácido nítrico a través de la lluvia ácida; 2) debido a la actividad de extracción minera en suelos ricos en pirita, ó 3) debido a aportes de origen volcánico. Los últimos dos procesos llevan a un idéntico resultado: lagos de extrema acidez con valores de pH inferiores a 4 y con concentraciones elevadas de elementos [e.g., hierro y sulfatos disueltos en lagos de mina en Alemania (Friese et al. 1998)]. Los estudios de lagos naturales de acidez extrema se restringen a descripciones de lagos volcánicos de Nueva Zelanda y Japón (Ueno 1958; Ohle 1936; Ivanov & Karavaiko 1966; Satake & Saijo 1974). Schindler et al. (1985) y Geller et al. (1998) han estudiado lagos ácidos de origen antrópico (lluvia ácida y explotación minera, respectivamente). Varekamp et al. (2000) realizaron una recopilación de información sobre lagos volcánicos y exploraron la geoquímica de los mismos. Muchos de estos trabajos reflejan la distribución geográfica de los lagos de cráteres volcánicos (Geller et al. 1998), por lo general ubicados en áreas no pobladas.
En la región andina de la Patagonia existen numerosos lagos, de gran área y profundidad de origen glaciario, muchos de ellos en sectores prístinos. Estos lagos, aunque muy semejantes en su composición química (i.e., bajo contenido de nutrientes y salinidad) (Pedrozo et al. 1993) y concentración de clorofila, muestran diferente composición fitoplanctónica (Diaz et al. 2007). Un caso particular del sector andino de la Patagonia en la Provincia del Neuquén, lo constituye el Lago Caviahue ubicado en una antigua caldera volcánica del complejo efusivo Copahue-Las Mellizas (Pesce 1989). Este lago es muy ácido (pH 2-3) (Pedrozo et al. 2001, 2008) debido a la influencia del Río Agrio Superior (RAS) cuyas nacientes se ubican en la ladera oriental del volcán Copahue (2965 m.s.n.m.) (Figura 1). En este trabajo se describen las influencias de la cuenca de alimentación que explican la composición química y el pH extremo del lago así como sus oscilaciones temporales. Asimismo, como consecuencia del gradiente de pH y acidez-alcalinidad que se observa en el sistema acuático, se describen las características limnológicas del mismo.
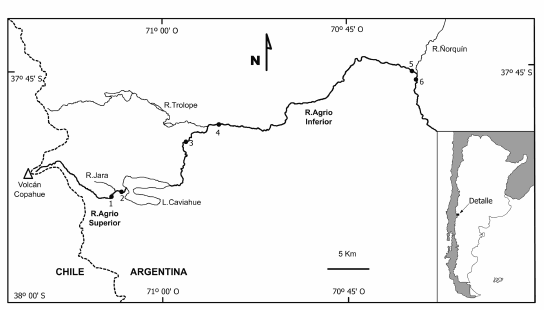
Figura 1. Área de estudio y sitios de muestreo en el Río Agrio Superior, Lago Caviahue y Río Agrio Inferior. Sitio 1, Km 11; Sitio 2, Km 12; Sitio 3, Efluente; Sitio 4, Salto; Sitio 5, Ruta 21; Sitio 6, Abajo Ñorquín.
Figure 1. Study area and sampling sites at Río Agrio Superior, Lago Caviahue and Río Agrio Inferior. Site 1, Km 11; Site 2, Km 12; Site 3, Efluente; Site 4, Salto; Site 5, Ruta 21; Site 6, Abajo Ñorquín.
EL ORIGEN DE LA ACIDEZ: EL RÍO AGRIO SUPERIOR
La cuenca del Rio Agrio-Lago Caviahue es de origen glaciar ubicada dentro de una depresión de génesis volcánica (Pesce 1989). La fuente de acidez son los gases volcánicos de SO2, HCl y HF que se disuelven en el lago de cráter durante los períodos de actividad de fumarolas del volcán activo Copahue formado por rocas andesíticas. El RAS aporta la mayor cantidad de acidez y minerales que controlan el sistema ácido del Lago aunque, en el recorrido de 13 km desde su naciente en el volcán hasta su desembocadura, reduce 10 veces su carga de acidez, conductividad y elementos transportados (Figura 2).
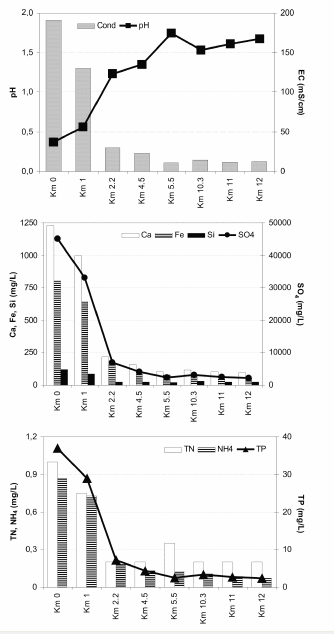
Figura 2. Valores de pH, conductividad (EC), elementos y nutrientes a lo largo del Río Agrio Superior desde sus nacientes hasta su desembocadura en el Lago Caviahue.
Figure 2. pH, conductivity (EC), elements and nutrients along the Upper Río Agrio from the sources to the mouth in Lago Caviahue.
El RAS presenta una gran variabilidad espacial (Figura 2), diaria (Figura 3), estacional e interanual (Pedrozo et al. 2008) de pH, conductividad, fósforo, nitrógeno y otros elementos (e.g., azufre, hierro, sílice, calcio) como consecuencia del deshielo en la cuenca superior, la dilución por los tributarios y la actividad magmática. La Figura 3 ejemplifica la variación diaria (7/4/2000, etapa de estiaje) en la concentración del fósforo reactivo soluble (PRS) donde las concentraciones variaron entre 6.6 y 8.0 mg P/L. Superpuesto a este patrón se verifica la variación en la carga de solutos por efecto de la impredecible actividad volcánica (Pedrozo et al. 2008). En el RAS el fósforo disuelto se halla principalmente en solución debido a la acidez y constituye hasta 95% del PT (fósforo total). Ambas situaciones, aquella de escala diaria o estacional, y la afectada por los aportes de solutos de origen magmático, quedan representadas por la correlación positiva entre la conductividad y la concentración del PRS (Figura 4). Esta relación no es la esperable en sistemas lóticos neutros ó alcalinos de transporte aluvional (Pedrozo & Bonetto 1987), en los cuales la relación típica entre la conductividad (C) y la concentración de PT es inversa como consecuencia del efecto que ejerce la variación del caudal (Q) sobre C y PT.
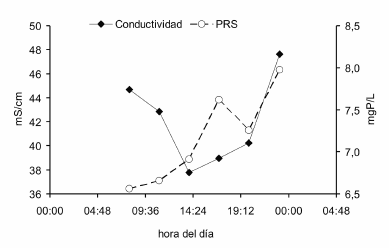
Figura 3. Variación diaria de la conductividad eléctrica y de la concentración del fósforo reactivo soluble (PRS) en el Río Agrio Superior (07/04/00).
Figure 3. Daily variations of electric conductivity and soluble reactive phosphorus (SRP) in Upper Río Agrio (04/07/00).
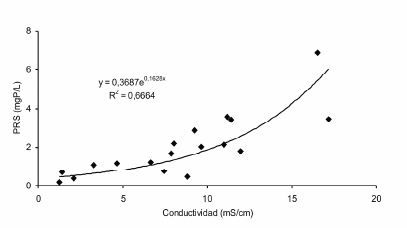
Figura 4. Concentración del fósforo reactivo soluble (PRS) en función de la Conductividad eléctrica en el Río Agrio Superior durante el período 1998 – 2005.
Figure 4. Relationship between soluble reactive phosphorus (SRP) concentration and electric conductivity in Upper Río Agrio during 1998-2005.
El contenido de amonio (70-130 µg N-NH4/L) es superior al de nitratos (30-50 µg N-NO3/L) y en las nacientes puede alcanzar los 800 µg N-NH4/L (Pedrozo et al. 2001). Debido a la cantidad elevada de P en disolución, las relaciones molares N/P son muy bajas (0.1). La excepción lo constituyen los tributarios del RAS que presentan pH neutro (Río Blanco) o baja acidez (pH 5.0-7.0), como el Río Jara (N/P=22.5).
Carga de elementos del RAS al Lago Caviahue
La relación multielemental de cargas respecto a la del P de los principales elementos que controlan la conductividad del lago es la siguiente (Pedrozo & Diaz, comunicación personal):
Cl639 S510 Fe193 Mg190Al160 Ca121 Na97 K24 N0.3 : P1
La carga de N (en base molar) es en su mayoría en forma de amonio y resultó 3 veces menor que la de P. Si se comparan con las relaciones multielementales para lagos andinos neutros (Markert et al. 1997), la proporción de elementos en solución es varias veces superior en el RAS debido a que la acidez mantiene en solución a la mayoría de los elementos. Asimismo, la baja relación N:P es coincidente con el déficit de N respecto al P en lagos andino patagónicos (Diaz et al. 2007).
Distribución del epiliton
El ambiente más extremo de la cuenca lo constituye el RAS, con un pH cercano a 2 y agua con mineralización elevada que se traduce en elevados valores de conductividad (Figura 2). La presencia de autótrofos en el RAS se registra a partir del km 5.5 (Figura 1) hasta su desembocadura en el Lago Caviahue (Tabla 1). Como consecuencia de estas condiciones extremas, las algas presentes en el epiliton son escasas y los valores de biomasa de la comunidad son bajos [<5 mg Clo. a/m2 (Baffico 2007)]. Baffico et al. (2004) encontraron que la comunidad epilítica está caracterizada en particular por una especie de Chrysophyceae (Gloeochrysis sp. Pascher) que fue encontrada asociada a "agregados" de materia orgánica e hifas de hongos. Gloeochrysis sp. sólo fue observada en las rocas del Río Agrio Superior. Otra especie frecuente en las muestras de epiliton fue Euglena mutabilis Schmitz (Euglenophyceae), aunque su presencia fue más importante en los sedimentos del RAS que en las rocas. En su gran mayoría, los sedimentos del río están constituidos por arena y un menor contenido de material fino, probablemente ceniza volcánica. E. mutabilis, uno de los organismos mejor adaptados a los ambientes ácidos (Olaveson & Stokes 1989; Olaveson & Nalewajko 2000) resultó la especie dominante en los sitios de muestreo localizados aguas arriba y aguas abajo de la unión del RAS con el Río Jara (Figura 1). Estos resultados concuerdan con otros estudios realizados en otros ambientes ácidos (Whitton & Diaz 1981; Nakatsu & Hutchinson 1988; López-Archilla et al. 2001) en los cuales esta euglenofita también estuvo presente.
Tabla 1. Lista de especies algales registradas en el sistema Río Agrio-Lago Caviahue. Las especies halladas en el Río Agrio Superior corresponden al muestreo de enero de 2000, antes de la erupción del volcán Copahue, ocurrida en julio de 2000. Los sitios hacen referencia a los mostrados en el mapa de la Figura 1.
Table 1. Algal species list registered along the Río Agrio-Lago Caviahue system. The Río Agrio Superior species were found during the sampling of January 2000, before the eruption of the volcán Copahue in July 2000. The sampling sites are the same showed in Figure 1.
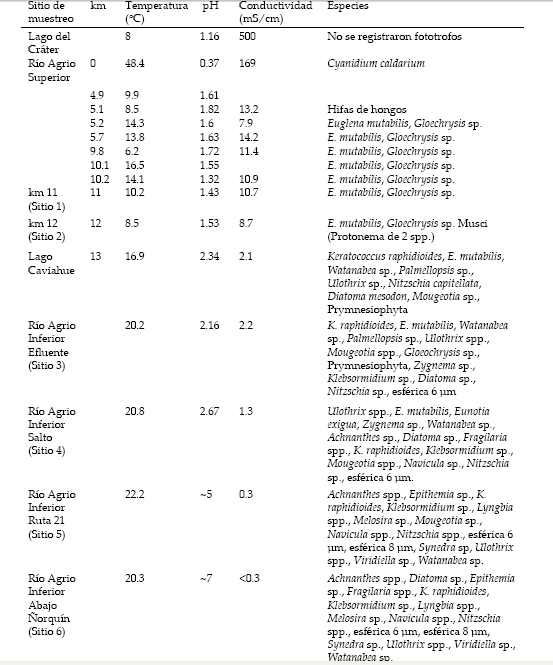
Como consecuencia de la erupción del volcán Copahue (julio de 2000), las comunidades algales del RAS desaparecieron y volvieron a ser registradas en el verano de 2003. La comunidad nueva estuvo representada en su mayoría por E. mutabilis, aunque con valores bajos de densidad y de biomasa (Baffico 2007). Junto a E. mutabilis se registró la presencia de una Prymnesiophyceae cuya especie no fue determinada (Baffico 2007).
EL EFECTO DE LA ACIDEZ SOBRE UN LAGO ANDINO-PATAGÓNICO: EL LAGO CAVIAHUE
El lago tiene forma de herradura, ocupa una superficie de 9.22 km2 y presenta dos cubetas, denominadas Norte y Sur, unidas por una angostura de poca profundidad (Figura 1). En la cubeta Norte del lago se encuentra la mayor profundidad (95 m), mientras que la cubeta Sur es un poco menos profunda (73 m). El Lago Caviahue es un cuerpo de agua de menor transparencia (profundidad del disco de Secchi, DS=2.3-5.5 m) que los otros grandes lagos de la región (e.g., Lago Nahuel Huapi, DS=22 m), con el límite inferior de la zona eufótica (1% de la irradiancia PAR en superficie) localizada a una profundidad de 16 m (Beamud et al. 2010). En concordancia con otros lagos profundos de la región, es de régimen monomíctico y la temperatura en el hipolimnion es 2 °C menor. Esto puede deberse a que el Lago Caviahue (1600 m.s.n.m.) se encuentra 900 m más alto que varios de los grandes lagos andinos. Mientras que la mayoría de los lagos glaciarios andino-patagónicos se caracterizan por una constancia en el tiempo de la salinidad y del pH (neutro o ligeramente alcalino), el Lago Caviahue se aleja mucho de este patrón. En pocos años se observan cambios en el pH, la conductividad (Figura 5) y las concentraciones de elementos y nutrientes.
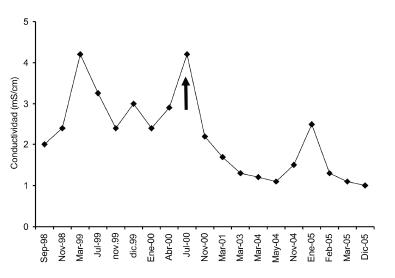
Figura 5. Conductividad eléctrica en el epilimnion del lago Caviahue durante el período 1998 – 2005. La flecha indica la última erupción conocida del Volcán Copahue (Julio 2000).
Figure 5. Electric conductivity in the epilimnion of Lago Caviahue during 1998-2005. The arrow shows the last eruption of Volcán Copahue (July 2000).
La concentración de nitrógeno inorgánico disuelto en el lago oscila entre 30-150 µg N/L, en su mayoría como amonio, aportado a través del RAS (Pedrozo et al. 2001, 2008). El nitrógeno orgánico total varía entre 32 y 91 µg N/L (Pedrozo et al. 2008). Estos valores se encuentran dentro del rango de valores hallados por Diaz et al. (2007) para lagos neutros andinos (24-223 µg N/L), pero resultan bajos comparados con los observados por Nixdorf et al. (1998a) para lagos ácidos de mina en Alemania (430 µg N/L). La distribución vertical de los nutrientes es homogénea a lo largo del año, a excepción de algunas situaciones en las que se detectan concentraciones altas cerca del fondo del lago.
En julio de 2000, el volcán Copahue entró en erupción. Este evento se reflejó de forma marcada en las condiciones químicas del Lago Caviahue [Figura 5 (Pedrozo et al. 2008)]. En un período de 5 años posteriores al evento, la conductividad disminuyó de 2.5 a 1.3 mS/cm. Al mismo tiempo, la concentración de P también se redujo a la mitad, y se produjo un incremento gradual del pH, desde pH<2 hasta casi pH=3. La relación N:P promedio varió entre 0.03 y 0.11, lo cual indica una deficiencia de nitrógeno en el lago. Dichos valores resultan bajos con respecto a los citados para lagos de mina en Alemania (92 y 1200), donde el nitrógeno no es el factor que limita el crecimiento algal (Nixdorf et al. 1998b).
Los contenidos de carbono inorgánico disuelto (CID) y de carbono orgánico disuelto (COD) son bajos (0.5-1.8 mg/L CID; 0.5-5 mg/L COD), en coincidencia con lo registrado en otros ambientes de pH bajo (Kamjunke et al. 2004). Las concentraciones de CID son homogéneas en profundidad y a lo largo del año, a diferencia del COD, que presenta mayores concentraciones epi-metalimnéticas a fines de verano y principios de otoño. En los ambientes ácidos, la principal fuente de CO2 es la atmósfera. Sin embargo, el CO2 también puede provenir de las aguas subterráneas, de la foto-oxidación de los compuestos orgánicos, de la actividad respiratoria de los microorganismos (Gross 2000) o de los gases volcánicos (Satake & Saijo 1974). Un pH ácido tiene una influencia importante sobre el CID disponible para la fotosíntesis, ya que se agota rápidamente al no haber bicarbonatos disponibles. Bajo estas condiciones, todo el CID estará presente como CO2. Este efecto negativo del escaso "pool" de CID es balanceado por una alta tasa de intercambio entre el CO2 disuelto y el CO2 atmosférico. En el caso del lago Caviahue, el balance de todos los procesos mencionados resulta positivo porque las concentraciones medidas son tres veces superiores a la concentración de equilibrio con la atmósfera (0.17 mg C/L).
Sedimentos del Lago Caviahue
Los sedimentos del lago Caviahue (en sus dos brazos, Norte=BN y Sur=BS) presentan una textura homogénea arenolimosa en la que predominan las fracciones de arena (52%, en promedio) y limo (43%, en promedio). La fracción de las arcillas (<3 µm) resultó baja (5%). Se caracterizan por presentar finas laminaciones (<1 cm de espesor) que se evidencian como lo más conspicuo al observar en fresco los testigos. Dichas laminaciones continuas indican la falta de bioturbación por la probable ausencia de una comunidad macrozoobentónica. Estos sedimentos son ácidos (pH entre 2.7 y 2.9), con potenciales redox negativos (Eh entre -211 mV y -130 mV). La concentración promedio de nutrientes, en ambos brazos, es de: PT=1.2 mg/g y carbono total (CT)=7%. El espectro químico elemental, en ambos brazos, es similar: Si (SiO2=73.0%) >> Al (Al2O3=11.5%) > S (SO36.0%) > Na (Na2O=2.6%) > Fe (Fe2O3=2.4%) > Ti (TiO2=1.3%) > Ca (CaO=1.1%) > K (K2O=0.9%) > Mg (MgO=0.7 %). La presencia de SO3 en estos sedimentos los hace diferentes a otros sedimentos de lagos patagónicos.
La principal fracción del P está asociada a la materia orgánica (P-MO=73%), mientras que la asociada al Fe/Al es de 25%, y la asociada al Ca es del 2%. La vinculación entre PT y CT fue evaluada en base a los contenidos en los diferentes estratos de los testigos de sedimento. Se observó que tanto el PT como el CT incrementan con la mayor antigüedad del estrato en el testigo, y se encuentra una correlación significativa entre ambas variables (P<0.05, r2 de 0.95 para BN y 0.96 para BS). Tanto los resultados de la extracción como el contenido de PT y CT en los testigos, sugieren que la materia orgánica es el principal factor que controla la retención del P en los sedimentos de este ambiente. En su gran mayoría, la materia orgánica sería de origen autóctono y producto de la sedimentación del plancton muerto. La adsorción del P a la materia orgánica es muy fuerte y es un resultado muy probable de la unión del P con compuestos de Fe (III) asociado con complejos húmicos, según lo propuesto por Boström et al. (1982). Bajo condiciones de extremo pH y alta concentración de metales, como las que se observan en el Lago Caviahue, es esperable que la degradación de la materia orgánica esté inhibida (Friese et al. 1998) y por lo tanto facilite su acción de adsorción.
Hupfer et al. (1998), encontraron que en los lagos ácidos originados por la explotación minera el P se encuentra unido principalmente a la fracción relacionada con los óxidos e hidróxidos de hierro y aluminio y sugieren que estos elementos controlan el sistema de retención de P en los sedimentos. En los sedimentos del lago Caviahue, la fracción de P asociada a los óxidos e hidróxidos de hierro y aluminio fue la segunda fracción más importante; puede jugar un rol junto a la materia orgánica en el control de la adsorción de P al sedimento, en coincidencia con las concentraciones relativamente elevadas de óxidos de hierro y aluminio encontradas en los sedimentos.
De acuerdo con Ohle (1938), la capacidad de adsorción del Fe (III) disminuye con el aumento del pH. Los valores de pH medidos en ambos brazos indican que los oxi-hidróxidos de Fe (III) poseen capacidad de adsorción. Por otro lado, se encontró una buena correlación entre el pH y el PT (r2=0.85) y entre el P-Fe/Al y el pH (r2=0.67). Estos resultados son similares a los encontrados por Friese et al. (1998) en sedimentos de lagos ácidos de mina.
El plancton de un ambiente extremo
Las condiciones de extrema acidez que posee el Lago Caviahue se expresan en una baja diversidad de especies del fitoplancton (Tabla 1), el bacterioplancton y el zooplancton (Pedrozo et al. 2001). La especie algal dominante es Keratococcus rhaphidioides (Hansg.) Pasch. (>90% de la abundancia total), seguida de Watanabea sp. Hanagata, Palmellopsis sp. Korshikov, Chlamydomonas sp. Ehrenberg y E. mutabilis (Beamud et al. 2007). El bacterioplancton consiste principalmente de pequeños cocos (0.5-1 µm), mientras que el zooplancton está dominado por rotíferos del tipo Bdelloideos (Philodina sp. Ehrenberg) y ocasionalmente, se ha detectado la presencia de ciliados (Pedrozo et al. 2001). Las Chlorococcales (K. raphidioides y Watanabea sp.) son un grupo de algas con amplia capacidad de asimilación de P (Tilman et al. 1986; Reynolds 1997) y prosperan donde el P es abundante, como ocurre en el Lago Caviahue. Son varias las características especiales que se reconocen en los organismos acidófilos y que les permiten vivir en un ambiente extremo, impidiendo que las altas concentraciones de protones destruyan a las células. Las algas acidófilas son capaces de mantener neutro el pH del citoplasma a través de diferentes mecanismos: generando un ΔpH a lo largo de la membrana plasmática, aprovechando la baja permeabilidad que dicha membrana tiene para transportadores únicos, una alta capacidad buffer interna, etc. (Pick 1999). E. mutabilis puede mantener su pH por encima de 6 (Lane & Burris 1981) y Chlamydomonas sp. puede crecer a pH 2, con un pH en el citosol de 6.6 (Messerli et al. 2005).
A diferencia de lo que ocurre en la mayoría de los lagos templados donde la amplitud anual de la densidad varía entre 5 ó 6 órdenes de magnitud (Wetzel 2001), el fitoplancton del lago presenta una elevada abundancia pero con pequeña variación estacional [7.5-46.5×103 cel/mL (Figura 6)]. Estos valores se mantienen constantes en toda la columna de agua y en ocasiones se registran máximos en el extremo superior del hipolimnion (Beamud et al. 2010a). El Lago Caviahue comparte con otros cuerpos de agua ácidos, por ejemplo con los lagos de mina en el Este de Alemania, los valores de biomasa fitoplanctónica y los patrones distintivos de distribución vertical. En este ambiente no existe una sucesión estacional de especies y los cambios observados en la abundancia en estos 10 años parecen estar ligados a las características geológicas ó geográficas de la cuenca y a la condición de acidez y de baja disponibilidad de N. Los máximos de biomasa están en concordancia con la de otros lagos patagónicos pero no se relacionan ni con el P ni con el zooplancton, sino con el amonio y con las distintas formas del carbono (Beamud 2010). Aunque la limitación por nutrientes varía entre las especies algales estudiadas, se observa una tendencia hacia la limitación por amonio y al uso de carbono orgánico (Beamud et al. 2010a), lo que indicaría una posible capacidad mixotrófica en algunas de las especies. La presencia de mecanismos de adquisición de carbono en las algas como una posible vía metabólica para sostener la fotosíntesis en condiciones de bajo CID fue demostrada por Diaz & Maberly (2009). De las siete especies de microalgas filogenéticamente diversas aisladas, dos de ellas poseen mecanismos activos de concentración de carbono: la forma elipsoidal de Watanabea sp. y E. mutabilis.
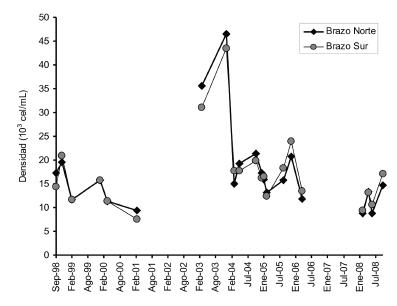
Figura 6: Densidad fitoplanctónica promedio de la columna de agua en los Brazos Norte y Sur del Lago Caviahue.
Figure 6: Average phytoplankton density in the water column at North and South arms in Lago Caviahue.
DE LA ACIDEZ A LA NEUTRALIDAD: EL RÍO AGRIO INFERIOR
El Río Agrio Inferior (RAI) cambia considerablemente sus características químicas desde el sitio efluente del Lago Caviahue hasta el sitio de confluencia con el Río Ñorquín, aproximadamente 40 km aguas abajo (Figura 1). En su naciente presenta características similares a las observadas en el Lago Caviahue, en cuanto a pH, conductividad, concentraciones de elementos y nutrientes. A medida que recibe el aporte de tributarios con diferente composición química se va neutralizando poniendo en evidencia un marcado gradiente que va de la acidez a la neutralidad.
Al ingresar el primer tributario de importancia [Río Trolope, aguas neutras (Figura 1)] aumenta el pH y disminuye la conductividad del RAI. Por ser ambos ríos de caudales similares, ocurre un efecto de dilución (casi de 50%) para la mayor parte de los elementos, excepto para el Fe, el cual comienza a precipitar debido al aumento del pH a valores mayores de 3. En consecuencia, las rocas del río muestran a partir de este sitio y hasta su confluencia con el río Ñorquín, una pátina de un vívido color anaranjado (Figura Suplementaria A) (Parker et al. 2008). Junto con la precipitación del Fe tiene lugar la disminución del P a valores que caen por debajo del límite de detección de la técnica analítica (Baffico 2010).
En los próximos 30 km de río [tramo entre los sitios Salto y Ruta 21 (Figura 1)], numerosos canales y desviaciones extraen agua ácida para regar tierras de pastoreo (mallines), lo que produce un paulatino aumento del pH y una disminución de la concentración de la mayoría de los elementos. El agua empleada para riego, en última instancia, retorna al RAI aguas abajo y algunos iones (e.g., Ca, Na, K, Mg) afectados por la acidificación del suelo circundante muestran concentraciones crecientes a lo largo de este tramo de río debido a su "elución" del suelo.
Aguas abajo de la confluencia con el Río Ñorquín (pH>8) el pH del RAI aumenta por encima de 5, mientras que la conductividad se encuentra alrededor de 0.2 mS/cm. Como consecuencia de este aumento de pH, las rocas del lecho del río muestran una pátina de color gris claro (Figura Suplementarias B1 y B2) que evidencian la deposición de oxihidróxidos de aluminio, y el agua del río adquiere un color lechoso y turbio. Las concentraciones de los elementos muestran valores similares a los encontrados en el sitio aguas arriba, excepto el Al que, producto de la precipitación por el aumento del pH, alcanza valores inferiores al límite de detección de la técnica (Baffico 2010).
Distribución de las comunidades algales epilíticas
El Lago Caviahue representa una discontinuidad en el patrón de distribución de las comunidades algales epilíticas entre el RAS y el RAI, debido a las diferencias en las concentraciones de los elementos en el agua de ambos tramos del río. En consecuencia, los descriptores algales de la comunidad (presencia y densidad de especies, biomasa y diversidad específica) también muestran una diferencia muy marcada entre ambas porciones del río (Baffico 2010).
En el gradiente de neutralización del RAI, las comunidades algales epilíticas encuentran condiciones ambientales variadas a lo largo del río y variables en el tiempo. En tal sentido, el ingreso del Río Trolope en el RAI, produce un profundo efecto en este último, pero los precipitados de color naranja que aparecen no son contraproducentes para el epiliton. Por el contrario, se puede asumir que resultan beneficiosos debido que a partir de este sitio se incrementa la producción de la comunidad, reflejándose en mayores biomasas y densidades celulares, así como también en el número de especies, la diversidad y la equitabilidad de la comunidad (Baffico 2007). Por su parte, el ingreso del Río Ñorquín en el RAI, produce un efecto negativo sobre la comunidad epilítica, ya que disminuyen todos los descriptores estudiados. En este caso, a los precipitados de Fe en las rocas del río se les superponen los precipitados de Al color gris claro como consecuencia del pH>5. La diferencia en el efecto de ambos precipitados sobre la comunidad algal es explicada por el comportamiento diferencial del Fe y el Al (Baffico 2010). En el primer caso, el Fe es susceptible de precipitar y redisolverse mediante fotooxidación, mientras que en el caso del Al los precipitados son estables e insolubles.
En el sitio Efluente (Tabla 1), la especie epilítica dominante es K. rhaphidioides (por deriva del lago Caviahue, ya que es una especie fitoplanctónica) acompañada por clorofitas filamentosas (Ulothrix spp., Mougeotia sp., Klebsormidium sp.) con importantes desarrollos de biomasa [>20 mg clo. a/m2 (Baffico 2007)]. A partir del ingreso del Río Trolope, la dominancia de la comunidad está representada por las clorofitas filamentosas que se mantienen a lo largo de más de 30 km de río, hasta el ingreso del Río Ñorquín, en donde ocurre una codominancia entre K. rhaphidioides y clorofitas filamentosas (Baffico 2007). También se registran diversas especies de diatomeas a lo largo del río (Tabla 1) aunque sus números son comparativamente bajos.
Desde el punto de vista biológico, el ingreso de los tributarios no produce grandes modificaciones en la flora del RAI, ya que las especies algales encontradas antes y después del ingreso de los afluentes son prácticamente las mismas. Evidentemente, las especies que crecen en el Río Agrio (e.g., Ulothrix spp.), tienen ventajas competitivas (por ejemplo, mayor tolerancia a los metales pesados, mejor captación de P) frente a las que ingresan por el Río Trolope (i.e., diatomeas y cianobacterias), ya que no se establecen poblaciones estables de estas últimas. Una situación similar ocurre con el ingreso del Río Ñorquín, aunque en este caso, aguas abajo de la confluencia, se registran diatomeas y cianobacterias en algunas oportunidades de muestreo (Baffico 2010).
CONSIDERACIONES FINALES
El Lago Caviahue está regulado por el Río Agrio Superior, su principal afluente, que controla la composición química de este ambiente (el pH, la concentración de nutrientes y la conductividad) en relación a la actividad magmática del volcán Copahue. La comunidad fitoplanctónica en el Lago Caviahue, a diferencia de otros lagos neutros, posee una diversidad baja (al igual que la zooplanctónica), y la cadena trófica es simple. La presencia mayoritaria de Keratococcus rhaphidioides es una situación extraordinaria y demuestra que no existe una sucesión de especies como la hallada en lagos neutros y oligotróficos. En el Lago Caviahue el control del fitoplancton no está dado por el zooplancton ni el fósforo (como sucede en otros lagos andino patagónicos), sino que se vincula con el amonio, el carbono disuelto (inorgánico y orgánico). La diversidad algal baja también se registra en el tramo superior del Río Agrio y en el tramo inferior, si bien en este último se incrementa con el aumento del pH. Esta escasa diversidad es esperada debido al bajo pH y a la alta concentración de metales disueltos que generan ambientes donde pocas especies son capaces de sobrellevar las condiciones extremas.
Las características distintivas y únicas del sistema Río Agrio-Lago Caviahue lo convierten en un ecosistema que es fundamental preservar en su estado natural. La realización de acciones que promuevan su conservación, posibilitará obtener mayor cantidad de información sobre este particular cuerpo de agua y sobre los especiales organismos que lo habitan.
AGRADECIMIENTOS
Este estudio recibió ayuda financiera de: SETCIP/Argentina (ARG/99/028); Fundación Antorchas (Argentina); Fundación Andes (Chile); Fed. Min. for Education and Research (BMBF, Alemania); ANPCyT (PICT 0108186, 38114 y 38137); Universidad Nacional del Comahue (Programa B001/4) y Fundación Volkswagen, (RA 1661/03, Alemania). Nuestro mayor agradecimiento a J. DiGiusto, M. Uguccioni, A. Taiano, P. Guitart por su valiosa ayuda en los trabajos de campo.
BIBLIOGRAFÍA
BAFFICO, GD. 2007. Factores que controlan el crecimiento de la comunidad perifítica en distintos ambientes acuáticos en Patagonia. Tesis Doctoral, Universidad Nacional del Comahue. Bariloche, Argentina. [ Links ]
BAFFICO, GD.2010. Epilithic algae distribution along a chemical gradient in a naturally acidic river, Río Agrio (Patagonia, Argentina). Microb. Ecol., 59:533-545. [ Links ]
BAFFICO, GD; MM DIAZ; MT WENZEL; M KOSCHORRECK; M SCHIMMELE; ET AL. 2004. Community structure and photosynthetic activity of epilithon from a highly acidic (pH=2) mountain stream in Patagonia, Argentina. Extremophiles, 8:463-473. [ Links ]
BEAMUD, SG. 2009. Control del crecimiento y la distribución vertical del fitoplancton de un lago ácido natural: Lago Caviahue. Tesis Doctoral, Universidad Nacional del Comahue. Bariloche, Argentina. [ Links ]
BEAMUD, SG; M DIAZ & F PEDROZO. 2007. Summer phytoplankton composition and nitrogen limitation of the deep, naturally-acidic (pH ~2.2) Lake Caviahue, Patagonia, Argentina. Limnologica, 37:37-48. [ Links ]
BEAMUD, SG; MM DIAZ & FL PEDROZO. 2009. Nutrient limitation of phytoplankton in a naturally acidic lake (Lake Caviahue, Argentina). Limnology, DOI 10.1007/s10201-009-0295-3. [ Links ]
BEAMUD, SG; MM DIAZ; N BACCALA & FL PEDROZO. 2010. Analysis of patterns of vertical and temporal distribution of phytoplankton using multifactorial analysis: Acidic Lake Caviahue, Patagonia, Argentina. Limnologica, 40:140-147. [ Links ]
BÖSTROM, B; M JANSSON & C FORSBERG. 1982. Phosphorus Release from Lake Sediments. Arch. Hydrobiol. Beih. Erg. Limnol., 18:5-59. [ Links ]
DIAZ, MM; FL PEDROZO; C REYNOLDS & P TEMPORETTI. 2007. Chemical composition an d the nitrogen-regulated trophic State of Patagonian lakes. Limnologica, 37:37-48. [ Links ]
DIAZ, M & SC MABERLY. 2009. Carbon concentrating mechanisms in acidophilic algae. Phycologia, 48(2):77-85. [ Links ]
FRIESE, K; M HUPFER & M SCHULTZE. 1998. Chemical Characteristics of Water and Sediment in Acid Minig Lakes of the Lusatian Lignite District. (Parte 2). Pp. 25-45 en: Geller, W; H Klapper & W Salomons (eds.). Acidic Mining Lakes: Acid Mine Drainage, Limnology and Reclamation. Springer, Berlin. [ Links ]
GELLER, W; H KLAPPER & M SCHULTZE. 1998. Natural and anthropogenic sulfuric acidification of lakes. (Parte 1). Pp. 3-14 en: Geller, W; H Klapper & W Salomons (eds.). Acidic Mining Lakes: Acid Mine Drainage, Limnology and Reclamation. Springer, Berlin. [ Links ]
GROSS, W. 2000. Ecophysiology of algae living in highly acidic environments. Hydrobiologia, 433:31-37. [ Links ]
HUPFER, M; P FISCHER & K FRIESE. 1998. Phosphorus Retention Mechanisms in the Sediment of an Eutrophic Mining Lake. Water, Air and Soil Pollut., 108:341-352. [ Links ]
IVANOV, MV & GI KARAVAIKO. 1966. The Role of microorganisms in the sulphur cycle in crater lakes of the Golovin Caldera. Z. Allg. Mikrobiol., 6:10-22. [ Links ]
KAMJUNKE, N; U GAEDKE; J TITTEL; G WEITHOFF & EM BELL. 2004. Strong vertical differences in the plankton composition of an extremely acidic lake. Archiv. Hydrobiol., 161:289-306. [ Links ]
LANE, AE & JE BURRIS. 1981. Effects of environmental pH on the internal pH of Chlorella pyrenoidosa, Scenedesmus quadricauda, and Euglena mutabilis. Plant. Physiol., 68:439-442. [ Links ]
LÓPEZ-ARCHILLA, AI; I MARIN & R AMILS. 2001. Microbial community composition and ecology of an acidic aquatic environment: the Tinto River, Spain. Microb. Ecol., 41:20-35. [ Links ]
MARKERT, B; F PEDROZO; W GELLER; S KORHAMMER; K FRIESE; ET AL. 1997. A contribution to the study of the heavy-metal and nutritional element status of some lakes in the southern Andes of Argentina (Patagonia). Sci. Tot. Env., 206:1-15. [ Links ]
MESSERLI, MA; LA AMARAL-ZETTLER; E ZETTLER; SK JUNG; PJS SMITH; ET AL. 2005. Life at acidic pH imposes an increased energetic cost for a eukaryotic acidophile. J. Exp. Biol., 208:2569-2579. [ Links ]
NAKATSU, C & TC HUTCHINSON. 1988. Extreme metal and acid tolerance of Euglena mutabilis and an associated yeast from Smoking Hills, Northwest Territories, and their apparent mutualism. Microb. Ecol., 16:213-231 [ Links ]
NIXDORF, B; K WOLLMANN & R DENEKE. 1998a. Ecological potentials for planktonic development and food web interactions in extremely acidic mining lakes in Lusatia. (Parte 2). Pp. 147-167 en: Geller, W; H Klapper & W Salomons (eds.). Acidic Mining Lakes: Acid Mine Drainage, Limnology and Reclamation. Springer, Berlin. [ Links ]
NIXDORF, B; U MISCHKE & D LESSMANN. 1998b. Chrysophytes and Chlamydomonads: Pioneer colonists in extremely acidic mining lakes (pH < 3) in Lusatia (Germany). Hydrobiologia, 369/370:315-327. [ Links ]
OHLE, W. 1936. Der schewefelsaure Tonteich bei Reinbeck. Monographie eines Idiotrophen Gewässers. Arch. Hydrobiol., 30:604-662. [ Links ]
OHLE, W. 1938. Die Bedeutung der Austauschvorgänge zwischen Schlam und Wasser für den Stoffkreislauf der Gewässer. Vom Wasser, XIII:87-97. [ Links ]
OLAVESON, MM & PM STOKES. 1989. Responses of the acidophilic alga Euglena mutabilis (Euglenophyceae) to carbon enrichment at pH 3. J. Phycol., 25:529-539. [ Links ]
OLAVESON, MM & C NALEWAJKO. 2000. Effects of acidity on the growth of two Euglena species. Hydrobiologia, 433:39-56. [ Links ]
PARKER, SR; CH GAMMONS; FL PEDROZO & SA WOOD. 2008. Diel changes in metal concentrations in a geogenically acidic river: Rio Agrio, Argentina. J. Vul. Geo. Res., 178:213-223. [ Links ]
PEDROZO, FL & CA BONETTO. 1987. Nitrogen and phosphorus transport in the Bermejo River (South America). Rev. Hydrobiol. Trop., 20(2):91-99. [ Links ]
PEDROZO, F; S CHILLRUD; P TEMPORETTI & M DIAZ. 1993. Chemical composition and nutrient limitation in rivers and lakes of Northern Patagonian Andes (39.5°-42° S; 71° W) (Rep. Argentina). Verh. Internat. Verein. Limnol., 25:207-214. [ Links ]
PEDROZO, F; L KELLY; M DIAZ; P TEMPORETTI; G BAFFICO; ET AL. 2001. First results on the water chemistry, algae and trophic status of an Andean acidic lake system of volcanic origin in Patagonia (Lake Caviahue). Hydrobiologia, 452:129-137. [ Links ]
PEDROZO, FL; P TEMPORETTI; G BEAMUD & M DIAZ. 2008. Influence of nutrients on the trophic state of Caviahue, a volcanically-acidified lake in Patagonia, Argentina. J. Vul. Geo. Res., 178:205-212. [ Links ]
PESCE, AH. 1989. Evolución volcano-tectónica del complejo efusivo Copahue-Caviahue y su modelo geotérmico preliminar. Asoc. Geol. Argent., XLIV(1-4):307-327. [ Links ]
PICK, U. 1999. Dunaliella acidophila - a most extreme acidophilic alga. (Capítulo 36). Pp. 465-478 en: Seckbach, J (ed.). Enigmatic microorganisms and life in extreme environments. Kluwer Academic Publishers, The Netherlands. [ Links ]
REYNOLDS, CS. 1997. Vegetation processes in the pelagic: a model for Ecosystem theory. Excellence in Ecology 9. Ecology Institute, England. [ Links ]
SATAKE, K & Y SAIJO. 1974. Carbon content and metablic activity of microorganisms in some acid lakes in Japan. Limnol. Oceanogr., 19:331-338. [ Links ]
SCHINDLER, DW; MA TURNER & RH HESSLEIN. 1985. Acidification and alkalinization of lakes by experimental addition of nitrogen compounds. Biogeochemistry, 1:117-133. [ Links ]
TILMAN, D; R KIESLING; R STERNER; SS KILHAM & FA JOHNSON. 1986. Green, blue-green and diatom algae: taxonomic differences in competitive ability for phosphorus, silicon and nitrogen. Arch. Hydrobiol., 106(4):473-485. [ Links ]
UENO, M. 1958. The Disharmonious Lakes of Japan. Verh. Internat. Verein Limnol., 13:217-226. [ Links ]
VAREKAMP, JC; GB PASTERNACK & GL ROWE. 2000. Volcanic lake systematics II. Chemical constraints. J. Vol. Geo. Res., 97:161-180. [ Links ]
WETZEL, RG. 2001. Limnology. Academic Press, California. USA. [ Links ]
WHITTON, BA & BM DIAZ. 1981. Influence of environmental factors on photosynthetic species composition in highly acidic waters. Verh. Internat. Verein Limnol., 21:1459-1465. [ Links ]














