Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral vol.20 no.3 Córdoba sep./dic. 2010
TRABAJOS ORIGINALES
Tamaño corporal y fecundidad de Hemileius suramericanus (Acari: Oribatida) en un bosque nativo del sudeste de Buenos Aires
Natalia A Fredes1,2,* & Pablo A Martínez1
1 Departamento de Biología, Universidad Nacional de Mar del Plata.
2 Consejo Nacional de Investigaciones Científicas y Técnicas - CONICET.
*Departamento de Biología, Universidad Nacional de Mar del Plata. Funes 3350, Mar del Plata. Email: nfredes@mdp.edu.ar.
Recibido: 15 de enero de 2010;
Fin de arbitraje: 1 de abril de 2010;
Revisión recibida: 27 de abril de 2010;
Segunda revisión recibida: 28 de junio de 2010;
Aceptado: 19 de septiembre de 2010
RESUMEN. Este trabajo analiza las variaciones en el tamaño corporal y la fecundidad de un microartrópodo edáfico en el suelo de un bosque nativo y en la matriz de vegetación circundante. Hemileius suramericanus (Hammer 1958) es un ácaro oribátido de amplia distribución en suelos de la Región Neotropical. Se estudió la variación en el largo y el ancho corporal de machos y hembras, y en el número de huevos portados por las hembras en suelos de un bosque nativo de Celtis tala y del ambiente vecino dominado por gramíneas. Relevamos dos parches de bosque de áreas diferentes y la matriz circundante (pastizal), en el Partido de Mar Chiquita, Buenos Aires, Argentina. Dividimos cada parche en centro y periferia, donde, además de la población de H. suramericanus, registramos la cobertura de mantillo y la resistencia mecánica del suelo como estimador del grado de compactación. Las hembras de H. suramericanus fueron de mayor tamaño que los machos y las del pastizal fueron las de menor ancho corporal. Los machos del pastizal fueron los más pequeños en largo y ancho corporal. Las mayor frecuencia de hembras del parche de bosque más grande portaron dos huevos, mientras que en el pastizal y en la periferia del parche más chico la frecuencia más alta fue de hembras sin huevos. La resistencia mecánica fue mayor en el pastizal que en los parches de bosque. Se propone que la presencia de mantillo y la compactación del suelo pueden ser factores que condicionan el tamaño corporal y la fecundidad, principalmente a través de su efecto sobre la disponibilidad de alimento.
Palabras clave: Ácaros; Oribátidos; Poblaciones; Celtis tala; Mar Chiquita; Argentina.
ABSTRACT. Body size and fecundity of Hemileius suramericanus (Acari: Oribatida) in a native forest in Southeast Buenos Aires:This work analyses the eventual changes of the body size and fecundity of an edaphic microarthropod, living in a native forest soil and in the surrounding area. Hemileius suramericanus (Hammer 1958) is an oribatid mite broadly distributed in the Neotropical Region. We studied the variation in male and female length and width, and in egg number in gravid females, in adults of H. suramericanus from Celtis tala wood patches and surrounding grassland. Samples were taken from soils of two different sized patches of a natural forest of Celtis tala and the grassland area (Pastizal) in the "Estancia Nahuel Rucá", Mar Chiquita District, Buenos Aires Province, Argentina. In each patch two zones were considered: center and periphery where, litter cover and mechanical resistance, as an estimator of soil compaction, were measured in addition to H. suramericanus population parameters. Females of H. suramericanus were bigger than males in general. Females from the grassland were narrower than those found in the forest patches. Males from the grassland were the smallest. The modal number of eggs per female were two in the bigger patch, and zero in Pastizal and the periphery of the patch smaller. Soil compaction was greater in the grassland than in the forest patches. We propose that litter cover and soil compaction can be factors that determine body size and fecundity, mainly through its effect on food availability.
Keywords: Mites; Oribatids; Populations; Celtis tala; Mar Chiquita; Argentina.
INTRODUCCIÓN
El ambiente afecta la estructura y distribución de las comunidades naturales (Stamou & Sgardelis 1989; Pzybylo et al. 2000; Fisher et al. 2003; Odum & Barret 2006). En estudios de fauna edáfica es común que se analicen variables como temperatura, contenido de agua, pH (Klironomos & Kendrick 1995) y materia orgánica del suelo (Ducarme & Lebrun 2004). Sin embargo, la arquitectura y la heterogeneidad del hábitat desempeñan un papel primordial en la composición y la diversidad de la comunidad de ácaros oribátidos (Hansen & Coleman 1998; Kaneko & Salamanca 1999; Hansen 2000). Un suelo o un mantillo con escasa complejidad estructural limitará la disponibilidad de alimento y de micrositios adecuados para la oviposición y el refugio de juveniles, lo que se traducirá en una disminución de la diversidad (Hansen 2000).
La compactación del suelo por pisoteo es uno de los procesos que determinan la disponibilidad espacial al modificar el número y el tamaño de los poros (Battigelli et al. 2004). Aunque existen muchos estudios sobre las comunidades naturales de oribátidos, en particular en suelos de bosque (Crossley & Bohnsack 1960; Badejo et al. 2002; Franklin et al. 2004), se conoce muy poco a nivel poblacional, particularmente sobre la respuesta de una especie a ambientes diferentes. Entre las múltiples variables que se pueden analizar están las morfológicas (e.g., tamaño o setación, entre otras) y las reproductivas (e.g., proporción de sexos y fecundidad). La fecundidad, definida como el número total de huevos puestos por una hembra a lo largo de su vida, es un factor determinante de la estrategia adaptativa de una especie. En oribátidos varía en función de la disponibilidad de alimento y de la densidad poblacional, y tiende a disminuir en condiciones ambientales extremas (Travé et al. 1996). En cuanto al tamaño corporal, algunos estudios vinculan el grado de variación de éste con la estabilidad ambiental (Fujikawa 1987a,b); el tamaño de algunas especies, incluso, puede variar según habiten el mantillo o el suelo de un mismo sitio (Prinzing et al. 2004).
Los ácaros oribátidos son, en esencia, herbívoros. Se alimentan de detritos, algas, hifas y esporas de hongos. Se ha observado que algunas especies del género Pergalumna depredan sobre nematodos (Oliveira et al. 2007), aunque en muchos géneros los hábitos tróficos son desconocidos. Con respecto al género Hemileius, el único registro lo proveen Denmark & Woodring (1965), quienes cultivaron ejemplares de H. nicki y los observaron alimentándose de Actinomycetes sp. y de algas halladas sobre hojas muertas de Cattleya. Schneider et al. (2004), usaron la relación de isótopos de nitrógeno (15N/14N) y brindaron la primera aproximación a la cantidad de nichos tróficos ocupados por los oribátidos en el suelo de un bosque templado. Sus resultados sugieren que existe una gran partición del recurso alimentario, lo que permite la coexistencia de especies congéneres.
Hemileius suramericanus (Hammer 1958) es una especie de oribátido ampliamente distribuida en la Región Neotropical, y también ha sido citada en la Región Holártica (Subías 2004). En Argentina ha sido hallada en casi todos los ambientes prospectados, incluidas las regiones montañosas y subtropicales, y aun en suelos suspendidos de la ciudad de La Plata (Salazar Martínez et al. 2007). También se la ha citado en Bolivia (Hammer 1958), Galápagos (Schatz 1998) y Uruguay (Altesor et al. 2006). En el sudeste bonaerense se registró la presencia de H. suramericanus en sitios diversos, entre los que se cuentan parches de bosques de tala (Celtis tala) y la matriz circundante dominada por gramíneas (Scampini et al. 2000; observación personal).
El objetivo de este trabajo es analizar el efecto del ambiente sobre el tamaño corporal y la fecundidad de H. suramericanus. Las situaciones a considerar son: bosque de Celtis tala y matriz circundante, parches de bosque de diferente tamaño areal y distintos sectores dentro de los parches. Las diferencias ambientales entre esos sitios se traducirán en diferencias de calidad de hábitat para H. suramericanus, manifestadas en rasgos morfológicos y ecológicos de los individuos. Se espera hallar menor variación de tamaños y/o tallas corporales mayores, y mayor cantidad de huevos portados por las hembras en los suelos de bosque. Por otra parte, se espera encontrar una relación positiva entre el número de huevos y el tamaño corporal de las hembras. Así mismo, dentro de cada parche se espera hallar variación en el tamaño corporal y/o la fecundidad de H. suramericanus según se trate del centro o la periferia.
MATERIALES Y MÉTODOS
El talar de Nahuel Rucá, Partido de Mar Chiquita, representa una de las dos comunidades extrazonales más australes de C. tala de la Provincia de Buenos Aires (Haene 2006). Este bosque debe considerarse como un complejo de talares que incluye parches puros y otros formados por la asociación de C. tala con Sambuco australis y Colletia paradoxa, junto a especies introducidas como Eucaliptus sp. y Acacia melanoxylon (Cicchino 2006). La estructura de este sistema se puede definir como un área fragmentada de parches de C. tala inmersos en una matriz de pastizales compuestos principalmente por gramíneas.
El muestreo se realizó en la Estancia Nahuel Rucá, Partido de Mar Chiquita, Buenos Aires, Argentina (37°37'09'' S, 57°25'20'' W) en junio de 2008. Se seleccionaron dos parches de C. tala de diferente área: 2.3 ha y 0.4 ha, separados por una distancia de 238 m. La edad estimada de los parches estudiados es aproximadamente 20 años para el menor y más de 50 años para el mayor (comunicación personal). Los parches se caracterizaron teniendo en cuenta el diámetro a la altura del pecho (DAP) de los ejemplares de C. tala. En el parche grande los diámetros oscilaron entre 8 y 55 cm, mientras que en parche chico, el ejemplar de mayor DAP alcanzó 12.5 cm, lo que coincide con lo hallado en estudios del desarrollo de C. tala (Horlent et al. 2003).
Los suelos de los parches se hallaron cubiertos de plantas herbáceas de porte bajo y ralo y, en algunos sectores, de un tapiz de musgos. El mantillo estaba constituido por hojas muertas y fragmentos de ramas secas de C. tala. La cobertura de los suelos de la matriz era escasa, dominada por pastos duros, algunos con raíces rastreras, con alta exposición a la erosión eólica y la desecación.
Los parches se dividieron en dos sectores: centro y periferia, mientras que a la matriz lindera a los parches se la denominó de Pastizal. Se tomaron 36 muestras de suelo (9 en cada sector del parche grande, 3 en cada sector del parche chico y 12 en el Pastizal). Las muestras consistieron en secciones de suelo superficial, de 6 cm de diámetro y 5 cm de profundidad; se extrajeron con pala y se colocaron en recipientes de plástico para su traslado al laboratorio; se dispusieron en embudos Berlese durante 12 días, colectándose la fauna en alcohol 70%. Los microartrópodos se extrajeron bajo lupa binocular y se determinaron con microscopio óptico, en preparaciones abiertas, siguiendo las claves de Balogh & Balogh (1988, 1990, 1992). De los ejemplares de H. suramericanus obtenidos se seleccionaron al azar 164 hembras y 167 machos provenientes en partes iguales de cada sector, excepto del centro del parche menor, donde no se hallaron individuos de esa especie. Se incluyeron sólo adultos esclerosados por completo; es decir, aquellos cuya cutícula del exoesqueleto había alcanzado el grado máximo de endurecimiento. Esta condición se pudo establecer a partir del color y opacidad de la misma, que es mínimo en un individuo recién mudado y aumenta con el endurecimiento, hasta alcanzar el color típico de la especie. La separación por sexos se realizó mediante observación con microscopio óptico, previo aclarado en ácido láctico 1:1, considerando como rasgo discriminante la presencia de huevos u ovipositor, visibles por transparencia. Se midió el tamaño corporal (largo y ancho) de los ejemplares escogidos: largo total, desde la punta del rostro hasta el extremo posterior del notogaster, y ancho máximo aproximadamente por debajo de la placa genital, ambas medidas con el ejemplar en vista dorsal. En el caso de las hembras también se registró la cantidad de huevos presentes.
Se midió la resistencia mecánica mediante un penetrómetro de cono según normas ASAE S 313 (Bradford 1986) como estimador del grado de compactación del suelo en cada uno de los sectores. Se tomaron 40 mediciones en total (10 en cada sector del parche grande y en el Pastizal y 5 en cada sector del parche chico). Los valores estimados de presión por superficie se expresaron en MPa (megapascales). Esta variable fue transformada con log(x+1) y se realizo un ANOVA de una vía para poner a prueba las diferencias en largo y ancho corporal entre el sexo de los individuos y los sectores de procedencia. Las diferencias halladas se comprobaron con la prueba de Tukey. Se realizó un ANOVA de dos vías para comprobar las diferencias en el largo y el ancho corporal, tomando como factores el sexo (machos o hembras) y el sector del cual provenían los datos (centro del parche grande, periferia del parche grande, periferia del parche chico o Pastizal). Para analizar la relación entre la cantidad de huevos portados por las hembras y el tamaño corporal según el sector de procedencia de los individuos se realizó una regresión Poisson con un modelo aditivo generalizado (GAM) (Crawley 2007; Zuur et al. 2009). Los datos fueron procesados con el software R (R Development Core Team 2007).
RESULTADOS
La resistencia mecánica del Pastizal (72.75 MPa) fue mayor a la de los parches de bosque grande (48.91 MPa) y chico (50.58 MPa) (P<0.01) y la de los sectores periféricos mayor que la de los céntricos (Figura 1).

Figura 1.Gráfico de red de los valores de resistencia mecánica por sector. Gcen= centro del parche grande, Gper=periferia del parche grande, Chper=periferia del parche chico y Pastizal. Los valores de resistencia mecánica se expresan en MPa.
Figure 1. Network plot of mechanical resistance value by sector. Gcen=center of bigger patch, Gper=peripheric of bigger patch, Chper=periphery of smaller patch, and Pastizal=surrounding grassland. Mechanical resistance values are expressed in MPa.
Se halló un total de 809 individuos de H. suramericanus (244, 219, 87 y 259 para la periferia y el centro del parche grande, y la periferia del parche chico y el Pastizal, respectivamente; de la estimación en individuos/m2 se obtuvieron 9588, 8606, 10256 y 7633, respectivamente). En el sector céntrico del parche chico no se hallaron ejemplares, por lo que no fue considerado en los análisis posteriores. La relación machos/hembras fue 1:1 en todos los sectores. En promedio, las hembras resultaron ser 7.12% más largas y 10.8% más anchas que los machos (Figura 2). Las diferencias máximas de tamaño entre machos y hembras tuvieron lugar en el Pastizal y en la periferia del parche chico. Los ejemplares de tamaños extremos, con dimensiones de 299x220 µm y 420x210 µm, fueron ambos machos y del Pastizal. La hembra de mayor tamaño alcanzó 419x236 µm, mientras que la menor midió 328x191 µm; estas hembras fueron halladas en la periferia del parche chico y en el Pastizal, respectivamente. El ANOVA mostró diferencias significativas entre machos y hembras y entre los sectores de procedencia de los individuos, así como una interacción significativa entre sexo y sector (Tabla 1). La prueba de Tukey permite atribuir esa significación a los machos, dado que el largo corporal de las hembras no resultó diferente entre sectores mientras que los machos del Pastizal tuvieron tamaños menores que los de los del la periferia y el centro del parche grande. El ancho corporal de las hembras del parche grande, tanto en la periferia como en el centro, resultaron significativamente mayores que las hembras de la periferia del parche chico y del Pastizal, mientras que las hembras de la periferia del parche chico también resultaron más anchas que las del Pastizal. Los machos del Pastizal presentaron valores de ancho corporal menores al resto (Figura 2).
Tabla 1. ANOVA de dos vías de largo y ancho de machos y hembras de H. suramericanus por sector; gl: grados de libertad, F: valor F de Fisher.
Table 1. Two way ANOVA for large and width of H. suramericanus male and female by sector; gl: degrees of freedom, F: Fisher value.


Figura 2. Largo (a) y ancho (b) de hembras y machos de H. suramericanus por sector. Los valores de largo y ancho se expresan en µm. La línea gruesa en el interior de cada caja señala la media de los datos, los extremos de la caja representan el primer y tercer cuartil, las líneas punteadas representan el rango y los círculos vacíos valores extremos. Referencias como en la Figura 1. Resultaron significativas las diferencias en largo de los machos de Gcen (P=0.03) y Gper (P<0.01) con Pastizal y de ancho entre las hembras de Chper (P<0.01) y Pastizal (P<0.01) con Gcen, los machos de Pastizal con los de Chper (P<0.01), las hembras de Chper con las de Gper (P<0.01) y los machos de Chper (P<0.01), Gper (P<0.01) y Gcen (P<0.01) con Pastizal.
Figure 2. Hemileius suramericanus male and female length (a) and width (b) by sector. Length and width are expressed in µm. Thick line inside each box represent mean value, dotted lines represent the range and empty circle represent outliers. References as Figure 1. Length size differences were found among males from Gcen (P=0.03) and Gper (P<0.01) with Pastizal ones; width between female of Chper (P<0.01) and Pastizal (P<0.01) with Gcen; males from Pastizal with Chper ones (P<0.01); females from Chper with Gper ones (P<0.01) and males from Chper (P<0.01), Gper (P<0.01) and Gcen (P<0.01) with Pastizal.
Del total de hembras analizadas, sólo 98 contenían huevos. La proporción de hembras con huevos por sectores fue 77.5%, 75%, 43.3% y 44.0% para los sectores centro y periferia del parche grande, para la periferia del parche chico y para el Pastizal, respectivamente. La mayor frecuencia de número de huevos portados por las hembras en los sectores centro y periferia del parche grande fue 2 y se registraron hembras con un máximo de 4 huevos. Por su parte, en el Pastizal y en la periferia del parche chico, más de la mitad de las hembras no portaba huevos y el número máximo registrado fue 4 y 3, respectivamente (Tabla 2). El GAM mostró un relación entre la cantidad de huevos portados por las hembras y el ancho corporal (P=0.02) (Figura 3) y no con el largo corporal (P=0.58), pero la variación explicada fue sólo 13.6% de la total y el coeficiente de regresión R2 fue 0.11.
Tabla 2. Frecuencia de huevos en hembras de H. suramericanus por sector. Referencias como en Figura 1.
Table 2. Frequency of eggs in H. suramericanus females by sector. References as Figure 1.

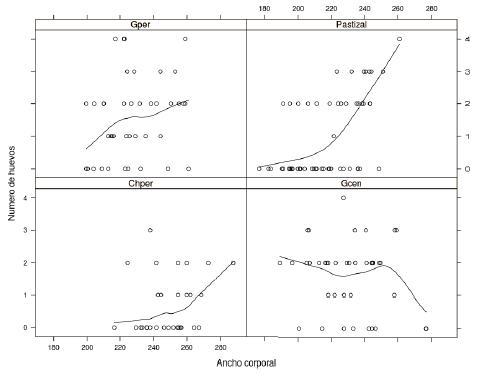
Figura 3. Relación entre el número de huevos y el ancho corporal de las hembras de H. suramericanus, según los sectores. Referencias como en Figura 1. Se incorpora una línea de ajuste LOESS en cada panel.
Figure 3. Relationships between egg number and body width of H. suramericanus females among sectors. References as Figure 1. LOESS line is showed in each panel.
DISCUSIÓN
En los ambientes edáficos, la presencia de la capa orgánica, también llamada mantillo, representa un componente crucial para las poblaciones de ácaros oribátidos. En un suelo de bosque, donde la capa de mantillo puede alcanzar hasta 3 cm de profundidad, la constitución faunística (en particular de oribátidos) contrasta mucho con la que puede encontrarse en un ambiente sin mantillo. Fredes et al. (2009) hallaron una disminución significativa en la abundancia y la diversidad de oribátidos, en comparación con suelos con y sin mantillo. Por lo general, esta disminución ha sido atribuida a un decrecimiento de la cantidad y la calidad del alimento (Maraun & Scheu 2000). Por otra parte, la compactación reduce el volumen total de poros del suelo, y aumenta el porcentaje de poros pequeños. Esto reduce la disponibilidad de aire y de agua (Battigelli et al. 2004), limita la disponibilidad de materia orgánica para los microorganismos y de estos microorganismos para sus depredadores [i.e., protistas, nematodes y microartrópodos, (Brelan & Hansen 1996)], y propicia un cambio en la comunidad de la microflora. Este cambio estará dado por la disminución de la población fúngica y por el aumento de las bacterias (McElroy et al. 1952).
En el presente estudio los valores de resistencia mecánica, variable utilizada como estimador de la compactación, aumentaron desde el centro hacia la periferia en ambos parches, y de estos parches hacia el Pastizal; esto supone una disminución en la porosidad y en la humedad relativa en esa dirección. Así, las características ambientales de la matriz de gramíneas influirían sobre la población de H. suramericanus a dos niveles: por un lado la menor disponibilidad de alimento en ese suelo, donde el mantillo es casi inexistente, afectaría la fecundidad y/o el tamaño corporal de los individuos; por otro lado, la alta compactación registrada provocaría una disminución de los sitios de oviposición y de refugio de los juveniles, quienes constituyen las víctimas principales de la depredación.
El tamaño corporal de H. suramericanus mostró variaciones según el sexo y el sector de procedencia. La diferencia de tamaños entre hembras y machos es atribuible a dimorfismo sexual, rasgo común en oribátidos dioicos. Los machos del Pastizal fueron de menor tamaño corporal que los machos de los demás sectores, mientras que en las hembras sólo el ancho corporal resultó diferente; las hembras del Pastizal presentaron los valores más bajos. Estos datos corroboran la hipótesis original. La diferente porosidad de los suelos de los parches y la matriz, inferida a partir de los valores de resistencia mecánica, es la causa probable de las diferencias corporales dentro de cada sexo. De manera similar, Prinzing et al. (2004) observaron que los machos del oribátido Carabodes labyrinthicus que ocupaban niveles diferentes de un suelo presentaban tallas diferentes debido a diferencias microambientales.
El valor bajo del índice de regresión entre el ancho y largo corporal y el número de huevos indica que esas variables tienen poca utilidad para predecir el número de huevos que puede portar una hembra. No obstante, la relación hallada con el ancho corporal es significativa, lo que indicaría que esta variable debe ser incluida en el desarrollo de futuros modelos. Un último punto a considerar acerca del tamaño corporal de las hembras y los huevos que portan es que los oribátidos Brachypylina (entre los que se encuentra H. suramericanus), poseen una piel blanda entre las placas dorsal y ventral que permite cierto grado de expansión del volumen corporal, por lo que es probable que un número de huevos mayor se refleje en un aumento de ese volumen, que sería detectable midiendo el alto de cada ejemplar. Sin embargo esta variable no fue medida a causa de su variabilidad, que es afectada, entre otros factores, por el calentamiento del medio de montaje.
En general, los ácaros oribátidos presentan desarrollo largo, adultos longevos (la longevidad en suelos templados se estima entre 1 y 2 años), pocos huevos por puesta y pocas puestas al año (Norton 1994). A partir de este estudio, podemos decir que H. suramericanus se ajusta a esa caracterización, con 76% de hembras grávidas y un promedio de 2 huevos/hembra en el ambiente óptimo (parche grande). Si bien el número de huevos observados en el interior de las hembras no es un estimador directo de la fecundidad (Travé et al. 1994), su uso de manera comparativa entre diferentes subpoblaciones, como el aplicado en este estudio, es el más viable para acercarse a ella. Un estudio de la fecundidad real implicaría el seguimiento de las hembras a lo largo de toda su vida, lo cual excede el objetivo de esta investigación.
Nuestros resultados apoyan la dependencia de la fecundidad respecto del ambiente, ya que se observa una disminución marcada de la proporción de hembras grávidas desde el parche grande hacia el parche chico y el Pastizal. La causa más posible de esas diferencias es la calidad del alimento, teniendo en cuenta los resultados de Seniczak (1998) en el oribátido Archegozates logisetosus, y de Norton (1994) en Epidamaeus kamaensis, Oppia concolor, Galumna flabellifera y Nothrus biciliatus, quienes observaron que la calidad de alimento afectaba el tamaño corporal, la fecundidad y los tiempos de desarrollo de esas especies.
Si bien las variables medidas en este estudio no incluyen la disponibilidad de alimento, la presencia de mantillo y el grado de compactación tienen estrecha relación con la disponibilidad de alimento, y ambas resultaron favorables a una mayor disponibilidad en el parche grande (presencia de mantillo y valores bajos de compactación) respecto del Pastizal. La periferia del parche chico presenta una situación aparentemente conflictiva: mientras la cantidad de mantillo y la compactación la asemejan a la periferia del parche grande, el estado reproductivo de las hembras que lo habitan es semejante al de las halladas en el Pastizal. Una posible explicación es que, dada la escasa edad del parche menor, la población de ácaros no ha modificado aún sus parámetros reproductivos en respuesta a los cambios ambientales ocurridos en ese parche menor. Un desfasaje entre variables ambientales y reproductivas fue descrito por Plaistow et al. (2006) como un efecto intergeneracional para el ácaro de suelo Sancassania berlesei. En este estudio los autores partieron de una población mal alimentada y con una talla menor a la máxima posible, y alimentaron de manera diferencial a los descendientes de aquella, hasta la tercera generación, y observaron que su rendimiento reproductivo se redujo aunque se las dispusiera en un ambiente propicio y con alimento de calidad.
AGRADECIMIENTOS
A los encargados de la estancia Nahuel Rucá y a la familia Urrutia por su buena disposición para con los autores del presente trabajo, y a la Dra. Fernanda Alvarez por su colaboración en la interpretación de las variables físicas. A los dos revisores anónimos cuyos comentarios enriquecieron el trabajo. Al CONICET por su apoyo a través de una beca de postgrado Tipo I otorgada a la Lic. Fredes.
BIBLIOGRAFÍA
1. ALTESOR, A; G PIÑEIRO; F LEZAMA; RB JACKSON; M SARASOLA & JM PARUELO. 2006. Ecosystem changes associated with grazing in subhumid South American grasslands. J. Veg. Sci., 17:323-332. [ Links ]
2. BADEJO, M; J ESPÍNDOLA; J GUERRA; A DE AQUINO & M CORREA. 2002. Soil oribatid mite communities under three species of legumes in an ultisol in Brazil. Exp. Appl. Acarol., 27:283-296. [ Links ]
3. BALOGH, J & P BALOGH. 1988. Oribatid mite of the Neotropical Region II. Elsevier Science Publishig. Amsterdam. Pp. 332. [ Links ]
4. BALOGH, J & P BALOGH. 1992. The oribatid mite genera of the Word. Volume I. Hungarian Natural History Museum. Budapest. Pp. 375. [ Links ]
5. BALOGH, P & P BALOGH. 1990. Oribatid mite of the Neotropical Region I. Elsevier Science Publishing. Amsterdam. Pp. 334. [ Links ]
6. BATTIGELLI, J; R SPENCER; DW LANGOR & SM BERCH. 2004. Short-term impact of forest soil compaction and organic matter removal on soil mesofauna density and oribatid mite diversity. Can. J. For. Res., 34:1136-1149. [ Links ]
7. BRADFORD, JM. 1986. Penetrability. Pp. 463-478 en: Klute, A (ed.). Methods of Soil Analysis. Part 1. Physical and Mineralogical Methods. 2nd ed. American Society of Agronomy, Madison, WI. USA. [ Links ]
8. BRELAND, TA & S HANSEN. 1996. Nitrogen mineralization and microbial biomass as affected by soil compaction. Soil Biol. Biochem., 28:655-663. [ Links ]
9. CICCHINO, AC. 2006. Diversidad de carábidos (Insecta, Coleoptera, Carabidae) de un talar joven de la laguna Nahuel Rucá, Partido de Mar Chiquita, Provincia de Buenos Aires. Pp. 137-145 en: MÉRIDA, E & J ATHOR (eds.). Talares bonaerenses y su conservación. Fundación de Historia Natural "Félix de Azara". Buenos Aires. [ Links ]
10. CROSSLEY JR, DA & KK BOHNSACK. 1960. Long-Term Ecological Study in the Oak Ridge Area: III. The oribatid mite fauna in pine litter. Ecology, 41: 628-638. [ Links ]
11. CRAWLEY, MJ. 2007. The R book. John Wiley and Sons, England. Pp. 942. [ Links ]
12. DENMARK, HA & JP WOODRING. 1965. Feeding habits of Hemileius new species (Acari: Cryptostigmata: Oribatulidae) on Florida orchids. Fla. Entomol., 48:9-16. [ Links ]
13. DUCARME, X & P LEBRUN. 2004. Spatial microdistribution of mites and organic matter in soils and caves. Biol. Fertil. Soil., 39:457-466. [ Links ]
14. FISHER, K; PM BRAKEFIELD & BJ ZWAAN. 2003. Plasticity in butterfly egg size: why larger offspring at lower temperatures? Ecology, 84:3138-3147. [ Links ]
15. FREDES, NA; PA MARTÍNEZ; V BERNAVA LABORDE; & ML OSTERRIETH. 2009. Microartrópodos como indicadores de disturbio antrópico en entisoles del área recreativa de Miramar, Argentina. Ci. Suelo, 27:89-101. [ Links ]
16. FUJIKAWA, T. 1987a. Biological features of Punctoribates insignis Berlese in nature farming field. Edaphologia, 36:13-20. [ Links ]
17. FUJIKAWA, T. 1987b. Biology of Oribatula sakamorii Aoki, a dominant species of the oribatid fauna in nature farming field. Pp. 544-552 en: STRIGATOVA, BR (ed.). Soil fauna and fertility. Proc. 9th Int. Congr. Soil Zool. Moscow. [ Links ]
18. HAENE, E. 2006. Caracterización y conservación de talares bonaerenses. Pp. 46-70 en: Mérida, E & J Athor (eds.).Talares bonaerenses y su conservación. Fundación de Historia Natural "Félix de Azara". Buenos Aires. [ Links ]
19. HAMMER, M. 1958. Investigations on the oribatid fauna of the Andes mountains I. The Argentine and Bolivia. Biol. Skr.Vid. Selsk., 10:1-146. [ Links ]
20. HANSEN, R. 2000. Effects of habitat complexity and composition on a diverse litter microarthropod assemblage. Ecology, 81:1120-1132. [ Links ]
21. HANSEN, R & DC COLEMAN. 1998. Litter complexity and composition are determinants of the diversity and species composition of oribatid mites (Acari: Oribatida) in litterbags. Appl. Soil Ecol., 9:17-23. [ Links ]
22. HORLENT, M; M ARTURI; JM CELLINI; D PÉREZ PASCAL; JM BUUS; ET AL. 2003. Crecimiento y competencia intraespecífica en Celtis tala en el este de Buenos Aires. Agriscientia, 20:79-84. [ Links ]
23. KANEKO, N & EF SALAMANCA. 1999. Mixed leaf litter effects on decomposition rates and soil microarthropod communities in an oak-pine stand in Japan. Ecol. Research, 14:131-138. [ Links ]
24. KLIRONOMOS, JN & B KENDRICK. 1995. Relationships among microarthropods, fungi, and their environment. Plant Soil, 170:183-197. [ Links ]
25. MARAUN, M & S SCHEU. 2000. The Structure of Oribatid Mite Communities (Acari, Oribatida): Patterns, Mechanisms and Implications for Future Research. Ecography, 23:374-383. [ Links ]
26. MCELROY, C; WH JONES & FA RINEHART. 1952. An investigation of the soil microflora of two grassland plots. Proc. Okla. Acad. Sci., 33:163-168. [ Links ]
27. NORTON, RA. 1994. Evolutionary aspects of oribatid mite life histories and consequences for the origin of the astigmata. Pp. 99-135 en: Houck, M (ed.). Mites: ecological and evolutionary analyses of life-history patterns. Chapman y Hall, New York. [ Links ]
28. ODUM, EP & GW BARRET. 2006. Fundamentos de ecología. 5a. Ed. Thomson, México. Pp. 598. [ Links ]
29. OLIVEIRA, AR; GJ MORAES & LCCB FERRAZ. 2007. Consumption rate of phytonematodes by Pergalumna sp. (Acari: Oribatida: Galumnidae) under laboratory conditions determined by a new method. Exp Appl. Acarol., 41:183-189. [ Links ]
30. PLAISTOW, SJ; CP LAPSLEY & TG BENTON. 2006. Context-dependent intergenerational effect: the interaction between past and present environments and its effects on population dynamics. Am. Nat., 167: 206-215. [ Links ]
31. PRINZING, A; P LENTZCH; F VOIGT & S WOAS. 2004. Habitat stratification strtatifies a local population: ecomorphological evidence from a bisexual, mobile invertebrate (Carabodes labyrinthicus; Acari). Ann. Zool. Fennici, 41:399-412. [ Links ]
32. PRZYBYLO, R; BC SHELDON & J. MERILÄ. 2000.Climatic efects on breeding and morphology: evidence for phenotypic plasticity. J. Animal Ecol., 69: 395-403. [ Links ]
33. R DEVELOPMENT CORE TEAM. 2007. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http: //www.R-project.org (accedido el 20/09/10). [ Links ]
34. SALAZAR MARTÍNEZ, A; C ACCATTOLI & JA SCHNACK. 2007. Oribátidos arborícolas del "Paseo del Bosque" (La Plata, Provincia de Buenos Aires, Argentina). Rev. Soc. Entomol. Argent., 66:159-163. [ Links ]
35. SCAMPINI, EM; ML OSTERRIETH & PA MARTÍNEZ. 2000. Estudio de las propiedades físico-químicas y mesofauna en una bordura del cordón hortícola de Laguna de Los Padres, provincia de Buenos Aires, Argentina. Neotrópica, 46:3-10. [ Links ]
36. SCHATZ, H. 1998. Review Oribatid mites of the Galápagos Islands - faunistics, ecology and speciation. Exp. Appl. Acarol., 22:373-409. [ Links ]
37. SCHNEIDER, K; S MIGGE; RA NORTON; S SCHEU; R LANGEL; ET AL. 2004.Trophic niche differentiation in soil microarthropods (Oribatida, Acari): evidence from stable isotope ratios (15N/14N). Soil Biol. Biochem., 36:1769-1774. [ Links ]
38. SENICZAK, A. 1998. Preliminary studies on the influence of food on the development and morphology of Archegozetes longisetosus Aoki (Acari, Oribatida) in laboratory conditions. Zesz. Nauk Akad. Tovarysztwa Roln. Bydgoszczy, Ochrona Srodowiska, 2:175-180. [ Links ]
39. SUBÍAS, LS. 2004. Listado sistemático, sinonímico y biogeográfico de los ácaros oribátidos (Acariformes, Oribatida) del mundo (1758-2002). Graellsia, 60:3-305. [ Links ]
40. STAMOU, GP & SP SGARDELIS. 1989. Seasonal Distribution Patterns of Oribatid Mites (Acari: Cryptostigmata) in a Forest Ecosystem. J. Animal Ecol., 58:893-904. [ Links ]
41. TRAVÉ, J; HM ANDRÉ; G TAVERLY & F BERNINI. 1996. 10. Biologies des populations. Pp. 75-85 en: Travé, J; HM André; G Taverly & F Bernini (eds.). Les Acariens Oribates. Éditions AGAR et SIALF. [ Links ]
42. ZUUR, AF; EN IENO; NJ WALKER; AA SAVELIEV & GM SMITH. 2009. Mixed Effects Models and Extensions in Ecology with R. Springer. USA. Pp. 574. [ Links ]














