Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Ecología austral
versão On-line ISSN 1667-782X
Ecol. austral vol.21 no.2 Córdoba jun. 2011
ARTÍCULO ORIGINAL
Desarrollo de un índice multimétrico basado en macroinvertebrados acuáticos para evaluar la integridad biológica en ríos de los valles interandinos de Bolivia
Nabor Moya1,*, Eduardo Domínguez2, Edgar Goitia3 & Thierry Oberdorff4,**
1. UMR BOREA, IRD 207, Unidad de Limnología y Recursos Acuáticos (ULRA), Universidad Mayor de San Simón, Cochabamba, Bolivia.
2. CONICET - Instituto de Biodiversidad Neotropical (IBN), Facultad de Ciencias Naturales, Universidad Nacional de Tucumán, Tucumán, Argentina.
3. Unidad de Limnología y Recursos Acuáticos (ULRA), Universidad Mayor de San Simón, Cochabamba, Bolivia.
4. UMR BOREA, IRD 207, DMPA, Muséum National d'Histoire Naturelle MNHN, Paris, France.
* UMR BOREA, IRD 207, Unidad de Limnología y Recursos Acuáticos (ULRA), Universidad Mayor de San Simón, postal #2352, Cochabamba, Bolivia. Email: nabor.moya@gmail.com
** UMR BOREA, IRD 207, DMPA, Muséum National d'Histoire Naturelle MNHN, Case postale 26, #75231, Paris cedex 05, France. Email: oberdorf@mnhn.fr
Recibido: 26 de junio de 2010;
Fin de arbitraje: 25 de octubre de 2010;
Revisión recibida: 5 de enero de 2011;
Aceptado: 3 de marzo de 2011
RESUMEN. Se presenta un índice multimétrico que permite discriminar la variabilidad ambiental natural de la antropogénica en 91 sitios (63 sitios de referencia y 28 sitios perturbados) distribuidos de manera uniforme a lo largo de la cuenca alta del Río Grande (Bolivia). En este procedimiento se utilizaron inicialmente 12 métricas que reflejan distintos atributos de la estructura y el funcionamiento de la comunidad de macroinvertebrados acuáticos, por su potencial como indicadoras de alteración de ambientes acuáticos. En principio, usando los sitios de referencia, se desarrollaron modelos estadísticos que describen la respuesta de las distintas métricas a la variabilidad ambiental natural. Luego se utilizaron estos modelos para predecir la respuesta de las métricas en condiciones alteradas, para lo cual se usaron los sitios que presentaban distintos tipos de perturbación antropogénica (i.e., perturbación por actividad agrícola, urbana y minera). De las 12 métricas iniciales se conservaron sólo cinco para elaborar el índice final (riqueza total, abundancia total, riqueza de Ephemeroptera, Plecoptera y Trichoptera (EPT), porcentaje en abundancia de EPT y porcentaje en abundancia de raspadores). Estas métricas resultaron las más efectivas al responder de manera significativa al gradiente de perturbación. Este índice distinguió con claridad los sitios de referencia de los perturbados, y mostró una relación lineal negativa significativa frente a un gradiente de perturbaciones físicas y químicas. Esta aproximación puede servir como herramienta de biomonitoreo para evaluar la integridad biótica y la biodiversidad acuática en los ríos de la región de los valles interandinos de Bolivia.
Palabras clave: Ríos neotropicales; Perturbación antropogénica; Bioindicadores; Insectos acuáticos.
ABSTRACT. Development of a multimetric index based on aquatic macroinvertebrates to assess the biological integrity in streams of the Bolivian inter-Andean valleys: We developed a multimetric index that could discriminate natural from anthropogenic variability in 91 sites (63 reference sites and 28 disturbed sites) fairly evenly distributed across the upper Grande River Basin (Bolivia). To do so, we examined 12 candidate metrics for their potential to indicate degradation and reflecting different aspects of macroinvertebrate assemblage structure and function. Initially, using the reference sites, we developed statistical models describing the response of the different metrics to the natural environmental variability. In a second step, using sites experiencing three types of anthropogenic disturbances (i.e., agriculture, urban and mining activities), we quantified the deviation in the response of each metric model between reference and disturbed conditions. From the initial 12 metrics, we retained only 5 metrics in the final index (total richness, total abundance, richness of Ephemeroptera, Plecoptera and Trichoptera (EPT), percentage of EPT abundance and percentage of scrapers abundance). These metrics were the most effective ones in responding to anthropogenic disturbances. Our final index performed well in discriminating between reference and disturbed sites, giving a significant negative linear response to a gradient of physical and chemical anthropogenic disturbances. This index can be used as a monitoring tool to evaluate the biological integrity and aquatic biodiversity of the Bolivian inter-Andean valleys streams.
Keywords: Neotropical streams; Anthropogenic disturbance; Bioindicators; Aquatic insects.
INTRODUCCIÓN
La evaluación de la influencia de la actividad humana sobre los sistemas acuáticos por medio del uso de las comunidades biológicas no es reciente. Desde comienzos del siglo pasado se documentan algunas relaciones entre las comunidades de invertebrados acuáticos y la degradación de los sistemas acuáticos (e.g., Kolkwitz & Marsson 1908; Hilsenhoff 1977; Metcalfe 1994). Sin embargo, muchos de estos estudios están dirigidos a detectar una única forma de degradación, ya sea por contaminación orgánica, acidificación, actividad minera o actividades agrícolas. Los métodos de evaluación más sofisticados surgen con el desarrollo de índices multimétricos, que fueron inicialmente desarrollados para comunidades de peces (Karr 1981) y más recientemente para comunidades de macroinvertebrados (e.g., Plafkin et al. 1989; DeShon 1995; Karr & Chu 1999; Morley & Karr 2003).
La complejidad de los sistemas biológicos y las diversas formas de alteración de los sistemas acuáticos por las actividades humanas requieren una aproximación multimétrica (Karr 1981) que refleje la calidad biológica del sistema y que responda de manera predecible a cada tipo de alteración (Oberdorff et al. 2001, 2002; Pont et al. 2006, 2009). En principio, el desarrollo del índice multimétrico requiere de conocer las relaciones de una serie de atributos biológicos con un gradiente de condiciones ambientales. Este gradiente abarca desde condiciones de referencia (con poca o ninguna perturbación antropogénica) (Karr & Chu 1999; Bailey et al. 2003) hasta distintos grados de perturbación antropogénica. Posteriormente, se requiere la integración de estos atributos biológicos independientes en un índice simple denominado índice de integridad biótica (IBI).
El IBI emplea una serie de medidas basadas sobre la estructura de la comunidad biótica que da señales puntuales sobre la condición del río. Las medidas que incluye el IBI se basan sobre varios atributos biológicos dependientes de la riqueza de especies, de la composición de especies, de la estructura trófica, de la abundancia y de condiciones individuales (Karr & Chu 1999). Cada atributo refleja la calidad de un aspecto diferente de la estructura, que responde de distinta manera a los factores de estrés del ecosistema (Hughes & Noss 1999). Así, la combinación de estos atributos o medidas refleja aspectos desde la perspectiva individual, poblacional, comunitaria, ecosistémica y zoogeográfica.
Desde su introducción, el IBI ha sido usado en distintas regiones, en especial en Norteamérica y Europa (ver revisiones de Karr & Chu 1999; Hughes & Oberdorff 1999; Dolédec & Statzner 2010), con propósitos de evaluación, mantenimiento y restauración de la "salud" de los ecosistemas acuáticos. Sin embargo, países en desarrollo como Bolivia aún carecen de políticas de gestión del agua que permitan prevenir de manera adecuada los impactos ecológicos en los sistemas acuáticos. En ese sentido, es necesario desarrollar herramientas prácticas y efectivas, con un enfoque basado sobre las estructuras biológicas para monitorear la calidad de los recursos hídricos (Hughes & Oberdorff 1999). Estas herramientas necesitan tener bases ecológicas, ser eficientes, rápidas y aplicables de forma consistente a diferentes regiones. Sin embargo, la adaptación efectiva de tales herramientas sobre áreas geográficas amplias requiere de una comprensión detallada de los patrones de composición y distribución de las comunidades bióticas dentro y entre cuerpos de agua con condiciones naturales, y la naturaleza de los principales gradientes ambientales que los causen (o que, al menos, expliquen estos patrones) (Smogor & Angermeier 1999). Esto permitirá comprender la respuesta de la biota acuática a los factores de estrés que pueden ser discriminados de las variaciones naturales.
En América del Sur, si bien existe un creciente número de trabajos sobre evaluación de ríos tomando en cuenta las comunidades de macroinvertebrados (e.g., Fernández et al. 2002; Silveira et al. 2005; Miserendino et al. 2008; Van Damme et al. 2008; Miserendino & Masi 2010), ninguno de ellos toma en cuenta en su procedimiento herramientas basadas sobre métodos multimétricos, excepto Baptista et al. (2007), Moya et al. (2007) y Moya et al. (2011).
La cuenca alta del Río Grande de Bolivia, que corresponde a parte de los valles interandinos, alberga una densidad poblacional elevada y, por lo tanto, tiene un riesgo alto de sufrir perturbaciones en sus ambientes acuáticos. Las principales fuentes de alteración provienen de las actividades mineras, de los asentamientos urbanos y de la degradación de la cobertura vegetal y edáfica por la actividad agrícola.
En esta región existen algunos depósitos importantes de minerales como el estaño, antimonio, wolframita, bismuto, zinc, plomo, plata, etc., principalmente en la región este del Departamento de Oruro y en el norte de Potosí, que son zonas mineras desde épocas coloniales. La explotación de estos minerales, si bien genera un importante movimiento económico para la región y el país, produce un impacto ecológico que aún no ha sido determinado (Van Damme et al. 2008). Muchos de estos centros mineros vuelcan los residuos ácidos directamente en los ríos próximos, que confluyen en la cuenca del Río Grande, que en su parte alta comprende la región de los Valles Interandinos y en su parte más baja comprende la Región Amazónica. Este trabajo pretende desarrollar un índice de integridad biótica, basado sobre las comunidades de macroinvertebrados acuáticos para evaluar la calidad biológica de los ríos en la cuenca alta del Río Grande.
MÉTODOS
Área de estudio
El área de estudio (de ~110000 km2) comprende los ríos de primer a cuarto orden de la Cuenca alta del Río Grande que corresponde a la región de los valles interandinos (Figura 1). Esta región forma un conjunto de bosques secos que en su mayoría se extienden por el centro y sur de Bolivia, sobre una serie de mesetas, colinas y valles, o en las laderas inferiores de las montañas entre ~500 y 3300 m de altitud, con temperaturas medias anuales entre 12 y 16 °C. La vegetación es decidua, con especies arbóreas típicas de Prosopis spp. (algarrobo), Acacia macracantha (kiñi), Schinus molle (molle) y Erythrina falcata (ceibo). A altitudes mayores se encuentran diversos tipos de matorrales dominados por arbustos y pastizales. Los bosques naturales del fondo de los valles están casi exterminados por la agricultura bajo riego, que es la actividad económica principal de la zona (Montes de Oca 1997).

Figura 1. Ubicación del área de estudio mostrando los puntos muestreados durante el periodo de estudio (2007-2008).
Figure 1. Study area showing the sampled sites during the study period (2007-2008).
Selección de estaciones de muestreo
En total se tomaron muestras biológicas y variables ambientales en 91 estaciones distribuidas de manera uniforme a lo largo de la Cuenca alta del Río Grande (Figura 1). De estas 91 estaciones se escogieron 63 como sitios de referencia (63SR) con poca o ninguna perturbación antropogénica, y las restantes 28 estaciones como sitios perturbados (28SP). En la zona de estudio se identificaron tres principales tipos de perturbación: la perturbación por actividades domésticas o urbanas (modificaciones del cauce y presencia de desechos domésticos), la perturbación agrícola (determinada por medio de mapas de uso del suelo) y la perturbación minera (determinada por la presencia de efluentes provenientes de actividades mineras).
Para diferenciar entre sitios de referencia y perturbados, cada uno de los tres tipos de perturbación (urbana, agrícola y minera) fue clasificado inicialmente en cuatro categorías desde (1) prístinas a muy poco alteradas, (2) poco alteradas, (3) medianamente alteradas, y (4) muy alteradas, similar a las categorías descritas en Moya et al. (2007). Luego, sumando las cuatro categorías para los tres tipos de perturbación se definieron los valores de condición ambiental, que pueden variar desde 3 hasta 12. Aquellos sitios que sumaron valores de condición ambiental, fueron considerados como sitios perturbados y aquellos con valores fueron considerados como sitios de referencia. Usando este criterio, de forma artificial se incluyeron algunos sitios ligeramente perturbados (e.g., sitios con valores de condición 4 ó 5) en el grupo de los sitios perturbados. Esta inclusión permitió asegurar mayor tamaño de muestra para los sitios de referencia y así construir modelos estadísticos más robustos. A pesar de que en muchos sitios se superponen al menos dos tipos de perturbación (en su mayoría la perturbación agrícola y urbana), se lograron distinguir los tres tipos de perturbación mediante el valor más alto de la categoría que corresponde a cada tipo de perturbación.
Recolección y análisis de muestras
Los macroinvertebrados fueron recolectados durante la época seca (abril-octubre) del año 2007 (19% de los sitios) y 2008 (81% de los sitios), cuando la variabilidad ambiental es mínima (con baja corriente y cuando la perturbación antropogénica es detectada con mayor facilidad), lo cual maximiza la eficiencia del método de muestreo. Los macroinvertebrados fueron recolectados con una red Surber de ~0.09 m2 de área colectora, con 250 µm de abertura de malla. Para cada sitio se tomó una muestra compuesta de cinco puntos (las cinco muestras en conjunto suman ~0.45 m2 de área total) en los rápidos con similar profundidad y tipo de sustrato, tal como proponen Karr & Chu (1999). Las muestras fueron conservadas "in situ" en formol al 4% y después trasladadas al laboratorio.
En el laboratorio, las muestras de macroinvertebrados fueron separadas, cuantificadas e identificadas hasta el nivel taxonómico familia por medio de las claves de Merrit & Cummins (1996), Fernández & Domínguez (2001) y Domínguez & Fernández (2009). La identificación a nivel familia puede conducir a una pérdida de información ecológica importante (Tomanova et al. 2008). Sin embargo, claves de identificación a nivel género o especie es aún limitado para los macroinvertebrados neotropicales. Por otro lado, la identificación a nivel familia en índices multimétricos puede ser una alternativa satisfactoria si se considera que la identificación a niveles más inferiores son de costo ineficiente (Karr & Chu 1999).
En cada sitio de recolección se midieron variables físicas como la velocidad de corriente (m/s) con un flujómetro digital modelo FP101, el ancho húmedo (m), la profundidad (cm) (estas dos últimas con una cinta métrica), la distancia a la fuente (km), el orden del río (estas dos últimas utilizando el software ArcGis 9.3), la inestabilidad de substrato [mediante el índice de Pfankuch (1975)] y la heterogeneidad del substrato (i.e., porcentaje de cada clase de tamaño de substrato, siguiendo la metodología descrita por Heino et al. 2003). Asimismo, se tomaron "in situ" variables químicas como la conductividad (µs/cm) (con un medidor portátil modelo YSI 85), el pH (con un pHmetro modelo Testo 230), nitratos (mg/L) y fosfatos (mg/L) (con un espectrofotómetro Hach modelo DR2400), y los sólidos totales (mg/L) (en laboratorio por el método de calcinación a 180 °C). La temperatura no se tomó en cuenta en los análisis estadísticos debido a que presenta una variación natural elevada según la hora del día. Estas variables ambientales son las más determinantes en la distribución y estructura de las comunidades de macroinvertebrados acuáticos (Vinson & Hawkins 1998).
Métricas
Para desarrollar el índice multimétrico se escogieron inicialmente 12 métricas basadas en la abundancia, riqueza, tolerancia a la perturbación antropogénica, composición taxonómica y estructura trófica de los macroinvertebrados (Tabla 1). Estas métricas son las más usuales en evaluaciones biológicas, tal como sugieren Karr (1981), Karr & Chu (1999), Moya et al. (2007), Dóledec & Statzner (2010) y Waite et al. (2010). Las comunidades se diferenciaron según su estructura trófica como recolectores, desmenuzadores, raspadores, filtradores y depredadores según códigos compuestos por afinidad (donde 0=sin afinidad del taxón con la categoría trófica, 1=afinidad débil, 2=afinidad media, 3=afinidad alta), tal como describen para Bolivia Tomanova et al. (2006, 2008). Cada una de estas variables refleja la calidad de los diferentes componentes de la comunidad de macroinvertebrados y responden de distintas maneras a las diferentes condiciones de los sistemas acuáticos (Karr 1981).
Tabla 1. Métricas candidatas basadas sobre la riqueza, la estructura y la tolerancia, y su respuesta esperada con la perturbación antropogénica ("+" incrementa, "-" disminuye) de acuerdo a Karr & Chu (1999) (*), Moya et al. (2007) (**) y Tomanova et al. (2008) (***).
Table 1. Candidate metrics based on assemblage richness, structure and tolerance, and their expected response to human perturbation ("+" increase, "-"decrease) according to Karr & Chu (1999)(*), Moya et al. (2007)(**) and Tomanova et al. (2008)(***).

Análisis de datos y proceso de selección de las métricas
Para cada una de las 12 métricas de los sitios de referencia se realizaron análisis de regresión múltiple utilizando los métodos stepwise para la selección de las variables ambientales. Se emplearon las métricas como variables dependientes en el modelo y los parámetros ambientales como variables independientes, previa normalización de aquellas variables cuando fuera necesario.
Para cada una de las métricas se obtuvo un modelo calculado por su ecuación de regresión con el grupo de los sitios de referencia (63SR). Los residuales de cada una de las métricas (i.e., desviación entre el valor observado y predicho de una métrica) miden el rango de variación de las métricas después de eliminar el efecto de las variables ambientales y en ausencia de cualquier perturbación antropogénica.
En principio, para la selección de las métricas se verificó que entre los residuales de dos o más métricas no existieran correlaciones Pearson superiores a 0.7 ó inferiores a -0.7. Este procedimiento evita la redundancia entre métricas a fin de no darle demasiado peso a alguna de las métricas en el índice final (Pont et al. 2006). Los residuales estandarizados de cada una de las métricas seleccionadas fueron usados como valores métricos esperados independientes de la variabilidad ambiental natural. Los residuales para los sitios perturbados (28SP) fueron computados por medio de los modelos seleccionados. Estos residuales fueron estandarizados al sustraer la media del residual y dividir por la desviación estándar del grupo de los sitios de referencia, tal como se describe en Oberdorff et al. (2002) y Pont et al. (2006, 2009).
Se planteó como hipótesis que los residuales de las métricas en sitios perturbados son significativamente diferentes de los residuales de los sitios de referencia por el efecto mismo de la perturbación. Mientras más grande sea la diferencia, mayor será el efecto de la perturbación (Figura 2). De acuerdo a esta hipótesis se eliminaron aquellas métricas que no respondieron a la perturbación usando la prueba de t entre los residuales estandarizados de los modelos de sitios de referencia y perturbados, tal como se describe en Oberdorff et al. (2002), Pont et al. (2006, 2009) y Moya et al. (2007).
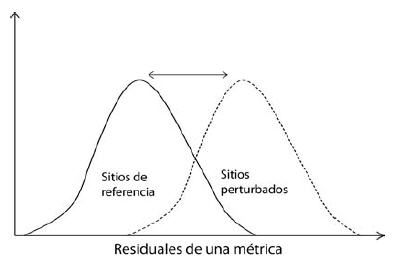
Figura 2. Distribución hipotética de los residuales de una métrica para sitios de referencia y perturbados, a mayor diferencia entre ambos grupos de sitios, mayor respuesta a la perturbación.
Figure 2. Residuals hypothetical distribution of a metric for reference and disturbed sites, with increasing difference between both groups, greater response to the disturbance.
Desarrollo del índice
Una vez seleccionadas las métricas se empleó una transformación normal de probabilidad para convertir los residuales estandarizados de cada una de las métricas en probabilidades (como valores métricos) con valores de 0-1 con una distribución uniforme esperada y una media de 0.5 (equivalente al residual de cero) para las métricas de probabilidades computados a partir de los sitios de referencia. Se esperan valores bajos de probabilidad para altos niveles de perturbación antropogénica, sin importar si el puntaje de una métrica disminuye o aumenta con la perturbación (Oberdorff et al. 2002; Pont et al. 2006, 2009). Por ello se computó el valor transformado de los puntajes de cada una las métricas (respuesta negativa típica a la perturbación) y uno menos el valor transformado de los puntajes de cada una de las métricas (respuesta positiva a la perturbación). Por ello, es posible que aquellos sitios con valores de probabilidad elevados (>0.50 para una determinada métrica seleccionada) tengan comunidades de macroinvertebrados en buenas condiciones ambientales para dicha métrica seleccionada, mientras que los sitios con valores bajos de probabilidad (<0.50) posiblemente tengan comunidades en condiciones ambientales pobres (Pont et al. 2009).
El índice final resultó de la sumatoria de cada uno de los valores de las probabilidades de las métricas seleccionadas. Por ejemplo, si son cinco métricas seleccionadas (como en este caso), el índice final puede alcanzar un valor máximo de cinco (óptima condición ambiental) que equivale a la suma de los valores de probabilidades de las cinco métricas seleccionadas y un posible valor mínimo de cero (condición ambiental muy pobre).
Luego se realizó un test de t con el propósito de comparar los índices finales entre el grupo de los sitios de referencia y perturbados, y un ANOVA para probar los tipos de perturbación sobre los índices finales. Por último, por medio de un ANOVA se verificó si alguno de los tres tipos de perturbación tenía alguna respuesta particular a las diferentes métricas incluidas en el índice final. Todos estos análisis fueron realizados en el programa SYSTAT 12.0.
RESULTADOS
Se encontró un total de 53 taxa de macroinvertebrados acuáticos a lo largo de los sitios recolectados de la cuenca alta del Río Grande, de los cuales 45 familias correspondieron a la clase Insecta, dos familias a la clase Gastropoda, una familia a la clase Crustacea, y los restantes cinco correspondieron a otros grupos (Oligochaeta, Tricladida, Hirudinea, Nematoda y Acari) (ver información suplementaria en www.ecologiaaustral.com.ar). En cada sitio se encontró una densidad media de 7063±9033 individuos/m2 y 9±4 taxa, entre los que la familia Chironomidae resultó la más abundante (3710 individuos/m2) y frecuente (en más de 96% de los sitios). Respecto a la composición trófica, el porcentaje de recolectores tuvo mayor proporción, con un promedio de 41.2%, los raspadores con 17.9%, los filtradores con 16.7%, los desmenuzadores con 13.4% y los depredadores con 10.8%.
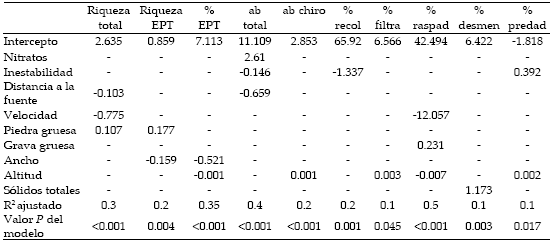
De las 12 métricas tomadas en cuenta en los modelos estadísticos, el porcentaje de Chironomidae fue excluido por tener alta correlación positiva con el porcentaje de depredadores (r=0.82 entre los residuales de las dos métricas). Asimismo, la abundancia de EPT fue excluida por tener alta correlación positiva con el porcentaje de EPT (r=0.73 entre los residuales de las dos métricas). Los modelos de regresión para las 10 métricas tuvieron valores de R2 ajustados que variaron entre 0.10 y 0.50 (Tabla 2).
Tabla 2. Modelos de regresión múltiple de las 10 métricas y nueve variables ambientales incluidas en el modelo. Ab=abundancia, chiro=Chironomidae, recol=recolectores, filtra=filtradores, raspad=raspadores, desmen=desmenuzadores, predad=depredadores.
Table 2. Stepwise multiple regression models obtained for each of the 10 metrics and nine environmental variables included in the model. Ab=abundance, chiro=Chironomidae, recol=collectors-gatherers, filtra=collectors-filterers, raspad=scrapers, desmen=shredders, predad=predators.
Cinco de las 10 métricas respondieron de manera significativa a efectos de perturbación (P<0.05) (Tabla 3), por lo cual sólo esas cinco fueron seleccionadas para ser incluidas en el índice final. Las cinco métricas fueron: riqueza total, riqueza de EPT, porcentaje en abundancia de EPT, abundancia total y porcentaje en abundancia de recolectores. Debido a que solo estas cinco variables fueron incluidas en el índice final, este índice puede variar en un rango de cero a cinco: cero es el posible valor mínimo de la suma de probabilidades y cinco es el posible valor máximo de la suma de probabilidades, tal como se describe en la sección Métodos.
Tabla 3. Resultados del test de t entre los residuales estandarizados de los sitios de referencia y perturbados. Las primeras cinco variables respondieron significativamente a efectos de perturbación antropogénica y fueron utilizados para el índice final.
Table 3. Results of t-tests applied to standardized residuals of reference and disturbed sites. The first five metrics respond significantly to anthropogenic disturbance and they were used to calculate the final index.

El promedio de índices de los sitios de referencia (2.569) fue significativamente mayor al de los sitios perturbados (1.352), t=10.16, P<0.0001 (Figura 3). Los rangos de índices de calidad biológica se establecieron tomando en consideración que ninguno de los sitios perturbados (28SP) tuvo valores >2.75, de la siguiente manera: excelente (>3.50), buena (2.76-3.50), media (2.00-2.75), mala (1.00-1.99), y muy mala (<1.00).

Figura 3. Distribución de los valores del índice para 63 sitios de referencia (63SR) (superior) y 28 sitios perturbados (28SP) (inferior) durante 2007-2008, en la cuenca alta del Río Grande (Bolivia). La media de los 63SR es significativamente mayor que la media de los 28SP (t=10.16, P<0.0001).
Figure 3. Distribution of the index scores for 63 reference sites (63RS) (upper diagram) and 28 disturbed sites (28DS) (lower diagram) during 2007-2008, in the upper Río Grande Basin (Bolivia). The mean of the index for 63RS is significantly greater than the mean of the index for 28DS (t=10.16, P<0.0001).
Se observó una relación negativa significativa entre el índice calculado para todos los sitios y las clases de condición ambiental (n=91, R2=0.35, P<0.0001) (Figura 4) y no se encontraron diferencias significativas entre los valores de índices entre los tres tipos de perturbación (urbana, agrícola y minera), pero éstas sí difirieron significativamente del grupo de los sitios de referencia (ANOVA, F=16.58, P<0.001) (Figura 5).
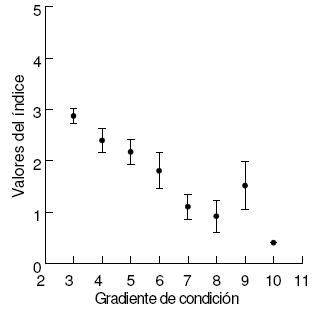
Figura 4. Relación entre el valor del índice (media y error estándar) y el gradiente de condición ambiental o estrés medidos visualmente en campo durante 2007-2008, en la cuenca alta del Río Grande (Bolivia).
Figure 4. Relationship between index scores (mean and standard error) and environmental condition gradient or stress visually assessed in the field during 2007-2008, in the upper Río Grande Basin (Bolivia).

Figura 5. Indice para sitios de referencia y los tres tipos de perturbación en la cuenca alta del Río Grande (Bolivia), la media de los índices de los sitios de referencia es significativamente superior a la media de los índices de los tres tipos de perturbación (ANOVA, F=16.58, P<0.001). Las cajas representan los percentiles 25 y 75, la línea dentro de la caja representa la mediana, y las barras representan los percentiles 5 y 95.
Figure 5. Index for the reference sites and the three types of disturbance in the upper Río Grande Basin (Bolivia), the mean of the index for the reference sites is statistically superior than the mean of the index for the three types of disturbance (ANOVA, F=16.58, P<0.001). Boxes represent the 25th and 75th percentiles, thick line within a box represents the median and whiskers represent the 5th and 95th percentiles.
Respecto a las respuestas de las diferentes métricas a distintos tipos de perturbación (incluidas en el índice), se encontró que sólo una métrica (la abundancia total) fue afectada de forma más significativa por la perturbación minera (ANOVA, F=5.046, P=0.014) que por los otros dos tipos de perturbación. Las otras cuatro métricas incluidas en el índice respondieron de forma similar a los tres tipos de perturbación (ANOVA, P>0.05).
DISCUSIÓN
Una de las ventajas del IBI es que contempla distintos atributos biológicos al considerar un amplio espectro de métricas, por lo que permite detectar las consecuencias de las distintas perturbaciones antropogénicas (Karr & Chu 1999; Angermeier et al. 2000). Este índice incluye cinco métricas que representan distintas clases de atributos biológicos. Dos métricas (riqueza total y abundancia total) representan la diversidad biológica y la productividad de los sistema acuáticos. Otras dos métricas (riqueza de EPT y % de EPT) contemplan la tolerancia y la composición al integrar grupos sensibles a la perturbación antropogéncia (Rosenberg & Resh 1993). Por último, una métrica basada sobre la composición trófica (% de raspadores) indica la condición funcional en la cadena alimentaria. Estas cinco métricas representan una imagen más o menos completa del ensamble de macroinvertebrados.
Algunas métricas (e.g., porcentaje de desmenuzadores) no mostraron respuestas significativas a efectos de perturbación antropogénica en la zona estudiada, y es probable que esto se deba a diversas causas. Por ejemplo, se sabe que los desmenuzadores dependen de la incorporación del detrito a partir de la vegetación ribereña (Cummins et al. 1989). En nuestra zona de estudio, debido a que las condiciones ambientales son xéricas (precipitación <500 mm/año) y grandes altitudes (>2500 m para el 86% de los sitios) hay un desarrollo pobre de vegetación ribereña, y por ende es probable que el grupo de desmenuzadores esté pobremente representado y que la respuesta esperada en la métrica no sea satisfactoria (Kerans & Karr 1994).
La sensibilidad relativa de cada una de estas variables cambia de una región a otra o de una cuenca a otra (Angermeier et al. 2000), en parte porque las métricas tienen distintas sensibilidades a varias perturbaciones (e.g., polución orgánica, alteraciones de flujo, toxinas). Asimismo, la variación natural en condiciones entre cuencas reduce la probabilidad que los índices basados en uno o pocos atributos proporcionen evaluaciones fiables sobre amplias áreas geográficas.
Nuestros resultados sugieren que los atributos relacionados a la riqueza, la densidad y la composición de los grupos intolerantes resultaron ser los más sensibles a los tipos de perturbación evaluados, lo cual contrasta con los resultados en otra región de Bolivia (Moya et al. 2007) y en regiones templadas (e.g., Rosenberg & Resh 1993; Karr & Chu 1999; Butcher et al. 2003; Morley & Karr 2003), mientras que los atributos relacionados a la estructura trófica (a excepción de los raspadores) muestran respuestas pobres a la perturbación antropogénica. Aunque en muchos casos éstas variables según la estructura trófica resultaron muy útiles en el biomonitoreo de ríos (e.g., Rosenberg & Resh 1993; Kerans & Karr 1994; Karr & Chu 1999; Dolédec & Statzner 2010), nuestros resultados así como otros estudios realizados en regiones tropicales (Palmer et al. 1996; Moya et al. 2007) indican que los grupos tróficos no siempre resultan eficientes en detectar perturbaciones antrópogénicas. Una posible explicación puede ser que los macroinvertebrados en regiones tropicales suelen tener tendencias generalistas (Tomanova et al. 2006). La mayoría de los taxa en esta región suelen ocupar al menos dos niveles tróficos (Tomanova et al. 2006). Esto significa que si un recurso específico asociado a un nivel trófico escasea con la perturbación, los organismos suelen eventualmente compensar esta limitación cambiando a recursos que corresponden a otro nivel trófico.
Los grupos tolerantes (e.g., los quironómidos) parecen tener respuestas particulares de acuerdo a la región y tipo de perturbación (Kerans & Karr 1994). Como ejemplo, en este estudio se incluyen sitios con perturbación minera, cuyo efecto es mucho más fuerte que los otros tipos de perturbación considerados (agrícola o urbana); esto sugiere que incluso los taxa tolerantes, como los quironómidos, disminuyeron drásticamente o desaparecieron en sitios fuertemente impactados por el drenaje ácido de minas (Van Damme et al. 2008; Gray & Delaney 2009).
Este estudio muestra que el IBI desarrollado, tomando en cuenta la variabilidad ambiental de los sitios estudiados, muestra una respuesta lineal negativa a un gradiente de perturbaciones antropogénicas, con una tendencia de respuesta más importante a la perturbación minera, seguido de la perturbación domestica y, finalmente, de la agrícola. Este índice desarrollado, a pesar de mostrar una respuesta marcada a la perturbación, aún presenta ciertas debilidades; una de ellas es la falta de validación de los modelos multimétricos. En términos ideales, se deberían validar los modelos desarrollados de los sitios de referencia (63SR) con otro grupo de sitios de referencia, independientemente de los sitios perturbados (28SP). Desafortunadamente, eso no fue posible porque en la zona de estudio no se encontraron suficientes sitios de referencia como para validar los modelos. Asimismo, debido a que no todos los sitios de referencia presentaron condiciones prístinas (ausencia de perturbación antropogénica), a algunos sitios se tuvo que incluir como referencia pese a que su calidad ambiental no fue completamente óptima.
Otro método de bioevaluación como es el RIVPACS (Sistema de Clasificación y Predicción de Invertebrados de Ríos) es también un modelo predictivo multivariado que permite la detección e interpretación del estrés antropogénico sobre el conjunto de invertebrados en arroyos y ríos (Wright et al. 1984). Los modelos RIVPACS se basan sobre relaciones empíricas relacionadas con la probabilidad de captura de un taxón individual de acuerdo a las características ambientales (e.g., composición del sustrato, alcalinidad, altitud, etc.) que son resultado de datos colectados a partir de una red de sitios de referencia. La principal diferencia con el presente trabajo es que RIVPACS sólo usa riqueza taxonómica para evaluar la condición del total de sitios, en vez de varios atributos biológicos como los que se usan en este trabajo. De manera similar a las aproximaciones de Oberdorff et al. (2002) y Pont et al. (2006, 2009), la métrica "riqueza de especies" puede ser considerada un tipo de descriptor de RIVPACS insertado dentro de una aproximación más general y multimétrica. Como cada métrica refleja un aspecto diferente del conjunto de macroinvertebrados que podría responder de manera distinta a los contaminantes de ecosistemas acuáticos, la combinación de distintas métricas (como la propuesta aquí) debería ser más eficiente y comprensiva para medir la condición en estos sistemas ecológicos complejos que una variable simple como la riqueza. En otras palabras, un modelo predictivo combina distintas potencialidades del IBI (Hughes & Oberdorff 1999; Karr 1981; Roset et al. 2007), mientras que la aproximación RIVPACS (Hawkins et al. 2000; Paulsen et al. 2008; Wright et al. 1984) evalúa y predice la condición del conjunto de macroinvertebrados.
Pese a algunas debilidades, éste índice desarrollado podría servir como un indicador útil para evaluar y monitorear los cambios en la condición biológica de estos ríos y proporcionar una base de referencia para la medición de la respuesta biótica en la restauración de aquellos ríos que han perdido su condición natural.
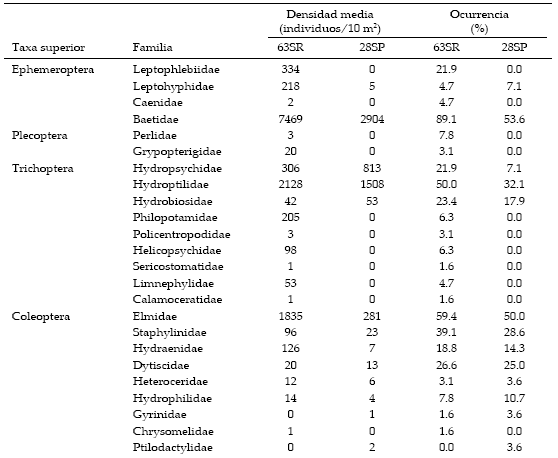
INFORMACIÓN SUPLEMENTARIA - SUPLEMENTARY INFORMATION
Densidad y frecuencia de ocurrencia de familias encontradas en sitios de referencia y perturbados (63SR y 28SP) en la cuenca alta del Río Grande (Bolivia).
Density and occurrence frequency of families for reference and disturbed sites (63RS and 28DS) in the upper Río Grande basin (Bolivia).


AGRADECIMIENTOS
Agradecemos al programa ASDI, a la Unidad de Limnología y Recursos Acuáticos y al Institut de Recherche pour le Développement (UMR BOREA, IRD 207) por el financiamiento de este trabajo, a Mabel Maldonado y Mirtha Rivero por el apoyo en la colecta de muestras y a Ángela Camargo, Marinely Bustamante y Andrea Yucra por la ayuda en la separación e identificación de las muestras.
BIBLIOGRAFÍA
1. ANGERMEIER, PL; RA SMOGOR & JR STAUFFER. 2000. Regional frameworks and candidate metrics for assessing biotic integrity in mid-Atlantic highland streams. T. Am. Fish. Soc. 129:962-981. [ Links ]
2. BAILEY, RC; RH NORRIS & TB REYNOLDSON. 2003. Bioassesment of freshwater ecosystems using the Reference Condition Approach. Springer Press, USA. [ Links ]
3. BAPTISTA, DF; DF BUSS; M EGLER; A GIOVANELLI; MP SILVEIRA; ET AL. 2007. A multimetric index based on benthic macroinvertebrates for evaluation of Atlantic Forest streams at Rio de Janeiro State, Brazil. Hydrobiologia 575:83-94. [ Links ]
4. BUTCHER, TJ; PM STUWART & TP SIMON. 2003. A benthic community index for streams in the Northern Lakes and Forests Ecoregion. Ecol. Indic. 3:181-193. [ Links ]
5. CUMMINS, KW; MA WILSBACH; DM GATES; JB PERRY & WB TALIAFERRO. 1989. Shredders and riparian vegetation. BioScience 39:24-30. [ Links ]
6. DESHON, JE. 1995. Development and application of the invertebrate community index (ICI). Pp.217-243 en: Davis, WS & TP Simon (eds.). Biological assessment and criteria: tools for water resource planning and decision making. CRC Press, Boca Raton, FL, USA. [ Links ]
7. DOLÉDEC, S & B STATZNER. 2010. Responses of freshwater biota to human disturbance: contribution of J-NABS to developments in ecological integrity assessments. J. N. Am. Benthol. Soc. 29:286-311. [ Links ]
8. DOMÍNGUEZ, E & HR FERNÁNDEZ. 2009. Macroinvertebrados bentónicos sudamericanos: Sistemática y Biología. Fundación Miguel Lillo. Tucumán, Argentina. [ Links ]
9. FERNÁNDEZ, HR & E DOMÍNGUEZ. 2001. Guía para la determinación de artrópodos bentónicos sudamericanos. Editorial Universitaria de Tucumán. Universidad Nacional de Tucumán. Argentina. [ Links ]
10. FERNÁNDEZ, HR; F ROMERO; MB VECE; V MANZO; C NIETO; ET AL. 2002. Evaluación de tres índices bióticos en un río subtropical de montaña (Tucumán-Argentina). Limnetica 21(1-2):1-13. [ Links ]
11. GRAY, NF & E DELANEY. 2010. Measuring community response of benthic macroinvertebrates in an erosional river impacted by acid mine drainage by use of a simple model. Ecol. Indic. 10:668-675. [ Links ]
12. HAWKINS, CP; RH NORRIS; JN HOGUE & JW FEMINELLA. 2000. Development and evaluation of predictive models for measuring the biological integrity of streams. Ecol. Appl. 10:1456-1477. [ Links ]
13. HEINO, J; T MUOTKA & R PAAVOLA. 2003. Determinants of macroinvertebrate diversity in headwater streams: regional and local influences. J. Anim. Ecol. 72:425-434. [ Links ]
14. HILSENHOFF, WL. 1977. Use of arthropods to evaluate water quality of streams. Department of Natural Resources, Madison, Wisconsin. Technical Bulletin Number 100. [ Links ]
15. HUGHES, RM & RF NOSS. 1992. Biological diversity and biological integrity: current concerns for lakes and streams. Fisheries 17:11-19. [ Links ]
16. HUGHES, RM & T OBERDORFF. 1999. Applications of IBI concepts and metrics to water outside the United States and Canada. Pp.79-83 en: Simon, TP (ed.). Assessing sustainability and biological integrity of water resources using fish communities. CRC Press, Boca Raton, FL, USA. [ Links ]
17. KARR, JR. 1981. Assessment of biotic integrity using fish communities. Fisheries 6:2-27. [ Links ]
18. KARR, JR & EW CHU. 1999. Restoring life in running waters: Better biological monitoring. Island Press. Washington, DC, USA. [ Links ]
19. KERANS, BL & JR KARR. 1994. A Benthic Index of Biotic Integrity (B-IBI) for rivers of the Tennessee Valley. Ecol. Appl. 4:768-785. [ Links ]
20. KOLKWITZ, R & M MARSSON. 1908. Okologie der pflanzlichen saprobien. Ber. Deut. Bot. Ges. 26:505-519. [ Links ]
21. MERRIT, R & KW CUMMINS. 1996. Aquatic insect of North America. Second edition. Kendall & Hunt Publishing Company. [ Links ]
22. METCALFE, JL. 1994. Biological water-quality assessment of rivers: use of macroinvertebrate communities. Pp. 145-170 en: Peter, C & EP Jeoffrey (eds.). The river handbook: hydrological and ecological principles. Blackwell Scientific Publications Press, Oxford. [ Links ]
23. MISERENDINO, ML; C BRAND & C DI PRINZIO. 2008. Assessing urban impacts on water quality, benthic communities and fish in streams of the Andes mountains, Patagonia (Argentina). Water Air Soil Poll. 194:91-110. [ Links ]
24. MISERENDINO, ML & CI MASI. 2010. The effect of land use on environmental features and functional organization of macroinvertebrate communities in Patagonian low order streams. Ecol. Indic. 10:311-319. [ Links ]
25. MONTES DE OCA, I. 1997. Geografía y Recursos Naturales de Bolivia. Ediciones EDOBOL. La Paz, Bolivia. Pp. 614. [ Links ]
26. MORLEY, SA & JR KARR. 2003. Assessing and Restoring the Health of Urban Streams in the Puget Sound Basin. Conserv. Biol. 16:1498-1509. [ Links ]
27. MOYA, N; S TOMANOVA & T OBERDORFF. 2007. Initial development of a multimetric index based on aquatic macroinvertebrates to assess streams condition in the upper Isiboro-Sécure Basin, Bolivian Amazon. Hydrobiologia 589:107-116. [ Links ]
28. MOYA, N; RM HUGHES; E DOMÍNGUEZ; F-M GIBON; E GOITIA; ET AL. 2011. Macroinvertebrate-based multimetric predictive models for evaluating the human impact on biotic condition of Bolivian streams. Ecol. Indicat. 11:480-487 [ Links ]
29. OBERDORFF, T; D PONT; B HUGHENY & D CHESSEL. 2001. A probabilistic model characterizing riverine fish communities of French rivers: a framework for environmental assessment. Freshwater Biol. 46:399-415. [ Links ]
30. OBERDORFF, T; D PONT; B HUGHENY & JP PORCHER. 2002. Development and validation of a fish-based index for the assessment of "river health" in France. Freshwater Biol. 47:1720-1734. [ Links ]
31. PAULSEN, SG; A MAYIO; DV PECK; JL STODDARD; E TARQUINIO; ET AL. 2008. Condition of stream ecosystems in the US: an overview of the first national assessment. J. N. Am. Benthol. Soc. 27:812-821. [ Links ]
32. PFANKUCH, J. 1975. Stream reach inventory and channel stability evaluation - U.S.D.A. Forest Service, Region 1 Missoula, Montana. Pp. 22. [ Links ]
33. PLAFKIN, JL; MT BARBOUR; KD PORTER; SK GROSS & RM HUGHES. 1989. Rapid bioassessment protocols for use in streams and rivers: benthic macroinvertebrates and fish. Assessment and Water Protection Division, U.S. Environmental Protection Agency, Report 444/4-89-001. [ Links ]
34. PONT, D; B HUGHENY; B BEIER; D GOFFAUX; A MELCHER; ET AL. 2006. Assessing river biotic condition at a continental scale: a European approach using functional metrics and fish assemblages. J. Appl. Ecol. 43:70-80. [ Links ]
35. PONT, D; RM HUGHES; TR WHITTIER & S SCHMUTZ. 2009. A predictive index of biotic integrity model for aquatic-vertebrate Assemblages of Western U.S. Streams. T. Am. Fish. Soc. 138:292-305. [ Links ]
36. ROSENBERG, DM & VH RESH. 1993. Freshwater biomonitoring and benthic macroinvertebrates. Chapman and Hall, New York. USA. [ Links ]
37. ROSET, N; G GRENOULLET; D GOFFAUX; D PONT & P KESTEMONT. 2007. A review of existing fish assemblage indicators and methodologies. Fish. Manage. Ecol. 14:393-405. [ Links ]
38. SMOGOR, RA & PL ANGERMEIER. 1999. Effects of drainage basin and anthropogenic disturbance on relations between stream size and IBI metrics in Virginia. Pp. 249-272 en: Simon, TP (ed.). Assessment approaches for estimating biological integrity using fish assemblages. Lewis Press, Boca Raton, FL, USA. [ Links ]
39. TOMANOVA, S; E GOITIA & J HELEZIC. 2006. Trophic levels and functional feeding groups of macroinvertebrates in neotropical streams. Hydrobiologia 556:251-264. [ Links ]
40. TOMANOVA, S; N MOYA & T OBERDORFF. 2008. Using macroinvertebrate biological traits for assessing biotic integrity of Neotropical streams. River Res. Appl. 24:1230-1239. [ Links ]
41. VAN DAMME, PA; C HAMEL; A AYALA & L BERVOETS. 2008. Macroinvertebrate community response to acid mine drainage in rivers of the High Andes (Bolivia). Environ. Pollut. 15:1061-1068. [ Links ]
42. VINSON, MR & CP HAWKINS. 1998. Biodiversity of stream insects: variation at local, basin and regional scales. Ann. Rev. Entomol. 43:271-293. [ Links ]
43. WAITE, IR; LR BROWN; JG KENNEN; JT MAY; TF CUFFNEY; ET AL. 2010. Comparison of watershed disturbance predictive models for stream benthic macroinvertebrates for three distinct ecoregions in western US. Ecol. Indic. 10:1125-1135. [ Links ]
44. WRIGHT, JF; D MOSS; PD ARMITAGE & MT FURSE. 1984. A preliminary classification of running water sites in Great Britain based on macroinvertebrate species and the prediction of community type using environmental data. Freswater Biol. 14:221-256. [ Links ]














