Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral vol.22 no.1 Córdoba abr. 2012
ARTÍCULO ORIGINAL
Efectos del herbicida glifosato sobre la estructura y el funcionamiento de comunidades microbianas de dos suelos de plantaciones de olivo
Paula V Bórtoli1; Romina A Verdenelli1; Cinthia Conforto2; Silvina Vargas Gil2 & José M Meriles1,*
1. Instituto Multidisciplinario de Biología Vegetal (IMBIV. CONICET-UNC). Instituto de Ciencia y Tecnología de los Alimentos (FCEFyNat-UNC). Cátedra de Química Orgánica. FCEFyNat-UNC.
2. Instituto de Fitopatología y Fisiología Vegetal (IFFIVE-INTA)
* Instituto Multidisciplinario de Biología Vegetal (IMBIV. CONICET-UNC). Instituto de Ciencia y Tecnología de los Alimentos (FCEFyNat-UNC). Cátedra de Química Orgánica. FCEFyNat-UNC. Av. Vélez Sarsfield 1611. Ciudad Universitaria. (5016)Córdoba, Argentina. Tel/fax: +54(0351)4334439. Email: jmeriles@efn.uncor.edu
Recibido: 8 de abril de 2011;
Fin de arbitraje: 24 de mayo de 2011;
Revisión recibida: 21 de julio de 2011;
Aceptado: 6 de noviembre de 2011
RESUMEN. Los herbicidas pueden alterar la estructura y el funcionamiento del suelo mediante efectos directos sobre varios componentes de su microbiota. Muchos autores han encontrado un efecto perjudicial del glifosato sobre la calidad del suelo y la diversidad microbiana. Sin embargo, la mayoría de los trabajos han sido realizados en sistemas de cultivos herbáceos y anuales y muy pocos en sistemas forestales o leñosos perennes. El objetivo del presente trabajo fue analizar el efecto a corto plazo de la aplicación de glifosato sobre parámetros microbiológicos generales y la estructura de las comunidades microbianas de suelos provenientes de lotes cultivados con olivo (Olea europaea L.). Realizamos un experimento de aplicación de distintas concentraciones de glifosato en dos tipos de suelo de olivar, con y sin historial de aplicación de pesticidas, y evaluamos distintas propiedades del suelo a lo largo de 55 días de incubación. En general, el impacto del glifosato sobre la microbiota fue mucho más importante en el suelo sin historial de aplicación de herbicida. En la mayoría de los parámetros analizados, el tratamiento con glifosato a la concentración recomendada a campo no se diferenció del tratamiento control. El cambio observado en la biomasa microbiana total no fue consistente. Sin embargo, en ambos suelos analizados, la aplicación de altas concentraciones de glifosato produjo un incremento significativo de las bacterias cultivables y de las bacterias Gram (-), estimada por medio de perfiles de ácidos grasos.
Palabras clave: Pesticidas; Microbiología de suelos; Bacterias del suelo; Argentina; Roundup UltraMax.
ABSTRACT. Effects of glyphosate on microbial community structure and activity in two soils under olive plantations: Herbicides may alter soil ecosystems by a direct effect on selected component of soil microflora. Several authors reported a harmful effect of glyphosate on soil quality and microbial diversity. Most studies have been focused in the effect of annual extensive crops and a few have been done in perennial woody plantations. The aim of our study was to study the short-term effect of glyphosate application on microbiological parameters and microbial community structure under olive plantations. We applied different dosages of glyphosate to soils corresponding to two olive plantations, with and without history of pesticide application and evaluated a number of functional and structural parameters of soil biota throughout 55 days. In general, the soil without history of glyphosate application had a greater impact of glyphosate on with respect to the soil with history of glyphosate application. There was no consistent effect on total microbial biomass. However, the effect of glyphosate application at field rate was similar to control treatment. In both soils analyzed, glyphosate applied at elevated dosages increased cultivable bacteria and Gram (-) bacteria, as estimated by fatty acids profiles.
Keywords: Pesticides; Soil microbiology; Soil bacteria; Argentine; Roundup UltraMax.
INTRODUCCIÓN
Los herbicidas pueden alterar los ecosistemas del suelo mediante un efecto directo y/o indirecto sobre varios componentes de la microbiota del suelo, tales como patógenos de plantas, antagonistas, micorrizas o comunidades microbianas (Duncan & Paxton 1981; Wilcox 1996). Estos efectos pueden resultar en un incremento o una disminución de la incidencia de enfermedades en los cultivos [e.g., a través de la promoción o supresión de las actividades de organismos patógenos (Lévesque & Rahe 1992)].
El glifosato es uno de los herbicidas más comúnmente utilizados en el mundo. Actúa inhibiendo la síntesis de aminoácidos aromáticos (Jaworski 1972). Originalmente fue utilizado en agricultura extensiva (en particular en soja y maíz), aunque en la actualidad se usa en diferentes tipos de cultivos, incluidas las forestaciones y los cultivos perennes leñosos (Busse et al. 2001). En nuestro país también se ha difundido su utilización en el cultivo de cítricos y olivares con el objeto de controlar malezas y aumentar la productividad de los cultivos (González-Torralva et al. 2010).
Estudios diversos realizados a campo y en condiciones controladas han encontrado efectos del glifosato sobre la actividad de distintos microorganismos del suelo. Por ejemplo, en condiciones de laboratorio se han documentado disminuciones del crecimiento micelial de Fusarium solani, Pythium spp., y Trichoderma viride frente a concentraciones altas del herbicida (Meriles et al. 2006). No obstante, también se han identificado a algunas especies de hongos patógenos (e.g., Pythium spp. y Fusarium spp.) como los principales colonizadores de raíces de plantas anuales y perennes tratadas con glifosato (Lévesque et al. 1993; Kawate et al. 1997; Descalzo et al. 1998). Además, se ha comprobado que los brotes de diferentes especies de plantas son menos sensibles al glifosato cuando crecen en suelo previamente esterilizado, lo que sugiere un sinergismo entre el herbicida y ciertos microorganismos patógenos (Johal & Rahe 1984; Lévesque et al. 1993; Descalzo et al. 1996). En condiciones de campo, si bien algunos estudios han descripto efectos pequeños o nulos del glifosato sobre la actividad microbiana (Ferreira et al. 2006), otros han encontrado efectos considerables. Así, Wardle & Parkinson (1990) observaron que la presencia de glifosato en suelo se relacionó con incrementos temporales de poblaciones bacterianas con su concomitante aumento de actividad. Otros estudios han documentado aumentos en la cantidad de hongos y bacterias cultivables (Roslycky 1982), respiración del suelo (Haney et al. 2000) y actividad enzimática del suelo (Gianfreda et al. 1995) como consecuencia de la aplicación de diferentes concentraciones de glifosato.
El impacto del glifosato sobre la actividad y biomasa microbianas podría estar relacionado con el tipo de suelo y con su historial de aplicaciones previas glifosato. Recientemente, Ratcliff et al. (2006) encontraron que la aplicación de glifosato produce un aumento de la diversidad funcional, en particular de suelos arcillo-limosos. Por otro lado, Araújo et al. (2003) demostraron que los suelos con aplicaciones previas de glifosato muestran una fuerte respuesta de su actividad microbiana frente a una nueva aplicación del herbicida. El objetivo del presente trabajo fue analizar el efecto a corto plazo de la aplicación de diferentes dosis de glifosato sobre parámetros microbiológicos generales y la estructura de comunidades microbianas de suelos provenientes de cultivo de olivo, una especie leñosa, de dos situaciones distintas: una con aplicaciones previas de este herbicida y otra sin aplicación previa. Es esperable que la aplicación de altas dosis de glifosato en suelos sin historia de aplicación sean los más perturbados.
MÉTODOS
Diseño experimental y toma de muestras
Realizamos un experimento de incubación de dos tipos de suelo bajo condiciones controladas, que sometimos a un control y a tres dosis de herbicida. El suelo fue recolectado en dos plantaciones de olivo localizadas en la región de traslasierra, provincia de Córdoba, Argentina. Una de las plantaciones se ubicaba en la localidad de Loma Bola y el tipo de suelo era franco-arenoso (Haplustol típico, arena 66.2%, limo 20.6%, arcilla 13.2%, materia orgánica 5.39%, carbono orgánico 3.13%); fue designado como CAS. Este suelo no recibió aplicación de agroquímicos durante el último año, previo al muestreo. La otra plantación se ubicaba en la localidad de Loma Bola y el tipo de suelo era franco (Haplustol típico, arena 41.6%, limo 41.4%, arcilla 17.0%, materia orgánica 5.26%, carbono orgánico 3.05%); fue designado como FIN. Este suelo recibió repetidas aplicaciones de agroquímicos, incluido el glifosato, en el período previo al muestreo. Ambas plantaciones se encuentran a una distancia respectiva de aproximadamente 15 km y los lotes de estudio tuvieron un tamaño aproximado de 1 ha. Las muestras de suelo fueron tomadas en abril de 2007, en un radio de 2 m desde el tronco de cada árbol seleccionado. El suelo se recolectó del horizonte superficial (15 cm) y fue tamizado con el objeto de eliminar los restos vegetales y escombros.
Aproximadamente 500 g de suelo fue fraccionado en bandejas plásticas (20 cm ancho x 25 cm largo x 7 cm de profundidad) y luego almacenado durante 7 días en cámara de cultivo para que se equilibrara. La aplicación de glifosato consistió en una única aplicación de una formulación comercial de glifosato (Roundup UltraMax, Monsanto Co, St. Louis, MO) de 20, 200 y 2000 mg de ingrediente activo por kg de suelo, y un control sin agregado de herbicida. Evaluamos parámetros del suelo en cuatro momentos: 1, 10, 30 y 55 días posteriores a la aplicación del herbicida. Se utilizaron tres repeticiones por tratamiento. Para el cálculo de la concentración recomendada a campo se supuso una penetración de 2 cm y una densidad de 1.1 y 1.3 g/cm3 en los suelos FIN y CAS, respectivamente. Los valores de glifosato aplicados en la formulación comercial coincidieron con los utilizados por otros autores (Accinelli et al. 2002). El tratamiento de menor concentración (20 mg) fue seleccionado con el objeto de simular una aplicación simple a la dosis recomendada a campo. La utilización de la dosis intermedia (200 mg) es recomendada en estudios de laboratorio para analizar el efecto de pesticidas sobre la microbiota del suelo (Sommerville 1987), mientras que la máxima concentración (2000 mg) representa un escenario de contaminación por derrame. Los suelos fueron incubados en oscuridad, a temperatura ambiente y a un 75% de su capacidad de campo, y fueron regados de forma periódica con agua destilada para mantener constantes los valores de humedad.
Variables estudiadas
El análisis de actividad microbiana total se realizó por espectrofotometría, según Adam & Duncan (2001). La concentración de fluoresceína se calculó utilizando la curva de calibración realizada con patrones de 0 a 5 µg/mL y se expresó como µg de fluoresceína/g de suelo. La respiración microbiana se determinó mediante la estimación del CO2 liberado de muestras de ~10 g de suelo, por medio de titulación con ácido clorhídrico (Alef 1995). La biomasa microbiana fue estimada mediante la técnica de fumigación-reinoculación e incubación de muestras de 20 g de suelo y tituladas con ácido clorhídrico (Jenkinson & Powlson 1976).
La estimación de las poblaciones de hongos y bacterias cultivables se realizó mediante la técnica de dilución en placa, sembrado en TSA y PDA (Larkin 2003). El análisis de las poblaciones de hongos totales se ensayó sobre agar papa glucosado (APG) suplementado con rosa de bengala (0.02 g/L), cloranfenicol (0.3 g/L) y estreptomicina (0.1 g/L). Para bacterias totales cultivables el medio de cultivo utilizado fue Trypticase Soy Agar (TSA). Se presentan los datos correspondientes a la dilución 10-4, que se sembró en cajas de Petri incubadas durante dos/cuatro días a 25 ºC. Las estimaciones cuantitativas de las unidades formadoras de colonias (ufc) por gramo de suelo se calcularon realizando un conteo visual del número de colonias formadas en cada placa, tanto para hongos totales cultivables como para bacterias totales cultivables.
La biomasa fúngica total se estimó a partir del contenido de ergosterol del suelo (Montgomery et al. 2000). Se extrajo el ergosterol de muestras de 250 mg de suelo con hexano y se determinó su concentración por cromatografía líquida (HPLC; Perkin-Elmer serie 200) equipado con una columna analítica de fase reversa C18 (Microsorb amino). La biomasa fúngica total se expresó como µg de ergosterol/g de suelo. Los fosfolípidos de ácidos grasos (PLFAs) se extrajeron según Bossio et al. (1998), para los 30 y 55 días de incubación. A partir de muestras de 10 g de suelo se extrajeron los ácidos grasos con hexano y se determinó su concentración por cromatografía gaseosa (Perkin-Elmer Clarus 500 equipado con una columna Elite-5 Crossbond 5% difenil - 95% dimetil polisiloxano). La cuantificación se realizó mediante el agregado de un estándar interno (19:0). Los ácidos grasos fueron identificados mediante una corrida previa de un estándar de ésteres metílicos de ácidos grasos bacterianos (Bacterial Acid Methyl Esters mix, Supelco, Bellefonte, PA). La concentración total de PLFAs fue estimada mediante la sumatoria de todos los ácidos grasos de fosfolípidos identificados, y utilizada como estimador de la biomasa microbiana total (Böhme et al. 2005).
Análisis estadístico
La actividad microbiana, respiración y biomasa microbianas, hongos y bacterias cultivables, biomasa fúngica total y los grupos taxonómicos estimados por PLFAs individuales fueron sometidos a un análisis de varianza a una vía (ANAVA) y análisis a posteriori con la prueba de Di Rienzo, Guzmán y Casanoves (DGC). El ANAVA se realizó entre concentraciones de glifosato para un mismo día de incubación y tipo de suelo. La normalidad de los datos fue puesta a prueba mediante la prueba de Shapiro-Wilks modificado. El análisis estadístico de los perfiles de ácidos grasos en los dos suelos fue realizado mediante un análisis multivariado de componentes principales (ACP). Para todos los análisis estadísticos se utilizó el software INFOSTAT/Professional 2005p.1 (F.C.A. - Universidad Nacional de Córdoba, Argentina).
RESULTADOS
Los valores de actividad microbiana no revelaron un efecto significativo del herbicida en ninguno de los suelos, en ninguno de los momentos evaluados (Figura 1). En ambos tipos de suelo se registró una caída importante de la actividad microbiana a medida que se desarrolló la incubación de los suelos. Tanto en FIN como en CAS, los menores valores de actividad siempre fueron observados hacia el día 55 de incubación.
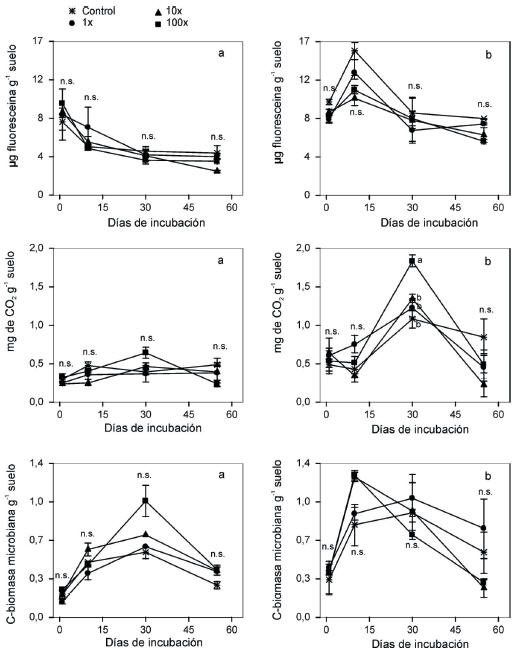
Figura 1. Actividad microbiana , respiración microbiana y biomasa microbiana de suelo no tratado (control) y tratado con tres concentraciones de glifosato (1x, 10x y 100x; x, concentración recomendada a campo) en el (a) suelo FIN (sin aplicación de glifosato) y (b) suelo CAS (con aplicaciones de glifosato). Las barras de error representan el error estándar. Letras diferentes indican diferencias significativas acorde con DGC (P≤.05). n.s: diferencia no significativa.
Figure 1. Microbial activity, microbial respiration and microbial biomass of untreated (control) and treated soil with three dosages of glyphosate (1x, 10x y 100x; x, recommended field rate) from (a) FIN soil (without glyphosate application) and (b) CAS soil (with glyphosate application). The error bars are the standard error of the mean. Bars topped with the same letter are not significantly different according with DGC (P≤.05). n.s.: No significant differences.
El agregado de glifosato al suelo CAS produjo diferencias en la respiración microbiana (Figura 1). Los valores más altos de respiración microbiana fueron observados en el suelo CAS. En ambos suelos analizados, el tratamiento con glifosato a máxima concentración (100x) produjo un aumento en la respiración microbiana en el día 30 de incubación, pero sólo se evidenció un incremento estadísticamente significativo en el suelo CAS.
La biomasa microbiana no mostró diferencias entre los tratamientos para ninguno de los tiempos/suelos estudiados (Figura 1). Los valores más altos de biomasa microbiana fueron observados a los 7 días de incubación del suelo CAS. Este patrón de respuesta se invirtió hacia el final del período de incubación. La aplicación de glifosato a la más alta concentración produjo un incremento no significativo hacia el día 30 de incubación del suelo FIN.
En ambos suelos, los hongos cultivables presentaron una respuesta poco consistente frente a la aplicación de las distintas concentraciones de glifosato (Figura 2). En general, el suelo FIN sin aplicación de glifosato mostró la menor abundancia de hongos cultivables y la mayor cantidad, durante los 15 y 30 días de incubación, se registró en el suelo tratado con las mayores concentraciones del herbicida (200 y 2000 mg), aunque estas diferencias no fueron estadísticamente significativas (Figura 2). Por su parte, el suelo CAS mostró un patrón de respuesta diferente. La menor abundancia fúngica fue observada hacia el final de la incubación en el suelo control. En general, y teniendo en cuenta todos los tratamientos con glifosato, el suelo CAS presentó valores más altos de poblaciones de hongos cultivables que el suelo FIN [P<0.0001, P=0.003, P=0.0009 para los 1, 7 y 30 días de incubación, respectivamente (Figura 2)]. El número de bacterias cultivables mostró una respuesta más uniforme a los tratamientos con glifosato en los dos suelos analizados (Figura 2). En ambos tipos de suelos, la aplicación de las más altas concentraciones de glifosato causó un incremento en las poblaciones bacterianas. A los 7, 30 y 55 días de incubación del suelo FIN, la aplicación de glifosato a las concentraciones mayores concentraciones produjo un significativo incremento de la biomasa bacteriana.

Figura 2. Hongos y bacterias cultivables de suelo no tratado (control) y tratado con tres concentraciones de glifosato (1x, 10x y 100x; x, concentración recomendada a campo) en el (a) suelo FIN (sin aplicación de glifosato) y (b) suelo CAS (con aplicaciones de glifosato). Las barras de error representan el error estándar. Letras diferentes indican diferencias significativas acorde con DGC (P≤.05). n.s: diferencia no significativa.
Figure 2. Culturable fungi and bacteria of untreated (control) and treated soil with three dosages of glyphosate (1x, 10x y 100x; x, recommended field rate) from (a) FIN soil (without glyphosate application) and (b) CAS soil (with glyphosate application). The error bars are the standard error of the mean. Bars topped with the same letter are not significantly different according with DGC (P≤.05). n.s.: No significant differences.
En el suelo FIN, la aplicación de glifosato aumentó significativamente la biomasa fúngica total a los día 30 de incubación, en comparación con el tratamiento control (Figura 3). En cambio, la biomasa fúngica del suelo CAS no mostró efectos significativos del agregado de glifosato.

Figura 3. Biomasa fúngica total (µg ergosterol/g suelo) de suelo no tratado (control) y tratado con tres concentraciones de glifosato (1x, 10x y 100x; x, concentración recomendada a campo) en el (a) suelo FIN (sin aplicación de glifosato) y (b) suelo CAS (con aplicaciones de glifosato). Las barras de error representan el error estándar. Letras diferentes indican diferencias significativas acorde con DGC (P≤.05). n.s: diferencia no significativa.
Figure 3. Total fungal biomass (microg. ergosterol g-1 soil) of untreated (control) and treated soil with three dosages of glyphosate (1x, 10x y 100x; x, recommended field rate) from (a) FIN soil (without glyphosate application) and (b) CAS soil (with glyphosate application). The error bars are the standard error of the mean. Bars topped with the same letter are not significantly different according with DGC (P≤.05). n.s.: No significant differences.
Los dos primeros componentes del análisis de componentes principales para los PLFAs explicaron 61% de la variación en el suelo FIN y 47% en el suelo CAS (Figura 4). En ninguno de los suelos analizados se observó una clara separación entre tratamientos con glifosato y/o entre días de muestreo. En ambos suelos ensayados se identificaron un total de 25 ácidos grasos de fosfolípidos, que fueron utilizados para el cálculo de la abundancia de 5 grupos taxonómicos y una estimación de biomasa microbiana total (Figura 5). Los ácidos grasos más abundantes encontrados en todas las muestras fueron los PLFAs a15:0, 16:0, 10Me16:0, 18:0, 18:1ω7c y 18:1ω9c (datos no mostrados). A los 30 días de incubación del suelo FIN no se encontraron diferencias significativas para ninguno de los grupos taxonómicos analizados. Sin embargo, hacia los 55 días de incubación, este suelo reflejó una disminución significativa de las bacterias Gram (+) y Gram (-) en el suelo control. Es decir, la aplicación de glifosato en todas las concentraciones (1x, 10x y 100x) produjo un aumento de bacterias Gram (+) y Gram (-). En esta fecha de muestreo, tampoco fue detectada ninguna alteración en la biomasa microbiana total. Por su parte, el suelo CAS mostró el mismo patrón de aumento de bacterias Gram (-) en suelo tratado con altas concentraciones de glifosato (200 y 2000 mg), tanto a los en el 30 como a los 55 días de incubación. En el día 30 también se detectó una disminución de bacterias Gram (+) en suelo tratado con glifosato a la más alta concentración (100x). Por último, hacia el día 30 de incubación, la aplicación de las más altas concentraciones de glifosato (10x y 100x) en el suelo CAS produjeron también un aumento de las bacterias totales. En ambos días de incubación, la biomasa microbiana total en ambos suelos resultó independiente de la concentración de glifosato aplicado.
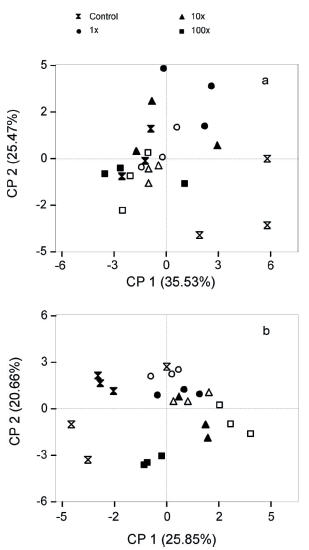
Figura 4. Análisis de componente principal de fosfolípidos de suelo no tratado (control) y tratado con tres concentraciones de glifosato (1x, 10x y 100x; x, concentración recomendada a campo) en el (a) suelo FIN (sin aplicación de glifosato) y (b) suelo CAS (con aplicaciones de glifosato). Símbolos rellenos y vacíos indican los 30 y 55 días de incubación, respectivamente.
Figure 4. Principal components analysis of phospholipids of untreated (control) and treated soil with three dosages of glyphosate (1x, 10x y 100x; x, recommended field rate) from (a) FIN soil (without glyphosate application) and (b) CAS soil (with glyphosate application). Solid and open symbols indicate 30 and 55 days of incubation, respectively.

Figura 5. Grupos taxonómicos microbianos (nmol% PLFA) y biomasa microbiana total (nmol PLFA/g suelo) en suelo no tratado (control) y tratado con tres concentraciones de glifosato (1x, 10x y 100x; x, concentración recomendada a campo) en suelo FIN (sin aplicación de glifosato) y CAS (con aplicaciones de glifosato), durante los días 30 y 55 de incubación. Letras diferentes indican diferencias significativas acorde con DGC (P≤.05). n.s: diferencia no significativa.
Figure 5. Microbial taxonomic groups (nmol% de PLFA) and total microbial biomass (nmol de PLFA g-1 soil) of untreated (control) and treated soil with three dosages of glyphosate (1x, 10x y 100x; x, recommended field rate) from (a) FIN soil (without glyphosate application) and (b) CAS soil (with glyphosate application), during 30 and 55 days of incubation. Bars topped with the same letter are not significantly different according with DGC (P≤.05). n.s.: No significant differences.
DISCUSIÓN
La mayoría de los parámetros estudiados no fueron afectados por la aplicación de glifosato en bajas concentraciones. Sin embargo, el suelo sin historial de aplicación demostró ser mucho más sensible al herbicida que el suelo con historial de aplicación.
La actividad microbiana es uno de los factores decisivos en la disipación del glifosato en el suelo (Araújo et al. 2003). La actividad de ambos tipos de suelo resultó similar y los valores reportados en este trabajo son coincidentes con los observados por otros autores (Miñambres et al. 2010). Aunque los herbicidas no son intencionalmente diseñados para inhibir microbios, algunas de las formulaciones comerciales pueden producir alteraciones en la actividad y biomasa microbiana si el suelo cuenta con la presencia de microorganismos sensibles. De acuerdo con Heinonen-Tanski (1989), los suelos con alta actividad microbiana favorecen la rápida degradación del glifosato ya que permiten su utilización como fuente de carbono. Carlisle & Trevors (1986) reportaron que el glifosato puede estimular o inhibir la actividad de los microorganismos de suelo dependiendo del tipo de suelo y la concentración de herbicida utilizado. Weaver et al. (2007) observaron una acelerada reducción de 19% de actividad microbiana (FDA) en un suelo franco-limoso tratado con concentraciones altas de glifosato, en condiciones de laboratorio. En concordancia con este estudio, los resultados obtenidos muestran que la actividad microbiana respondió de manera diferencial a la aplicación de glifosato, en relación con el tipo de suelo involucrado. En el suelo FIN no se encontró una respuesta consistente, mientras que en el suelo CAS la aplicación de altas concentraciones del herbicida produjo una rápida y duradera reducción de la actividad microbiana total. Estos resultados podrían estar asociados con el historial de los dos suelos utilizados en este estudio. El suelo FIN estuvo sometido a un manejo que incluyó repetidas aplicaciones de pesticidas. Por el contrario, el suelo CAS no tuvo aplicaciones de herbicida durante el último año. De esta manera, la reducción en el contenido de fluoresceína en suelos tratados podría estar relacionada con la inhibición de la actividad microbiana en poblaciones sensibles al agroquímico. En general, en ambos tipos de suelo, la actividad microbiana mostró una reducción con el tiempo de incubación. Resultados similares han sido observados por otros autores (Gómez et al. 2009), y podrían deberse a la reducción progresiva del carbono disponible.
El impacto del glifosato sobre la respiración y biomasa microbiana del suelo ha presentado resultados contrapuestos dependiendo de las dosis y el tipo de suelo estudiado (Haney et al. 2000, 2002; Gómez et al. 2009). El glifosato es un herbicida fosforado que puede ser utilizado como fuente de C, N, y P por bacterias Gram (+) y Gram (-) (van Eerd et al. 2003). Los resultados del presente trabajo sugieren que el glifosato aplicado a altas concentraciones produce un aumento significativo de la respiración y biomasa microbiana entre los días 15 y 30 de incubación, en los dos suelos probados. Es posible que el herbicida provea nutrientes para el crecimiento de bacterias heterotróficas, a la vez que produzca mortalidad en otras poblaciones de bacterias, que también serán utilizadas como fuente de nutrientes por el resto de los microorganismos más resistentes (Chen et al. 2001). Esta hipótesis que justificaría el aumento de la respiración y la biomasa microbiana en los días posteriores a la aplicación de glifosato también ha sido postulada por otros autores (Haney et al. 2002). Por el contrario, en general, la aplicación del glifosato a las concentraciones recomendadas no afectó significativamente la respiración ni la biomasa microbiana, en comparación con el tratamiento control.
De modo similar a lo observado con la biomasa microbiana total en nuestro ensayo, las bacterias cultivables analizadas también se vieron afectadas por la aplicación de glifosato. En concordancia con la hipótesis acerca del rol de las bacterias en los procesos de disipación del glifosato, varios autores han encontrado una alta correlación entre la velocidad de mineralización del glifosato y el conteo de Pseudomonas spp. en cinco diferentes tipos de suelo (Gimsing et al. 2004). Zabaloy et al. (2008) también encontraron un aumento de bacterias heterótrofas cultivables luego de tres días de la aplicación de herbicida. Los resultados del presente trabajo demuestran un aumento de bacterias cultivables en relación directa con las concentraciones de glifosato aplicada. En general, un mayor número de bacterias cultivables fue observado en los tratamientos con altas concentraciones de glifosato, mientras que el tratamiento control presentó los valores más bajos. Si bien estas tendencias fueron observadas en los dos suelos analizados, el suelo CAS mostró valores muy superiores a los del suelo FIN, en los días 15 y 30 de incubación. Esta diferencia también podría estar asociada con la ausencia/presencia de historial de aplicación a campo del herbicida.
Ratcliff et al. (2006) reportaron un significativo incremento del número de propágulos fúngicos después de la adición de glifosato en bajas concentraciones. No obstante, cuando el suelo fue tratado con altas concentraciones del herbicida no se observó incremento en los hongos del suelo, respecto al tratamiento control. Estos resultados concuerdan parcialmente con los obtenidos en el presente estudio. No se observó una respuesta uniforme en los hongos cultivables del suelo tratado con glifosato. Sin embargo, el tratamiento con glifosato a concentraciones media-alta produjo un aumento de biomasa fúngica total, a los 15 y 30 días posteriores a la aplicación, en los dos tipos de suelo evaluados.
En nuestro trabajo, el análisis de componentes principales de ácidos grasos del suelo no logró discriminar entre concentraciones de glifosato para ninguno de los tipos de suelo analizados. Resultados similares fueron observados por otros autores que han cuestionado el poder resolutivo de la técnica. En este sentido, Ratcliff et al. (2006) no encontraron cambios en la composición estructural de la microbiota luego de la aplicación de glifosato. Sin embargo, los datos del presente trabajo muestran que algunos grupos taxonómicos fueron afectados significativamente por la aplicación del herbicida. En particular, estos grupos han sido conformados por ácidos grasos de cadena larga, ácidos grasos monoinsaturados e hidroxilados. Estos ácidos grasos están asociados con la población de bacterias Gram (-) y bacterias totales (Leckie 2005). Excepto el suelo FIN en el día 30 de incubación, el resto de tratamientos mostró un aumento marcado de bacterias Gram (-) en proporción con el aumento en la cantidad de glifosato aplicado. Otros autores han sugerido que este incremento en ciertas poblaciones microbianas puede deberse a la utilización del pesticida como fuente de carbono y/o a la utilización de biomasa afectada, que sustente el crecimiento de ciertas poblaciones en desmedro de otras más sensibles al pesticida (Kuklinsky-Sobral et al. 2005). Estos resultados son relativamente coincidentes con los obtenidos mediante otras técnicas de medición de biomasa microbiana, tales como la titulación del anhídrido carbónico con el método de fumigación-incubación. Sin embargo, no fue posible obtener una correlación significativa entre el contenido de ergosterol y el bioindicador lipídico PLFA 18:2ω6, 9 (datos no mostrados). Las discrepancias entre estas técnicas han sido documentadas por otros autores, y deberán ser objeto de estudios futuros (Hogberg 2006).
En conclusión, los resultados del presente estudio mostraron que la aplicación de concentraciones altas de glifosato puede alterar la actividad y estructura de las comunidades microbianas del suelo, aunque dicho efecto fue menos acentuado y consistente en las concentraciones más bajas. El impacto del glifosato fue mucho más evidente en suelos sin historia de aplicación de herbicidas. El glifosato también mostró un marcado efecto sobre las bacterias Gram negativas, y poco o ningún efecto sobre los hongos totales. A nuestro juicio, los estudios toxicológicos debieran completarse con futuras investigaciones que aborden el impacto de este herbicida sobre los perfiles proteicos y de utilización de sustrato en distintos tipos de suelo.
BIBLIOGRAFÍA
1. ACCINELLI, C; C SCREPANTI; G DINELLI & A VICARI. 2002. Short-time effects of pure and formulated herbicides on soil microbial activity and biomass. Intern. J. Environ. Anal. Chem. 82:519-527. [ Links ]
2. ADAM, G & H DUNCAN. 2001. Development of a sensitive and rapid method for measurement of total microbial activity using fluorescein diacetate (FDA) in a range of soils. Soil Biol. Biochem. 33:943-951. [ Links ]
3. ALEF, K. 1995. Soil respiration. Pp. 214-219 en: Alef, K & P Nannipieri (eds.). Methods in Applied Soil Microbiology and Biochemistry. Academic Press, Harcourt Brace & Company Publishers, London, UK. [ Links ]
4. ARAÚJO, ASF; RTR MONTEIRO & RB ABARKELI. 2003. Effect of glyphosate on the microbial activity of two brazilian soils. Chemosphere 52:799-804. [ Links ]
5. BÖHME, L; U LANGER & F BÖHME. 2005. Microbial biomass, enzyme activities and microbial community structure in two European long-term field experiments. Agr. Ecosyst. Environ. 109:141-152. [ Links ]
6. BOSSIO, DA; KM SCOW; N GUNAPALA & KJ GRAHAM. 1998. Determinants of soil microbial communities: effects of agricultural management, season, and soil type on phospholipid fatty acid profiles. Microb. Ecol. 36:1-12. [ Links ]
7. BUSSE, MD; AW RATCLIFF; CJ SHESTAK & RF POWERS. 2001. Glyphosate toxicity and the effects of long-term vegetation control on soil microbial communities. Soil Biol. Biochem. 33:1777-1789. [ Links ]
8. CARLISLE, SM & JT TREVORS. 1986. Effect of the herbicide glyphosate on respiration and hydrogen consumption in soil. Water Air Soil Pollut. 27:391-401. [ Links ]
9. CHEN, S-K; CA EDWARDS & S SUBLER. 2001. Effects of the fungicides benomyl, captan and chlorothalonil on soil microbial activity and nitrogen dynamics in laboratory incubations. Soil Biol. Biochem. 33:1971-1980. [ Links ]
10. DESCALZO, RC; ZK PUNJA; CA LÉVESQUE & JE RAHE. 1996. Assessment of host specificity among different species of glyphosate synergistic Phytium. Micol. Res. 100:1445-1453. [ Links ]
11. DESCALZO, RC; ZK PUNJA; CA LÉVESQUE & JE RAHE. 1998. Glyphosate treatment of bean seedlings causes short-term increases in Pythium populations and damping off potential in soils. Appl. Soil Ecol. 8:25-33. [ Links ]
12. DUNCAN, DR & JD PAXTON. 1981. Trifluralin enhancement of Phytophthora root rot of soybean. Plant Dis. 65:435-436. [ Links ]
13. FERREIRA, EA; JB SANTOS; AA SILVA; L VARGAS & MR REIS. 2006. Glyphosate application for Italian ryegrass biotype control and impact on soil microbiota. Planta Dañina 24:573-578. [ Links ]
14. GIANFREDA, L; F SANNINO & A VIOLANE. 1995. Pesticida effects on the activity of free, inmobilized and soil invertase. Soil Biol. Biochem. 27:1201-1208. [ Links ]
15. GIMSING, AL; OK BORGGAARD; OS JACOBSEN; J AAMAND & J. SORENSEN. 2004. Chemical and microbiological soil characteristics controlling glyphosate mineralization in Danish surface soils. Appl. Soil Ecol. 27:233-242. [ Links ]
16. GÓMEZ, E; L FERRERAS; L LOVOTTI & E FERNÁNDEZ. 2009. Impact of glyphosate application on microbial biomass and metabolic activity in a Vertic Argiudol from Argentina. Eur. J. Soil Biol. 45:163-167. [ Links ]
17. GONZÁLEZ-TORRALVA, F; H CRUZ-HIPÓLITO; F BASTIDA; N MÜLLEDER; RJ SMEDA; ET AL. 2010. Differential susceptibility to glyphosate among the Conyza weed species in Spain. J. Agric. Food Chem. 58:4361-4366. [ Links ]
18. HANEY, RL; SA SENSEMAN & FM HONS. 2002. Effect of Roundup Ultra on microbial activity and biomass from selected soils. J. Environ. Qual. 31:730-735. [ Links ]
19. HANEY, RL; SA SENSEMAN; FM HONS & DA ZUBERER. 2000. Effect of glyphosate on soil microbial activity and biomass. Weed Sci. 48:89-93. [ Links ]
20. HEINONEN-TANSKI, H. 1989. The effect of temperature and liming on the degradation of glyphosate in two arctic forest soils. Soil Biol. Biochem. 21:313-317. [ Links ]
21. HOGBERG, MN. 2006. Discrepancies between ergosterol and the phospholipid fatty acid 18,2ω6,9 as biomarkers for fungi in boreal forest soils. Soil Biol. Biochem. 38:3431-3435. [ Links ]
22. JAWORSKI, EG. 1972. Mode of action of n-phosphonomethylglycine:Inhibition of aromatic amino acid biosynthesis. J. Agr. Food Chem. 20:1195-1205. [ Links ]
23. JENKINSON, DS & DS POWLSON. 1976. The effects of biocidal treatments on metabolism in soil-V. A method for measuring soil biomass. Soil Biol. Biochem. 8:209-213. [ Links ]
24. JOHAL, GS & JE RAHE. 1984. Effect of soilborne plant-pathogenic fungi on the herbicidal action of glyphosate on bean seedlings. Phytopathology 74:950-955. [ Links ]
25. KAWATE, MK; AG COLWELL; AG OGG & JM KRAFT. 1997. Effect of glyphosate-treated henbit (Lamium amplexicaule) and downy brome (Bromus tectorum) on Fusarium solani f. sp. Pisi and Pythium ultimum. Weed Sci. 45:739-743. [ Links ]
26. KUKLINSKY-SOBRAL, J; WL ARAÚJO; R MENDES; AA PIZZIRANI-KLEINER & JL AZEVEDO. 2005. Isolation and characterization of endophytic bacteria from soybean (Glycine max) grown in soil treated with glyphosate herbicide. Plant Soil 273:91-99. [ Links ]
27. LARKIN, RP. 2003. Characterization of soil microbial communities under different potato cropping systems by microbial population dynamics, substrate utilization, and fatty acid profiles. Soil Biol. Biochem. 35:1451-1466. [ Links ]
28. LECKIE, SE. 2005. Methods of microbial community profiling and their application to forest soils. For. Ecol. Manage. 220:88-106. [ Links ]
29. LÉVESQUE, CA; JE RAHE & DM EAVES. 1993. Fungal colonization of glyphosate-treated seedlings using a new root plating technique. Mycol. Res. 97:299-306. [ Links ]
30. LÉVESQUE, CA & JE RAHE. 1992. Herbicide interactions with fungal root pathogens, with special reference to glyphosate. Annu. Rev. Phytopathol. 30:579-602. [ Links ]
31. MERILES, JM; S VARGAS GIL; RJ HARO; GJ MARCH & CA GUZMÁN. 2006. Glyphosate and previous crop residue effect on deleterious and beneficial soil-borne fungi from a peanut-corn-soybean rotations. J. Phytopathol. 154:309-316. [ Links ]
32. MIÑAMBRES, GG; MY CONLES; EI LUCINI; RA VERDENELLI, JM MERILES; ET AL. 2010. Application of thymol and iprodione to control garlic white rot (Sclerotium cepivorum) and its effect on soil microbial communities. World J. Microbiol. Biotech. 26:161-170. [ Links ]
33. MONTGOMERY, HJ; CM MONREAL; JC YOUNG & KA SEIFERT. 2000. Determination of soil fungal biomass from soil ergosterol analyses. Soil Biol. Biochem. 32:1207-1217. [ Links ]
34. RATCLIFF, AW; MD BUSSE & CJ SHESTAK. 2006. Changes in microbial community structure following herbicide (glyphosate) additions to forest soils. Appl. Soil Ecol. 34:114-124. [ Links ]
35. ROSLYCKY, EB. 1982. Glyphosate and the response of the soil microbiota. Soil Biol. Biochem. 14:87-92. [ Links ]
36. SOMMERVILLE, L. 1987. Perspective on side effect testing. Pp 5-13 in: Sommerville L & MP Greaves (eds.). Pesticide effects on soil microbiota. Taylor and Francis. London. [ Links ]
37. VAN EERD, LL; RE HOAGLAND; RM ZABLOTOWICZ & JC HALL. 2003. Pesticide metabolism in plants and microorganisms. Weed Sci. 51:472-495. [ Links ]
38. WARDLE, DA & D PARKINSON. 1990. Effects of three herbicides on soil microbial activity and biomass. Plant Soil 122:21-28. [ Links ]
39. WEAVER, MA; LJ KRUTZ; RM ZABLOTOWICZ & KN REDDY. 2007. Effects of glyphosate on soil microbial communities and its mineralization in a Mississipi soil. Pest Manag. Sci. 63:388-393. [ Links ]
40. WILCOX, WF. 1996. Influence of dinitroanaline herbicides on growth, sporulation, and infectivety of four Phytophthora spp. pathogenic to deciduous fruit trees. Phytopathology 86:906-913. [ Links ]
41. ZABALOY, MC; JL GARLAND & MA GÓMEZ. 2008. An integrated approach to evaluate the impacts of the herbicides glyphosate, 2-4-D and metsulfuron-methyl on soil microbial communities in the Pampas region, Argentina. Appl. Soil Ecol. 40:1-12. [ Links ]














