Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral vol.23 no.2 Córdoba ago. 2013
ARTÍCULO ORIGINAL
Caracterización funcional y estructural del biofilm epipélico en relación al aumento de la urbanización en un arroyo de la Llanura Pampeana (Argentina)
María V. Sierra1,*; Nora Gómez1; Agostina V. Marano2 & Miguel A. Di Siervi1
1. Instituto de Limnología "Dr. R.A. Ringuelet", Conicet - Universidad Nacional de La Plata.
2. Instituto de Botánica Spegazzini, Universidad Nacional de La Plata.
* mvsierra@ilpla.edu.ar
Editor Asociado: Fernando Unrein
Recibido: 11 de septiembre de 2012, Fin de arbitraje: 6 de noviembre,
Versión revisada: 5 de marzo de 2013, Aceptado: 21 de marzo.
RESUMEN
El objetivo del presente estudio fue analizar las respuestas estructurales (densidad de organismos, biomasa total, biomasa autotrófica e índice autotrófico) y funcionales (producción primaria neta, respiración, producción primaria bruta y tasa de asimilación) del biofilm epipélico en tres sitios de un arroyo pampeano que presentan diferentes proporciones del uso del suelo expuesto a la urbanización. Los resultados mostraron que el aumento en el porcentaje del uso del suelo destinado a la urbanización fue evidenciado por los cambios en la calidad del agua y por los descriptores funcionales y estructurales del biofilm epipélico. En tal sentido, la calidad del agua disminuyó en los sitios más urbanizados como consecuencia principalmente del incremento de nutrientes. Esto repercutió en la producción primaria neta, la tasa de asimilación y el cociente producción primaria bruta/respiración, reflejando que el biofilm fue marcadamente autotrófico y más eficiente en términos fotosintéticos. Estos cambios en los descriptores metabólicos se condicen con el patrón seguido por la clorofila, que reflejó un cambio en el estado trófico de mesotrófico a eutrófico. Asimismo, la composición específica en aquellos sitios mostró cambios a favor del incremento de organismos tolerantes a la polución.
Palabras clave: Epipelon; Calidad del agua; Uso del suelo
ABSTRACT
Functional and structural characteristics of the epipelic biofilms in a lowland Pampean stream (Argentina) exposed to the increase of the urbanization. The purpose of the present study was to analyze the structural (organisms density, total biomass, autotrophic biomass and autotrophic index) and functional (net primary production, respiration, gross primary production and assimilation rate) responses of the epipelic biofilm at three sites of a Pampean stream presenting different proportions of land use exposed to urbanization. The results showed that the increase in the percentage of land use destined to urbanization was evidenced by the changes in the water quality and by the functional and structural descriptors of the epipelic biofilm. In this regard, the quality of water diminished at the most urbanized sites mainly as a consequence of the nutrient increase. This affected the net primary production, the assimilation rate and the gross primary production/ respiration ratio, reflecting that the biofilm was markedly autotrophic and more efficient photosynthetically. These changes in the metabolic descriptors are coincident with the pattern followed by the chlorophyll which reflected a change in the trophic state from mesotrophic to eutrophic. Likewise, the specific composition in those sites showed changes favoring the increase of organisms tolerant to pollution.
Keywords: Epipelon; Water quality; Land use
INTRODUCCIÓN
Los ecosistemas fluviales son sistemas dinámicos y complejos que canalizan, intercambian, transforman y disipan materia y energía, y que modulan su entorno de manera activa (Elosegi & Butturini 2009). Estos ecosistemas pueden ser afectados tanto por perturbaciones naturales (e.g., sequías, crecidas, aludes, erupciones), respondiendo con un dinamismo marcado, como por perturbaciones de origen humano; algunas de estas perturbaciones son permanentes y acaban afectando de forma irreversible a los ecosistemas fluviales (Sabater et al. 2009). Los diferentes usos del suelo (e.g., agricultura, ganadería, el desarrollo urbano e industrial) modifican las características físicas y químicas del agua, e influyen de manera marcada sobre la biota y sobre el funcionamiento de los sistemas fluviales (Pozo & Elosegui 2009). Los distintos tipos de sustratos existentes en los sistemas acuáticos son colonizados por organismos autótrofos y heterótrofos, los que se hallan embebidos en una matriz de polisacáridos formando el biofilm. Este complejo biológico cumple un rol muy importante en el funcionamiento de los ecosistemas fluviales ya que cada uno de sus componentes interviene en la transferencia de energía y en el mecanismo de descomposición y mineralización de la materia orgánica; de esta manera contribuyen con el proceso de autodepuración de los sistemas acuáticos (Sabater et al. 2007). En los sistemas fluviales de la Llanura Pampeana, el biofilm epipélico alcanza gran representatividad debido a que el lecho de los mismos está constituido principalmente por fracciones finas de sedimento (limos y arcillas); allí encuentran un sustrato favorable para su desarrollo (Gómez & Licursi 2001). Estudios llevados a cabo en la Llanura Pampeana para determinar el estado ecológico de cursos de agua han revelado el impacto antropogénico sobre las respuestas estructurales del fitoplancton, de los ensambles de macroinvertebrados y de diatomeas bentónicas (Bauer et al. 2002; Gómez et al. 2011). También existen antecedentes a nivel local en relación a los efectos de la degradación del hábitat sobre las respuestas funcionales y estructurales del biofilm epipélico (Sierra & Gómez 2007, 2010; Cortelezzi et al. 2012). Sin embargo, no hay estudios que hayan integrado los distintos componentes de dicha microcomunidad (bacterias, hongos, algas y microinvertebrados) para evaluar las consecuencias del avance de la urbanización. En tal sentido hipotetizamos que los cambios en la calidad del agua, producto del avance de la urbanización, estimulan el aumento de la densidad de microorganismos, de la biomasa, de la proporción de taxa tolerantes a la contaminación y favorecen el predominio de los procesos autotróficos. Los resultados obtenidos pretenden generar información sobre el impacto que produce este tipo de uso sobre uno de los primeros niveles tróficos de un pequeño arroyo de la Llanura Pampeana.
MATERIALES Y MÉTODOS
Área de estudio y usos del suelo
La Llanura Pampeana es recorrida por arroyos y ríos que se destacan por la baja velocidad de la corriente debido a la escasa pendiente del terreno circundante, por los altos niveles de sólidos en suspensión, por su reducido ritron y por contener sedimentos limosos en su lecho. La ausencia de bosque ribereño es otra característica distintiva (Rodrigues Capitulo et al. 2010) que convierte a la producción primaria autóctona (algas e hidrófitas) en la principal fuente de energía de tales sistemas fluviales (Pozo et al. 2009). Para verificar la hipótesis planteada se seleccionaron tres sitios de muestreo en el Aº Martín. El Aº Martín es un curso de agua de segundo orden, localizado en cercanías de la ciudad de La Plata, cuya longitud es de 14.5 km y desemboca en el estuario del Río de la Plata. Los puntos de muestreo fueron situados en áreas influenciadas por diferentes usos del suelo: el sitio 1 (M1; 34º54'54.45'' S; 58º4'41.59'' O) localizado en una área de uso principalmente hortícola. El sitio 2 (M2; 34º52'32.13'' S; 58º4'10.75'' O) y el 3 (M3; 34º51'31.35'' S; 58º3'47.60'' O) están afectados principalmente por el uso del suelo urbano. Aguas abajo del sitio 1 se han llevado a cabo dragados y canalizaciones que modificaron el cauce del arroyo. Para cuantificar el uso del suelo en la cuenca del arroyo Martín se utilizó el sistema de información geográfico (Quantum GIS 1.6) y se empleó un mapa de uso del suelo y uno de elevación para delimitar la cuenca (1:50000, Hurtado et al. 2006). La escala que se empleó incluyó un segmento de 2 km aguas arriba de cada sitio y un ancho de banda a cada lado de 0.25 km. Esta escala se seleccionó considerando que las escalas locales (menores a 2 km) son adecuadas para evaluar cambios en la integridad biótica de arroyos (Allan et al. 1997).
Diseño de muestreo
Para el análisis de los descriptores del biofilm se emplearon sustratos artificiales (unidades muestrales) que consistieron en recipientes de plástico (135 cm2 de superficie; Figura 1a). Se dispusieron 24 unidades muestrales en cada sitio; las unidades muestrales permanecieron allí durante cuatro semanas para la colonización y desarrollo del biofilm (Sierra & Gómez 2010; Figura 1b).Transcurrido dicho período se procedió a la medición de las variables fisicoquímicas y a la obtención de los descriptores biológicos, lo cual se llevó a cabo de forma estacional a lo largo de un ciclo anual (2005-2006). Estas mediciones se realizaron bajo condiciones climáticas e hidrológicas similares y en días consecutivos, comenzando por el sitio M1.

Figura 1. a) Sustrato artificial situado en el sitio de muestreo. b) Sustrato artificial después del período de colonización. c) Cámaras de acrílico empleadas para la medición de las variables metabólicas del epipelon.
Figure 1. a) Artificial substratum at the sampling site. b) Artificial substratum after the colonization period. c) Acrylic cameras employed for the measurement of the metabolic variables of the epipelon.
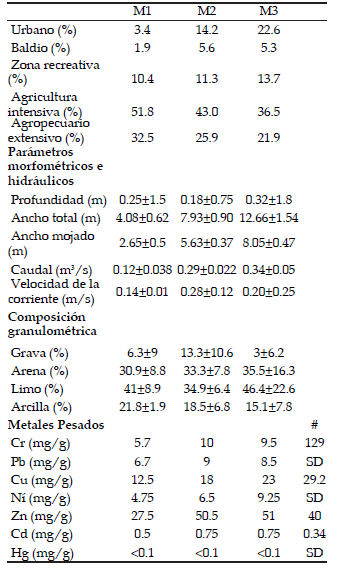
Caracterización del hábitat y calidad del agua Para caracterizar el hábitat, en cada sitio se delimitó un tramo de 50 m y allí se midieron parámetros morfométricos tales como ancho, profundidad, velocidad de la corriente y caudal. Para el análisis de la comunidad de macrófitas se llevó a cabo un mapeo y se registraron las especies presentes en el tramo delimitado (Feijoó & Menéndez 2009) e identificaron las mismas a través de Cabrera & Zardini (1993). También se determinó la cobertura vegetal (%) y se llevó a cabo una clasificación de los modos de vida (flotante, emergente y sumergida). Por otro lado, se colectaron muestras de sedimento en los tres sitios de muestreo para el análisis de la granulometría, y de las concentraciones de Cr, Pb, Cu, Ni, Zn, Cd, Fe y Hg. El análisis granulométrico del sustrato se realizó según Folk (1974), quien clasificó al sedimento en las siguientes clases: grava (>500 µm), arena (62.5-500 µm), limo (3.9- 62.5 µm) y arcilla (<3.9 µm). Las concentraciones de los metales fueron determinadas por medio de espectrofotometría de absorción atómica de acuerdo a EPA SW (846) (1986) y APHA (1998). La concentración de estos metales se comparó con la concentración natural promedio para rocas sedimentarias y suelo (Frink 1996) con la finalidad de establecer cuanto se desviaron los valores obtenidos de los esperados en la naturaleza.
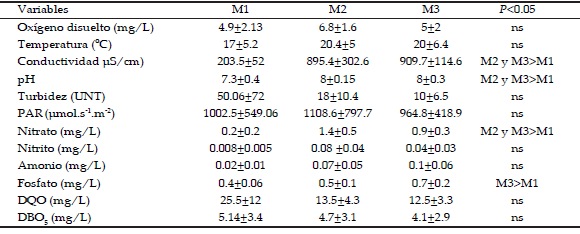
En cada ocasión de muestreo se midieron las siguientes variables fisicoquímicas: oxígeno disuelto (YSI 52), conductividad (Lutron CD-4303), temperatura y pH (Hanna HI 8633). También se recolectaron muestras de agua para el análisis de nutrientes y de materia orgánica (DBO5 y DQO), las cuales fueron transportadas en frío al laboratorio para su procesamiento. Para la determinación de las concentraciones de fosfato, nitrito y nitrógeno amoniacal se empleó el método colorimétrico (Tabatabai 1974; Mackereth et al. 1978). La demanda bioquímica de oxígeno (DBO5) se determinó luego de cinco días de incubación a 20 ºC, mientras que la demanda química de oxígeno (DQO) se realizó a través de la oxidación con dicromato de potasio en medio ácido (APHA 1998).
Parámetros funcionales del epipelon
La medición de las variables metabólicas del biofilm epipélico se llevó a cabo a través de cámaras de incubación de acrílico (largo 35 cm, ancho 28.5 cm, alto 10 cm, vol. 6 L). La producción primaria neta (PPN) y la respiración (R) fueron obtenidas a partir de la medición del oxígeno disuelto con un oxímetro (ISY 52). Se empleó una cámara como control (con agua del arroyo) y tres cámaras con dos unidades muestrales cada una (Figura 1c). Para determinar el consumo de oxígeno del biofilm, las muestras fueron incubadas entre 60 y 90 minutos en oscuridad (cubriéndose con un nylon negro) y luego, para determinar la producción de oxígeno, fueron expuestas a la luz solar. Durante este período se registró la radiación fotosintéticamente activa (PAR, Li-Cor 250). En cada sitio se realizaron dos mediciones de metabolismo, la primera fue entre las 9:00 y las 12:00 h y la segunda entre las 13:00 y 16:00 h. En la cámara usada como control se colocaron dos unidades muestrales, sin colonizar, para mantener el mismo volumen de agua que en las otras cámaras. El objetivo de esto fue corregir los cambios en la concentración de oxígeno debido a la actividad metabólica del plancton (Sierra 2009). El cálculo de PPN se obtuvo a partir de las variaciones de la concentración del oxígeno disuelto en las cámaras transparentes, mientras que R se obtuvo a partir de las variaciones de la concentración del oxígeno disuelto en las cámaras oscurecidas (Guasch & Sabater 1995; Fleituch 1998). Para el cálculo de ambas variables se empleó la ecuación modificada de Fellow et al. (2006):
Donde:
[ODico] = concentración de oxígeno inicial en cámara oscura (mg O2/L)
[ODfco] = concentración de oxígeno final en cámara oscura (mg O2/L)
[ODicco] = concentración de oxígeno inicial en cámara control oscura (mg O2/L)
[ODfcco] = concentración de oxígeno final en cámara control oscura (mg O2/L)
[ODiccl] = concentración de oxígeno inicial en cámara clara (mg O2/L)
[ODfccl] = concentración de oxígeno final en cámara clara (mg O2/L)
[ODicccl] = concentración de oxígeno inicial en cámara control clara (mg O2/L)
[ODfcccl] = concentración de oxígeno final en cámara control clara (mg O2/L)

vol. cámara = volumen de la cámara (L)
tpo. Incub. = tiempo de incubación (h)
sup. sust = superficie del sustrato (cm2)
Una vez obtenidos los valores de PPN y de R se calcularon otros parámetros metabólicos del epipelon: la producción primaria bruta (PPB), la tasa de asimilación (TA) y el cociente producción primaria bruta/respiración (PPB/R). La PPB resulta de sumar los valores de PPN y R, mientras que la TA es una medida de la proporción relativa de la biomasa del biofilm que es fotosintéticamente activa y se obtiene al dividir PPN por la clorofila 'a' (Crossey & La Point 1988). El cociente PPB/R se obtiene al dividir PPB por R (Vannote et al. 1980) y permite clasificar los sistemas acuáticos como autotróficos (PPB/R>1) o heterotróficos (PPB/R<1).
Parámetros estructurales del epipelon
Al final de cada experiencia de metabolismo se colectaron por pipeteo, alícuotas de 5 ml del biofilm epipélico (1 cm2) desarrollado sobre las unidades muestrales. Dos repeticiones, constituidas cada una de ellas de dos alícuotas del material colectado, fueron destinadas a la determinación de clorofila 'a' (Cl 'a') y a la obtención del peso seco libre de cenizas (PSLC). Para el análisis de Cl 'a', las muestreas fueron filtradas a través de filtros de fibra de vidrio (Whatman GF/C) que fueron inmersos en acetona 90% y conservados en oscuridad por 24 horas a 4 ºC (APHA 1998). El extracto fue leído con un espectrofotómetro y las concentraciones de Cl 'a' fueron obtenidas de acuerdo a Steinman & Lamberti (1996). Para la obtención del PSLC, el material fue dispuesto en crisoles que se mantuvieron en estufa por 24 horas a 60 ºC para determinar el peso seco. Una vez transcurrido dicho período fueron pesados y dispuestos en una mufla por 4 horas a 550 ºC. El PSLC fue calculado como la diferencia entre el peso seco y el peso obtenido de la incineración en mufla (Bourassa & Cattaneo 1998). A partir de la clorofila y del PSLC se calculó el índice autotrófico (IA), el cual provee la proporción de biomasa algal en relación a la biomasa total del biofilm y se calcula como el cociente entre el PSLC y la Cl 'a' (Clark et al. 1979). Este índice se emplea como indicador de polución orgánica, ya que valores superiores a 100 indicarían el aumento de la proporción de organismos heterótrofos y/o detritus orgánicos (Lowe & Pan 1996).
Para el análisis cuantitativo del componente autotrófico y de los microinvertebrados (tamaño <1 mm) se colectaron, desde las unidades muestrales, 10 alícuotas de 5 ml cada una, que conformaron cada repetición (dos en total). Las mismas fueron fijadas con formaldehído (4%) y fueron observadas mediante una cámara de Sedgwick-Rafter en un microscopio óptico Olympus BX50, con una magnificación de 600X. En el caso de las diatomeas se realizaron preparados fijos siguiendo la metodología de Gómez & Licursi (2001). La identificación de los taxa de algas y microinvertebrados se realizó a través de bibliografía específica para cada grupo taxonómico. Las muestreas destinadas al análisis cuantitativo de bacterias, constituidas de dos alícuotas de 5 ml cada una fueron fijadas con formaldehído (2%) y teñidas siguiendo el procedimiento de coloración para epifluorescencia con naranja de acridina (Hobbie et al. 1977; Di Siervi 2002). Cada muestra fue diluida hasta alcanzar una concentración de 20 a 30 bacterias por campo, concentración recomendada para facilitar la cuantificación bacteriana (Di Siervi 2002) y fue filtrada a través de filtros de policarbonato negros (Nuclepore de 0.2 µm de tamaño de poro). La cuantificación se realizó empleando un microscopio con equipo de epifluorescencia (Carl Zeiss, Standard 14) observándose campos al azar hasta alcanzar un total de 300 a 400 bacterias por filtro.
Para la caracterización de la comunidad bentónica de organismos zoospóricos (phyla Blastocladiomycota y Chytridiomycota del Reino Fungi y Oomycota del Reino Straminipila) se colectaron, desde las unidades muestrales, 5 alícuotas de 5 ml cada una, que conformaron cada repetición (dos en total) y fueron procesadas dentro de las 12 a 24 horas posteriores a su obtención. Las mismas fueron homogeneizadas en laboratorio, se realizaron diluciones 1x10-1 con agua destilada estéril y se las fraccionó en submuestras de 30 ml. Las submuestras, procesadas de acuerdo con la "técnica de cebado" (Sparrow 1960; Stevens 1974), fueron colocadas en cápsulas de Petri con cinco unidades de sustrato (5 mm diám.) de diferente composición: celulósicos (chalas de Zea mays y semillas de Sesamum indicum) y queratínicos (mudas de serpiente). Se realizaron triplicados por cada tipo de sustrato y sitio de muestreo, y se analizó un total de 81 cápsulas de Petri (unidades muestrales) y 405 unidades de sustrato. Las cápsulas fueron incubadas a temperatura ambiente (20-25 ºC), y se realizaron observaciones a los 4, 7, 10, 14, 21, 30 y 42 días mediante un microscopio óptico Olympus BX 40. Las identificaciones taxonómicas se realizaron a partir del reconocimiento de las estructuras reproductivas asexuales y sexuales según los trabajos de Coker (1923); Sparrow (1960); Seymour (1970); Karling (1977); Fuller & Jaworski (1987); Johnson et al. (2002) y Rocha & Pires-Zottarelli (2002). Se calculó la riqueza (S), frecuencia (F) y abundancia (A) de la comunidad en el arroyo y en cada uno de los sitios de muestreo de acuerdo con Marano et al. (2008).
Análisis estadístico
Para analizar la correlación entre las variables físico-químicas y el porcentaje de usos del suelo se utilizó el índice Tau de Kendall (Zar 1996). Para obtener el ordenamiento de los sitios de muestreo en base a las variables físico-químicas se llevó a cabo un análisis de componentes principales (ACP). Con el fin de determinar cuáles de estas variables diferenciaron significativamente a un sitio de otro se llevó a cabo un análisis de la varianza en rangos. También se realizó un análisis de la varianza de dos vías (ANOVA) con las variables biológicas para determinar cuáles difirieron significativamente entre los sitios de muestreo y entre las estaciones del año. Aquellas variables que no se ajustaron a una distribución normal fueron transformadas: Cl 'a', PPN, PPB y TA a través de log10(x+1) y R y PSLC a través de raíz cuadrada. La frecuencia y abundancia de organismos zoospóricos fue comparada mediante el test de Kruskall-Wallis, previo análisis de la normalidad de los datos mediante el test de Shapiro-Wilk (datos no normales P<0.05).
RESULTADOS
Uso del suelo, caracterización del hábitat y calidad del agua
A partir del análisis del uso del suelo se advirtió que el área de uso urbano en el sitio M1 fue cuatro veces menor que en M2 y siete veces menor que en M3 (Tabla 1). Los tres sitios muestreados tuvieron una profundidad promedio menor a 50 cm y la velocidad de la corriente fluctuó entre 0.14 y 0.28 m/s y no varió significativamente entre los sitios (Tabla 1). A partir del análisis granulométrico se determinó que en M2 la proporción de grava fue entre dos y cuatro veces mayor que la proporción en M1 y M3, respectivamente. Los metales pesados que excedieron la concentración natural promedio para rocas sedimentarias y suelo fueron el Zn en M2 y M3 y el Cd en los tres sitios de muestreo.
Tabla 1. Proporción de usos del suelo, parámetros morfométricos e hidráulicos, composición granulométrica y concentración de metales pesados registrados en cada sitio de muestreo (sitio 1: M1; sitio 2: M2; sitio 3: M3; promedio±desvío estándar; SD: sin dato; #: concentración natural promedio para rocas sedimentarias y suelos, Frink 1996).
Table 1. Proportion of land use, morphometric and hydraulic parameters, granulometric composition and concentration of heavy metals recorded at each sampling site (mean values±standard deviation; site 1: M1; site 2: M2; site 3: M3; N/A: data not available; #: average natural concentration for the sedimentary rocks and soils, Frink 1996).
En relación a las hidrófitas, M2 presentó la mayor riqueza y la menor cobertura vegetal, en tanto en M3 se observó la mayor cobertura vegetal, representada principalmente por las hidrófitas arraigadas, cuya especie dominante fue Hydrocleys nymphoides. Por otro lado, M1 presentó la mayor proporción de emergentes, donde la especie dominante fue Eleocharis palustris (Tabla 2).
Tabla 2. Cobertura vegetal de hidrófitas y listado de las especies halladas en los sitios de muestreo (sitio 1: M1; sitio 2: M2; sitio 3: M3; *: ≤10 %, **: >10-40 %, ***: >40 %).
Table 2. Hydrophyte vegetal cover and list of the species found at the sampling sites.

Los dos primeros factores del ACP acumularon el 72% de la varianza total (Figura 2 a y b), mostrando que las variables con mayor peso (autovectores>0.70) en el factor 1 fueron los nutrientes (+), pH (+) y la conductividad (+) mientras que en el factor 2 fue el oxígeno disuelto (+). El primer factor, que explicó 46% de la varianza, separó claramente los sitios 2 y 3 del sitio 1. De acuerdo a estos resultados, las variables relacionadas con la calidad del agua explicaron un mayor porcentaje de la varianza en comparación con el resto de las variables. Complementando los resultados arrojados por el ACP, el ANOVA en rangos mostró que la conductividad, pH y NO3 - fueron significativamente mayores (P<0.05) en M2 y M3 con respecto a M1, mientras que el PO4 -3 fue significativamente mayor (P<0.05) en M3 con respecto a M1 (Tabla 3).

Figura 2. a) Representación de los dos primeros factores del ACP en base a las variables físico-químicas de los sitios muestreados en las cuatro estaciones del año. b) Ubicación de los casos en el plano definido por los dos primeros factores (sitio 1: M1; sitio 2: M2; sitio 3: M3; invierno: inv; otoño: ot; primavera: prim; verano: ver).
Figure 2. a) Representation of the first two factors of the principal component analysis based on the physicochemical variables of the sampling sites in the four seasons of the year. b) Location of the cases on the plane defined by the first two first.
Tabla 3. Características físico-químicas de los sitios de muestreo (promedio±desvío estándar; sitio 1: M1; sitio 2: M2; sitio 3: M3; ns: no significativo).
Tabla 3. Physicochemical characteristics of the sampling sites (mean values±standard deviation).
Parámetros funcionales
La PPN, la R y la TA no mostraron diferencias significativas entre los sitios de muestreo (P>0.05). La PPB fue significativamente mayor en M3 con relación a M1 (P<0.05) (Figura 3). El valor promedio del cociente PPB/R fue <1 en M1, mientras que en M2 y M3 fue >1. En la escala temporal, sólo la respiración fue significativamente diferente (P<0.05), y alcanzó los valores mayores en verano.

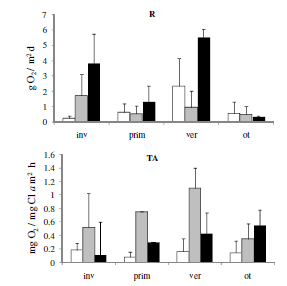
Figura 3. Promedio y desvío estándar de los descriptores metabólicos del epipelon analizados en cada sitio de muestreo a lo largo de las estaciones del año (sitio1: M1; sitio 2: M2; sitio 3: M3; invierno: inv; otoño: ot; primavera: prim; verano: ver; producción primaria neta: PPN; respiración: R; tasa de asimilación: TA; producción primaria bruta: PPB).
Figure 3. Average and standard deviation of the metabolic descriptors of the epipelon analyzed at each sampling site among seasons.
Parámetros estructurales
Las cianobacterias fueron más abundantes en M2 alcanzando la mayor densidad en primavera y otoño, donde las especies dominantes a lo largo del periodo muestreado fueron Oscillatoria subbrevis, Merismopedia glauca y Phormidium tergestinum. Por otro lado, las diatomeas fueron más abundantes en M3 con un pico de abundancia en otoño, siendo Diadesmis confervacea, Navicula cryptocephala, Nitzschia umbonata y N. palea las especies dominantes a lo largo del periodo muestreado.
Los nematodes alcanzaron su mayor densidad en M1 y también fueron más abundantes en otoño, en tanto los ciliados, representados principalmente por Paramecium sp. y las bacterias lo fueron en M3, coincidiendo que la densidad de ambos grupos fue mayor en otoño (Tabla 4). En relación a los organismos zoospóricos fueron identificados un total de 13 taxa, seis correspondientes al Reino Fungi (un Blastocladiomycota y cinco Chytridiomycota) y siete pertenecientes al Reino Straminipila (Oomycota) (Tabla 5). De las 81 unidades muestrales empleadas fueron colonizadas 47 (Frecuencia: 58 %) y de las 405 unidades de sustrato utilizadas fueron colonizadas 203 (Abundancia: 50.12%). A nivel temporal se registraron los mayores valores de frecuencia y abundancia en primavera y otoño. En cuanto a la riqueza (S), fue similar entre los sitios de muestreo, encontrándose 10, 11 y 9 especies en M1, M2 y M3, respectivamente. Algunas especies, tales como Catenophlyctis variabilis, Pythium sp. y Rhizophlyctis rosea, fueron encontrados en los tres sitios de muestreo pero presentaron diferentes valores de frecuencia y abundancia. Por otro lado, hubo especies que fueron exclusivas de alguno de los sitios de muestreo, así Chytriomyces hyalinus y Nowakowskiella hemiphaerosphora fueron exclusivos de M1, Dictyuchus monosporus de M2, en tanto Brevilegnia sp. y Nowakowskiella sp. fueron registrados sólo en M3. A pesar de las tendencias observadas en las variables estructurales descriptas precedentemente, el análisis estadístico no reflejó diferencias significativas a escala temporal y espacial (P>0.05).
Tabla 4. Densidad promedio (±desvío estándar) de los grupos de organismos en los sitios muestreados (sitio 1: M1; sitio 2: M2; sitio 3: M3).
Table 4. Average density (±standard deviation) of the groups of organisms at the sampled sites.

Tabla 5. Organismos zoospóricos (Fungi y Straminipila) registrados en los sitios de muestreo [sitio 1: M1; sitio 2: M2; sitio 3: M3; frecuencia porcentual: F (%); abundancia porcentual: A (%)].
Table 5. Zoosporic organisms (Fungi and Straminipila) recorded at each sampling site.

El contenido de Cl 'a' en el epipelon y el PSLC fueron significativamente mayores (P<0.05) en M3 con respecto a M1, en cambio el IA no mostró diferencias a escala espacial (Figura 4). En la escala temporal, mientras el PSLC no mostró diferencias significativas (P>0.05), la Cl 'a' y el IA fueron significativamente mayores durante el verano (P<0.05).


Figura 4. Variación de los descriptores estructurales del epipelon analizados en cada sitio de muestreo a lo largo de las estaciones del año (sitio1: M1; sitio 2: M2; sitio 3: M3; M3; invierno: inv; otoño: ot; primavera: prim; verano: ver; clorofila 'a': Cl 'a'; peso seco libre de cenizas: PSLC; índice autotrófico: IA).
Figure 4. Variation of the structural descriptors of the epipelon analyzed at each sampling site among seasons.
DISCUSION
Los efectos de la urbanización en la cuenca del arroyo Martín, quedaron reflejados principalmente por los cambios en la calidad del agua en los sitios con mayor proporción de uso urbano (sitios M2 y M3), que influenciaron las respuestas del biofilm epipélico. El ingreso de poluentes a través de los efluentes domésticos, la descarga del drenaje pluvial, como así también los provenientes de la escorrentía urbana pueden reconocerse como las principales fuentes de contaminación relacionadas con la actividad urbana en la cuenca de este arroyo. Entre los principales cambios relacionados con la calidad del agua se pudo advertir el incremento en la concentración de nutrientes, particularmente fosfato y nitrato. En relación a la concentración de metales pesados determinados en el sedimento de este arroyo, sólo el Zn y el Cd superaron, ligeramente, los niveles naturales para rocas sedimentarias. Esto podría ser atribuido a los desechos que se generan en las zonas urbanas, por ejemplo a través de los residuos del tránsito vehicular, que suelen llegar a los cursos de agua a través de la escorrentía (Cuffney et al. 2000; Paul& Meyer 2001). Es reconocido que el biofilm microbiano reacciona al enriquecimiento con materia orgánica y nutrientes, o a la exposición a sustancias tóxicas, cambiando su composición, usualmente a favor de los taxa más tolerantes (Sabater et al. 2007; Hill et al. 2000). En el presente estudio se observó que si bien los cambios de los grandes grupos taxonómicos no revelaron diferencias significativas entre los sitios, la composición específica en aquellos lugares influenciados por una mayor urbanización mostró cambios a favor del incremento de organismos tolerantes a la polución. En tal sentido, se incrementó la densidad de especies tales como N. palea, N. umbonata y N. cryptocephala, las cuales han sido reportadas como abundantes en arroyos pampeanos con mala calidad del agua, en donde la concentración de fósforo reactivo soluble superó los 0.5 mg/L (Gómez & Licursi 2001; Gómez et al. 2011). A su vez, el enriquecimiento con nutrientes también repercute sobre la biomasa algal y la bacteriana, reconociéndose generalmente que el desarrollo de los productores primarios es uno de los factores más influyente en el incremento de la densidad de bacterias (Rier & Stevenson 2002). En nuestro caso, el sitio M3 fue el que reunió la mayor concentración de bacterias y una mayor cobertura de hidrófitas, el cual es un sustrato favorable para ser degradado por ellas, contribuyendo así a su aumento poblacional y al reciclado de nutrientes en el arroyo. Al igual que las bacterias, los organismos zoospóricos también desempeñan un papel importante en la descomposición de detritos, siendo la disponibilidad de nutrientes un factor estructurador de las comunidades fúngicas halladas en los cursos de agua (Tank & Dodds 2003). Asimismo, algunos trabajos han indicado que las variables ambientales y/o la naturaleza y disponibilidad de sustratos para la descomposición, pueden influenciar la composición de especies, frecuencia y abundancia de las comunidades de organismos zoospóricos presentes en un cuerpo de agua (Park et al. 1978; El-Hissy et al. 2001; Marano et al. 2008, 2011a, b). Otros estudios han reportado que en la mayoría de los ambientes, pocas especies son frecuentes y abundantes (por ejemplo Ch. hyalinus en ambientes dulceacuícolas y R. rosea en suelos agrícolas) (Letcher & Powell 2001; Letcher et al. 2004). En concordancia con esto, nosotros registramos sólo tres taxa (C. variabilis, Pythium sp. y R. rosea) que exhibieron altos valores de frecuencia y abundancia, encontrándose en los tres sitios muestreados. A su vez, varias de las especies halladas en el A° Martín han sido halladas en otros arroyos de la provincia de Buenos Aires: R. rosea (arroyos Don Carlos, Rodríguez y Las Cañas), Ch. hyalinus, C. variabilis, D. monosporus, N. hemisphaerosphora y N. elegans (A° Las Cañas) (Marano& Steciow 2006; Marano et al. 2011a). Muchas de ellas son capaces de utilizar compuestos inorgánicos tales como sulfato, nitrato e iones amonio directamente del agua (Sparrow 1968; Schoenlein-Crusius et al. 1998) como es el caso de N. elegans (Goldstein 1961).
Otros factores ambientales que regulan las respuestas del biofilm microbiano son los factores físicos tales como la velocidad de la corriente, la turbidez y la disponibilidad de luz (Sigee 2005; Stevenson 2005), los cuales pueden ser modificados por el efecto de la urbanización en las cuencas (Cortelezzi et al. 2012). En el A° Martín, si bien se han realizado obras de canalización para mitigar los efectos de las inundaciones, no se observaron diferencias marcadas en la velocidad de la corriente entre los sitios de muestreo. Este hecho puede deberse a que los muestreos se llevaron a cabo bajo condiciones climáticas e hidrológicas similares, por lo tanto este factor no habría contribuido sustancialmente en las respuestas del biofilm. En relación con la disponibilidad de luz, Giorgi & Malacalza (1994) han reportado que tanto las hidrófitas como los sólidos en suspensión reducen la cantidad de luz que alcanza el lecho de los sistemas acuáticos. Aunque enfatizan que las macrófitas serian el factor más importante que interfiere con la intensidad lumínica, afectando en consecuencia el desarrollo del fitobentos. En nuestro caso, uno de los sitios con mayor proporción de uso urbano (M3) y donde se registró mayor cobertura vegetal, el biofilm alcanzó la mayor biomasa, en correspondencia con una mayor concentración de nutrientes, demostrando que la disponibilidad de luz fue suficiente para el desarrollo del mismo. Como contraparte, en el sitio M1 con un menor impacto de la urbanización y una mejor calidad del agua, dada principalmente por un menor contenido de nutrientes, el biofilm presentó hasta un 50% menos de clorofila que la estimada para el biofilm de M2 y M3. Incluso el IA en M1 fue entre el 40% y el 20% más elevado que en M2 y M3 respectivamente. Estos valores revelan un cambio en el estado trófico del Aº Martín de mesotrófico a eutrófico de acuerdo a lo propuesto por Dodds & Welch (2000) para sistemas fluviales. Asimismo, estos resultados fueron acompañados por una menor producción primaria neta en M1, que resultó entre 10% y 30 % más baja que la registrada en M2 y M3, respectivamente. Por otro lado, en el sitio M2 se registraron los mayores valores de producción primaria neta, tasa de asimilación y del cociente producción primaria neta / respiración, demostrando que en este sitio el biofilm fue marcadamente más autotrófico y fotosintéticamente más eficiente. Si comparamos los resultados del metabolismo hallados en el A° Martín con los obtenidos en otros arroyos pampeanos (Tabla 6) como el Ao Las Flores, con un bajo impacto del uso urbano y con el Ao Don Carlos, con más del 50% del área de la cuenca destinada a la actividad urbana, es posible advertir la influencia de la urbanización sobre la funcionalidad del biofilm microbiano. Al considerar la PPB, la cual integra la PPN y la R, el arroyo Martín quedó posicionado en una situación intermedia con respecto a los otros dos arroyos. Es así que un aumento del 20 % en la superficie ocupada por el uso urbano entre el sitio M1 y M3, se manifestó en un efecto directo sobre la biomasa de los productores primarios. En relación a los cambios estacionales, se advirtió un aumento en la clorofila, en el índice autotrófico y en la respiración durante el verano. Estos resultados difieren de los observado en arroyos menos impactados por la urbanización como es el Ao Las Flores (Giorgi et al. 2004) pero son consistentes con los reportados por Artigas et al. (2013) quienes en una experiencia de fertilización con nutrientes en un arroyo pampeano (Ao La Choza) reconocieron la existencia de una ventana de oportunidades para el incremento de la biomasa algal durante el período más cálido.
Tabla 6. Comparación de las variables metabólicas del biofilm epipélico registradas en arroyos de de la Llanura Pampeana (producción primaria neta: PPN; respiración: R; producción primaria bruta: PPB; cociente producción primaria bruta/respiración: PPB/R; en gr O2.m-2.d-1).
Table 6. Comparison of the metabolic variables of the epipelic biofilm recorded in streams of the pampean plain.

Según Paul & Meyer (2001) las concentraciones de nutrientes en ríos y arroyos han mostrado altas correlaciones con las actividades humanas, en particular con la agricultura y la urbanización. Pese a ocupar superficies inferiores a las que se le dedican a las áreas cultivables, la urbanización se ubica como la segunda causa de ingreso de nutrientes a los cuerpos de agua en los Estados Unidos. Los resultados obtenidos en el presente estudio resaltan estas apreciaciones y enfatizan la necesidad de la planificación sostenible del uso del suelo en la Llanura Pampeana, considerando el impacto que puede infringir la creciente presión demográfica en esta ecorregión.
AGRADECIMIENTOS: Agradecemos a la Dra. Delia E. Bauer por su colaboración durante los muestreos y a los revisores del artículo que con sus sugerencias contribuyeron a mejorar la versión del mismo. Este trabajo fue subsidiado por el CONICET (PIP nro. 5305).
BIBLIOGRAFIA
1. ALLAN, JD; DL ERICKSON & J FAY. 1997. The influence of catchment land use on stream integrity across multiple spatial scales. Freshwater Biol., 37:149-161. [ Links ]
2. AMERICAN PUBLIC HEALTH ASSOCIATION (APHA). 1998. Standard methods for examination of water and wastewater. American Public Health Association, American Water Works Association and Water Pollution Control Federation. Washington, DC. [ Links ]
3. ARTIGAS, AJ; E GARCÍA-BERTHOU; DE BAUER; MI CASTRO; J COCHERO; ET AL. 2013. Global pressures, specific responses: effects of nutrient enrichment in streams from different biomes. Environ. Res. Lett., 8 DOI:10.1088/1748-9326/8/1/014002. [ Links ]
4. BAUER, DE; JL DONADELLI; N GÓMEZ; M LICURSI; C OCÓN; ET AL. 2002. Ecological status of pampean plain streams and rivers. Verh. Internat. Verein. Limnol., 28:259-262. [ Links ]
5. BOURASSA, NA & A CATTANEO. 1998. Control of periphyton biomass in Laurentian streams (Québec). J. N. Am. Benthol. Soc., 17:420-429. [ Links ]
6. CABRERA, L & EM ZARDINI. 1993. Manual de la flora de los alrededores de Buenos Aires. ACME, Buenos Aires. [ Links ]
7. CLARK, JR; KL DICKSON & J CAIRNS JR. 1979. Estimating, aufwuchs biomass. Pp. 116-141 en: WEITZEL, RL (ed.). Methods and measurement of periphyton communities: A review. Special Technical Publication 690. American Society for Testing and Materials. Philadelphia. [ Links ]
8. COKER, WC. 1923. The Saprolegniaceae with notes on other water molds. Chapel Hill, North Carolina. The University of North Carolina Press. Pp. 201. [ Links ]
9. CORTELEZZI, A; MV SIERRA; N GÓMEZ; C MARINELLI & A RODRIGUES CAPÍTULO. 2012. Macrophytes, epipelic biofilm, and invertebrates as biotic indicators of physical habitat degradation of lowland streams (Argentina). Environ. Monit. Assess., 185:5801-5815. [ Links ]
10. CROSSEY, MJ & TW LA POINT. 1988. A comparison of periphyton community structural and functional responses to heavy metals. Hydrobiologia, 162:109-121. [ Links ]
11. CUFFNEY, TF; MR MEADOR; SD PORTER & ME GURTZ. 2000. Responses of physical, chemical, and biological indicators of water quality to a gradient of agricultural land use in the Yakima river basin, Washington. Environ. Monit. Assess., 64:259-270. [ Links ]
12. DI SIERVI, M. 2002. Bacterias. Aquatec, 7:53. [ Links ]
13. DODDS, WK & EB WELCH. 2000. Establishing nutrient criteria in streams. J. N. Am. Benthol. Soc., 19:186-196. [ Links ]
14. EL-HISSY, FT; MSM NASSAR; AM KHALLIL & FF ABDELMOTAAL. 2001. Aquatic fungi from water and submerged mud polluted with industrial effluents. Online J. Biol. Sc., 1:854-858. [ Links ]
15. ELOSEGI, A & A BUTTURINI. 2009. El transporte de los materials inorgánicos particulados. Pp. 85-96 en: ELOSEGI, A & S SABATER (eds.). Conceptos y técnicas en ecología fluvial. Fundación BBVA, España. [ Links ]
16. ENVIRONMENTAL PROTECTION AGENCY (EPA). 1986. Acid digestion of sediments, sludges, and soils. Method 3050. Test methods for evaluating solid water. SW-846. Chapter 3: Metallic analytes. Office of solid waste and emergency response. Washington, DC. [ Links ]
17. FEIJOÓ, C & M MENÉNDEZ. 2009. La biota de los ríos: los macrófitos. Pp. 243-251 en: ELOSEGI, A & S SABATER (eds.). Conceptos y técnicas en ecología fluvial. Fundación BBVA, España. [ Links ]
18. FELLOWS, CHS; JE CLAPCOTT; JW UDY; SE BUNN; BD HARCH; ET AL. 2006. Benthic metabolism as an indicator of stream ecosystem health. Hydrobiologia, 572:71-87. [ Links ]
19. FLEITUCH, T. 1998. Responses of benthic community metabolism to abiotic factors in a mountain river in southern Poland. Hydrobiologia, 380:27-41. [ Links ]
20. FOLK, RL. 1974. Petrology of sedimentary rocks. Hemphill Pub. Co. Austin, Texas. Pp. 182. [ Links ]
21. FRINK, CR. 1996. A perspective on metal in soils. J. Soil Contam., 5:329-335. [ Links ]
22. FULLER, MS & A JAWORSKI (eds.). 1987. Zoosporic fungi in teaching and research. Southeastern Publishing Corporation, Athens, Georgia. [ Links ]
23. GIORGI, A & L MALACALZA. 1994. Biomass variation of phytobenthos in a plain stream. Verh. Internat. Verein. Limnol., 25:1883-1887. [ Links ]
24. GIORGI, A; C FEIJOÓ & G TELL. 2004. Primary producers in a Pampean stream: temporal variation and structuring role. Biodivers. Conserv., 14:1699-1718. [ Links ]
25. GOLDSTEIN, S. 1961. Physiology of aquatic fungi I. Nutrition of two monocentric chytrids. J. Bacteriol., 80:701-707. [ Links ]
26. GÓMEZ, N & M LICURSI. 2001. The Pampean Diatom Index (IDP) for assessment of rivers and streams in Argentina. Aquat. Ecol., 35:173-181. [ Links ]
27. GÓMEZ, N; MV SIERRA; J COCHERO; M LICURSI & DE BAUER. 2011. Epipelic biofilms as indicators of environmental changes in lowland fluvial systems. Pp. 259-291 en: BAILEY, WC (ed.). Biofilms: Formation, Development and Properties. Nova Science Publishers, Inc. [ Links ]
28. GUASCH, H & S SABATER. 1995. Seasonal variations in photosynthesis-irradiance responses by biofilms in Mediterranean streams. J. Phycol., 31:727-735. [ Links ]
29. HILL, BH; RK HALL; P HUSBY; AT HERLIHY & M DUNNE. 2000. Interregional comparisons of sediment microbial respiration in streams. Freshwater Biol., 44:213-222. [ Links ]
30. HOBBIE, JE; JR DALEY & S JASPER. 1977. Use of nucleopore filtres for couting bacteria by epifluorescence microscopy. Appl. Environ. Microb., 33:1225-1228. [ Links ]
31. HURTADO, MA; JE GIMÉNEZ & MG CABRAL. 2006. Análisis ambiental del partido de La Plata. Aportes del ordenamiento territorial. Consejo Federal de Inversiones. Buenos Aires. Pp. 156. [ Links ]
32.JOHNSON JR, TW; RL SEYMOUR & DE PADGETT. 2002. Biology and systematics of the Saprolegniaceae. Pp. 1028. ilumina-dlib.org/ digilib/biology/fungi/taxonomy and systematics/ padgettbook/ [último acceso: 25 septiembre de 2010]. [ Links ]
33. KARLING, JS. 1977. Chytridiomycetarum Iconographia. Vaduz: Lubrecht & Cramer. Monticello, New York. Pp. 414. [ Links ]
34. LETCHER, PM & MJ POWELL. 2001. Distribution of zoosporic fungi in forest soils of the Blue Ridge and Appalachian Mountains of Virginia. Mycologia, 93:1029-1041. [ Links ]
35. LETCHER, PM; PA MCGEE & MJ POWELL. 2004. Diversity of chytrids from soils of four vegetation types in New South Wales, Australia. Can. J. Bot., 82:1490-1500. [ Links ]
36. LOWE, RL & Y PAN. 1996. Benthic algal communities and biological monitors. Pp. 705-739 en: STEVENSON, RJ; ML BOTHWELL & RL LOWE (eds.). Algal ecology: Freshwater Benthic Ecosystems. Academic Press, San Diego, California. USA. [ Links ]
37. MACKERETH, FJH; J HERON & JF TALLING. 1978. Water analysis: some revised methods for limnologists. Freshw. Biol. Assoc., 36:120. [ Links ]
38. MARANO, AV; MD BARRERA; MM STECIOW; JL DONADELLI & MCN SAPARRAT. 2008. Frequency, abundance and distribution of zoosporic organisms from Las Cañas stream (Buenos Aires, Argentina). Mycologia, 100:691-700. [ Links ]
39. MARANO, AV; MD BARRERA; MM STECIOW; FH GLEASON & JL DONADELLI. 2011a. Diversity of zoosporic true fungi and heterotrophic straminipiles in Las Cañas stream (Buenos Aires, Argentina): assemblages colonizing baits. Fund. Appl. Limnol., 178:203-218. [ Links ]
40. MARANO, AV; CLA PIRES-ZOTTARELLI; MD BARRERA; MM STECIOW; FH GLEASON. 2011b. Diversity, role in decomposition and succession of zoosporic fungi and straminipiles on submerged decaying leaves in a woodland stream. Hydrobiologia, 659:93-109. [ Links ]
41. PARK, HC; WG SORENSON; RJ DAVIS. 1978. Aquatic Oomycetes in farm ponds in Bryan County, Oklahoma. Proc. Ok. Acad. Sc., 58:48-53. [ Links ]
42. PAUL, MJ & JL MEYER. 2001. Streams in the urban landscape. Annu. Rev. Ecol. Syst., 32:333-365. [ Links ]
43. POZO, J & A ELOSEGI. 2009. El marco físico: la cuenca. Pp. 39- 49 en: ELOSEGI, A & S SABATER (eds.). Conceptos y técnicas en ecología fluvial. Fundación BBVA, España. [ Links ]
44. POZO, J; A ELOSEGI; J DIEZ & J MOLINERO. 2009. Dinámica y relevancia de la materia orgánica. Pp. 141-167 en: ELOSEGI, A & S SABATER (eds.). Conceptos y técnicas en ecología fluvial. Fundación BBVA, España. [ Links ]
45. RIER, ST & RJ STEVENSON. 2006. Response of periphytic algae to gradients in nitrogen and phosphorus in streamside mesocosms. Hydrobiologia, 561:131-147. [ Links ]
46. ROCHA, M & CLA PIRES-ZOTTARELLI. 2002. Chytridiomycota e Oomycota da "Represa do Guarapiranga", São Paulo, SP. Acta Bot. Bras., 16:287-309. [ Links ]
47. RODRIGUES CAPÍTULO, A; N GÓMEZ; A GIORGI & C FEIJOÓ. 2010. Global changes in pampean lowland streams (Argentina): implications for biodiversity and functioning. Hydrobiologia, 657:53-70. [ Links ]
48. SABATER, S; H GUASCH; M RICART; A ROMANÍ; G VIDAL; ET AL. 2007. Monitoring the effect of chemicals on biological communities. The biofilm as an interface. Anal. Bioanal. Chem., 387:1425-1434. [ Links ]
49. SABATER, S; JCH DONATO; A GIORGI & A ELOSEGI. 2009. El río como ecosistema. Pp. 23-37 en: ELOSEGI A & S SABATER (eds.). Conceptos y técnicas en ecología fluvial. Fundación BBVA. España. [ Links ]
50. SCHOENLEIN-CRUSIUS, IH; CLA PIRES-ZOTTARELLI; AI MILANEZ & RD HUMPHREYS. 1998. Influence of nutrients concentration on the aquatic mycota of leaves submerged in a stream in the Atlantic rainforest. Int. Ver. Theor. Angew. Limno., 26:1125-1128. [ Links ]
51. SEYMOUR, RL. 1970. The genus Saprolegnia. Nova Hedwigia, 19:1-124. [ Links ]
52. SIERRA, MV. 2009. Microbentos de sistemas lóticos pampeanos y su relación con la calidad del agua: respuestas estructurales y funcionales. Tesis doctoral. Facultad de Ciencias Naturales y Museo. Universidad Nacional de La Plata. La Plata, Argentina. [ Links ]
53. SIERRA, MV & N GÓMEZ. 2007. Structural characteristics and oxygen consumption of the epipelic biofilm in three lowland streams exposed to different land uses. Water Air Soil Pollut., 186:115-127. [ Links ]
54. SIERRA, MV & N GÓMEZ. 2010. Assessing the disturbance caused by an industrial discharge using field transfer of epipelic biofilm. Sci. Total Environ., 408:2696-2705. [ Links ]
55. SIGEE, DC. 2005. Freshwater microbiology. Wiley & Sons, Ltd, England. Pp. 524. [ Links ]
56. SPARROW JR, FK. 1960. Aquatic Phycomycetes. Ann. Arbour, University of Michigan Press, Michigan. [ Links ]
57. SPARROW JR, FK. 1968. Ecology of freshwater fungi. Pp. 41-93 in: GC AINSWORTH & AS SUSSMAN (eds.). The Fungi. Vol. 3. Academic Press, New York. [ Links ]
58. STEINMAN, AD & GA LAMBERTI. 1996. Biomass and pigments of benthic algae. Pp. 295-313 en: Hauer, R & GA Lamberti (eds.). Stream ecology. Academic Press, New York. [ Links ]
59. STEVENS, RB. 1974. Mycological Guidebook. University of Washington Press, Seattle. Pp. 703. [ Links ]
60. STEVENSON, RJ. 1996. The stimulation and drag of current. Pp. 321-340 en: Stevenson, RJ; ML Bothwell & RL Lowe (eds.). Algal ecology: Freshwater Benthic Ecosystems. Academic Press, San Diego, California. USA. [ Links ]
61. TABATABAI, MA. 1974. Determination of sulphate in watersamples. Sulphur Institute J., 10:2. [ Links ]
62. TANK, JL & WK DODDS. 2003. Nutrient limitation of epilithic and epixylic biofilms in 10 North American streams. Freshw. Biol., 48:1031-1049. [ Links ]
63. VANNOTE, RL; GW MINSHALL; KW CUMMINGS; JR SEDELL& CE CUSHING. 1980. The river continuum concept. Can. J. Fish. Aquat. Sci., 37:130-137. [ Links ]
64. VILCHES, C & A GIORGI. 2008. Metabolismo de productores primarios de un arroyo pampeano. Biol. Acuática, 24: 87-93. [ Links ]
65. ZAR, JH. 1996. Biostatistical Analysis. 3ra edn. Prentice Hall. Upper Saddle River. New Jersey. Pp. 662. [ Links ]














