Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral vol.26 no.1 Córdoba abr. 2016
ARTÍCULO ORIGINAL
Diversidad de escarabajos coprófagos (Coleoptera: Scarabaeinae) en un remanente ribereño y un fragmento de bosque húmedo tropical en Córdoba, Colombia
Leidys Murillo-Ramos1*; Roger Ayazo2 & Claudia A. Medina3
1 Departamento de Biología, Universidad de Sucre. Colombia. Carrera 28 N° 5-267, Barrio Puerta Roja Sincelejo, Sucre, Colombia.
2 Grupo de Investigación BIODIVERSIDAD UNICÓRDOBA, Departamento de Biología, Universidad de Córdoba. Colombia. Carrera 6 N° 76-103, Montería, Colombia. C.P. 230002.
3 Programa de Gestión de Información y Conocimiento GIC- Colecciones Biológicas, Instituto Alexander von Humboldt, Boyacá, Colombia.
*leidys.murillo@unisucre.edu.co
Editora asociada: Adriana Ruggiero
Recibido: 20 de Marzo de 2015 Aceptado: 27 de Octubre de 2015
Resumen
La expansión de la frontera agropecuaria genera fragmentación de paisajes, disminución de hábitats y pérdida de diversidad. En estos paisajes, los remanentes de vegetación ribereña son elementos que ayudan a mantener la biodiversidad. En este estudio se evaluó la hipótesis de que un remanente ribereño puede mantener una diversidad de escarabajos coprófagos comparable a un fragmento de bosque húmedo tropical. Por lo tanto, se esperaba encontrar valores similares de diversidad entre el remanente ribereño y un fragmento de bosque húmedo adyacente. El estudio se realizó en una localidad de la zona amortiguadora del Parque Nacional Natural Paramillo (PNNP) en Córdoba, Colombia. Se realizaron dos muestreos en la época de lluvias de 2011. En cada uno se trazó una transecta lineal por sitio y se instalaron 15 trampas "pitfall" separadas 30 m entre sí. Se recolectaron 575 individuos de 26 especies. En comparación con el fragmento de bosque, la comunidad de escarabajos fue más equitativa y diversa en el remanente ribereño. El fragmento de bosque estuvo dominado por la especie Canthon sp.01H, que concentró ~40% de los individuos colectados, mientras que en el remanente ribereño hubo codominancia de las especies Canthon sp.01H, Scybalocanthon moniliatus y Canthidium sp.02H. La diversidad beta fue <1.4 (beta máxima = 2); sin embargo, la mayor diferencia en los ensambles se presentó en las especies dominantes de cada hábitat. Los resultados sugieren que las zonas ribereñas son importantes para la diversidad de los escarabajos coprófagos por tener valores más altos de diversidad y por presentar ensambles particulares, diferenciándose del bosque en las especies dominantes. Sin embargo, este resultado debe tomarse con precaución debido a la condición particular de nuestro sistema de estudio, que involucró una comparación entre un solo fragmento de bosque y un remanente ribereño. Para poder generalizar se necesitarán más trabajos en el futuro.
Palabras clave: Bosque en galería; Caribe; Insectos; Zona amortiguadora; Scarabaeidae
Abstract
Diversity of dung beetles (Coleoptera: Scarabaeinae) in a rainforest fragment and a remnant riparian forest in Córdoba, Colombia. The expansion of the agricultural frontier produces fragmented landscapes, habitat decline and loss of diversity. In these landscapes, remnants of riparian vegetation are important elements to maintain biodiversity. We tested the hypothesis that a riparian remnant keeps similar values of dung beetles diversity, compared with a rainforest fragment. Therefore, we expected to fnd similar values of diversity between the riparian remnant and the adjacent rainforest fragment. The study was carried out in an area of the buffer zone of Natural Paramillo National Park of Córdoba, Colombia. A linear transect including 15 pitfall traps (30 m apart from each) was established at each sampling sites between April and May 2011. We collected 575 specimens, which were distributed among 26 species. The results show a community of dung beetles more equitable and diverse inside remnant forest riparian compared to forest fragment. The forest fragment was dominated by a species Canthon sp.01H that concentrated about 40% of the individuals captured, while in the remnant riparian forest three species were co-dominant Canthon sp.01H, S. moniliatus and Canthidium sp.02H. Beta diversity was <1.4 (maximum beta = 2.0). However, the biggest difference in the assemblies is presented in dominant species in each habitat. Results highlight the importance of riparian vegetation to the diversity of dung beetles to keep particular assemblages differing of the forest fragment mainly in dominant species. The remnant riparian forest was also important to present values of diversity that duplicate the forest fragment diversity and conserves some different species, contributing to the diversity of this landscape. However, this result should be taken with caution due to the particular condition of our study system that involved a comparison between a single fragment and a single riparian remnant. Future studies are needed for further generalization.
Key words: Gallery forest; Caribbean region; Insects; Buffer zone; Scarabaeidae
Introducción
La agricultura tradicional y la ganadería extensiva representan la principal amenaza para la biodiversidad (Haberl et al. 2007; Wright et al. 2012; Phalan et al. 2013). En zonas tropicales, estas dos actividades transforman paisajes intactos a paisajes fragmentados y generan pérdida de hábitat para un número elevado de especies (Fahrig 2003). Los paisajes nuevos conforman un mosaico de zonas de cultivo, áreas para el ganado y fragmentos de bosque de distinto grado de perturbación (Harvey et al. 2008). Uno de los elementos más comunes en estos paisajes transformados son las franjas de vegetación nativa a orillas de ríos y quebradas, conocidas como remanentes ribereños o bosques en galería (Harvey et al. 2006; Barlow et al. 2010). Estos remanentes ribereños suelen retenerse en el paisaje por su función para la protección de cuerpos de agua dado que proveen sombra para el ganado o que su ubicación en zonas montañosas con pendientes fuertes los hace difíciles de transformar (Patten 1998). Además de los servicios que prestan al sector agrícola, los remanentes ribereños también tienen una función en el mantenimiento de la diversidad en paisajes transformados (NRC 2002; Lees & Peres 2008). Pueden representar sitios de paso para la biota al conectar poblaciones (Bryant 2006), o incluso proveer hábitat para algunas especies especialistas del bosque (Marczak et al. 2010). Varios estudios han señalado la importancia de los remanentes ribereños para la diversidad tanto de vertebrados (Lees & Peres 2008; Ribeiro et al. 2012) como de invertebrados terrestres (Lambeets et al. 2008; Ives et al. 2011; Baiocchi et al. 2012). Sin embargo, el valor real para la biodiversidad aún genera controversias y es pobremente entendido. La mayoría de los estudios se han enfocado a remanentes ribereños de zonas templadas empleando especies de aves (Marczak et al. 2010). Por otra parte, algunos taxones (en especial aquellos restringidos al bosque nativo) son incapaces de mantener poblaciones en estos ambientes, en tanto que otros (i.e., especies generalistas) pueden aumentar su abundancia (Marczak et al. 2010). Esto ocurre porque especies diferentes pueden exhibir respuestas distintas ante un mismo escenario de perturbación (Perry et al. 2011; Akasaka et al. 2010). Se ha señalado que el valor de estas franjas de vegetación para la diversidad puede depender del contexto en que están inmersos. Por ejemplo, en paisajes muy fragmentados, la fauna usaría en mayor grado los remanentes ribereños, en relación a aquellos inmersos en un contexto boscoso (Virgós 2001). Por ello es necesario entender cómo estas franjas de vegetación nativa podrían ayudar a mantener la diversidad en el paisaje fragmentado de un sector de la zona amortiguadora del PNNP. Comprender como se mantienen las características ecológicas y la funcionalidad de las zonas de amortiguamiento es un reto a la hora de asegurar el éxito de las áreas protegidas (Laurance et al. 2012).
Se usó el gremio de los escarabajos coprófagos (Coleoptera, Scarabaeinae) como grupo focal. Estos escarabajos no sólo son buenos modelos para estudios ecológicos y biogeográficos por su alta diversidad y su respuesta rápida ante perturbaciones naturales o humanas (Halffter & Favila 1993; Davis et al. 2010; Gollan et al. 2011), sino que son claves en la dinámica de los ecosistemas que habitan por las funciones y procesos ecológicos que regulan (Halffter & Favila 1993; Nichols et al. 2008). Entre las funciones que realizan estos escarabajos figuran la incorporación de materia orgánica al suelo, el control de parásitos gastrointestinales del ganado, la aireación del suelo, la dispersión secundaria de semillas y la bioturbación (Nichols et al. 2008). En esta investigación se estudió la diversidad de escarabajos coprófagos (Scarabaeinae) en un remanente ribereño y en un fragmento de bosque húmedo tropical en un sector de la zona amortiguadora del PNNP en Córdoba, para evaluar la hipótesis que un remanente ribereño puede mantener una diversidad de escarabajos coprófagos comparable a un fragmento de bosque húmedo tropical. Por lo tanto, se esperaba encontrar valores similares de diversidad entre estos dos ambientes.
Materiales y Métodos
Área de estudio
El estudio se realizó en una localidad de la zona amortiguadora del PNNP en el municipio de Tierralta, Córdoba, noroccidente de Colombia. El sitio se ubicó específicamente en la vereda Tuis-Tuis (08°02'23.7'' N -076°05'59.6'' O, altitud: 125 m.s.n.m.) (Figura 1). Tuis-Tuis se localiza en zona de piedemonte del cerro Murrucucú y se caracteriza por presentar una topografía plana a ondulada. Según el sistema de clasificación de Holdridge (Holdridge 1979), Tuis-Tuis corresponde a la formación vegetal de bosque húmedo tropical. El régimen de precipitación en la zona es unimodal, con promedio anual de 2000 mm.

Figura 1. Ubicación geográfica de la vereda Tuis Tuis, municipio de Tierra Alta, departamento de Córdoba (Colombia).
Figure 1. Geographical Location of Tuis Tuis, department of Córdoba (Colombia).
La temperatura promedio anual es 25 °C y la humedad relativa superior a 80%. La época de lluvias comprende el período abril-octubre y la época seca noviembre-marzo (CVS-UNAL 2008). Se seleccionaron dos ambientes, un remanente ribereño de aproximadamente 20 m de ancho y 500 m de longitud, y un fragmento de bosque de 16 ha en una zona alta adyacente. Los ambientes estuvieron separados por un cultivo mixto de piña (Ananas comosus [L.]) Merr 1917) y palma barbasco (Cryosophila kalbreyeri [Dammer ex Burret] Dahlgren 1936). El fragmento de bosque se ha mantenido bajo un régimen de protección privada por más de 20 años. El bosque ribereño es usado para el cultivo de cacao (Theobroma cacao Linnaeus 1753) bajo sombra.
Muestreo de escarabajos coprófagos (Scarabaeinae)
En cada ambiente se realizaron dos jornadas de muestreo en la época de lluvias de 2011 (en abril y mayo). En cada jornada se trazó una transecta lineal donde se instalaron quince trampas de caída, separadas 30 m entre sí. Las trampas consistieron en recipientes de 1 L (11.5 cm de diámetro x 14.5 cm de altura) enterrados a nivel del suelo, llenados un cuarto de su capacidad con una solución de alcohol al 70% como líquido letal y preservante. Las trampas se cebaron con excremento humano, reconocido por su efectividad para la captura de estos escarabajos en ambientes tropicales (Arellano et al. 2005; Amézquita & Favila 2010; Rös et al. 2012). El cebo (~20 g) se ubicó en un vaso (capacidad 25 mL) suspendido por un alambre galvanizado en forma de L invertida por encima del recipiente para capturar los escarabajos. Las trampas permanecieron activas en campo durante 48 horas. Los especímenes recolectados se almacenaron en frascos con etanol 70%, debidamente rotulados. La determinación taxonómica se hizo inicialmente siguiendo las claves de Medina & Lopera (2001), Kholmann & Solís (2001), Solís & Kholmann (2002), Camero (2010) y Vaz de Mello et al. (2011). Luego, las especies fueron comparadas con la colección de referencia de escarabajos coprófagos (Coleoptera, Scarabaeinae) depositada en el Instituto de Investigaciones Alexander Von Humboldt (IAvH). Las determinaciones se unificaron con la nomenclatura propuesta por el IAvH para las especies reportadas en Colombia. Una copia de la colección quedó depositada en el IAvH y otra en la Colección Zoológica de la Universidad de Córdoba (CZUC).
Análisis de datos
Se estimó la cobertura de la muestra para cada ambiente como una medida de la completitud del muestreo (Chao & Jost 2012; Hsieh et al. 2014). La cobertura de la muestra representa la proporción (respecto a todos los individuos de la comunidad) que constituyen los individuos de las especies recolectadas en la muestra. La comparación de comunidades mediante la riqueza de especies estimada a través de la cobertura de la muestra, a diferencia del método tradicional de rarefacción, permite realizar comparaciones justas; es decir, la comparación se hace a una misma proporción de la comunidad (misma cobertura) y no a igual tamaño de muestra. Generalmente, las comunidades estandarizadas por el tamaño tienen diferente grado de completitud. Cuando los ambientes a comparar registran niveles de cobertura cercanos a 1 es posible realizar comparaciones directas de su diversidad (Chao & Jost 2012).
Para comparar la diversidad alfa de los ambientes, se generaron perfiles de diversidad, (Tóthmérész 1995). Los perfiles descritos por Tóthmérész (1995) son representaciones gráficas (a manera de curvas) de la diversidad, construidas en función de una familia paramétrica de diversidad. Los perfiles facilitan la ordenación y comparación de comunidades. El uso de familias paramétricas de diversidad en vez de un único valor de diversidad tiene la ventaja de considerar la naturaleza multidimensional de las comunidades, lo que permite analizar la comunidad en distintas escalas (porciones) independientes. A medida que la escala cambia a través del perfil, los valores de diversidad varían su sensibilidad a la ocurrencia de especies raras y abundantes. Si los perfiles generados para dos comunidades no se traslapan, indica que las comunidades difieren en su diversidad, siendo la de mayor diversidad la que describe el perfil más alto. Si los perfiles se traslapan, las comunidades no son comparables en su diversidad. Lo anterior significa que las comunidades no pueden ordenarse de manera adecuada ya que podrían arreglarse de manera distinta al emplear diferentes métodos en el cálculo de la diversidad. Los perfiles se generaron usando las diversidades de orden "q", también llamadas "diversidad verdadera" (Jost 2006, 2007). La expresión general de las diversidades verdaderas es (qD):
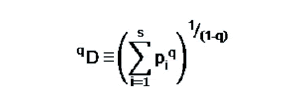
Donde pi es la abundancia relativa de la especie i (es decir, la abundancia de la especie i dividida entre la suma de las abundancia de las S especies que componen la comunidad). La diversidad calculada de esta forma tiene la ventaja de no depender de la forma funcional del índice que se emplee, contrario a las entropías (índice de diversidad de Shannon) y probabilidades (índice de diversidad de Simpson) que se han venido usando tradicionalmente como indicadores de la diversidad (Jost 2006). Los perfiles de diversidad se generaron con los órdenes q=0, q=1 y q=2. La diversidad de orden cero (q=0) es insensible a la frecuencia de las especies, por lo que le da igual peso a las especies raras que al resto de las especies. Es decir, el cálculo favorece de manera no proporcional a las especies raras. Esta diversidad corresponde a la riqueza de especies. La diversidad de orden uno (q=1) usa las frecuencias de las especies tal como son recolectadas en campo. La diversidad calculada de esta forma no favorece ni a las especies raras ni a las abundantes y se conoce como el exponencial de la entropía de Shannon. Finalmente la diversidad de orden dos (q=2) le da mayor peso a las especies dominantes de la comunidad, corresponde al inverso de la concentración de Simpson (Jos 2010). Estas medidas permiten evaluar de forma comparativa cambios en la diversidad de las comunidades (Jost et al. 2010). El cálculo de la cobertura de la muestra y la estimación de los órdenes de la diversidad se hicieron con el paquete iNterpolation and EXTrapolation - iNEXT (Chao & Jost 2012; Hsieh et al. 2014) integrado recientemente al programa estadístico R (v3.1.2) (R CoreTeam 2014). Este método permite además de estimar y comparar la diversidad de comunidades a un mismo nivel de completitud (Chao & Jost 2012; Hsieh et al. 2014), generar intervalos de confianza del 95% para cada orden "q" de la diversidad (Hsieh et al. 2014). Además, se calculó el factor de desigualdad (IFoq ) como una medida de la disminución de la diversidad a través del perfil (Jost 2010). El IF representa la relación de la diversidad 0D (riqueza de especies, S) y diversidades de otros ordenes (q). Valores más bajos de IF significa ensambles más equitativos.
Se usaron las curvas de rango-abundancia (Whittaker 1965; Feisinger 2003) para comparar la estructura de la comunidad entre los ambientes. Estas curvas son útiles porque permiten comparar la composición, abundancia y la uniformidad entre las comunidades.
Para analizar la variación en la composición de especies entre hábitats se calculó la diversidad beta verdadera usando la partición multiplicativa de gamma (βD=γD/αD) propuesta originalmente por Whittaker (ver Jost 2007). La beta calculada empleando la partición multiplicativa asegura que gamma sea independiente de alfa, así, alfa nunca superará a gamma. Esta propiedad se rompe cuando se considera que los componentes de gamma se relacionan aditivamente. La diversidad beta representa el número efectivo de comunidades en una región y puede variar desde uno (cuando las comunidades son iguales) hasta el número de comunidades que se están comparando (cuando las comunidades no comparten especies). Los cálculos se realizaron con el programa estadístico R (v3.1.2) (R CoreTeam 2014).
Resultados
Se recolectaron 575 individuos, 26 especies, seis tribus y 14 géneros (Tabla 1). La tribu Ateuchini tuvo el mayor número de géneros (cuatro), aunque representadas por pocos individuos. Por su parte, el género Canthon tuvo el mayor número de especies (seis), seguido por el género Onthophagus con cuatro. Del total de individuos, 332 se recolectaron en el fragmento de bosque y 243 en el remanente ribereño. La especie más abundante fue Canthon sp.01H con 158 individuos (27.5%), seguida por Canthidium sp.02H con 85 individuos (14.8%) y Onthophagus sp.04H con 61 individuos (10.6%). Por su parte Dichotomius sp.07H, Trichillidium pilosum Robinson 1948, Scatimus ovatus Harold 1862, Ateuchus aenomicans Harold 1868, Canthon sp.06H, Oxysternon conspicillatum Weber 1801 y Onthophagus lebasi Boucomont 1932 representaron en conjunto 3% de todos los individuos recolectados (Tabla 1).
Tabla 1. Especies de escarabajos coprófagos en un fragmento de bosque húmedo tropical y un remanente ribereño en la vereda Tuis-Tuis departamento de Córdoba (Colombia).
Table 1. Dung beetles in a Rainforest fragment and a remnant riparian forest in Tuis-Tuis, Córdoba (Colombia).

El análisis de completitud por el método de la cobertura de la muestra reveló que en ambos ambientes se obtuvo una completitud mayor a 99%. El análisis de diversidad alfa muestra que aunque los intervalos de confianza se traslapan en q=0 (riqueza de especies), los perfiles de diversidad generados para ambos hábitats señalan que la zona ribereña presenta mayor diversidad que el fragmento de bosque (Figura 2). El índice de desigualdad muestra que el ensamble del remanente ribereño fue más equitativo que el fragmento de bosque (remanente ribereño IF(0-2)=1.63; fragmento de bosque IF(0-2)=4.08). La magnitud de la diferencia entre la diversidad de la zona ribereña con respecto al fragmento de bosque muestra que la zona ribereña es entre 1.14 y 2.78 veces más diversa que el fragmento de bosque.

Figura 2. Perfiles de diversidad alfa verdadera para la comunidad de escarabajos coprófagos en un fragmento de bosque húmedo tropical y un remanente ribereño, Tuis-Tuis departamento de Córdoba (Colombia). Las barras verticales indican intervalos de confianza del 95%.
Figure 2. True alpha diversity profiles for the community of dung beetles in a tropical rainforest fragment and remnant riparian forest, Tuis-Tuis department of Córdoba (Colombia). Vertical bars represent 95% confidence intervals.
La pendiente de las gráficas de rango-abundancia indica una tendencia ligeramente diferente entre los dos hábitats. El remanente ribereño presenta una pendiente menos pronunciada que la distribución de abundancias generada para el fragmento de bosque. No hay una clara dominancia de una especie en la zona ribereña, como si ocurre en el fragmento de bosque donde Canthon sp.01H concentra ~40% de los individuos recolectados. En el remanente ribereño se presentan tres especies como codominantes Canthon sp.01H, S. moniliatus Bates 1873 y Canthidium sp.02H (Figura 3).

Figura 3. Curva de rango-abundancia de los escarabajos coprófagos de un fragmento de bosque húmedo tropical y un remanente ribereño, en la vereda Tuis Tuis, departamento de Córdoba-Colombia. Can01H: Canthon sp. 01H; Scymon: Scybalocanthon monilliatus; Cant02H: Canthon sp. 02H; Ont04H: Ontophagus sp. 04H.
Figure 3. Range-abundance curve of dung beetles of a tropical rainforest fragment and a remnant riparian forest, department of Córdoba, Colombia.Can01H: Canthon sp. 01H; Scymon: Scybalocanthon monilliatus; Cant02H: Canthon sp. 02H; Ont04H: Ontophagus sp. 04H.
Al ordenar las especies por su abundancia en cada ambiente y comparar su posición jerárquica se observa que solo dos especies Canthon sp. 01H y Dichotomius sp.07H mantuvieron su posición (Tabla 1). Varias especies por su parte (Canthidium sp.02H, Deltochilum sp.02H, Dichotomius sp.06H, Eurysternus foedus Guérin 1844 y Onthophagus sp. 04H), concentraron su abundancia (n≥70%) en el fragmento de bosque. Mientras que S. moniliatus acumuló mayor abundancia en el remanente ribereño (93%) (Tabla 1).
En cuanto a la diversidad beta, en términos generales la diversidad fue baja (beta varió entre 1.15 y 1.23; la beta máxima que se podría obtener es de 2.0). A pesar de esto, se observa que la mayor diferencia en los ensambles se presenta en las especies abundantes de cada hábitat (Figura 4).

Figura 4. Perfil de diversidad beta verdadera para la comunidad de escarabajos coprófagos en un fragmento de bosque húmedo tropical y un remanente ribereño, Tuis-Tuis departamento de Córdoba (Colombia).
Figure 4. True beta diversity profile for the community of dung beetles in a tropical rainforest fragment and remnant riparian forest, Tuis-Tuis department of Córdoba (Colombia).
Discusión
La riqueza de especies registrada en esta investigación representa 69% de las especies de Scarabaeinae reportadas para la costa Caribe de Colombia. El 80% de las especies recolectadas para el bosque húmedo de la vereda Tuis-Tuis (zona amortiguadora del PNNP) se han registrado en zonas de bosque seco tropical de la región (ver: Martínez et al. 2009; Barraza et al. 2010; Solís et al. 2011).
Según IAvH (1998), la diversidad de Scarabaeinae es comparable entre estos dos ambientes, en especial si se trata de zonas de bosque húmedo de tierras bajas. Este resultado concuerda con la tendencia registrada tanto para los vertebrados como para cerca de la mitad de las familias de plantas con flores del bosque seco tropical. Según Ceballos (1996) y IAvH (1998), las especies de estos grupos que habitan en el bosque seco provienen de los bosques húmedos cercanos. Los resultados obtenidos para escarabajos coprófagos en este estudio reafirman la similitud taxonómica elevada que existe entre las biotas del bosque húmedo y bosque seco tropical del Caribe colombiano (IAvH 1998; Pizano & García 2014).
El análisis de diversidad mostró que el remanente ribereño fue más diverso que el fragmento de bosque. Este resultado es contrario a lo reportado por Gray et al. (2014), quienes encontraron que fragmentos de bosque adyacentes a remanentes ribereños tuvieron mayor riqueza y diversidad de escarabajos coprófagos. Este resultado sugiere que los remanentes ribereños del bosque húmedo de la vereda Tuis-Tuis serían importantes para la diversidad de estos escarabajos a escala del paisaje por mantener ensambles distintos y más diversos. Sin embargo, esto debería tomarse con cautela ya que al contemplar un solo remanente ribereño y un fragmento de bosque los resultados podrían estar reflejando un efecto idiosincrático de las condiciones particulares de los dos sitios. Dado que no es posible establecer si realmente el remanente ribereño estudiado puede mantener poblaciones viables de escarabajos, la mayor diversidad reportada para este ambiente podría también ser producto de la entrada frecuente de individuos de distintas especies de zonas adyacentes, constituyendo un hábitat sumidero. Esto es posible dado que el remanente ribereño se encuentra embebido en un contexto boscoso.
Para algunos grupos taxonómicos se han reportado resultados positivos de la función de los remanentes ribereños para la diversidad (Marczak et al. 2010). Por su heterogeneidad ambiental, la vegetación ribereña permite la coexistencia de especies y proporciona hábitat, refugio y alimento ante la modificación de los hábitats originales (Meave et al. 1991; Meave & Kellman 1994). Para los escarabajos coprófagos, la contribución de estos elementos a la diversidad aún es controversial. Varios estudios han revelado que las franjas de vegetación a orillas de cuerpos de agua resultan en beneficios para la diversidad regional de estos escarabajos (Harvey et al. 2006; Gollan et al. 2011). Sin embargo, autores como Barlow et al. (2010) sugieren que para Scarabaeinae este tipo de ambientes no son los más adecuados para el establecimiento de poblaciones viables ya que la humedad alta de sus suelos podría incrementar la mortalidad de las larvas.
Las curvas de rango-abundancia mostraron que el ensamble de escarabajos del remanente ribereño fue más uniforme que el ensamble del fragmento de bosque. Este resultado se debió a que en el fragmento de bosque, Canthon sp.01H dominó la abundancia para este ambiente (~40%). Esta tendencia es similar a la observada en fragmentos de bosque seco tropical del Caribe colombiano, donde especies de Canthon son dominantes (Pizano & García 2014). La abundancia y el número de especies de Canthon en bosques tropicales están asociadas a la presencia de excremento de primates, principalmente de dos especies de monos aulladores Alouatta seniculus Linnaeus 1766 y A. palliata Gray 1849 (Estrada & Coates-Estrada 1991; Solís & Kohlmann 2002; Martínez et al. 2012). Para la zona de estudio se registró la presencia de tropas de tití cabeza blanca (Saguinus oedipus Linnaeus 1758), en cuyas excretas detectadas en el remanente ribereño se recolectaron dos especies de Canthon (C. septemmaculatus Latreille 1811 y C. acutoides Schmidt 1922) y una de Scybalocanthon (S. moniliatus). S. oedipus es una especie endémica del noroccidente de Colombia y se encuentra críticamente amenazada (Miller et al. 2004; IUCN 2014). Es la primera vez que se registra la asociación de estos escarabajos al excremento de este primate.
De las 26 especies recolectadas, cinco mostraron preferencias por el remanente ribereño (Canthon sp.06H, C. septemmaculatus, Ox. conspicillatum, O. lebassi y O. marginicollis Harold 1880), mientras que dos especies (T. pilosum y S. ovatus) estuvieron sólo en el fragmento de bosque. Esto podría sugerir que estas especies reconocen condiciones particulares asociadas a estos ambientes tal vez relacionadas a estructura y tipo de vegetación, condiciones microclimáticas, disponibilidad y calidad del recurso. Estas características han sido señaladas por varios autores como determinantes de la presencia y abundancia de estos escarabajos en los hábitats (Halffter & Matthews 1966; Horgan 2007-2009). Por ejemplo, se ha reportado a Ox. Conspicillatum en el interior de bosques donde explota una amplia variedad de excrementos (Edmonds & Zídek 2004). El hecho de registrarla en este estudio para el remanente ribereño sugiere que esta zona, a pesar de estar más propensa a perturbaciones naturales y humanas, puede mantener especies típicas de bosques. Por otra parte, los valores bajos de diversidad beta entre el fragmento de bosque y el remanente ribereño se deben en parte al número elevado de especies compartidas (19, que representan entre 79% y 90% de las especies recolectadas para el fragmento de bosque y el remanente ribereño, respectivamente). La similitud taxonómica de escarabajos entre fragmentos de bosque y remanentes ribereños adyacentes ha sido reportada en un estudio reciente en un bosque húmedo de Borneo (Gray et al. 2014). La cercanía de los ambientes, el hecho de que los remanentes ribereños sean elementos derivados de la transformación de bosques continuos o el contexto boscoso en el que se ubica el remanente ribereño estudiado pudo incidir la alta similitud taxonómica de sus ensambles. A pesar de los bajos valores de la beta diversidad, la tendencia observada a incrementar el perfil cuando se consideran las especies más abundantes (q=2) sugiere que los ambientes presentan diferencias en las especies dominantes de cada ensamble. Esta diferenciación de los ambientes está reflejada en diferencias en sus especies más abundantes y no tanto en cambios en la identidad de las especies de los ensambles.
En conclusión, los resultados sugieren que los remanentes ribereños de bosque húmedo deberían mantenerse en el paisaje fragmentado de la zona amortiguadora del PNNP como complemento de los fragmentos de bosque porque estas franjas podrían retener especies nativas, ensambles distintos y altos valores de diversidad. Esta conclusión debe considerarse como preliminar debido a las limitaciones inherentes al diseño de muestreo del presente trabajo (i.e., se realizó una única comparación entre un fragmento de bosque y un remanente ribereño). Será necesario llevar a cabo más estudios en el futuro a fin de poder realizar generalizaciones mayores.
AGRADECIMIENTOS. Agradecemos a A. Hernández por permitirnos el acceso a sus predios (finca El Tutifruti) para la realización de esta investigación. A C. Zapata (Corpotuistuis), J.A. Vergara y A. Vargas por el apoyo logístico durante la fase campo y laboratorio. Finalmente, a F. A. Gonzales por su ayuda en la determinación taxonómica de los especímenes.
Referencias
1. Akasaka, T; M Akasaka & H Yanagawa. 2010. Relative importance of the environmental factors at site and landscape scales for bats along the riparian zones. Landsc. Ecol., 6:247-255. [ Links ]
2. Amézquita, S & ME Favila. 2010. Removal rates of native and exotic dung by dung beetles (Scarabaeidae: Scarabaeinae) in a fragmented tropical rain forest. Environ. Entomol., 39:328-336. [ Links ]
3. Arellano, L; M Favila & C Huerta. 2005. Diversity of dung and carrion beetles in a disturbed mexican tropical montane cloud forest and on shade coffee plantations. Biodivers. Conserv., 14:601-615. [ Links ]
4. Baiocchi, S; S Fattorini; P Bonavita & AV Taglianti. 2012. Patterns of beta diversity in riparian ground beetle assemblages (Coleoptera Carabidae): A case study in the river Aniene (Central Italy). Ital. J. Zool., 79(1):136-150. [ Links ]
5. Barlow, J; J Louzada; L Parry; MIM Hernández; J. Hawes; et al. 2010. Improving the design and management of forest strips in human-dominated tropical landscapes: a feld test on Amazonian dung beetles. J. Appl. Ecol., 47:779-788. [ Links ]
6. Barraza, J; J Montes; N Martínez & C Deloya. 2010. Ensamblaje de escarabajos coprófagos (Scarabaeidae: Scarabaeinae) del bosque tropical seco, bahía Concha, Santa Marta (Colombia). Rev. Colomb. Entomol., 36:285-291. [ Links ]
7 Bryant, MM. 2006. Urban landscape conservation and the role of ecological greenways at local and metropolitan scales. Landsc. Urban. Plan., 76:23-44. [ Links ]
8. Camero, E. 2010. Los escarabajos del género Eurysternus Dalman, 1824 (Coleoptera: Scarabaeidae) de Colombia. Boletín de la Sociedad Entomológica Aragonesa (S.E.A.), 46:147-179. [ Links ]
9. Ceballos, G. 1995. Vertebrate diversity, ecology, and conservation in neotropical dry forest. Pp. 195-222 en: Bullock, S; E Medina & HA Mooney (eds). Tropical deciduous Forest Ecosystem. Cambridge Univ. Press, Cambridge. [ Links ]
10 Chao, C & L Jost. 2012. Coverage-based rarefaction and extrapolation: standardizing samples by completeness rather than size. Ecology, 9:2533-2547. [ Links ]
11. CVS-UNAL (Corporación de los Valles del Sinú y San Jorge-Universidad Nacional de Colombia). 2008. Plan de ordenación forestal-cerro murrucucú. Área de amortiguamiento del PNNP. Municipio de Tierralta, Departamento de Córdoba. Cuencas hidrográfcas de las quebradas Tay, Urrá, Ceniza y Juy. Montería. Pp. 208. [ Links ]
12. Davis, AL; C Scholtz; U Kriger; C Deschodl & W Strümpher. 2010. Dung beetle assemblage structure in Tswalu Kalahari reserve: responses to a mosaic of landscape types, vegetation communities, and dung types. Environmental Entomology, 39(3):811-820. [ Links ]
13. Edmonds, WE & J Zídec. 2004. Revision of Neotropical Dung Beetle Genus Oxysternon (Scarabaeidae: Scarabaeinae: Phanaeini). Folia Heyrovskyana, 11:1-58. [ Links ]
14. Estrada, A & R Coates-Estrada. 1991. Howler monkeys (Alouatta palliata), dung beetles (Scarabaeidae) and seed disperal: ecological interactions in the tropical rain forest of Los Tuxtlas, Mexico. J. Trop. Ecol., 7:459-474. [ Links ]
15. Fahrig, L. 2003. Effects of habitat fragmentation on biodiversity. Ann. Rev. Ecol. Syst., 34:487-515. [ Links ]
16. Feinsinger, P. 2003. El diseño de estudios de campo para la conservación de la biodiversidad. Editorial FAN, Santa Cruz de la Sierra, Bolivia. Pp. 243. [ Links ]
17. Gray, CL; EM Slade; DJ Mann & OT Lewis. 2014. Do riparian reserves support dung beetle biodiversity and ecosystem services in oil palm-dominated tropical landscapes? Ecol. Evol., 4(7):1049-1060. [ Links ]
18. Gollan, J; C Reid; P Barnes & L Wilkie. 2011. The ratio of exotic-to-native dung beetles can indicate habitat quality in riparian restoration. Insect Conserv. Divers., 4:123-131. [ Links ]
19. Haberl, H; KH Erb; F Krausmann; V Gaube; A Bondeau; et al. 2007. Quantifying and mapping the human appropriation of net primary production in earth's terrestrial ecosystems. Proc. Natl. Acad. Sci. USA, 4(31):12942-12947. [ Links ]
20. Halffter, G & E Matthews. 1966. The natural history of dung beetles of the subfamily Scarabaeinae. Folia Entomol. Mex., 12-14:1-312. [ Links ]
21. Halffter, G & M Favila. 1993. The Scarabaeinae (Insecta: Coleoptera) and animal group for analyzing, inventorying and monitoring biodiversity in tropical rainforest and modifed landscapes. Biology International, 27:15-21. [ Links ]
22. Harvey, CA; A Medina; DM Sánchez; S Vilchez; B Hernández; et al. 2006. Patterns of animal diversity in different forms of tree cover in agricultural landscapes. Ecol. Appl., 16:1986-1999. [ Links ]
23. Harvey, CA; O Koman; R Chazdon; B Ferguson; B Finegan; et al. 2008. Integrating agricultural landscapes with biodiversity conservation in the Mesoamerican hotspot. Conservation Biology, 22(1):8-15. [ Links ]
24. Holdridge, LR. 1979. Ecología basada en zonas de vida. San José de Costa Rica. Pp. 217. [ Links ]
25. Horgan, F. 2007. Dung beetles in pasture landscapes of Central America: proliferation of synanthropogenic species and decline of forest specialists. Biodivers. Conserv., 16:2149-2165. [ Links ]
26. Horgan, F. 2009. Invasion and retreat: shifting assemblages of dung beetles amidst changing agricultural landscapes in central Peru. Biodivers. Conserv., 18:3519-3541. [ Links ]
27. Hsieh, TC; K Ma & A Chao. 2013. iNEXT online: interpolation and extrapolation (Version 1.2.0) [Software]. Available from: http://chao.stat.nthu.edu.tw/inext/. [ Links ]
28. IAvH-Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. 1998. El bosque seco tropical (Bs-T) en Colombia. Programa de Inventario de la Biodiversidad Grupo de Exploraciones y Monitoreo Ambiental GEMA-IAvH. Bogotá, Colombia. [ Links ]
29. IUCN. 2014. The IUCN Red List of Threatened Species. Version 2014.3. http://www.iucnredlist.org. [ Links ]
30. Ives, C; G Hose; D Nipperess & M Taylor. 2011. Environmental and landscape factors influencing ant and plant diversity in suburban riparian corridors. Landsc. Urban Plan., 103:372-382. [ Links ]
31. Jost, L. 2006. Entropy and diversity. Oikos, 113:363-375. [ Links ]
32. Jost, L. 2007. Partitioning diversity into independent alpha and beta components. Ecology, 88:2427-2439. [ Links ]
33. Jost, L. 2010. The relation between evenness and diversity. Diversity, 2:207-232. [ Links ]
34. Kohlmann, B & A Solís. 2001. El género Onthophagus en Costa Rica. G. Ital. Entomol., 49(9):159-261. [ Links ]
35. Lambeets, K; F Hendrickx; S Vanacker; K Van Looy; J Maelfait; et al. 2008. Assemblage structure and conservation value of spiders and carabid beetles from restored lowland river banks. Biodivers. Conserv., 17:3133-3148. [ Links ]
36. Laurance, W; DC Useche; J Rendeiro; M Kalka; CJ Bradshaw; et al. 2012 Averting biodiversity collapse in tropical forest protected areas. Nature, 489(7415):290-294. [ Links ]
37. Lees, C & C Peres. 2008. Conservation value of remnant riparian forest corridors of varying quality for amazonian birds and mammals. Conserv. Biol., 22:439-449. [ Links ]
38. Marczak, L; T Sakamiki; S Turvey; I Deguise; S Wood & J Richardson. 2010 Are forested buffer an effective conservation strategy for riparian fauna? An assessment using meta-analysis. Ecol. Appl., 20:126-134. [ Links ]
39. Martínez, NJ; H García; A Pulido, D Ospino & JC Narváez. 2009. Fauna de escarabajos coprófagos (Coleoptera: Scarabaeinae) en un gradiente altitudinal en la vertiente Noroccidental de la Sierra Nevada de Santa Marta, Colombia. Neotrop. Entomol., 38:708-715. [ Links ]
40. Martínez, NJ; G Salcedo Muñoz; K Sierra Quintero & J Barraza Méndez. 2012. Escarabajos coprófagos (Coleoptera: Scarabaeinae) asociados a excrementos de mamíferos en un fragmento de bosque seco tropical en el Departamento del Atlántico, Colombia. Ecol. Austral, 22:203-210. [ Links ]
41. Meave, J; M. Kellman; A Macdougall & J Rosales. 1991. Riparian habitats as tropical forest refugia. Glob. Ecol. Biogeogr. Lett., 1:69-76. [ Links ]
42. Meave, J & M Kellman. 1994. Maintenance of rain forest plant diversity in tropical riparian forest fragments: implications for species conservation during Pleistocene drought. J. Biogeogr., 21:121-135. [ Links ]
43. Medina, CA & A Lopera-Toro. 2001. Clave ilustrada para la identificación de géneros de escarabajos coprófagos (Coleoptera: Scarabaeinae) de Colombia. Caldasia, 22(2):299-315 [ Links ]
44. Miller, L; A Savage & H Giraldo. 2004. Quantifying remaining forested habitat within the historic distribution of the cotton-top tamarin (Saguinus oedipus) in Colombia: implications for long-term conservation. Am. J. Primatol., 64: 451-457. [ Links ]
45. Nichols, E; S Spector; J Louzada; T Larsen; S Amezquita; et al. 2008. Ecological functions and ecosystem services provided by Scarabaeinae dung beetles. Biol. Conserv., 141:1461-1474. [ Links ]
46. NRC (National Research Council). 2002. Riparian areas: functions and strategies for management. National Academy Press, Washington, D.C., USA. [ Links ]
47. Patten, D. 1998 Riparian ecosystems of semi-arid North America: diversity and human impacts. Wetlands, 18:498-512. [ Links ]
48. Perry, R; T Wingley; M Melchior; R Thill; P Tappe & D Miller. 2011. Widh of riparian buffer and structure of adjacent plantations infuence occupancy of conservation priority birds. Biodivers. Conserv., 20:625-642. [ Links ]
49. Phalan, B; M Bertzky; SHM Butchart; PF Donald; JPW Scharlemann; et al. 2013. Crop expansion and conservation priorities in tropical countries. PLoS ONE, 8(1):e51759. [ Links ]
50. Pizano, C & H. García (eds.). 2014. El Bosque Seco Tropical en Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH). Bogotá, D.C., Colombia. [ Links ]
51. R Core Team. 2014. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-project.org. [ Links ]
52. Ribeiro, JW; AP Lima & WE Magnusson. 2012. The Effect of Riparian Zones on Species Diversity of Frogs in Amazonian Forests. Copeia, 3:375-381. [ Links ]
53. Rös, M; F Escobar & G Halffter. 2012. How dung beetles respond to a human-modified variedated landscape in Mexican cloud forest: a study of biodiversity integrating ecological and biogeographical perspectives. Divers. Distrib., 18:377-384. [ Links ]
54. Solís, A & B Kohlmann. 2002. El género Canthon (Coleoptera:Scarabaeidae) en Costa Rica. G. Ital. Entomol., 10:1-68. [ Links ]
55. Solís, C; JA Noriega & G Herrera. 2011. Escarabajos coprófagos (Coleoptera: Scarabaeinae) en tres bosques secos del departamento del Atlántico-Colombia. Bol. Mus. Entomol. Univ. Valle, 12:33-41. [ Links ]
56. Tóthmérész, B. 1995. Comparison of dierent methods for diversity ordering. J. Veg. Sci., 6:283-290. [ Links ]
57. Vaz-de-Mello, FZ; WD Edmonds; FC Ocampo & P Schoolmeesters. 2011. A multilingual key to genera and subgenera of the subfamily Scarabaeinae of the New World (Coleoptera: Scarabaeidae). Zootaxa, 2854:1-73. [ Links ]
58. Virgós, E. 2001. Relative value of riparian woodlands in landscapes with different forest cover for medium-sized Iberian carnivores. Biodivers. Conserv., 10:1039-1049. [ Links ]
59. Whittaker, RH. 1965. Dominance and diversity in land plant communities. Science, 147:250-260. [ Links ]
60. Wright, HL; IR Lake & PM Dolman. 2012. Agriculture a key element for conservation in the developing world. Conserv. Lett., 5:11-19. [ Links ]














