Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral vol.28 no.1 Córdoba abr. 2018
ARTÍCULO
Fitotoxicidad de un formulado comercial de glifosato sobre Lemna gibba L.
Silvana M. J. Sione1,*; Adriana C. Ramírez2; María C. Sasal3; Enrique V. Paravani4; Marcelo G. Wilson3; Emmanuel A. Gabioud3; Wanda Polla2; María R. Repetti5 & José D. Oszust1
1 Facultad de Ciencias Agropecuarias, Universidad Nacional de Entre Ríos. Entre Ríos, Argentina.
2 Facultad de Humanidades y Ciencias, Universidad Nacional del Litoral. Santa Fe, Argentina.
3 Instituto Nacional de Tecnología Agropecuaria, EEA Paraná. Entre Ríos, Argentina.
4 Facultad de Ingeniería, Universidad Nacional de Entre Ríos. Entre Ríos, Argentina.
5 Facultad de Ingeniería Química, Universidad Nacional del Litoral. Santa Fe, Argentina.
Recibido: 12 de junio de 2017
Aceptado: 24 de noviembre de 2017
Editor asociado: Pedro Laterra
RESUMEN
El objetivo fue evaluar la fitotoxicidad de un formulado comercial de glifosato (sal potásica al 62%, equivalente a 506 g p.a./L) sobre Lemna gibba, a campo y en laboratorio. El estudio a campo se desarrolló en un embalse asociado a un ambiente agrícola. Allí se realizó un análisis temporal, con observaciones en cuatro momentos en función de la proximidad a la fecha de aplicación del herbicida en el lote agrícola y al primer evento de precipitación que generó escurrimiento. La fitotoxicidad se evaluó sobre biomasa seca por fronde (BF) y contenido total de clorofila (CTC). Durante 15 días, en condiciones controladas se ensayaron 8 tratamientos con exposición a concentraciones de glifosato que variaron entre 0 y 15 mg/L. Se determinó el crecimiento poblacional, CTC y longitud de raíz. A campo, la inhibición significativa de BF y CTC registrada a posteriori del evento de precipitación no se pudo asociar a concentraciones de glifosato en el cuerpo de agua. Estos efectos podrían ser atribuidos al escurrimiento de otros agroquímicos que no fueron analizados. En laboratorio se verificó efecto fitotóxico sobre la longitud radical a partir de concentraciones de 0.2 mg/L. La información generada contribuye al diagnóstico de riesgo de contaminación por herbicidas en agroecosistemas. Los resultados obtenidos no son concluyentes e indican la necesidad de profundizar este tipo de estudios, dada la complejidad que reviste la investigación del efecto de agroquímicos en el ambiente.
Palabras clave: Herbicida; Efectos fitotóxicos; Bioindicadores; Lenteja de agua; Agroecosistemas.
ABSTRACT
Phytotoxicity of one commercial formulated glyphosate on Lemna gibba L.
The aim was to evaluate the phytotoxicity of one commercial formulated glyphosate (potassium salt, 62%, 506 g e.a./L) on Lemna gibba in field trials and in controlled laboratory conditions. The field study was conducted in a lentic water body associated with an agro-environment (Entre Ríos, Argentina). We conducted a temporary analysis with observations at four moments according to the proximity of the date of herbicide application in the agricultural lot and the first rainfall event that caused runoff. The phytotoxicity was evaluated on the dry biomass of frond (BF) and total chlorophyll content (TCC). In the laboratory, eight treatments were tested according to different concentrations of glyphosate (0 to 15 mg/L). The phytotoxic effects were assessed on the growth rate (GR), TCC and root length. In field study, the significant inhibition of BF and TCC observed in the subsequent sampling to the rainfall event that caused runoff could not be associated with concentrations of glyphosate in the body of water. These effects may be a��ributed to runoff of others agrochemicals not analyzed. In the laboratory, a significant reduction of root length was detected, while no significant differences were observed in GR and TCC between treatments. The information generated contributes to the diagnosis of risk herbicide contamination in agroecosystems. The results obtained are not conclusive and show the need to deepen this type of studies, given the complexity of the agrochemicals research and their effects on the environment.
Keywords: Herbicide; Phytotoxic effects; Biomarkers; Duckweed; Agroecosystems.
INTRODUCCIÓN
En la Argentina se ha producido un proceso de expansión del cultivo de soja debido al reemplazo de sistemas naturales a partir del desmonte y por la sustitución del área sembrada con otros cultivos; esto dio origen a un escenario de simplificación agrícola (Aizen et al. 2009). En los últimos diez años, la superficie destinada al cultivo de soja alcanzó 20.2 millones de hectáreas, con una producción de 55.6 millones de toneladas de granos de soja en la campaña 2013/2014 (Bolsa de Comercio de Rosario 2015). El incremento en la superficie sembrada con soja bajo siembra directa, sumado al uso casi exclusivo de variedades transgénicas resistentes a glifosato, generó un aumento significativo en los volúmenes utilizados de este herbicida, lo que representa 65% del volumen de fitosanitarios comercializados (CASAFE 2014).
Los sistemas acuáticos constituyen los sumideros naturales de la mayoría de las sustancias emitidas por las actividades agrícolas e industriales, por lo que son vulnerables a la contaminación (Manahan 2007). En la provincia de Entre Ríos, el riesgo de contaminación del agua superficial con herbicidas por escurrimiento es elevado dadas las características topográficas, la baja capacidad de infiltración de los suelos, el régimen pluviométrico y la profusa red hidrológica. Estudios de lixiviación y escurrimiento indican que el glifosato puede ser transportado desde parcelas agrícolas hacia cursos de agua superficiales vía difusa cuando su aplicación se realiza en momentos previos a lluvias intensas (Flury 1996; Villholth et al. 2000; Jaynes et al. 2001; Elliot et al. 2002; Petersen et al. 2002; Sasal et al. 2010; Di Fiori et al. 2012). En la Región Pampeana argentina se detectó glifosato en cursos de aguas superficiales. En un cuerpo léntico asociado a un ambiente agrícola, el monitoreo de las concentraciones de glifosato en el agua, en un período de 5 años, arrojó valores que oscilaron entre no detectado (ND), inferiores al umbral de detección por HPLC (0.2 μg/L) y 30 μg/L (Sasal et al. 2013). Por su parte, en cuatro cursos de agua del área agrícola de la Pampa Ondulada bonaerense, Peruzzo et al. (2008) registraron concentraciones de glifosato de 0.10 a 0.70 mg/L. Investigaciones desarrolladas en cursos de agua superficial de la provincia de Santa Fe asociados a ambientes agrícolas informaron niveles de glifosato en la fracción disuelta entre 0.5 y 7.8 μg/L, en tanto que en los sedimentos, las valores de glifosato variaron entre 8.0 y 49.1 μg/kg húmedo (Ayarragaray et al. 2014). Sasal et al. (2017), en una red de 300 puntos de monitoreo de aguas superficiales en la provincia de Entre Ríos, registraron concentraciones de glifosato muy elevadas en el 4.7% de los puntos; los valores oscilaron entre 73 y 105 mg/L, atribuidos a la contaminación puntual por el lavado de los envases. Cabe destacar que, además del principio activo (p.a.), otros componentes de los formulados comerciales (i.e., coadyuvantes y surfactantes) también pueden llegar a los cursos de agua. Se ha indicado que estos coadyuvantes (e.g., el POEA del formulado Roundup®) podrían tener efectos de mayor toxicidad que el principio activo solo (Adam et al. 1997; Dallagrave et al. 2002), lo que incorpora complejidad en los estudios de toxicidad de los formulados comerciales.
El uso de bioindicadores de toxicidad ha adquirido relevancia para evaluar el efecto de los plaguicidas sobre el ambiente (Athie and Cerri 1987; Fairchild et al. 1997; Marozzi et al. 2004; Attademo et al. 2011; Agostini et al. 2013; Bonifacio et al. 2016). En este sentido, se señaló la eficiencia de las macrófitas acuáticas en el tratamiento de aguas residuales, dado su poder de proliferación, capacidad de absorción y acumulación de contaminantes (Novotny and Olem 1994; Pezzolesi et al. 1998; Otto et al. 1999; Pilon-Smits et al. 1999; Qiu et al. 2001), y en ensayos de fitotoxicidad, para evaluar el efecto de plaguicidas, detergentes y metales pesados sobre organismos vivos (Olguín and Hernández 1998). A fin de evaluar la fitotoxicidad de contaminantes, la Agencia de Protección Ambiental de los Estados Unidos (EPA, su sigla en inglés) recomienda usar algunas especies vegetales en protocolos estandarizados. Entre estas plantas se encuentran Lemna gibba L. y Lemna minor L. (lentejas de agua), de mayor sensibilidad a los herbicidas y a los metales pesados, en relación a los químicos industriales (EPA 1996; Environment Canada 1999).
A su vez, a las especies del género Lemna se las considera indicadoras de toxicidad debido a sus características de alta productividad y eficiencia de remoción de nutrientes y contaminantes, su alta dominancia en condiciones naturales adversas y su fácil cosecha. Las especies de Lemna son plantas vasculares pequeñas, formadas por una estructura tipo talo denominada fronde, con una sola raíz adventicia. Las frondes son suborbiculares, de 3-8 mm de diámetro, generalmente reunidos de a tres (colonias) (Giardelli 1968). Estas especies se reproducen asexualmente mediante la producción de frondes hijos, con tasas de crecimiento muy elevadas: bajo condiciones óptimas pueden duplicar su biomasa en 2 ó 3 días (Hillman 1961; Leng et al. 1995), o en tan sólo 24 h. Pueden producir entre 10 y 20 nuevas frondes por fronde (Curt Fernández de la Mora 2005). Si bien existen investigaciones que muestran el potencial de Lemna spp. para remover fosfatos y acumular metales pesados disueltos en cuerpos de agua (Athie and Cerri 1987; Boniardi et al. 1999; Lianget al. 2011), existen pocos estudios relacionados con su uso en bioensayos para determinar la fitotoxicidad por herbicidas, en general, y por glifosato, en particular.
El objetivo de este trabajo fue evaluar la fitotoxicidad del formulado comercial de glifosato Sulfosato Touchdown® sobre la especie no-blanco Lemna gibba L. en condiciones controladas de laboratorio y en un estudio observacional de campo. La cuantificación de la concentración de glifosato que llega a un cuerpo de agua luego de una aplicación y el estudio detallado de su efecto sobre una especie nativa característica de los cursos de agua de la región contribuirán al diagnóstico de riesgo de contaminación en agroecosistemas y, en consecuencia, servirán como herramientas para planes de mitigación de los impactos ambientales por el uso de agroquímicos.
MATERIALES Y MÉTODOS
Estudio observacional en condiciones de campo
La investigación se desarrolló en la Estación Experimental Agropecuaria Paraná (Entre Ríos, Argentina) del Instituto Nacional de Tecnología Agropecuaria (INTA). El clima del área es templado húmedo de llanura, con una precipitación anual media de 1000 mm. El período octubre-abril concentra 73% de la precipitación anual. Enero, febrero y marzo son los meses con mayor índice de erosividad de las lluvias. Este índice aumentó en los últimos años: en el decenio 1995-2005 se registró un incremento de 15% con respecto al período 1950-1994 (Saluso 2008).
El estudio observacional se llevó a cabo en un embalse endicado hace más de 40 años, que conforma un cuerpo de agua léntico de ~1 ha (31°50’47.44’ S - 60°31’48.5’ O). El cuerpo de agua es un área de descarga de una capa freática colgante que alcanza hasta 9 m de profundidad en las partes más altas del paisaje y recibe agua por escurrimiento de una microcuenca agrícola de 24 ha. Esta microcuenca posee dos laderas, con pendientes de 4% (oeste) y 8% (este), que desaguan a un canal central que desemboca en el cuerpo de agua. En el lote agrícola se practica una secuencia de cultivos maíz-trigo/ soja (tres cultivos en dos años) bajo siembra directa. Anualmente, el lote recibe entre 2 y 3 aplicaciones de glifosato para controlar las malezas. El suelo es Argiudol ácuico.
El cuerpo de agua presenta dominancia de L. gibba en asociación con Wolffia sp. El aporte de nutrientes desde la cuenca agrícola favorece el desarrollo de estas especies y el mantenimiento de sus poblaciones. En determinadas épocas del año se alcanzan coberturas cercanas al 100%. La temperatura del agua a 5 cm de profundidad durante el estudio observacional osciló entre 18.3 y 24.2 °C.
En noviembre de 2014 se desarrolló un estudio observacional de fitotoxicidad del formulado comercial de glifosato Sulfosato Touchdown®, de Syngenta (una sal potásica del ácido N-(fosfonometil) glicina al 62%, equivalente a 506 g p.a./L) sobre L. gibba. Se realizó un análisis temporal en función de la proximidad a la fecha de aplicación de glifosato en el lote agrícola asociado, y al primer evento de precipitación que generó escurrimiento desde la microcuenca hacia el cuerpo de agua.
Para la evaluación temporal, una semana antes de que se aplicara el herbicida en el lote agrícola se instalaron 20 unidades experimentales (limnocorrales) en el cuerpo de agua. Los limnocorrales consistían en recipientes de plástico de 25 cm de diámetro, cuya base y laterales fueron calados y cubiertos con tela tipo tul para permitir la circulación del agua. Estas unidades fueron ubicadas en la desembocadura del canal de desagüe de aporte desde el lote agrícola. A cada dispositivo se le anexó un flotador para que flotara libremente. En cada limnocorral se colocó un total de 200 frondes de L. gibba; se seleccionaron colonias de hasta 3 frondes con buen grado de desarrollo. En cada momento del análisis temporal se evaluaron 5 limnocorrales seleccionados al azar. Se efectuaron observaciones sobre los individuos de L. gibba en cuatro momentos: 1 día antes de la aplicación del herbicida (pre-aplicación, T1), a 2 días desde la aplicación (T2), a 5 días desde la aplicación y 1 día después del evento de precipitación (T3), y a 8 días desde la aplicación y 5 días posteriores al evento de precipitación (T4). Se considera al tiempo como variable clasificatoria.
El formulado comercial fue aplicado en el lote agrícola asociado al cuerpo de agua, a una dosis de 2 L/ha (equivalente a 1.012 kg p.a./ha). Cabe destacar que en el marbete del formulado comercial no se indican qué coadyuvantes contiene. La fecha de aplicación fue el 26 de noviembre de 2014, momento de la siembra de soja (en siembra directa) en el lote agrícola asociado. Al momento de la aplicación, la velocidad media del viento era de 7.5 km/h, con dirección E-NE. A 4 días de la aplicación del herbicida se registró una precipitación de 33.2 mm que generó escurrimiento. Para la región de estudio, en parcelas de escorrentía con diseño FAO, con 3.5% de pendiente, se determinó que una lluvia genera escurrimiento cuando supera los 15 mm/día (Sasal et al. 2010).
Para determinar la fitotoxicidad del formulado de glifosato sobre L. gibba se retiraron los limnocorrales del cuerpo de agua (en cada uno de los cuatro momentos de observación) y se procesó el material vegetal en laboratorio. Se analizó: a) la biomasa seca, que se determinó pesando la biomasa total contenida en cada limnocorral, previo secado en estufa a 75 °C hasta peso constante. Además, se estimó la biomasa por fronde (BF, μg/fronde) mediante el cociente entre la biomasa total obtenida en cada limnocorral y el número total de frondes presentes en cada uno, y b) el contenido total de clorofila (CTC) por medio del método de extracción con acetona (Lichtenthaler 1987). Sobre 1 g de peso húmedo, se homogeneizó en mortero con acetona grado analítico y se centrifugó a 10000 rpm durante 5 minutos. Con el sobrenadante se determinó la absorbancia. El CTC fue expresado en mg/g de peso fresco (PF) de material vegetal.
La inhibición aparente producida por el herbicida sobre las variables estudiadas se calculó como el porcentaje de reducción respecto a los valores de esas variables en T1 (pre-aplicación del formulado). En cada momento de observación se extrajeron muestras de agua para el análisis de glifosato. Las muestras se colectaron en botellas estériles, refrigeradas hasta el momento de su análisis. La concentración de glifosato fue determinada mediante la técnica UHPLC-MS/MS (según Ibáñez et al. 2006]y Hanke et al. 2008, con modificaciones por Sasal et al. 2015), con un límite de detección de 0.2 μg/L. Se utilizó un cromatógrafo Acquity UPLC (The Science of What´s Possible®, Waters) acoplado a un espectrómetro de masa de triple cuadrupolo con fuente ESI (TQD, Waters Micromass, Reino Unido). Las separaciones se realizaron a 40 °C usando una columna Acquity UPLC HSS C18 (tamaño de partícula 1.8 μm, 2.1x100 mm) a una velocidad de flujo de 0.35 mL/ min. Las alícuotas de 10 μL del patrón y los extractos de las muestras fueron introducidas por medio de un inyector automático (Waters). La fase móvil consistió de H2O/MeCN (98:2 + 0.1% AF, denominada A1) y MeCN (0.1% AF, denominada B1), operando con un gradiente de tiempo de ejecución de 10 min. La ionización fue realizada en modo de ion positivo usando nitrógeno como gas de desolvatación y gas de cono a 600 y 15 L/h, respectivamente.
Para registrar las condiciones físico-químicas del agua durante el período del ensayo, asociado a cada uno de los tratamientos evaluados se determinó el pH y la temperatura del agua con una sonda multiparamétrica (Consort C933). Las determinaciones se realizaron en puntos próximos a los limnocorrales.
Ensayo en condiciones de laboratorio
Previo a la aplicación del herbicida en el lote agrícola se colectaron frondes de L. gibba en el mismo cuerpo de agua donde se efectuó el estudio observacional a campo. Las frondes fueron enjuagadas con abundante agua destilada y mantenidas una semana bajo las condiciones de laboratorio, antes de realizar la experiencia. El ensayo se inició con 10 frondes por tratamiento, seleccionando cuidadosamente colonias formadas por no más de 3 frondes con buen grado de desarrollo y que presentaran raíces bien desarrolladas. Las frondes fueron colocadas en recipientes de 500 mL, donde se prepararon diluciones del formulado de glifosato Sulfosato Touchdown de Syngenta 62% (mismo producto que el aplicado a campo). Para las diluciones se utilizó agua extraída del cuerpo léntico (en la que no se detectó presencia de glifosato por HPLC), previamente filtrada.
Se ensayaron 8 tratamientos con 3 repeticiones cada uno, correspondientes a las siguientes concentraciones de ingrediente activo: T1) 0 mg/L; T2) 0.2 mg/L; T3) 0.5 mg/L; T4) 1 mg/ L; T5) 2.5 mg /L; T6) 5 mg/L; T7) 7.5 mg/L y T8) 15 mg/L. Las concentraciones evaluadas se corresponden con valores registrados en ensayos previos en parcelas experimentales de escurrimiento superficial donde se detectaron concentraciones máximas de 2.5 mg/L (Sasal et al. 2012) y en puntos de monitoreo de cursos de aguas superficiales a escala provincial (Sasal et al. 2017).
El ensayo duró 15 días. Los recipientes fueron mantenidos en condiciones controladas de laboratorio (24±2 °C y fotoperíodo de 16 h de luz por medio de un fluorescente de luz blanca de 4300 lux). La exposición al herbicida se realizó en ensayos sin renovación de la solución. El pH de la solución se mantuvo entre 7.6 y 8.1 a lo largo del ensayo, ajustado diariamente con ácido clorhídrico (HCl) 1N. Para estimar la reducción de la concentración de glifosato a lo largo del ensayo, por medio de UHPLC-MS/MS se determinó su concentración en la solución al inicio y a los 15 días.
La fitotoxicidad del formulado fue evaluada sobre la tasa de multiplicación poblacional de las colonias de frondes, el contenido total de clorofila y la longitud de raíz. a) Tasa de multiplicación (TM). Para obtener esta variable poblacional se determinó el número de frondes a los 2, 4, 7, 9, 12 y 15 días de exposición al formulado de glifosato. La tasa de multiplicación diaria fue estimada para cada tiempo de exposición evaluado, a partir de la fórmula propuesta por Environment Canada (1999), citada por Sobrero et al. (2007):
TM = 1000*(log Ft-log F0)/t
donde Ft = número de frondes en el tiempo t; F0 = número de frondes en el tiempo 0, y t: duración del ensayo en días.
Se construyeron las curvas de crecimiento poblacional en cada tratamiento evaluado y se representó el número de frondes en función del tiempo de exposición al herbicida, b) contenido total de clorofila (CTC) a los 15 días de exposición, c) longitud de raíz, determinada con calibre, a los 15 días de exposición al herbicida (final del ensayo). Se calculó el promedio de la longitud radical de 10 frondes seleccionados aleatoriamente en cada unidad experimental. En este ensayo también se estimó la inhibición producida por el formulado sobre la TM, el CTC y la longitud radical. La inhibición se calculó como el porcentaje de reducción de estas variables en relación al tratamiento sin exposición al producto (testigo, T1).
Análisis estadístico de los datos
Los datos de BF y CTC obtenidos en el análisis temporal a campo fueron comparados mediante la prueba t de Student al 5% de significancia, respecto a los valores determinados en el momento pre-aplicación del herbicida (T1). Para el análisis de los datos de número de frondes obtenidos en condiciones de laboratorio se utilizó un modelo lineal generalizado mixto (MLGMx) para variables discretas, y se empleó la distribución de Poisson dado que se considera más adecuada para una variable de recuento (número de frondes en este estudio). Los valores de TM se analizaron mediante un modelo lineal general mixto por tratarse de una variable continua. Se aplicó un análisis de regresión para comparar las curvas de crecimiento poblacional, linealizadas por transformaciones logarítmicas y comparadas sus pendientes.
Por su parte, los datos de CTC y longitud de raíz fueron analizados mediante ANOVA, una vez comprobada la normalidad de los datos (prueba de Shapiro-Wilks). Para el caso de datos no normales, se efectuó la transformación a raíz cuadrada, previo a la aplicación del ANOVA. La comparación de medias de los diferentes tratamientos se realizó aplicando el método de LSD Fisher (P≤0.05). Se trabajó con el software estadístico InfoStat (2005).
RESULTADOS Y DISCUSIÓN
Estudio observacional en condiciones de campo
Se encontraron diferencias significativas (P=0.0117) entre los momentos T1 (prepulverización) y T3 (post-escurrimiento), en términos de BF. Al respecto, las medias muestrales sugieren una menor BF promedio en T3 respecto a T1. También se detectó en T4 un valor medio de BF significativamente inferior (P=0.0007) respecto al momento preaplicación. Para T3, a los 5 días de la aplicación del herbicida y un día después de un evento de precipitación de 33.2 mm, esta reducción fue ~33%, en tanto que para T4, pasados los 8 días desde la aplicación (y 5 días desde la lluvia), la BF resultó 50% inferior en relación a T1 (Figura 1). Respecto al CTC, los valores oscilaron entre 14.6±1.4 y 20.6±1.5 mg/g PF; sólo se observó una inhibición significativa en T4 respecto a T1 (P=0.0074). En este momento de observación, las frondes presentaron CTC 23% inferior al determinado antes de la aplicación del herbicida. En coincidencia con estos resultados, en un estudio efectuado en un arroyo asociado a un lote agrícola, Sobrero et al. (2007) detectaron una reducción de 35.5% en la BF de L. gibba a 5 días de la aplicación del producto comercial Roundup, y una reducción significativa de CTC.

Figura 1. Dinámica de la biomasa (μg/fronde) de Lemna gibba durante el estudio observacional a campo. Las barras de error indican un desvío estándar. La flecha roja indica momento de aplicación del herbicida; la flecha punteada indica el momento del evento de precipitación de 33.2 mm.
Figure 1. Dynamic of dry biomass of frond (μg/frond) of Lemna gibba during field study period. Error bars indicate standard deviation. The red arrow indicates the time of the application of herbicide; the dotted arrow indicates the time of the rainfall event (33.2 mm).
HPLC informaron concentraciones de glifosato inferiores al límite de detección (0.2 μg/L), tanto antes como después de la aplicación del herbicida, en el cuerpo de agua asociado al lote agrícola. Este resultado inesperado puede deberse a que el glifosato se adsorbe con fuerza a la arcilla, al limo y a la materia orgánica de los sedimentos y al material en suspensión, por lo que puede no ser detectado en los ambientes acuáticos cuando se analiza agua sin separar compuestos solubles de particulados (Morillo et al. 2000), como en este trabajo. Por otro lado, Sobrero et al. (2007) indican que los pulsos de concentración de glifosato en agua que producen fitotoxicidad en plantas acuáticas pueden no ser detectados en los muestreos efectuados, y que la sensibilidad de la especie podría obedecer también a la toxicidad de los surfactantes presentes en el formulado ensayado (toxicidad que es aun mayor en pH alcalinos). Si bien en el marbete del formulado aplicado no se detallan los coadyuvantes que lo componen, esta apreciación podría resultar válida para el presente trabajo, ya que el pH determinado en el cuerpo de agua a lo largo del ensayo fue 8.6±0.4. En otra investigación sobre los efectos del glifosato en organismos acuáticos, Ronco (2010) detectó una contribución mayor a la toxicidad del principio activo dado por la toxicidad de POEA. Este autor indica, además, que la presencia de plaguicidas en el medio muestra un comportamiento pulsátil, con variable grado de disipación en función del tipo de compuesto.
Como las concentraciones de glifosato en el cuerpo de agua resultaron inferiores al límite de detección, los efectos observados sobre BF y CTC de L. gibba en T3 y T4 podrían responder al escurrimiento de otros agroquímicos que se usan habitualmente en el área agrícola de aporte al cuerpo de agua, y que no fueron analizados. Primost et al. (2017) midieron concentraciones de glifosato en agua total y en material en suspensión en aguas superficiales de Urdinarrain (Entre Ríos). Estos autores detectaron concentraciones de 0.73±0.65 μg/L de glifosato en agua, y cuando separaron la fracción particulada en las mismas muestras obtuvieron concentraciones de 1126±423 μg/L. Esto explicaría que no se hayan podido cuantificar concentraciones de glifosato, ya que en este trabajo no se analizó la fracción asociada a partículas.
Ensayo en condiciones de laboratorio
En condiciones de laboratorio, la inhibición en la elongación de las raíces resultó el principal efecto fitotóxico observado en los individuos de L. gibba expuestos al formulado de glifosato (Figura 2). A los 15 días de exposición se verificó una reducción significativa (P≤0.05) en la longitud radical a partir de 0.2 mg/L, con relación al testigo (Figura 3). Si bien el NOEL (nivel de efecto no observado) establecido por la EPA (2007) para esta especie es entre 1400 y 1800 μg/L para 14 días, la toxicidad se evidenció con mayor intensidad a concentraciones de 7.5 y 15 mg/L del herbicida, y se detectaron inhibiciones de 85 y 98.6%, respectivamente. Sobrero et al. (2007) observaron una inhibición en la elongación de las raíces de L. gibba por efecto de la exposición a Roundup® Max, y verificaron una inhibición significativa a 7.5 mg/L de principio activo a partir del tercer día de exposición.

Figura 2. Efecto de las aplicaciones del formulado de glifosato sobre la longitud de raíces de Lemna gibba, a 15 días de exposición. Letras distintas indican diferencias significativas (LSD Fisher P≤0.05). Las barras indican un desvío estándar.
Figure 2. Effect of formulated glyphosate applications on the root length of Lemna gibba. Different letters indicate significant differences (LSD Fisher P≤0.05). Error bars indicate one standard deviation.

Figura 3. Efecto de las aplicaciones del formulado de glifosato sobre el crecimiento poblacional de Lemna gibba, según concentración y tiempo de exposición.
Figure 3. Effect of formulated glyphosate applications on the population growth of Lemna gibba, according to concentration and exposure time.
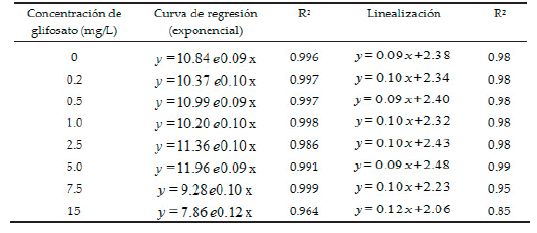
Respecto al número de frondes y TM, no se observaron diferencias significativas para la interacción tiempo y concentración de glifosato. El efecto de las diferentes concentraciones de glifosato sobre las curvas de crecimiento poblacional de L. gibba durante los 15 días de exposición se observan en la Figura 3. Para todas las concentraciones evaluadas, el crecimiento poblacional de la especie siguió un modelo exponencial, con valores de R2 que oscilaron entre 0.96 y 0.99, y pendientes estadísticamente similares (P≤0.05) entre tratamientos (Tabla 1).
Tabla 1. Ecuaciones correspondientes a las curvas de crecimiento poblacional de Lemna gibba, según concentración de glifosato durante 15 días de exposición. Variable y = número de frondes; variable x = tiempo de exposición al herbicida (días).
Table 1. Equations corresponding to Lemna gibba population growth curves, according to glyphosate concentration during 15 days of exposure. Variable y = number of fronds; variable x = exposure time to herbicide (days).
Si bien no se observaron diferencias significativas en TM por exposición a diferentes concentraciones del herbicida, durante los 15 días de duración del ensayo se evidencian tendencias a que los efectos sean de mayor magnitud sobre la TM a 7.5 y 15 mg/L del herbicida y durante los primeros días de exposición, en relación al testigo (Tabla 2, Figura 4). Cooley and Foy (1986) observaron un efecto de inhibición del crecimiento de L. gibba por acción del glifosato, lo que indica que 10-4 M redujeron el crecimiento de la especie a casi un tercio del crecimiento registrado en los controles no tratados, mientras que 10-5 M no tuvo ningún efecto. A 7.5 mg/L, la mayor sensibilidad se observó a los dos días de exposición, con una inhibición de 35.7% en la TM y una reducción progresiva y recuperación total a los 15 días. A 15 mg/L del formulado de glifosato, el porcentaje de inhibición en la TM durante el tiempo de exposición posee un patrón de variación diferente. En esta concentración, la inhibición en la TM alcanzó 7% a los dos días de exposición y 25% desde los cuatro hasta los nueve días. Hacia los 15 días se determinó una recuperación en la TM (Figura 4).
Tabla 2. Efecto de las aplicaciones del formulado de glifosato sobre la tasa de multiplicación (1000 F/día) de Lemna gibba, según concentración y tiempo de exposición.
Table 2. Effect of formulated glyphosate applications on the growth rate (1000 F/día) de Lemna gibba, according to concentration and exposure time.


Figura 4. Inhibición en la tasa de multiplicación de Lemna gibba por efecto de la concentración del formulado de glifosato (7.5 y 15 mg/L) y tiempo de exposición en relación al control.
Figure 4. Inhibition of the growth rate of Lemna gibba by the formulated glyphosate concentration (7.5 and 15 mg/L) and exposure time.
Martin et al. (2003) afirman que a bajas concentraciones del ingrediente activo del Roundup® Max, los efectos sobre la TM son más severos a los tres días de exposición y que se observa una recuperación del daño a los 7 días, posiblemente debido a la disminución de principio activo en el medio (70% de reducción a las 24 h). En este trabajo, si bien en cada tratamiento hubo una reducción de la concentración de glifosato al finalizar el ensayo (15 días), la reducción varió entre 4 y 14%. La máxima reducción fue de 1.2 mg/L (T7). Goldsborough and Beck (1989) afirman que las principales formas de pérdida de glifosato en la columna de agua se deben a la adsorción por el sedimento y a la biodegradación. Las características de este ensayo no permiten identificar la causa de la reducción de la concentración de glifosato en agua. Para atribuirlo a absorción por L. gibba debería haberse realizado un análisis de tejido.
Estudios desarrollados por Sobrero et al. (2007) en los que se evalúa la fitotoxicidad del herbicida Roundup® Max sobre L. gibba, indican efecto sobre el crecimiento poblacional de concentraciones mayores a 1 mg/L de glifosato (tanto de p.a. como de formulado) durante 10 días de exposición. Estos autores observaron un efecto negativo altamente significativo sobre la producción de nuevas frondes a partir de 7.5 mg/L de principio activo, determinando curvas de crecimiento lineales. Para el caso del principio activo, para concentraciones de 7.5 y 15 mg/L, la inhibición registrada por estos autores en la TM permanece constante a partir del quinto día de exposición.
En nuestro estudio, los valores de CTC registrados a los 15 días de exposición al formulado de glifosato oscilaron entre 9.7 mg/g (T1) y 22.9 mg/g (T8). Si bien no pudo detectarse efecto significativo (P≤0.05) del herbicida sobre el CTC, se observó marcada clorosis sobre los individuos expuestos a concentraciones de 15 mg/L. Este efecto se verificó principalmente en frondes jóvenes y fue muy marcado respecto a las frondes madres, lo cual, sumado a la reducción en el número y el tamaño de las frondes nuevas, podría interferir en la cuantificación del CTC al causar una subestimación del efecto del formulado de glifosato sobre esta variable. Sobrero et al. (2007) observaron clorosis en L. gibba a partir de los dos días de exposición a 7.5 mg p.a./L y concentraciones mayores, como principio activo y formulado comercial, respectivamente; los efectos se incrementaron con el tiempo de exposición. A 1 y 7.5 mg p.a./L de Roundup (dos días), los autores registraron exaltación en el CTC, y una reversión de esta respuesta a mayor tiempo de ensayo. A los 7 días de exposición a 1 mg/L de glifosato como p.a. (CEA), la reducción del CTC de la población resultó significativa (23%), y no fue así para la misma concentración del formulado Roundup.
El mecanismo de acción del glifosato es por medio de la inhibición de la biosíntesis de aminoácidos aromáticos en las plantas (triptófano, fenilalanina y tirosina) al inhibir la enzima 5-enolpiruvil-shikimato-3-fosfatosintetasa (EPSPS). Esto reduce la producción de proteína y el desarrollo de la planta (Eslava et al. 2007). Por otra parte, afecta la síntesis de clorofilas y carotenos, además de la actividad de enzimas relacionadas, lo cual inhibe la fotosíntesis.
En la provincia de Entre Ríos se ha identificado un total de 59 embalses de agua superficial para riego. Estos embalses cubren una superficie de ~9400 ha, sin considerar aquellos de menor tamaño, que suelen ser destinados al consumo animal (Carñel et al. 2006). En estos embalses, las pendientes pronunciadas se aprovechan para captar agua para distintos usos, y constituyen áreas de descarga de napas freáticas. El valor ambiental que presentan estos cuerpos de agua es significativo, principalmente por la provisión de hábitats esenciales para la conservación de diversos grupos de especies vegetales y animales, por lo que es relevante preservar su calidad. Por esta razón es preocupante el arrastre de agroquímicos hacia esos reservorios de biodiversidad. La Subsecretaría de Recursos Hídricos de Argentina publicó en el año 2003 los niveles guías de calidad de agua ambiente en relación al glifosato; a la protección de la biota acuática le corresponde un valor crónico final de 240 μg/L. En coincidencia con este valor, en condiciones de laboratorio se observaron efectos fitotóxicos sobre L. gibba a partir de concentraciones de 0.2 mg/L.
Los resultados obtenidos en este trabajo presentan controversia. En condiciones de campo, la inhibición significativa de la biomasa por fronde y del contenido total de clorofila de L. gibba luego de la aplicación del herbicida en el lote agrícola asociado y del evento de precipitación no se pudieron asociar a concentraciones de glifosato en el cuerpo de agua, mientras que en laboratorio, concentraciones crecientes de glifosato generaron efectos fitotóxicos sobre la longitud de raíz.
CONCLUSIONES
Este trabajo evalúa la fitotoxicidad del formulado comercial de glifosato Sulfosato Touchdown® sobre la especie no blanco Lemna gibba L. en condiciones controladas de laboratorio y en un estudio observacional de campo. En laboratorio, dosis crecientes de glifosato y superiores al nivel guía para la vida acuática, afectan principalmente el crecimiento radical de la especie evaluada.
Estos resultados contribuyen con el diagnóstico de riesgo de contaminación por herbicidas en agroecosistemas. Sin embargo, la investigación de contaminantes en el ambiente bajo producción agrícola es compleja y los resultados obtenidos no son concluyentes. Esto indica la necesidad de profundizar los estudios, de explorar otras variables para caracterizar la fitotoxicidad y de mejorar la precisión en la detección analítica en fracciones disueltas y particuladas para dilucidar efectos a exposiciones de glifosato y otros agroquímicos en condiciones de campo.
AGRADECIMIENTOS
Este trabajo fue realizado con fondos presupuestarios del MINCyT, en el marco de la línea PFIP del COFECyT (PFIP 512-09), y de los Proyectos INTA PNNAT 1128043 y PRET ERIOS-1263101/2/ 3/4/5. Los autores agradecen a la Dra. M. C. Sobrero por el asesoramiento en el diseño de limnocorrales y recomendaciones relacionadas a la determinación de clorofila.
REFERENCIAS
1. Adam, A., A. Marzuki, H. A. Rahman, and M. A. Ariz. 1997. The oral and intracraneal toxicities of Roundoup and its components in rats. Vet Human Toxicol 39:147-151. [ Links ]
2. Agostini, M. G., F. Kacoliris, P. Demetrio, G. S. Natale, C. Bonetto, and A. E. Ronco. 2013. Anormalities in amphibian populations inhabiting agroecosystems in northeastern Buenos Aires Province, Argentina. Diseases of Aquatic Organisms 104:163-171. [ Links ]
3. Aizen, M. A., L. A. Garibaldi, and M. Dondo. 2009. Expansión de la soja y diversidad de la agricultura argentina. Ecología Austral 19(1):45-54. Versión online. URL: https://goo.gl/YCwGsn. Fecha de consulta: 02/03/2016. [ Links ]
4. Athie, D., and C. C. Cerri. 1987. The use of macrophytes in water pollution control. Pergamon Press, Oxford. Pp. 186. [ Links ]
5. Attademo, A. M., M. Cabagna-Zenklusen, R. C. Lajmanovich, P. M. Peltzer, C. Junges, and A. Basso. 2011. β-esterase activities and blood cell morphology in the frog Leptodactylus chaquensis (Amphibia: Leptodactylidae) on rice agroecosystems from Santa Fe Province (Argentina). Ecotoxicology 20:274-282.
6. Ayarragaray, M., L. Regaldo, U. Reno, and M. F. Gutiérrez. 2014. Monitoreo de glifosato y ácido aminometilfosfónico (AMPA) en ambientes acuáticos cercanos a la ciudad de San Justo (Santa Fe, Argentina). Presentado en: V Congreso Argentino de la Sociedad de Toxicología y Química Ambiental SETAC Argentina, “Producción Sustentable y Compromiso Social para el Cuidado del Ambiente”.
7. Bolsa de Comercio de Rosario. 2015. Rindes superadores reposicionan a la soja en 59 millones t. URL: www.bcr.com.ar/Pages/gea/estimaProd.aspx. Fecha de consulta: 02/03/2016. [ Links ]
8. Boniardi, N., R. Rota, and G. Nano. 1999. Effect of dissolved metals on the organic load removal efficiency of Lemna gibba. Water Res 33(2):530-538. [ Links ]
9. Bonifacio, A., J. Cazenave, C. Bacchetta, M. L. Ballesteros, M. Bistoni, M. V. Amé, L. Bertrand, and A. C. Hued. 2016. Alterations in the general condition, biochemical parameters and locomotor activity in Cnesterodon decemmaculatus exposed to commercial formulations of chlorpyrifos, glyphosate and their mixtures. Ecological Indicators 67:88-97. [ Links ]
10. Cámara de Sanidad Agropecuaria y Fertilizantes (CASAFE). 2014. URL: www.casafe.org/biblioteca. [ Links ]
11. Carñel, G. E., E. L. Díaz, O. C. Duarte, M. G. Wilson, and L. M. Lenzi. 2006. Identificación y cuantificación de las presas para riego en la provincia de Entre Ríos. Pp. 479-492 en R. Benavídez. El arroz. Su cultivo y sustentabilidad en Entre Ríos. Editorial UNER-UNL. C. del Uruguay, Entre Ríos. [ Links ]
12. Cooley, W. E., and C. L. Foy. 1986. Effects of SC-0224 and glyphosate on inflated duckweed Lemna gibba growth and EPSP-synthase activity from Klebsiella pneumonia. Pesticide Biochemistry and Physiology 26:365-374. [ Links ]
13. Curt Fernández de la Mora, M. D. 2005. Macrófitas de interés en fitodepuración. Pp. 91-106 en J. Fernández González (coord.). Manual de Fitodepuración. Filtros de macrófitas en flotación. Proyecto Life. Madrid, España. [ Links ]
14. Dallagrave, E., F. D. Mantese, P. R. Dalsenter, and A. Langeloh. 2002. Acute oral toxicity of glyphosate in Wistar rats. Online J Vet Res 1:29-36. [ Links ]
15. Di Fiori, E., H. Pizarro, M. dos Santos Alfonso, and D. Cataldo. 2012. Impact of the invasive mussel Limnoperma fortunei on glyphosate concentration in water. Ecotoxicol Environ Saf 81:106-13. [ Links ]
16. Dosnon-Olette, R., M. Couderchet, M. A. Oturan, and P. Eullaffroy. 2011. Potential use of Lemna Minor for the phytoremediation of isoproturon and glyphosate. International Journal of Phytoremediation 13(6):601-612. [ Links ]
17. Elliott, J. A., A. J. Cesna, K. B. Best, W. Nicholaichuk, and L. C. Tollefson. 2002. Leaching rates and preferential flow of selected herbicides through tilled and untilled soil. J Environ Qual 29:1650-1656. [ Links ]
18. Environment Canada. 1999. Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte Lemna minor. EPS 1/RM/37, Environmental Canada, Environmental Protection Service, Ottawa. Pp. 98. [ Links ]
19. EPA (Environmental Protection Agency). 1996. Ecological effects test guidelines. Aquatic plant toxicity test using Lemna spp. Tiers I and II. URL: www.epa.gov [ Links ]
20. Eslava, P., W. Ramírez, and I. Rondón. 2007. Sobre los efectos del glifosato y sus mezclas: impacto en peces nativos. Instituto de Acuicultura de los Llanos. Instituto de Investigaciones de la Orinoquia Colombiana. Pp. 34-43. [ Links ]
21. Fairchild, J. F., D. S. Ruessler, P. S. Haverland, and A. R. Carlson. 1997. Comparative sensitivity to Selenastrum capricornutum and Lemna minor to sixteen herbicides. Arch. Environ Contam Toxicology. New York, Springer- Verlag. Pp. 353-357. [ Links ]
22. Flury, M. 1996. Experimental evidence of transport of pesticides through field soil. A review. J Environ Qual 25:25- 45. [ Links ]
23. Giardelli, M. L. 1968. Lemnaceae. Pp. 428-447 en A. L. Cabrera (ed.). Flora de la provincia de Buenos Aires 1, f. 79-85. [ Links ]
24. Hanke, I., H. Singer, and J. Hollender. 2008. Ultratrace-level determination of glyphosate, aminomethylphosphonic acid and glufosinate in natural waters by solid-phase extraction followed by liquid chromatography-tandem mass spectrometry: performance tuning of derivatization, enrichment and detection. Anal Bioanal Chem 391:2265-2276. [ Links ]
25. Hillman, W. S. 1961. The Lemnaceae or Duckweeds: a review of the descriptive and experimental literature. Botan Rev 27:21-87. [ Links ]
26. Ibáñez, M., O. J. Pozo, J. V. Sancho, F. J. López, and F. Hernández. 2006. Re-evaluation of glyphosate determination in water by liquid chromatography coupled to electrospray tandem mass spectrometry. J Chromatogr 1134:51-55. [ Links ]
27. InfoStat. 2005. InfoStat versión 1.1. Grupo InfoStat, FCA, Universidad Nacional de Córdoba. Primera Edición, Editorial Brujas. Argentina [ Links ]
28. ISTA. 2006. Rules International Seed Testing. Switzerland. [ Links ]
29. Jaynes, D. B., S. I. Ahmed, K. J. Kung, and R. S. Kanwar. 2001. Temporal dynamics for preferential flow to a subsurface drain. Soil Sci Soc Am J 65:1368-1376. [ Links ]
30. Leng, R. A., J. H. Stambolie, and R. Bell. 1995. Duckweed: a potential high-protein feed resources for domestic animals and fish. Livestock Research for Rural Development 7:141-152. [ Links ]
31. Liang, M. Q., Ch. F. Zhang, Ch. L. Peng, Z. L. Lai, D. F. Chen, and Z. H. Chen. 2011. Plant growth, community structure, and nutrient removal in monoculture and mixed constructed wetlands. Ecol Eng 37:309-316. [ Links ]
32. Lichtenthaler, H. K. 1987. Chlorophyll and carotenoids: Pigments of Photosynthetic biomembranes. Methods Enzymol 148:350-382. [ Links ]
33. Manahan, S. 2007. Introducción a la Química Ambiental. Ed. Reverté. Barcelona, España. Pp. 725. [ Links ]
34. Marozzi, M., M. Devercelli, W. Polla, and A. Villalba. 2004. Cambios en la morfología y en la Tasa de crecimiento de repollito de agua (Pistiastratiotes L.) asociados a la presencia de cromo. Natura Neotropicalis 34-35:63-69. [ Links ]
35. Martin, M. L., M. C. Sobrero, C. Rivas, F. Rimoldi, and A. E. Ronco. 2003. Impacto del uso de plaguicidas asociado a la siembra directa sobre especies no-blanco: Flora riparia y acuática. Memorias Conferencia Internacional Usos del Agua, Agua 2003, Cartagena de Indias, Colombia. Pp. 27-31. [ Links ]
36. Morillo, E., T. Undabeytia, C. Maqueda, and A. Ramos. 2000. Glyphosate adsortion on soils of different characteristics. Influence of copper addition. Chemosphere 40:103-107. [ Links ]
37. Novotny, V., and H. Olem. 1994. Water quality: prevention, identification and management of diffuse pollution. Van Nostrand Reinhold, New York. Pp. 1054. [ Links ]
38. Olguín, E., and E. Hernández. 1998. Use of aquatic plants for recovery of nutrients and heavy metals from wastewater. Institute of Ecology, Environmental Biotechnology. Vancouver. URL: www.idrc.ca/industry/canada. [ Links ]
38. Otto, S., P. M. Groffman, S. E. Findlay, and A. E. Arreola. 1999. Invasive plant species and microbial processes in a tidal freshwater marsh. J Environ Qual 28:1252-1257.
40. Paradiso Giles, M. 2000. Variabilidad interclonal en Lemna gibba L. frente a dos herbicidas con distinto modo de acción. Tesis de Maestría en Biología (Ecología), Facultad de Ciencias, Universidad de la República, Montevideo, Uruguay. Pp. 73. [ Links ]
41. Peruzzo, P. J., A. A. Porta, and A. E. Ronco. 2008. Levels of glyphosate in surface waters, sediments and soils associated with direct sowing soybean cultivation in North pampasic region of Argentina. Environmental Pollution 156:61- 66. [ Links ]
42. Petersen, C., J. Holm, C. B. Koch, H. E. Jensen, and S. Hansen. 2002. Movement of pendimethalin, ioxynil and soil particles to field drainage tiles. Pest Manag Sci 59:85-96. [ Links ]
43. Pezzolesi, T. P., R. E. Zartman, E. B. Fish, and M. G. Hickey. 1998. Nutrients in a playa wetland receiving wastewater. J Environ Qual 27:67-74. [ Links ]
44. Pilon-Smits, E. A., M. P. De Souza, G. Hong, A. Aamini, R. C. Bravo, S. T. Payabyab, and N. Terry. 1999. Selenium volatilization and accumulation by twenty aquatic plant species. J Environ Qual 28:1011-1018. [ Links ]
45. Primost, J. E., D. J. G. Marino, V. C. Aparicio, J. L. Costa, and P. Carriquiriborde. 2017. Glyphosate and AMPA, “pseudopersistent” pollutants under real-world agricultural management practices in the Mesopotamic Pampas agroecosystem, Argentina. Environmental Pollution, DOI: http://dx.doi.org/10.1016/j.envpol.2017.06.006.
46. Qiu, D., Z. Wu, B. Liu, J. Deng, G. Fu, and F. He. 2001. The restoration of aquatic macrophytes for improving water quality in a hypertrophic shallow lake in Hubei Province, China. Ecol Eng 18(2):147-156. [ Links ]
47. Ronco, A. E. 2010. Impacto de plaguicidas en ambientes acuáticos pampeanos: Integración de estudios químico ecotoxicológicos en experimentos de campo y laboratorio, con especial énfasis al caso del glifosato. Pp. 85-94 en M. Camino y V. Aparicio (eds.). Aspectos ambientales del uso de glifosato. Ed. INTA. [ Links ]
48. Saluso, J. H. 2008. Actualización del factor R de la ecuación universal de pérdida de suelo (EUPS) para una amplia zona del país. Período 1950/2005. Agricultura sustentable. Actualización técnica. Serie extensión nro. 51. [ Links ]
49. Sasal, M. C., A. E. Andriulo, M. G. Wilson, and S. I. Portela. 2010. Pérdidas de glifosato por drenaje y escurrimiento en molisoles bajo siembra directa. Información tecnológica 5:135-142. [ Links ]
50. Sasal, M. C., M. G. Wilson, A. E. Andriulo, J. D. Oszust, and E. A. Gabioud. 2013. Estudios del impacto de la agricultura sobre la calidad del agua. Simposio Fertilidad 2013. Nutrición de cultivos para la intensificación productiva sustentable. Pp. 286-293. [ Links ]
51. Sasal, M. C., L. Demonte, A. Cislaghi, E. A. Gabioud, J. D. Oszust, M. G. Wilson, N. Michlig, H. R. Beldomenico, and M. R. Repetti. 2015. Glyphosate loss by runoff and its relationship with phosphorous fertilization. J Agric Food Chem 63(18):4444-4448. [ Links ]
52. Sasal, M. C., M. G. Wilson, S. M. Sione, S. M. Beghetto, E. A. Gabioud, J. D. Oszust, E. V. Paravani, L. Demonte, M. R. Repetti, D. J. Bedendo, S. L. Medero, J. J. Goette, N. Pautasso, and G. A. Schulz. 2017. Monitoreo de glifosato en agua superficial en Entre Ríos. La investigación acción participativa como metodología de abordaje. RIA. URL: ria.inta.gob.ar/sites/default/files/trabajosenprensa/sasal-castellano-5.pdf. [ Links ]
53. Sobrero, C., M. L. Martin, and A. Ronco. 2007. Fitotoxicidad del herbicida Roundup® Max sobre la especie no blanco Lemna gibba en estudios de campo y laboratorio. Hidrobiológica 17(1):31-39. [ Links ]
54. USEPA. 2007. United States Environmental Protection Agency. Restricted Database. [ Links ]
55. Villholth, K. G., N. J. Jarvis, O. H. Jacobson, and H. de Jonge. 2000. Field investigations and modelling of particlefacilitated pesticide transport in macroporous soil. J Environ Qual 29:1298-1309. [ Links ]














