Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Ecología austral
On-line version ISSN 1667-782X
Ecol. austral vol.28 no.1 supl.1 Córdoba Apr. 2018
SECCIÓN ESPECIAL
Morfometría y morfología de estomas y de polen como indicadores indirectos de poliploidía en especies del género Polylepis (Rosaceae) en Ecuador
Joselin C. Caiza*; Dominique Vargas; Camila Olmedo; Mario Arboleda; Lissette Boada; Osmar Acurio; Carlos Arroyo; Alexis Debut & María Segovia-Salcedo
Universidad de las Fuerzas Armadas-ESPE. Sangolquí. Ecuador.
Recibido: 12 de febrero de 2017
Aceptado: 21 de diciembre de 2017
Editora asociada: Erica Cuyckens
RESUMEN
Los bosques de Polylepis (Familia: Rosaceae), originarios de los Andes, son considerados como uno de los ecosistemas boscosos más amenazados. A lo largo de su historia evolutiva se evidenciaron varios episodios de poliploidía que impactaron en sus procesos de especiación. Las estructuras celulares como el polen y células oclusivas se encuentran muy influenciadas por la cantidad de genes presentes en cada especie, por lo que representa un método indirecto para determinar el grado de ploidía. En este estudio se analizó la relación del tamaño del grano de polen y la longitud de las células oclusivas con el tamaño del genoma y el número cromosómico, además de la viabilidad polínica de Polylepis incana, P. pauta, P. microphylla, P. racemosa y P. sericea recolectadas en los páramos andinos del Ecuador. Se fotografiaron granos de polen y estomas con un aumento de 400X y se midió su longitud en micrómetros con el programa ImageJ 1.49v. Para determinar la viabilidad del polen se utilizó una técnica de tinción. Los resultados muestran que existe una correlación positiva que varía de R2=0.32 a R2=0.65 entre las variables empleadas, según la especie, por lo cual sirven para analizar indirectamente la poliploidía. Estos datos son relevantes para el manejo y la conservación de Polylepis en Ecuador, ya que permiten identificar de antemano, rápida y económicamente potenciales citotipos e individuos híbridos a lo largo de los Andes ecuatorianos. Además, abre la posibilidad tanto de utilizar estos datos en estudios de cambio climático como para determinar parentales en proyectos de reforestación y restauración.
Palabras clave: Andes; Análisis morfológico; Células oclusivas; Ploidía; Microgameto.
ABSTRACT
Measurement of stomata and pollen as an indirect indicator of polyploidy in the genus Polylepis (Rosaceae) in Ecuador.
Polylepis forests (Family: Rosaceae) are originated in the Andes and are considered one of the most threatened forest ecosystems. Throughout their evolutionary history, they have shown several episodes of polyploidy affecting their process of speciation. Cellular structures such as pollen and guard cells are highly influenced by the number of genes in each species, representing an indirect method to determine the degree of ploidy. In this study, the relationship of pollen grain size and the length of the guard cells were analyzed with genome size and chromosome number, in addition to the pollen viability of Polylepis incana, P. pauta, P. microphylla, P. racemosa y P. sericea collected from the Andean highlands of Ecuador. Stomata and pollen grains were photographed at 400X magnification and their length was measured in micrometers using ImageJ program 1.49v. Staining technique was used to determine the viability of the pollen. The results show a positive correlation that varies from R2=0.32 a R2=0.65 between the variables used depending of the species; therefore, it serves as an indirect analysis method for polyploidy. These data are important for the management and conservation of Polylepis in Ecuador, allowing prior identification of potential hybrid individuals and cytotypes along the Ecuadorian Andes in a quick and inexpensive fashion. Additionally, it opens the possibility of use this data in studies of climate change, as well as the determination of parental in reforestation and restoration projects.
Keywords: Andes; Morphological analysis; Guard cells; Ploidy; Microgamete.
INTRODUCCIÓN
Dentro de los géneros más representativos de la flora sudamericana se encuentra Polylepis, un conjunto de árboles y arbustos leñosos pertenecientes a la familia Rosaceae, que se encuentran distribuidos en sistemas altoandinos desde Venezuela hasta la Argentina en un rango altitudinal entre 3500 y 5000 m s. n. m. (Kessler 2006), mientras que P. australis, desde los 900 m s. n. m. (Renison et al. 2013). En Ecuador se han descrito 8 de las 28 especies (Schmidt-Lebuhn et al. 2010; Segovia-Salcedo et al. en este número), una especie introducida P. racemosa, y 7 nativas (P. sericea, P. incana, P. weberbaueri, P. pauta, P. microphylla, P. reticulata y P. lanuginosa), de las cuales P. lanuginosa es endémica. Los bosques de Polylepis cumplen varias funciones; una de ellas es regular la temperatura interna del ecosistema, lo que permite el desarrollo de una flora y fauna diversa (mucha de ella endémica). Esto los convierte en sistemas biológicos singulares de los Andes (Simpson 1986; Kessler 2006; Mendoza and Cano 2011).
Estos ecosistemas boscosos sufrieron una presión antropogénica notable en los últimos siglos, lo cual determinó la destrucción de más de 95% de su rango de distribución original (Kessler 2006). Esto generó una gran preocupación y, en el ámbito científico, la producción de varios estudios en diferentes áreas (e.g., la construcción de modelos potenciales de distribución y estado de conservación en la Argentina [Renison et al. 2013], el efecto del fuego sobre la producción de semillas y el crecimiento en Córdoba, Argentina [Renison et al. 2002], o el efecto de la ganadería y la quema, que erosionan el suelo e influyen sobre la baja viabilidad de semillas [Renison et al. 2004]). Sin embargo, todavía hay mucho por estudiar, en especial su biología básica, que nos ayudará a entender su historia natural. Este conocimiento puede ser aplicado a iniciativas de conservación y manejo del género Polylepis.
Dentro de la genética, una de las áreas con poca información es la poliploidía. La poliploidía es el estado de poseer tres o más juegos o sets completos de cromosomas (Leitch and Bennett 1997). Se determinó que los organismos poliploides surgen a partir de la hibridación de individuos de diferentes poblaciones de una misma especie o por hibridación interespecífica, fenómenos conocidos como autoploidía y aloploidía, respectivamente (Wendel 2015). Los datos genómicos de plantas constatan múltiples eventos de duplicación del genoma completo. Así, la poliploidía representa un mecanismo evolutivo clave en el proceso de especiación, en particular en angiospermas (Soltis et al. 2015; Wendel 2015). Algunas estimaciones sostienen que hasta 70% de las plantas con flores tienen un origen poliploide (Soltis et al. 2015) y que las especies poliploides son más frecuentes en altas latitudes y altitudes (Alcántar 2014; Soltis et al. 2015). Análisis filogenéticos sugieren que el género Polylepis surgió a partir de la poliploidización del género Acaena y que existen eventos antiguos y recientes de alopoliploidización en la tribu Sanguisorbeae (Kerr 2004; Kessler 2006). Los procesos evolutivos que se dieron en el género Polylepis son atribuidos a la hibridación entre especies, conforme las poblaciones se aproximan debido al crecimiento geográfico de los bosques y a la reubicación de las poblaciones como consecuencia de las actividades humanas (Kessler and Schmidt- Lebuhn 2005; Quija et al. 2010).
La subfamilia Rosoideae, que incluye al género Polylepis, posee un número cromosómico base de X=7 (Longhi et al. 2014). Resultados de citometría de flujo de algunas especies de Polylepis sugieren que se pueden catalogar en grupos diploides, tetraploides y octoploides (Schmidt-Lebuhn et al. 2010), donde la abundante heterogeneidad genética se puede generar por el nivel de poliploidía entre especies que se encuentran relacionadas estrechamente (Liu et al. 2010). En Ecuador se registró hibridación en especies de Polylepis (Romoleroux 1996), sobre todo en las especies que no están aisladas geográficamente (simpátricas) (Villota 2012), de acuerdo con los estudios morfológicos (Mendoza and Cano 2011).
Estas circunstancias dificultan la determinación del número cromosómico. Además, el conteo directo por técnicas citogenéticas se ve afectado por el reducido tamaño de los cromosomas (Simpson 1979; Schmidt-Lebuhn et al. 2010). Recién en el año 2010, un estudio determinó el número cromosómico para las especies ecuatorianas (Quija et al. 2010), lo cual demuestra que es un trabajo arduo y tedioso. Estos datos son fundamentales no sólo desde el punto de vista evolutivo, sino también para los intentos de conservación y manejo (Villota 2012), ya que se puede incurrir en una reforestación inapropiada mediante la introducción de especies exóticas que alteran el ecosistema altoandino nativo (Segovia-Salcedo 2011). Dentro de este contexto, se exploraron otras formas de determinar la poliploidía para facilitar su análisis.
Como parámetros morfométricos de ploidía se encuentran el tamaño del polen y la longitud de las células guardianas estomáticas, u oclusivas. El tamaño de las células está vinculado con la cantidad de ADN y, a su vez, con el número cromosómico. Por lo tanto, el estudio de la extensión de las células guardianas u oclusivas del estoma y el diámetro de polen permite una estimación del nivel de ploidía (Masterson 1994; Yang et al. 2015). La morfología del polen es una característica conservada de las especies, y permite establecer relaciones evolutivas dentro de la familia Rosaceae (Hebda and Chinnappa 1994). La viabilidad del polen se vincula con el éxito reproductivo y con el rendimiento del fruto (Jorgensen and León-Yánez 1999; Chaturvedi et al. 2016). Los estudios palinológicos en Polylepis se centraron en determinar su distribución dentro del contexto histórico, con escaso énfasis en su evolución y sus adaptaciones. El polen del género Polylepis es mónada, con una forma isopolar, relativamente esférico, tricolporado, pontoperculado y achatado ligeramente en los polos; la exina presenta un patrón microequinato (Simpson 1979; Simpson 1986; Chung et al. 2010). Por otro lado, las células oclusivas de los estomas se encuentran en su mayoría en el envés de hojas. Los estomas regulan de forma eficiente el ingreso de CO2 y la pérdida de vapor de agua (Berry et al. 2010; Vargas 2011) y están relacionados con procesos fisiológicos clave como el balance hídrico (Mishra 1997; Vatén and Bergmann 2012). Los estomas de Polylepis están adaptados a los cambios ambientales; para mantener la humedad se ubican en criptas con cavidades subestomáticas anchas (Colmenares et al. 2005). En la presente investigación se utilizaron muestras de colecciones anteriores correspondientes a proyectos enfocados en Polylepis incana, P. pauta, P. microphylla, P. racemosa y P. sericea, especies registradas en las provincias de Pichincha y Chimborazo, para obtener datos morfométricos y responder la pregunta ¿es posible inferir el nivel de ploidía de especies de Polylepis mediante una relación del número cromosómico y el tamaño del genoma con datos morfométricos de células guardianas estomáticas o granos de polen? Además, también se buscó describir la estructura morfológica de los aparatos estomáticos y los granos de polen utilizando SEM y microscopía con focal, y, finalmente, reportar los primeros registros en el país sobre viabilidad de polen para las especies antes mencionadas.
MATERIALES Y MÉTODOS
Área de estudio
Las muestras de flores y hojas se colectaron en la región andina de Ecuador. Las de P. incana se colectaron camino al Parque Nacional Illinizas (00°12’8.56’’ S - 68°40’24.65’’ O); las de P. pauta se colectaron de la Población 1, camino a Oyacachi (00°07’01.7’’ S - 78°07’05.3’’ O); las de P. microphylla, cerca de Achupallas (02°16’ S - 78°44’ O); las de P. racemosa, de la Población 2, en la carretera Quito-Baeza, en Papallacta (0°20’35.3’’ S - 78°12’05.2’’ O), y las de P. sericea se colectaron en la Reserva Privada Yanacocha (00°08’03.2’’ S - 78°35’17.9’’ O).
Análisis de Morfometría
Microscopía óptica de células guardianas de estomas. Se siguió el protocolo establecido por Schmidt-Lebuhn et al. (2010) con las siguientes modificaciones: se colectaron hojas de 10 individuos de cada población. Se escogieron 3 folíolos por cada individuo de cada población. En el caso de las especies con exceso de tricomas (P. pauta, P. racemosa y P. sericea) se eliminaron con bisturí los tricomas del envés de las hojas. Cada foliolo fue fijado por su envés a un portaobjetos con pegamento de cianoacrilato. Se eliminó el haz del folíolo hasta evidenciar el tejido epidérmico de la parte superficial del envés, se aplicó acetona para eliminar el remanente de clorofila, se fotografiaron diez células oclusivas por folíolo con un aumento de 400X con el microscopio óptico Olympus BX41. Se midió su longitud en micrómetros empleando el programa ImageJ 1.49v. Posteriormente, con los datos obtenidos se realizaron análisis estadísticos y correlaciones empleando el software RStudio 3.2.3.
Microscopía óptica para granos de polen. Se siguió el protocolo de Ramírez et al. (2013) con las siguientes modificaciones: se colectaron muestras de flores de individuos de P. incana, P. pauta, P. microphylla, P. racemosa y P. sericea de diferentes poblaciones. Para la solución de polen se seleccionaron los botones colectados que estuvieran más frescos. Se sumergió en agua destilada y luego se agitó en un vortex durante un minuto. Para la solución de tinción se colocaron limaduras de hierro en un matraz y se mantuvo en ebullición durante 4 minutos. A continuación, se adicionaron 25 mL de ácido acético disuelto en 30 mL de agua destilada, se añadió 1 g de carmín por 100 mL de disolución, se continuó con la ebullición durante 1 minuto y se filtró repitiendo el proceso hasta que la solución estuvo libre de limaduras de hierro, para ser almacenado en un gotero. Se sumergió un pincel en la solución con polen, revolviendo para evitar su sedimentación y se impregnó sobre un portaobjetos. Luego se depositó una gota de la solución de colorante acetocarmín al 1% preparada anteriormente sobre el polen impregnado, se agitó sutilmente y se esperó ~15 minutos para su absorción. Se colocó un cubreobjetos y se procedió a la observación y toma de fotografías en el microscopio óptico Olympus BX41 a 400X por cada muestra de polen. Para el recuento se realizaron dos preparaciones por especie con el polen recién colectado. Se procedió a la medición del diámetro axial y ecuatorial en μm de los granos de polen de las especies encontradas por cada población, con las herramientas de medición del programa ImageJ 1.49v y se realizaron análisis estadísticos con los datos obtenidos, utilizando el programa RStudio 3.2.3.
Datos genómicos y número cromosómico
El tamaño del genoma y el número cromosómico de las especies P. incana, P. pauta, P. microphylla, P. racemosa y P. sericea fueron obtenidos de estudios anteriores (Segovia-Salcedo 2014; Segovia-Salcedo and Quijia-Lamina 2014).
Análisis de morfología
Microscopía electrónica (SEM) para células guardianas de estomas. Se siguió el protocolo de Palanyandy et al. (2013) con las siguientes modificaciones: se procedió a colocar hojas secas de P. incana, P. pauta, P. microphylla, P. racemosa y P. sericea en tubos Eppendorf y se prefijaron con 250 μL de 4% de glutaraldehído en tampón cacodilato de sodio 0.1 M (pH 6.8) a temperatura ambiente durante 2 horas. Después se retiró el fijador de cada tubo y se enjuagaron las muestras con tampón cacodilato de sodio 0.1 M (pH 6.8) tres veces durante 3 minutos cada vez. Se realizó una deshidratación gradual con una serie creciente de etanol (30%, 50%, 70%, 80%, 90%, 99%), las 4 primeras por 15 minutos y las dos últimas por 30 minutos. Para el secado, la muestra se colocó en un tubo Eppendorf 250 μL de HDMS por 15 minutos. Las muestras se dejaron secar durante toda la noche en un desecador colocado dentro de una cabina extractora de gases. Al día siguiente, las muestras fueron colocadas sobre cinta doble faz de carbono, luego se introdujo la muestra en un evaporador Quorum durante 1 minuto con 20 nm de oro y se observó cada muestra en el microscopio electrónico TESCAM MIRA3.
Microscopía electrónica (SEM) para granos de polen. Se realizó un proceso modificado de fijación y deshidratación establecido por Guerra and Debut (2012). Se tomó el polen de las anteras secas y se lo colocó en una caja Petri con glutaraldehído al 3% por 60 minutos. Para la deshidratación se utilizaron concentraciones crecientes de etanol (50%, 70%, 90%, 95% y 99%), cada una durante 20 minutos. Luego, se dejó secar las muestras en una estufa durante 48 horas a 70 °C. Para la observación se seleccionaron tres granos de polen de cada especie y se colocaron sobre cinta doble faz de carbono. Luego se introdujo la muestra en un evaporador Quorum durante 1 minuto con 20 nm de oro y se observó cada muestra en el microscopio electrónico TESCAM MIRA3 a 5 kV.
Microscopía de fluorescencia para granos de polen. Se seleccionaron los estambres de las flores en condiciones óptimas (estructuras completas y sin presencia de agentes contaminantes) y se cortaron los filamentos conservando las anteras. La placa se limpió con alcohol 70%, sin topar el centro; con una pinza se colocó sobre un portaobjetos y se adicionó una gota de glicerina. Se procedió a remover, quedando impregnada completamente la antera. A continuación, se cubrió la muestra con un cubreobjetos con presión durante 1 minuto para que la muestra se distribuya por toda el área del cubreobjetos. Se esperó unos minutos y se procedió a su observación en el microscopio de fluorescencia Olympus IX53 Reflected con el objetivo de 40X y se tomaron fotografías de cada muestra de polen.
Análisis de viabilidad de polen
La viabilidad de polen se estimó considerando los granos de polen redondeados y coloreados de rojo como viables y los constreñidos como no viables, de acuerdo con Stone et al. (1995), Lagos et al. (2005) y Srinivasan and Gaur (2012). Se contabilizó el número de granos de polen viables e inviables y se calculó el porcentaje de viabilidad.
Datos de variables ambientales
Se realizaron correlaciones entre variables ambientales (e.g., altitud y temperatura) y los datos morfométricos obtenidos de estomas y de granos de polen. Para ello, se utilizaron registros del Ministerio de Ambiente del Ecuador y del Instituto Geográfico Militar (2016).
RESULTADOS
Datos morfométricos de células guardianas y granos de polen
La longitud media de las células guardianas de las cinco especies de Polylepis varía entre 9.71±0.46 y 21.70±3.76 μm. Los valores del diámetro axial del polen fluctúan entre 26.17±0.38 y 44.28±0.38 μm. El valor mínimo del diámetro ecuatorial fue 23.36±0.28 μm, y el máximo fue 41.02±0.32 μm (Tabla 1). Los datos del número cromosómico y del tamaño del genoma se obtuvieron de estudios anteriores (Segovia-Salcedo 2014; Segovia-Salcedo and Quijia-Lamina 2014).
Tabla 1. Medias de los valores medidos y viabilidad del polen de cinco especies de Polylepis Ruiz and Pav. (Sanguisorbeae, Rosaceae) de diferentes poblaciones de Ecuador.
Table 1. Mean values measured and pollen viability of five species of Polylepis Ruiz and Pav. (Sanguisorbeae, Rosaceae) from different populations in Ecuador.

La mayor longitud de las células oclusivas de los estomas a 400X se observó en la población de Papallacta de P. racemosa (Figura 1e). El máximo valor del diámetro del polen axial y ecuatorial se visualizó a 40X y 4X en la población de Oyacachi de P. pauta (Figura 3 d-e). Por otro lado, los mínimos valores de longitud de las células oclusivas de los estomas, diámetro de polen axial y ecuatorial se observó en la población de P. incana (Figura 1d) (Figura 3a).

Figura 1. a) Estomas de Polylepis microphylla, población camino a Achupallas. b) Estomas de Polylepis pauta, población Oyacachi. c) Estomas de Polylepis sericea, población Yanacocha. d) Estomas de Polylepis incana, población Illinizas. e) Estomas de Polylepis racemosa, población Papallacta.
Figure 1. a) Stomata of Polylepis microphylla, population way to Achupallas. b) Stomata of Polylepis pauta, population Oyacachi. c) Stomata of Polylepis sericea, population Yanacocha. d) Stomata of Polylepis incana, population Illinizas. e) Stomata of Polylepis racemosa, population Papallacta.

Figura 3. Fotografías en microscopía de fluorescencia. a) Polen de Polylepis incana, población Illinizas. b) Polen de Polylepis microphylla, población camino a Achupallas. c) Polen de Polylepis sericea, población Yanacocha. d, e, f) Polen de Polylepis pauta, población Oyacachi.
Figure 3. Photographs in fluorescence microscopy. a) Pollen of Polylepis incana, population Illinizas. b) Pollen of Polylepis microphylla, population way to Achupallas. c) Pollen of Polylepis sericea, population Yanacocha. d, e, f) Pollen of Polylepis pauta, population Oyacachi.
Existe una diferencia aproximada de 4 μm entre la longitud de las células oclusivas de los estomas de dos poblaciones de P. racemosa. A pesar de tener un número cromosómico similar, también se observa que difieren los diámetros axiales y ecuatoriales de granos de polen en ~10 μm de dos poblaciones de P. pauta con el mismo número cromosómico.
Relación de datos morfométricos y parámetros de ploidía
Para el análisis como método indirecto de ploidía se correlacionaron las variables morfométricas como longitud de estomas y diámetros de polen (axial y ecuatorial) con el número cromosómico y el tamaño del genoma (Figura 5) (Segovia-Salcedo 2014; Segovia-Salcedo and Quijia-Lamina 2014). Se evidenciaron correlaciones positivas entre la longitud de los estomas y el número cromosómico (R2=0.32) y entre la longitud de los estomas y el tamaño del genoma (R2=0.65). Se correlacionó el diámetro axial del polen con el diámetro ecuatorial (R2=0.97), el diámetro axial del polen con el número cromosómico (R2=0.53) y el diámetro axial del polen con el tamaño del genoma (R2=0.24). También se encontraron correlaciones entre el diámetro ecuatorial del polen con el número cromosómico (R2=0.48) y entre el diámetro ecuatorial del polen y el tamaño del genoma (R2=0.21).

Figura 5. Coeficientes R2 de la longitud de las células oclusivas del estoma y del diámetro del polen axial y ecuatorial con el número cromosómico y el tamaño del genoma.
Figure 5. Coefficients R2 of the length of the guard cells from the stoma, axial and equatorial diameter pollen with chromosome number and genome size.
Relación de datos morfométricos y variables ambientales
También se incluyeron datos ambientales (altitud y variación de temperatura) para realizar correlaciones con el tamaño de las células guardianas y polen (Tabla 2). Se obtuvo una relación inversamente proporcional entre la altitud y la longitud de estomas (R=-0.63), altitud con el diámetro polen axial (R=-0.95) y ecuatorial (R=-0.93) de todas las especies analizadas. También se relacionó la variación de la temperatura y la longitud de estomas (R=-0.11), la variación de la temperatura con el diámetro de polen axial (R=-0.47) y ecuatorial (R=-0.46). P. incana fue la especie que demostró que a mayor altitud y variación de temperatura, menores longitudes de estomas y diámetro de polen.
Tabla 2. Variables ambientales de los sitios de muestreo y medias de los valores medidos de cinco especies de Polylepis Ruiz and Pav. (Sanguisorbeae, Rosaceae) de Ecuador.
Table 2. Environmental variables of sampling places and mean values measured of five species of Polylepis Ruiz and Pav. (Sanguisorbeae, Rosaceae) in Ecuador.

Datos morfológicos de células guardianas y granos de polen
Los estomas del género Polylepis son dispersos. Se encuentran bajo el nivel de la epidermis, es decir, están hundidos, dentro de criptas (Colmenares et al. 2005; Schmidt- Lebuhn et al. 2010) (Figura 2 a-b-c-d). Además, los estomas no poseen células subsidiarias (amonocíticos), característica propia de la familia Rosaceae (Metcalfe and Chalk 1965). Las criptas estomáticas no son notorias en las microfotografías realizadas con microscopio óptico debido a que la imagen obtenida del tejido está en dos dimensiones. Sin embargo, mediante el microscopio electrónico de barrido SEM se obtuvo una evidencia fehaciente de las criptas en todas las especies analizadas. Las criptas estomáticas no son generales para la familia Rosaceae. Aunque presentes en varias especies, son más bien adaptaciones a las condiciones climáticas. Es por eso que dentro de un mismo género de Polylepis se pueden encontrar especies en las que los estomas están sobre, al mismo nivel o bajo la epidermis (Thair and Thair 2009). Se caracterizó a las hojas del género como hipoestomáticas (Colmenares et al. 2005). La superficie abaxial, además, está cubierta de tricomas tectores y artefactos adicionales (Metcalfe and Chalk 1965; Colmenares et al. 2005); su cantidad y longitud varían en cada especie.
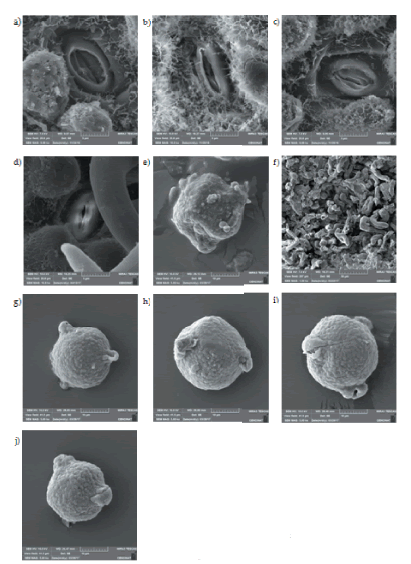
Figura 2. Fotografías con SEM. a) Estomas de Polylepis sericea. b) Estomas de Polylepis racemosa. c) Estomas de Polylepis pauta. d) Estomas de Polylepis microphylla. e) Estomas de Polylepis incana. f) Polen de Polylepis sericea. g) Polen de Polylepis racemosa. h) Polen de Polylepis pauta. i) Polen de Polylepis microphylla. j) Polen de Polylepis incana.
Figure 2. Photograps with SEM. a) Stomata of Polylepis sericea. b) Stomata of Polylepis racemosa. c) Stomata of Polylepis pauta. d) Stomata of Polylepis microphylla. e) Pollen of Polylepis sericea. f) Stomata of Polylepis incana. g) Pollen of Polylepis racemosa. h) Pollen of Polylepis pauta. i) Pollen of Polylepis microphylla. j) Pollen of Polylepis incana.
Las hojas de P. incana están cubiertas por tricomas cortos, enrollados, irregulares y multicelulares por el envés, mezclados con un exudado resinoso. Por esta razón, no fue satisfactorio obtener imágenes en microscopia electrónica (SEM) (Figura 2e).
Las fotografías en microscopia electrónica de barrido (SEM) evidenciaron que los granos de polen de las especies analizadas son mónadas, de tamaño relativamente mediano (axial=26.17-44.28 μm; ecuatorial=23.36-41.02 μm). P. incana es la especie con el grano de polen más pequeño y P. pauta, la del tamaño más grande. La forma del polen es esférica, con isometría ecuatorial y mónada en 4 de las 5 especies (Figura 2 f-g-h-i), en concordancia con lo observado por Schmidt-Lebuhn et al. (2010). La especie P. sericea (Figura 2e) presentó una forma esferoide irregular, con aperturas menos prominentes, y presencia de ciertas esporas fúngicas en su superficie. Todas las especies son tricolporadas y distribuidas isométricamente. Los poros (colpi) son prominentes y esferoides, con una apertura elongada, tal y como lo menciona Chung et al. (2010). En todas las especies, el patrón de la superficie externa, denominado exina, es microequinado. Las verrugas son generalmente pronunciadas y se distribuyen uniformemente a lo largo de la superficie. Las fotografías en microscopia con focal evidenciaron que los granos de polen presentan fluorescencia propia. Además, poseen una forma esférica, y, según la posición de las aperturas del polen, son del tipo tricolporado (Figura 3).
Análisis de viabilidad
Se consideró que el polen es viable cuando se torna completamente de color rojo. Caso contrario, el polen es no viable (Figura 4). De las cinco especies analizadas, P. microphylla tiene mayor viabilidad, con un valor de 98%, mientras que P. sericea presenta una menor viabilidad (60%) (Tabla 1).

Figura 4. Fotografías en microscopía de campo claro. a) Estructura de polen no viable de P. racemosa. Población Oyacachi. b) Estructura de polen viable de P. racemosa. Población Oyacachi.
Figure 4. Photographs in light field microscopy. a) Non-viable pollen structure of P. racemosa. Population Oyacachi. b) Structure of viable pollen of P. racemosa. Population Oyacachi.
DISCUSIÓN
En los últimos años se descubrió que existen varios citotipos en las especies de Polylepis (Segovia-Salcedo 2014; Segovia- Salcedo and Quijia-Lamina 2014). Estas diferencias pueden deberse a procesos de evolución cromosómica, así como respuestas ecofisiólogicas a la intensidad de la luz y al estrés hídrico (Reigosa 2001). Definir la ploidía de un organismo es clave para procesos de restauración y reforestación. Sin embargo, no siempre se cuenta con los implementos técnicos más adecuados para diferenciar entre individuos o poblaciones. Las mediciones morfométricas de estomas y granos de polen en el género Polylepis pueden dar indicios de estas variaciones.
Los datos obtenidos en la presente investigación en poblaciones ecuatorianas de P. incana, P. pauta, P. microphylla, P. racemosa y P. sericea muestran un incremento en la longitud de las células oclusivas de los estomas y en el diámetro del polen conforme aumenta el tamaño del genoma y el número cromosómico. Esto evidencia que el número cromosómico y el tamaño del genoma influyen sobre características fenotípicas. Los resultados presentan una relación directa a medida que aumenta la ploidía, y se ha documentado que el incremento del nivel de ploidía trae consecuencias morfológicas y fisiológicas como cambios en la regulación metabólica (Otto and Whitton 2000; Mable 2004a; Alcántar 2014) y en la relación de los componentes celulares (Comai 2005). La consecuencia más evidente de una ploidía alta es el aumento de volumen celular, que, a su vez, determina alteraciones en el radio superficie-volumen (Otto and Whitton 2000; Mable 2004a; Alcántar 2014). Las dimensiones de estomas, polen y, en general, la envergadura de los órganos es mayor si aumenta el número de cromosomas (Otto and Whitton 2000; Oliveira et al. 2004) debido a que el tamaño celular tiene correlación con la cantidad de ADN (Masterson 1994; Mable 2004b). Estudios previos demostraron que la longitud de los estomas es un indicador exitoso de poliploidía en Trifolium pratense, T. repens (Evans 1955), Medicago sativa (Speckmann et al. 1965) y en Acacia mearnsii (Beck et al. 2003).
Se observaron variaciones en la longitud de las células oclusivas de los estomas entre individuos del mismo nivel de ploidía y especie, en especial en las poblaciones de P. racemosa (P<2.2e-16). Estos resultados reflejan la complejidad taxonómica de las especies analizadas, en especial P. racemosa por su alto nivel de hibridación y variabilidad morfológica (Segovia-Salcedo et al. en este número). Datos similares se encontraron en Coffea (Mishra 1997) y en Lolium multiflorum, en las que para un mismo nivel de ploidía, la longitud de estomas difiere entre individuos (Speckmann et al. 1965). Schwanitz (1952) menciona que en varios géneros, los rangos de longitud de los estomas para los diferentes niveles de ploidía son demasiado amplios para determinar una diferenciación fiable basándose en esta característica y, al parecer, P. racemosa entra dentro de esta categoría. Por lo tanto, es necesario profundizar los análisis de estomas con un muestreo que cubra toda la distribución de las especies y buscar otras características que contribuyan a clarificar el nivel de ploidía.
Los datos obtenidos muestran una variación alta en la longitud de las células guardianas, en comparación con una baja variación respecto al tamaño genómico entre individuos de la misma especie. Esto se ve reflejado en las desviaciones estándares obtenidas. Jordan et al. (2014) mencionan que una alta variación en la longitud de las células guardianas y una falta de variación en el tamaño genómico sugiere que los cambios evolutivos sustanciales en el tamaño de las células ocurren después de darse cambios en el tamaño del genoma. Este fenómeno es evidenciado en procesos de poliploidización recientes, como se presume en el género Polylepis (Kerr 2004).
De los análisis indirectos de ploidía en polen en el presente estudio se evidenció que en dos poblaciones distantes geográficamente de P. pauta existe una diferencia en los diámetros axiales y ecuatoriales del polen, lo que sugiere, y acorde con Schmidt-Lebuhn et al. (2010), que los procesos de ploidización se pueden generar de forma independiente varias veces en este género, lo cual promueve el desarrollo de potenciales especies híbridas que aún no se han identificado.
Por primera vez en Ecuador se estableció un protocolo para obtener fotografías en microscopia electrónica (SEM) de células oclusivas de los estomas encriptados de Polylepis pauta, P. sericea, P. racemosa y P. microphylla. Según Metcalfe and Chalk (1965), son estomas anomocíticos encriptados. Esta estructura funciona como adaptación a las condiciones ambientales, así como otras protecciones estomáticas asociadas a la reducción de la pérdida de agua por transpiración. Se ha constatado la presencia de estomas encriptados en ambientes húmedos (Roth-Nebelsick et al. 2007; Haworth and McElwain 2008; Jordan et al. 2008; Hassiotou et al. 2009), como el caso del páramo. Este tipo de estomas está relacionado con características esclerófilas en lugar de xerófilas (Read et al. 2000; Hassiotou et al. 2009). Los estomas encriptados o cubiertos por tricomas están protegidos de los daños mecánicos causados por estrés abiótico o biótico (Haworth and McElwain 2008; Hassiotou et al. 2009). Además, se ha sugerido que las criptas estomáticas crean un microclima de amortiguamiento a las condiciones del páramo andino (Hassitou et al. 2009).
Se observaron fotografías de polen en microscopia electrónica (SEM). Los granos presentaron isometría isopolar y forma esferoidal, y fueron tricolpados (triaperturados). La apertura es, por lo general, una endoapertura, y son pontoperculados. La morfología de la superficie externa, la exina, presenta una estructura no estriada, microverrucada, dispersa a lo largo del grano de polen. Las verrugas suelen ser pronunciadas y cubren la superficie del grano. Todas estas características son propias del polen de la familia Rosaceae (Chung et al. 2010). La morfología de polen, es una característica morfológica que sustenta las relaciones filogenéticas, siempre que sean realizadas con un soporte molecular. En la familia Rosaceae, la estructura de la exina es una característica informativa de las relaciones filogenéticas (Hebda and Chinnappa 1994).
Los datos morfológicos de estomas y de polen permiten realizar diferencias morfológicas intraespecíficas e interespecíficas tomando en cuenta la complejidad taxonómica del género Polylepis. Además, brindan información preliminar sobre citotipos y viabilidad, datos fundamentales para procesos de restauración ecológica y de reforestación. Con protocolos sencillos se obtienen datos que posteriormente se pueden correlacionar con información ecológica, genética y molecular.
De las especies de Polylepis analizadas en el actual estudio, los porcentajes de viabilidad muestran valores elevados, variando entre 60% (P. sericea) y 98% (P. microphylla). Esto indica que la viabilidad de polen producido en una flor de Polylepis puede influir directamente en la calidad de su fruto. En el caso de obtener especies citotipos, su estudio es vital para conocer la calidad de una semilla híbrida. Según Ramírez et al. (2013), el cálculo de la viabilidad de polen es primordial para estudiar la biología de la reproducción, el mejoramiento genético de plantas y para formar híbridos e incrementar la viabilidad. Por lo tanto, este estudio da una oportunidad para iniciar nuevas estrategias para aumentar el éxito reproductivo. De igual manera, es importante mencionar que las altas concentraciones de CO2, también podrían influir en los procesos de desarrollo de estructuras reproductivas, que, en ocasiones, pueden afectar el rendimiento de la semilla. En consecuencia, este enfoque podría ser una razón para entender el alto nivel de viabilidad de polen y la baja tasa de germinación de semillas en Polylepis (Dermody et al. 2006).
Las diferentes adaptaciones evidenciadas en la polinización del género Polylepis le han permitido a esta especie sobrevivir en el tiempo y establecerse en grandes altitudes (Simpson 1986). Además, factores ambientales como la dispersión por el viento le ha permitido germinar sin la ayuda de polinizadores, incluso si presentase baja viabilidad (Domic et al. 2013).
Ciertos protocolos para la reforestación de las diferentes especies de Polylepis proponen una reproducción vegetativa de esquejes debido a la baja tasa de germinación de semillas, a pesar de la alta viabilidad del polen, como se indicó anteriormente (Pretell et al. 1985; Brandbyge and Holm-Nielsen 1987; Reynel and Leon 1990). La germinación de las semillas se ve afectada por la fragmentación de los páramos andinos o la degradación del suelo (Renison et al. 2004). Por lo tanto, es transcendental comprender las causas de las bajas tasas de germinación, ya que dificulta la reforestación y puede afectar la regeneración natural. Al mismo tiempo, al haber bajas tasas de germinación se promueve el uso de estacas, que crecen más rápido que los árboles producidos a partir de plántulas y no contribuyen a la diversidad genética en los páramos andinos.
Polylepis incana presentó menor tamaño de las células oclusivas y diámetro de polen en individuos que se encontraban en condiciones de mayor altitud y variación de temperatura. Nicotra et al. (2010) menciona que los efectos moleculares y morfológicos en las estructuras celulares, órganos y tejidos son consideradas respuestas a tensiones ambientales. Algunos estudios demostraron que factores abióticos como luz, temperatura, humedad e, incluso, la estación hídrica intervienen en el tamaño de las células oclusivas (Mishra 1997; Colmenares et al. 2005). Es importante mencionar que los organismos poliploides son más abundantes en situaciones de mayor estrés ambiental (Soltis et al. 2015).
Polylepis racemosa (población Papallacta) posee la mayor longitud de células estomáticas y posiblemente está sometida a mayores concentraciones de CO2 por su ubicación cercana a poblaciones urbanas. En contraste, P. incana (población Illinizas) presenta menor longitud de estomas y estaría expuesta a menores concentraciones de CO2 debido a su ubicación distante de asentamientos poblados. Los cambios climáticos pueden alterar la forma o la arquitectura final de la planta, tanto a nivel de órganos individuales como de toda la planta. En Glycine max, la presencia de hojas más grandes es una respuesta a niveles elevados de CO2 (Dermody et al. 2006). Por lo tanto, altas concentraciones de CO2 podrían producir un aumento en el tamaño de las hojas y, por ende, en la longitud de los estomas (Taylor et al. 2003).
La determinación de la longitud de células oclusivas y diámetro de polen permite obtener indicios del nivel de ploidía dentro del género Polylepis, al comparar datos entre especies. Sin embargo, la comprobación definitiva se obtiene con ayuda del número cromosómico, al observar el cariotipo y el tamaño genómico. El examen morfométrico de células oclusivas y de polen representa una aproximación indirecta, rápida, fácil y económica del nivel de poliploidía, ya que de esta manera se puede realizar una identificación previa de potenciales organismos híbridos que alteren el ecosistema natural por equivocadas prácticas de reforestación. Además, estos datos permiten obtener un enfoque de la presencia silenciosa de altas concentraciones de CO2 provocados por el cambio climático que actualmente se presenta en los páramos andinos. Esta investigación evidencia la necesidad de trabajos en el área de biología reproductiva y morfología de estas especies para entender mejor sus procesos de especiación y diversificación.
AGRADECIMIENTOS
El equipo de trabajo agradece el apoyo de las siguientes personas u organizaciones: Laboratorio de Cultivos Vegetales de la Universidad de las Fuerzas Armadas ESPE y su directora Ph.D. Mónica Jadán, Ing. María José Vallejo del Laboratorio de Investigación de Biotecnología Humana de la Universidad de las Fuerzas Armadas ESPE, Ing. Andrea Vaca e Ing. Carla Vizuete, del Centro de Nanociencia y Nanotecnología de la Universidad de las Fuerzas Armadas ESPE, Ph.D. María Emilia Medina del Laboratorio de Microbiología de Suelos de la Universidad de las Fuerzas Armadas ESPE, Ph.D. Rachid Sqquat, Marcelo Gómez, Proyecto Páramo Andino, Florida Museum of Natural History, Tropical Conservation and Environment and Development Program, Secretaría Nacional de Educación Superior Ciencia y Tecnología, Universidad de las Fuerzas Armadas ESPE. Este artículo se realizó con los datos parciales de la tesis de doctorado de Claudia Segovia y muestras colectadas durante esa época bajo el permiso de investigación No. 048-2011-ICFLO- DPAP-MA.
REFERENCIAS
1. Alcántar, J. P. 2014. La Poliploidía y su importancia evolutiva. Temas de ciencia y Tecnología 18:17-29. [ Links ]
2. Beck, S. L., R. W. Dunlop, and A. Fossey. 2003. Stomatal length and frequency as a measure of ploidy level in black wattle, Acacia mearnsii (de Wild). Botanical Journal of the Linnean Society 141:177-181. [ Links ]
3. Brandbyge, J., and L. B. Holm-Nielsen. 1987. Reforestation of the High Andes with Local Species, Reports from the Botanical Institute 13:1-114. [ Links ]
4. Berry, J. A., J. D. Beerling, and P. J. Franks. 2010. Stomata: key players in the earth system, past and present. Curr Opin Plant Biol 13:232-239. [ Links ]
5. Chaturvedi, P., A. Ghatak, and W. Weckwerth. 2016. Pollen proteomics: from stress physiology to developmental priming. Plant Reprod 29:119-132. [ Links ]
6. Chung, K., W. J. Elisens, and J. Skvarla. 2010. Pollen morphology and its phylogenetic significance in tribe Sanguisorbeae (Rosaceae). Plant Syst Evol 285:139-148. [ Links ]
7. Colmenares, M. C., F. J. Rada, and R. Luque. 2005. Anatomía Foliar de Polylepis sericea Wedd. (Rosaceae) a dos altitudes en los altos andes venezolanos. Plantula 3:141-148. [ Links ]
8. Comai, L. 2005. The advantages and disadvantages of being polyploid. Nature Reviews Genetics 6:836-846. [ Links ]
9. Domic, A. I., E. Mamani, and C. Gerardo. 2013. Reproductive phenology of kewiña (Polylepis tomentella, Rosaceae) in the semi-humid puna of Chuquisaca (Bolivia). Ecology in Bolivia 48:31-45. [ Links ]
10. Dermody, O., S. P. Long, and E. H. DeLucia. 2006. How does elevated CO2 or ozone affect the leaf-area index of soybean when applied independently? New Phytol 169:145-155. [ Links ]
11. Evans, A. 1955. The production and identification of Polyploids in red clover, white clover and lucerne. The New Phytologist 54:149-162. [ Links ]
12. Guerra, S., and A. Debut. 2012. Comparación entre cuatro protocolos para la preparación de muestras de referencia usando el microscopio electrónico de barrido, Ciencia y Tecnología. ISSN:1390-4663. Universidad de las Fuerzas Armadas, CENCINAT, Sangolquí, Pichincha, Ecuador. [ Links ]
13. Hassiotou, F., J. Evans, M. Ludwig, and E. Veneklaas. 2009. Stomatal crypts may facilitate diffusion of CO2 to adaxial mesophyll cells in thick sclerophyllspce. Plant, Cell and Environment 32:1596-1611. [ Links ]
14. Haworth, M., and J. McElwain. 2008. Hot, dry, wet, cold or toxic? Revisiting the ecological significance of leaf and cuticular micromorphology. Palaeogeography, Palaeoclimatology, Palaeoecology 262:79-90. [ Links ]
15. Hebda, R. J., and C. C. Chinnappa. 1994. Studies on pollen morphology of Rosaceae. Acta Botanica Gallica 141:183- 193. [ Links ]
16. Instituto Geográfico Militar del Ecuador. 2016. URL: goo.gl/GaJ3Xv. [ Links ]
17. Jordan, G. J., P. H. Weston, R. J. Carpenter, R. A. Dillon, and T. J. Brodribb. 2008. The evolutionary relations of sunken, covered, and encrypted stomata to dry habitats in Proteaceae. American Journal of Botany 95:521-530. [ Links ]
18. Jordan, G. J., R. J. Carpenter, A. Koutoulis, A. Price, and T. J. Brodribb. 2014. Environmental adaptation in stomatal size independent of the effects of genome size. New Phytologist 205:608-617. [ Links ]
19. Jorgensen, P. M., and S. León-Yánez. 1999. Catalogue of the vascular plants of Ecuador. Monogr Syst Bot Missouri Bot Gard 75:1-11. [ Links ]
20. Kerr, M. S. 2004. A phylogenetic and biogeographic analysis of Sanguisorbeae (Rosaceae), with emphasis on the Pleistocene radiation of the High Andean genus Polylepis. Tesis doctoral, University of Maryland, Maryland, U.S.A. Pp. 191. [ Links ]
21. Kessler, M., and A. N. Schmidt-Lebuhn. 2005. Taxonomical and distributional notes on Polylepis (Rosaceae). Organisms, Diversity and Evolution 6:67-69. [ Links ]
22. Kessler, M. 2006. Bosques de Polylepis. Botánica Económica de los Andes Centrales. Pp. 110-120. [ Links ]
23. Lagos T. C., C. M. Caetano, F. A. Vallejo, J. E. Muñoz, H. Criollo, and C. Olaya. 2005. Caracterización palinológica y viabilidad polínica de Physalis peruviana L. y Physalis philadelphica Lam. Agronomía Colombiana 23:55-61. [ Links ]
24. Leitch, I. J., and M. D. Bennett. 1997. Polyploidy in angiosperms. Trends in Plant Science 2:470- 476. [ Links ]
25. Liu, L., L. Yu, and S. Edwards. 2010. A maximum pseudo-likelihood approach for estimating species trees under the coalescent model. BMC Evolutionary Biology 10:1-18. [ Links ]
26. Longhi, S., L. Giongo, M. Buti., N. Surbanovski., R. Viola, R. Velasco., J. Ward, and D. J. Sargent. 2014. Molecular genetics and genomics of the Rosoideae: State of the art and future perspectives. Horticulture Research 1:2052-7276. [ Links ]
27. Mable, B. K. 2004a. Why polyploidy is rarer in animals than in plants: myths and mechanisms. Biological Journal of the Linnean Society 82:453-466. [ Links ]
28. Mable, B. K. 2004b. Breaking down taxonomic barriers in polyploidy research. Trends Plant Sci 8:582-590. [ Links ]
29. Masterson, J. 1994. Stomatal size in fossil plants: evidence for polyploidy in majority of angiosperms. Science 264: 421-424. [ Links ]
30. Mendoza, W., and A. Cano. 2011. Diversidad del género Polylepis (Rosaceae, Sanguisorbeae) en los Andes peruanos. Revista Peruana de Biología 18:197-200. [ Links ]
31. Metcalfe C. R., and L. Chalk. 1965. Anatomy of Dicotyledons Volume I. Clarendon Press Oxford. London, England, United Kingdom. [ Links ]
32. Ministerio del Ambiente del Ecuador. 2016. URL: goo.gl/JjvWSH. [ Links ]
33. Mishra, M. K. 1997. Stomatal Characteristics at Different Ploidy Levels in Coffea L. Annals of Botany 80:689-692. [ Links ]
34. Nicotra, A. B., O. K. Atkin., S. P. Bonser, A. M. Davidson, E. J. Finnegan, U. Mathesius, P. Poot, M. D. Purugganan, C. L. Richards, F. Valladares, and M. van Kleunen. 2010. Plant phenotypic plasticity in a changing climate. Trends Plant Sci 15:684-692. [ Links ]
35. Oliveira de, V. M., E. R. Forni-Martins, P. M. Magalhães, and M. N. Alves. 2004. Chromosomal and morphological studies of diploid and polyploid cytotypes of Stevia rebaudiana (Bertoni) Bertoni (Eupatorieae, Asteraceae). Genetics and Molecular Biology 27:215-222. [ Links ]
36. Otto, S., and J. Whintton. 2000. Polyploid Incidence and Evolution. Annu Rev Genet 34:401-37. [ Links ]
37. Palanyandy, S. R., P. Suranthran, S. Gantait, U. R. Sinniah, S. Subramaniam, M. A. Aziz, and S. H. Roowi. 2013. In vitro developmental study of oil palm (Elaeis guineensis Jacq.). Acta physiologiae plantarum 35:1727-1733 [ Links ]
38. Pretell, J., D. Ocaña, R. Jon, and E. Barahona. 1985. Apuntes sobre algunas especies forestales nativas de la sierra peruana. FAO/Holanda/INFOR, Lima, Lima, Perú [ Links ].
39. Quija-Lamina, P., M. C. Segovia-Salcedo, M. Jadán, and K. Proaño. 2010. Estandarización de la metodología para el conteo cromosómico en especies del género Polylepis en el Ecuador. Revista Ecuatoriana de Medicina y Ciencias Biológicas 31:33-49. [ Links ]
40. Ramírez, F., V. Robledo, R. Foroughbakhch, A. Benavides, and M. A. Alvarado. 2013. Viabilidad de polen, densidad y tamaño de estomas en autotetraploides y diploides de Physalis ixocarpa. Botanical Sciences 91:11-18. [ Links ]
41. Reigosa, M. J. 2001. Handbook of Plant Ecophysiology Techniques. University of Vienna, Austria. DOI: 10.1007/0- 306-48057-3_17. [ Links ]
42. Read, J., C. Edwards, G. D. Sanson, and N. Aranwela. 2000. Relationships between sclerophylly, leaf biomechanical properties and leaf anatomy in some Australian heath and forest species. Plant Biosystems 134:261-277. [ Links ]
43. Renison, D., A. Singolani, and R. Suárez. 2002. Revista Chilena de Historia Natural 75:719-727. [ Links ]
44. Renison, D., I. Hensen, and A. Cingolani. 2004. Anthropogenic soil degradation affects seed viability in Polylepis australis mountain forests of central Argentina. Forest Ecology and Management 196:327-333. [ Links ]
45. Renison, D., A. E. Cuyckens, S. Pacheco, G. F. Guzman, H. R. Grau, P. Marcora, G. Robledo, A. M. Cingolani, J. Dominguez, M. Landi, L. Bellis, and I. Hensen. 2013. Distribución y estado de conservación de las poblaciones de árboles y arbustos del género Polylepis (Rosaceae) en las montañas de Argentina. Ecología Austral 23:27-36. [ Links ]
46. Reynel, C., and G. J. Leon. 1990. Árboles y arbustos andinos para agroforestería y conservación de suelos. Proyecto FAO/ Holanda/DGFF, Lima, Perú [ Links ].
47. Romoleroux, K. 1996. Rosaceae. Pp. 71-89 in G. Harling and L. Andersson (eds.). Flora of Ecuador. Council for Nordic Publications in Botany, Copenhagen, Denmark. [ Links ]
48. Roth-Nebelsick, A. 2007. Computer-based studies of diffusion through stomata of different architecture. Annals of Botany 100:23-32. [ Links ]
49. Schmidt-Lebuhn, A. N., J. Fuchs, D. Hertel, H. Hirsch, J. Toivonen, and M. Kessler. 2010. An Andean radiation: polyploidy in the tree genus Polylepis (Rosaceae, Sanguisorbeae). Plant Biology 12:917-926. [ Links ]
50. Schwanitt, F. 1952. Einige kritische Bemerkungen zur Methode der Bestimmung der Polyploidie durch Messung der Pollen and Spaltoffnungsgrosse. Der Ziichter 22:273-275. [ Links ]
51. Segovia-Salcedo, M. C. 2011. Los riesgos de la reforestación de los páramos con especies exóticas: El caso de Polylepis racemosa. Propuestas Andinas Páramo Número 4. Consorcio para el Desarrollo Sostenible de la Ecorregión Andina (CONDESAN), Proyecto Páramo Andino (PPA), Quito, Pichincha, Ecuador. [ Links ]
52. Segovia-Salcedo, M. C. 2014. New Insights into The Evolutionary History of The Complex Andean Genus Polylepis (Rosaceae: Sanguisorbeae) and Implications for Conservation and Management. PhD thesis, University of Florida. U.S.A. Pp. 182. [ Links ]
53. Segovia-Salcedo M. C., and P. Quijia-Lamina. 2014. Citogeografía de cuatro especies de Polylepis (Rosaceae) en el Ecuador: Información relevante para el manejo y conservación de los bosques andinos. Pp. 467-485 en F. Cuesta, J. Sevink, L. D Llambi, B. De Bievre and J. Posner (eds.). Avances en investigación para la conservación de los páramos andinos. CONDESAN, Quito, Pichincha, Ecuador. [ Links ]
54. Simpson, B. B. 1986. Speciation and specialization of Polylepis in the Andes. Pp. 304-316 in F. Vuillemier and M. Monasterios (eds.). High altitude tropical biogeography. Oxford University Press. England. [ Links ]
55. Simpson, B. B. 1979. A revision of the genus Polylepis (Rosaceae: Sanguisorbeae). Smithsonian Contributions to Botany 43:1-62. [ Links ]
56. Soltis, P. S., D. B. Marchant, Y. V. de Peer, and D. E, Soltis. 2015. Polyploidy and genome evolution in plants. Genetics and Development 35:119-125. [ Links ]
57. Speckmann, G., J. Post, and H. Dijkstra. 1995. The Length of Stomata as an Indicator for Polyploidy in Rey-Grasses. Euphytica 14:225-230. [ Links ]
58. Srinivasan, S., and P. M. Gaur. 2012. Genetics and characterization of an open flower mutant in chickpea. Journal of Heredity 103:297-302. [ Links ]
59. Stone, J. L., J. D. Thomson, and S. J. Dent. 1995. Assessment of pollen viability in hand-pollination experiments: A review. American Journal of Botany 82:1186-1197. [ Links ]
60. Thair, S., and M. Thair. 2009. S.E.M. Structure distribution and taxonomic significance of foliar stomata in Sibbaldia L. Species (Rosaceae). Pakistan Journal Botany 41: 2137-2143. [ Links ]
61. Taylor, G., P. J. Tricker, F. Z. Zhang, V. J. Alston, F. Miglietta, and E. Kuzminsky. 2003. Spatial and Temporal Effects of Free-Air CO2 Enrichment (POPFACE) on leaf growth, cell expansion, and cell production in a closed canopy of poplar. Plant Physiol 131:177-185. [ Links ]
62. Vargas, G. 2011. Botánica General: desde los musgos hasta los árboles. Editorial Universidad Estatal a Distancia. San José, San José, Costa Rica. [ Links ]
63. Vatén, A., and D. C. Bergmann. 2012. Mechanisms of stomatal development: an evolutionary view. EvoDevo 3:1-11. [ Links ]
64. Villota, S. D. 2012. Evaluación de la dinámica poblacional en especies simpátricas de Polylepis en el Páramo de la Virgen, provincia de Napo y Pichincha mediante marcadores moleculares. Tesis de licenciatura. Escuela de Ciencias Biológicas, Pontificia Universidad Católica del Ecuador, Pichincha. Ecuador. Pp. 106. [ Links ]
65. Wendel, J. 2015. The wondrous cycles of polyploidy in plants. American Journal of Botany 102:1753-1756. [ Links ]
66. Yang, N., E. H. Rong., Q. R. Li, J. Dong, T. Q. Du, X. M. Zhao, and Y. X. Wu. 2015. Tetraploid Induction and Identification of Gossypium arboreum. Agricultural Sciences 6:436-444. [ Links ]














