Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Ecología austral
On-line version ISSN 1667-782X
Ecol. austral vol.28 no.2 Córdoba Aug. 2018
ARTÍCULO
Respuestas fenológicas de gramíneas C3 y C4 a variaciones interanuales de precipitación y temperatura
Martín S. Chicahuala1,*; Diego F. Steinaker2 & Manuel R. Demaría1
1 Instituto Nacional de Tecnología Agropecuaria (INTA), EEA-San Luis, Villa Mercedes, San Luis, Argentina.
2 Canadian Institute of Ecology and Evolution Department of Biology University of Regina, SK, Canada.
* chicahuala.martin@inta.gob.ar
RESUMEN
La temperatura y las precipitaciones son factores determinantes de la fenología y la productividad de las plantas. Alteraciones climáticas leves pueden modificar de forma significativa los ciclos de crecimiento y afectar así diferentes funciones ecosistémicas. Para evaluar las relaciones entre la fenología reproductiva de gramíneas, la temperatura y las precipitaciones, en un estudio observacional a campo se investigaron cuatro especies (dos C3 [Piptochaetium napostaense y Poa ligularis] y dos C4 [Eustachys retusa y Schizachyrium condensatum]) representativas de la Región Semiárida Central argentina. Se compararon relevamientos fenológicos llevados a cabo en dos periodos (1976-1986 y 2008-2010) sobre el mismo sitio de estudio. Para las cuatro especies, los veranos más cálidos se asociaron con ciclos reproductivos más largos. Las primaveras más cálidas se relacionaron con un adelanto en el inicio reproductivo de las C4 (pero con un retraso de las C3), los inviernos lluviosos, con un adelanto en el inicio floral de las especies C3, mientras que años con elevadas precipitaciones estivales se relacionaron con un retraso y una extensión del ciclo reproductivo de las C4. En las cuatro especies estudiadas, el inicio del ciclo reproductivo fue menos variable que el final. Esto sugiere que el inicio estaría controlado por factores externos poco variables entre años (e.g., fotoperíodo), mientras que su final podría estar regulado, en mayor medida, por factores con mayor variabilidad interanual (e.g., precipitaciones y temperaturas). El ciclo reproductivo de las dos especies C4 fue más tardío y extenso que el de las especies C3. Las relaciones encontradas en este trabajo entre clima y fenología podrían ser útiles para diseñar estrategias de manejo sustentables de estos pastizales.
Palabras clave: Gramíneas invernales; Gramíneas estivales; Poa ligularis; Piptochaetium napostaense; Eustachys retusa; Schizachyrium condensatum; Cambio climático; Grupos funcionales; Correlaciones climáticas; Fenología reproductiva.
ABSTRACT
Phenological responses of C3 and C4 grasses to annual changes in precipitation and temperature.
Temperature and precipitation are key factors in plant phenology and productivity. Modifications on growth and reproductive cycles may affect the relative fitness of the species, altering their interactions and ecosystem functions. In native grasslands of San Luis province, Argentina, C3 (cold-season) and C4 (warm-season) grasses coexist, which makes these grasslands particularly interesting. In this study, we evaluated how phenology of four native grasses (two C3 and two C4) is related to changes in temperature and rainfall. We compared phenological data collected in situ during two periods: from 1976 to 1986 and from 2008 to 2010. We found that warmer summers were related with a delay on the reproductive offset and the length of the reproductive cycle in all four species. In contrast, warmer springs were related with earlier flowering of C4, but later flowering of C3 grasses. Years with rainy winters were related with earlier flowering onsets in C3 species, while rainy summers were related with later and longer reproductive cycles in C4 grasses. These results provide valuable information about vegetation responses to climate and may be used for range management purposes.
Keywords: Winter grasses; Summer grasses; Poa ligularis; Piptochaetium napostaense; Eustachys retusa; Schizachyrium condensatum; Climate change; Functional groups; Climatic correlations; Reproductive phenology.
Recibido: 4 de octubre de 2017
Aceptado: 17 de abril de 2018
Editor asociado: Pedro Laterra
INTRODUCCIÓN
La respuesta fenológica de los organismos al cambio climático ha recibido mucha atención, en especial la fenología reproductiva de las plantas, dado que es uno de los componentes más sensibles a los cambios en la precipitación y la temperatura, y, a su vez, por ser un atributo de fácil observación y evaluación (Badeck et al. 2004; Menzel et al. 2006; Khanduri 2008; Gordo and Sanz 2010; Moore et al. 2015). Sin embargo, la mayoría de los estudios que evalúan las relaciones entre clima y fenología se realizan sobre especies arbóreas de bosques templados (Menzel and Fabian 1999; Kudo and Hirao 2006; Cleland et al. 2007; Steinaker et al. 2010) y sobre ecosistemas en los cuales la nieve cubre el suelo durante la mayor parte del año (Marion et al. 1997; Price and Waser 1998; Steinaker and Wilson 2008; Aldridge et al. 2011). Por otro lado, pocos trabajos determinaron la respuesta fenológica de gramíneas a variaciones climáticas; estas respuestas no fueron estudiadas para ambientes semiáridos del centro de la Argentina.
Es esperable que las variaciones del clima alteren la estacionalidad de los fenómenos biológicos como el crecimiento y la floración de las plantas, fuertemente determinados por los factores ambientales (Khanduri 2008). En las regiones con marcada estacionalidad térmica e hídrica, la temperatura es el mayor control de los principales procesos de desarrollo en las plantas (Sparks et al. 2000; Peñuelas et al. 2004; Khanduri 2008; Munson and Long 2017). En otro trabajo llevado a cabo en Inglaterra se encontró, sobre un total de 243 especies estudiadas, que el tiempo de floración en el 90% de las especies se relacionó de manera significativa y presentó sincronía con la temperatura (Fitter et al. 1995). En regiones frías, la floración se adelanta con el aumento de las temperaturas, mientras que en zonas cálidas, la fenología en su conjunto se atrasa con este aumento (Munson and Long 2017). Asimismo, un trabajo con más de 20 años de datos, realizado en bosques de zonas frías y templadas de Europa, mostró incrementos en el largo de la estación de crecimiento con el aumento de la temperatura (Menzel and Fabian 1999).
Alteraciones en los regímenes pluviométricos asociados al cambio climático pueden afectar de manera diferente a distintos grupos funcionales de plantas y ser el factor preponderante en los cambios fenológicos en ambientes áridos o semiáridos. Las especies con metabolismo C4 poseen una eficiencia en el uso del agua (EUA) más alta que las C3 bajo condiciones de estrés, pero con mayor costo energético por gramo de carbono fijado (Lambers et al. 1998). Por lo tanto, en ambientes con restricciones hídricas (constantes o estacionales) como en la región central semiárida de la Argentina, los cambios estacionales en las precipitaciones afectarían menos a las plantas C4 que a las especies C3 (Craine et al. 2011).
Varios autores estudiaron el comportamiento climático de la Región Central argentina durante el siglo XX (Hoffman 1988; Forte Lay and Falasca 1991; Carballo and Hartman 1996; López Gay et al. 1996; Viglizzo et al. 1997). En términos generales, los análisis de regresión mostraron una disminución de las precipitaciones en toda la Región Pampeana hasta 1950, y luego, durante la segunda mitad del siglo XX, una inversión de la tendencia (Viglizzo et al. 1997). La provincia de San Luis presentó un patrón general similar al observado en la Región Central argentina, con un aumento significativo de las precipitaciones a partir de la segunda mitad del siglo XX (Bertón et al. 2006; Echeverría and Giulietti 2006) La superficie considerada árida según los registros climáticos del período 1921-50 pasó a ser semiárida según los datos de las precipitaciones de la segunda mitad del siglo XX. Asimismo, a aquellas áreas históricamente consideradas semiáridas, hoy se las podría clasificar como sub-húmedas debido al desplazamiento de las isohietas hacia el oeste (Bertón et al. 2006). Los cambios registrados podrían afectar la respuesta fenológica de las especies del pastizal natural, lo que podría generar cambios en las comunidades vegetales en el largo plazo.
Para predecir las respuestas a nivel ecosistémico y garantizar prácticas de manejo adecuadas es fundamental conocer en qué medida los cambios temporales y cuantitativos en las precipitaciones y temperaturas afectaron la fenología reproductiva de las especies clave de una comunidad (Price and Waser 1998). El objetivo de este estudio fue evaluar, para un período de 24 años (1976 y 2010), los cambios en la fenología reproductiva de gramíneas C3 y C4 ampliamente distribuidas en la Región Semiárida Central argentina, y analizar cómo estos cambios se relacionan con las variaciones de la precipitación y la temperatura.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en bosques de caldén (Prosopis caldenia Burkart) ubicados al sureste de la provincia de San Luis, Argentina, entre los 34°51' S, 65°06´ O y los 35°30´ S, 65°55´ O (Figura 1). El Distrito del Caldén, perteneciente a la Provincia Fitogeográfica del Espinal (Cabrera 1976), se extiende en el centro y sureste de la provincia de San Luis. Originalmente ocupaba 600000 ha al suroeste de la provincia de Córdoba, el centro de la provincia de La Pampa y el sur de Buenos Aires (Anderson et al. 1970). La comunidad vegetal clímax estaría constituida por un bosque abierto de caldén, con árboles de entre 8 y 10 m de altura, con un estrato arbustivo pobre y un estrato herbáceo mixto compuesto principalmente por gramíneas C4 (Digitaria californica, Setaria leiantha, Eustachys retusa, Schizachyrium condensatum, Setaria leucopila, Pappophorum pappipherum), latifoliadas anuales (Heteroteca latifolia, Chenopodium spp.), gramíneas C3 palatables (Piptochaetium napostaense, Poa ligularis, Bromus brevis) y gramíneas C3 no palatables conocidas como “pajas” (Jarava ichu Ruiz and Pav. [antes, Stipa eriostachya Kunth] y Nassella tenuissima (Trin.) Barkworth [antes, Stipa tenuissima Trin.]) (Cabrera 1976; Gallego and Distel 2004).
Figura 1. Área de estudio dentro de la región Bosque de Caldén (Anderson et al. 1970) en la provincia de San Luis, Argentina.
Figure 1. Study area in the Caldén Forest region (Anderson et al. 1970), in the province of San Luis, Argentina.
El potrero donde se realizó el estudio tuvo una historia de pastoreo típica de la región, basado en un sistema rotativo de cría con cargas entre moderadas y bajas (0.08-0.1 E.V./ha), con bovinos de la raza Angus. No se registraron incendios en el área de muestreo durante el lapso del estudio.
La temperatura media anual del sitio es 15.8 °C. La precipitación anual de la zona es 669 mm, con un coeficiente de variación interanual de 21%; el invierno es la estación más seca y variable en cuanto a precipitaciones anuales (74%), y el verano es la más lluviosa y menos variable (31%). El régimen hídrico es ústico, que, en general, indica humedad restringida, aunque en determinado momento permite el crecimiento normal de las plantas. El suelo es un Entisol Ustipsamente típico, con textura arenosa franco gruesa (Peña Zubiate et al. 1998).
Datos climáticos
Los datos de precipitaciones y temperaturas fueron obtenidos de la estación meteorológica del INTA (EEA San Luis), ubicada a 1.9 km del sitio de estudio. Los datos utilizados fueron resúmenes diarios de precipitación y de temperatura mínima, media y máxima registrados entre 1976 y 2010.
Datos fenológicos
Se utilizaron datos fenológicos de cuatro especies, registrados en dos periodos: 1976- 1986 y 2008-2010. Las especies consideradas fueron dos de crecimiento otoño-primaveral y ciclo metabólico C3 (Poa ligularis [“pasto poa”, de valor forrajero alto] y Piptochaetium napostaense [“flechilla negra”, de valor forrajero bueno]) y dos de crecimiento primavero-estival y ciclo C4 (Eustachys retusa [“pata de gallo”, de valor forrajero bueno] y Schizachyrium condensatum [“pasto escoba”, de valor forrajero intermedio]). Desde el punto de vista forrajero, las cuatro especies son consideradas claves en la región; las tres primeras, por su palatabilidad, y S. condensatum, por su abundancia. Cuando están presentes, las dos especies C3 aportan la principal disponibilidad forrajera inviernoprimaveral de pastizales en buena condición ecológica.
Los registros fenológicos históricos (1976- 1986) fueron tomados cada quince días por el equipo de pastizales naturales de INTA de la Estación Experimental Agropecuaria San Luis (Anderson et al. 1976). Los relevamientos actuales (2008-2010) se realizaron en el mismo lote donde se obtuvieron los datos fenológicos históricos (1976-1986), empleando la misma metodología.
Para cumplir los objetivos sólo se analizaron las fases reproductivas prefloración, floración, fructificación y diseminación de semillas (Anderson et al. 1976), sintetizadas, a los fines de este trabajo, en tres fases: inicio, fin y largo del ciclo reproductivo. El inicio y el fin corresponden a la prefloración y la diseminación de semillas, respectivamente, mientras que el largo del ciclo reproductivo es el número de días transcurridos entre el inicio y el fin. Una especie se encuentra en una fenofase determinada cuando más de 50% de los individuos de esa especie, observados dentro del área de estudio en un recorrido de 500 m, alcanzaron esa fenofase.
Análisis de los datos
Se consideró el 1 de julio como el comienzo del año fenológico (día 1), y el 30 de junio del siguiente año calendario como el fin (día 365). Las variables fenológicas (inicio, fin y largo del ciclo reproductivo de cada especie) y las variables climáticas (precipitaciones mensuales y temperaturas [mínimas, medias, máximas, bimensuales y estacionales]) se analizaron primero por separado y luego se las relaciónó entre sí por medio de regresiones lineales y correlaciones de Pearson. La unidad de análisis es el grupo de individuos observados de una misma especie cada 15 días. Los análisis de regresión y correlación se hicieron considerando todos los años juntos. Cada año está compuesto por 24 registros fenológicos (quincenales) por especie. Sin embargo, se consideró sólo una fecha por fase para cada año determinado (n total=12 para cada fase; correspondientes a 9 ciclos históricos y 3 actuales). Los datos cumplen con los requisitos de normalidad (Shapiro y Wilks) homogeneidad (Levene). En las correlaciones de Pearson se revisaron las nubes de dispersión.
Aquellas correlaciones entre las variables climáticas y las fenológicas que resultaron significativas (P<0.05) se analizaron mediante correlaciones por senderos (“path analysis”) para conocer por medio de sus efectos directos e indirectos la contribución real de un grupo de variables independientes (e.g., precipitaciones, temperatura) sobre una variable dependiente (e.g., inicio de la floración). El análisis de senderos permitió modelar los controles sobre el inicio, el fin y el largo reproductivo; se obtuvo un valor de ajuste (R2) para cada sistema que forma el modelo, resultado del producto de todos los efectos directos multiplicado por el “r” de cada sistema y un valor residual (E), que explica la fracción exógena al modelo que no es explicada por dicho modelo (E=1-R2) (Abbott 2007).
Las regresiones lineales se utilizaron para examinar las tendencias de las variables climáticas y fenológicas durante el período de estudio completo (1976-2010). Por último, también se evaluó la ocurrencia de cambios fenológicos durante el período de estudio, comparando para cada especie el inicio, fin y largo del ciclo reproductivo entre ambos períodos estudiados (1976-1986 y 2008-2010) a través de la prueba de t.
RESULTADOS
Clima
Durante el período 1976-2010, la precipitación media anual en el área de estudio aumentó 37.4 mm en forma no significativa (P=0.59), mientras que la temperatura media anual disminuyó 0.007 °C en forma no significativa (P=0.99) (Figura 2a). La temperatura y la precipitación se relacionaron negativamente entre sí (P=0.005) (Figura 2b).
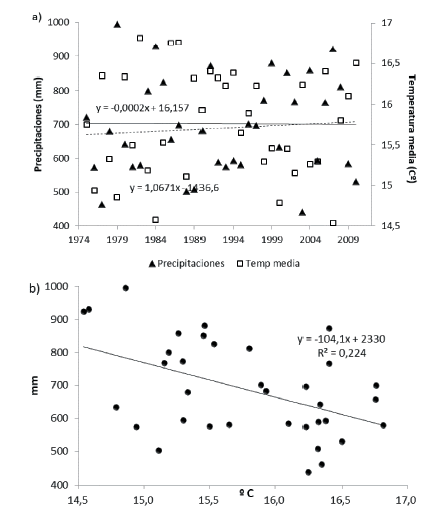
Figura 2. a) Temperatura (media anual) y precipitación, con sus respectivas líneas de tendencias lineales (entera y cortada respectivamente) durante el período 1976 a 2010, para el área de estudio. b) Relación entre la temperatura y precipitación media anual para el mismo período.
Figure 2. a) Temperature and precipitation (annual average and linear trends) during the period 1976 to 2010, for the study area. b) Relationship between temperature and annual precipitation for the same period.
Fenología
Las especies C3 (P. napostaense y P. ligularis) comenzaron su ciclo reproductivo (floración) a principios de primavera (mediados de octubre), mientras que las especies C4 (E. retusa y S. condensatum) lo hicieron a fines de primavera (mediados de diciembre), casi dos meses más tarde (Tabla 1). A su vez, como el ciclo reproductivo fue más corto en las especies C3 que en las C4 (85 vs. 122 días), el final de la reproducción, dado por la diseminación de semillas, fue casi cuatro meses más temprano en las especies C3 (mediados de enero) que en las C4 (mediados de abril) (Tabla 1).
Tabla 1. Estacionalidad del ciclo reproductivo para las cuatro especies. Se indican fechas promedio y rango para el inicio y el fin del ciclo reproductivo, y cantidad de días (d) para la extensión. GF=grupo funcional, DE=desvío estándar, EE=error estándar.
Table 1. Seasonality of the reproductive cycle for the four species. It is indicated average and range dates for the start and end of the reproductive cycle, and amount of days (d) for the length. GF=functional group, DE=standard deviation, EE=standard error.

En general, el inicio del ciclo reproductivo (floración) fue menos variable que el final (ver DS, Tabla 1). A su vez, el inicio y el largo del ciclo reproductivo fueron más variables en las especies C4 que en las C3. La extensión del ciclo reproductivo fue explicada más por el fin que por el momento de inicio del ciclo (Tabla 2). Sólo para E. retusa, el largo del ciclo reproductivo estuvo determinado tanto por el su inicio como por su finalización.
Tabla 2. Correlaciones de Pearson entre el inicio, el fin y el largo de un ciclo reproductivo, y el inicio, el fin y el largo del ciclo anterior (L ant). GF=grupo funcional. Los asteriscos indican correlaciones estadísticamente significativas (*0.001>P<0.05; **P<0.0001).
Table 2. Pearson´s correlations between start, end, and length of the reproductive cycle and the start, end and length of the previous cycle (L ant). GF=functional group. Asterisks indicate statistically significant correlations (*0.001>P<0.05; **P<0.0001).
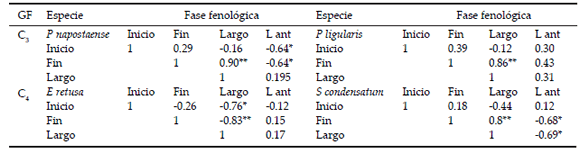
El fin y el largo del ciclo reproductivo de S. condensatum están relacionados en forma negativa con el largo del ciclo anterior (Tabla 2). Es decir, cuanto más largo fue un ciclo reproductivo, más corto fue el siguiente, y viceversa. En el mismo sentido, el inicio y fin del ciclo reproductivo de P. napostaense estuvieron negativamente correlacionados con el ciclo anterior (Tabla 2). Por lo tanto, cuanto más extenso fue el ciclo reproductivo, más temprano empezó el siguiente ciclo.
Comparando los períodos 1976-1986 vs. 2008- 2010, sólo P. ligularis, de las cuatro especies, presentó cambios fenológicos significativos a través del tiempo. En esta especie el inicio se retrasó 38 días (P=0.05) y el fin del ciclo reproductivo lo hizo en 16 días entre un periodo y otro (P=0.03) (Figura 3).
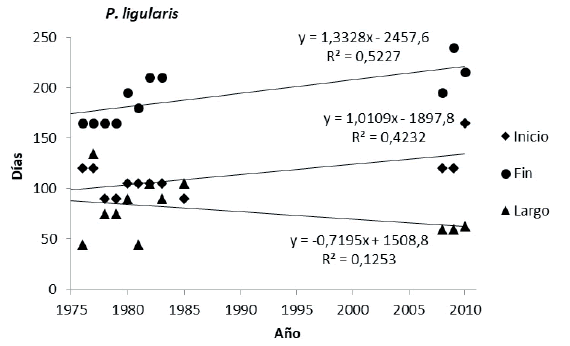
Figura 3. Cantidad de días a partir del de julio para el inicio, el fin y el largo reproductivo para cada año durante el período evaluado para Poa ligularis.
Figure 3. Number of days to the start and end (from July 1 of each year), and length of the reproductive cycle, in Poa ligularis.
Relación fenología-clima
La fenología (inicio, fin y largo) del ciclo reproductivo se relacionó con las precipitaciones y la temperatura, de diferentes maneras para cada una de las cuatro especies estudiadas.
Piptochaetium napostaense
El inicio del ciclo reproductivo estuvo relacionado de forma negativa con las lluvias de julio (-0.61; P=0.04) y de manera positiva con las temperaturas máximas de octubre (0.50; P=0.01). En el año 1985, por ejemplo, las lluvias del mes de julio (188 mm) estuvieron muy por encima de la media (17 mm), y el inicio de la floración sucedió 16 días antes, mientras que años en los que no se registraron lluvias en julio (e.g., 1976 y 1980) o cuando la temperatura máxima de octubre fue muy elevada (e.g., +3 °C, años 1977 y 2009), el inicio del ciclo reproductivo se atrasó 15 días.
Por su parte, el fin reproductivo se asoció positivamente con la temperatura de diciembre (0.36) y con las precipitaciones de octubre (0.43), y negativamente con las precipitaciones de noviembre (-0.38) (Figura 4). El modelo de correlaciones positivas para el largo del ciclo reproductivo con las lluvias de octubre presentó un buen ajuste (R2=84), del cual, el mayor efecto es indirecto a través del fin del ciclo (0.48). En el año 1979, por ejemplo, la temperatura media de diciembre fue 2 °C menor a la media, el final del ciclo se adelantó 24 días y el largo de la etapa reproductiva se acortó 8 días, mientras que en el año 1982, cuando las temperaturas medias de diciembre fueron más elevadas, estas dos fases se retrasaron y se extendieron 18 y 20 días (fin y largo, respectivamente).
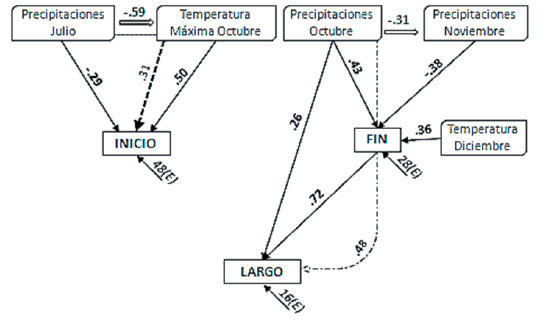
Figura 4. Relaciones fenológicas para Piptochaetium napostaense, evaluadas mediante análisis de senderos. Flechas llenas y números en negrita=relaciones directas; flechas punteadas y números sin negrita=relaciones indirectas. Flechas dobles=correlaciones climáticas. En cursiva se indica la residualidad en porcentaje del modelo (E).
Figure 4. Phenological relationships in Piptochaetium napostaense, by using path analyses. Solid arrows and bold numbers=direct relationships; dotted arrows and regular numbers=indirect relationships. Double arrows indicate climatic correlations. The percentages of the residual of the models (E) are indicated in italics.
Poa ligularis
Esta fue la única especie en la cual el ciclo reproductivo no presentó ninguna correlación con las precipitaciones (Figura 5). El inicio reproductivo se correlacionó positivamente y de manera directa con las temperaturas máximas de octubre (0.53). El fin del ciclo reproductivo se correlacionó con las temperaturas mínimas de febrero (0.65) y llamativamente también lo hizo en sentido opuesto (-) con las mínimas de julio (-0.46). El fin del ciclo a su vez estuvo relacionado con el largo del ciclo reproductivo (0.73).

Figura 5. Relaciones fenológicas para Poa ligularis, evaluadas mediante análisis de senderos. Flechas llenas y números en negrita=relaciones directas; flechas punteadas y números sin negrita=relaciones indirectas. Flechas dobles indican correlaciones climáticas. En cursiva se indica la residualidad en porcentaje del modelo (E).
Figure 5. Phenological relationships in Poa ligularis, by using path analyses. Solid arrows and bold numbers=direct relationships; dotted arrows and regular numbers=indirect relationships. Double arrows indicate climatic correlations. The percentages of the residual of the models (E) are indicated in italics.
Eustachys retusa
Las lluvias de junio (-0.50) y las temperaturas mínimas de septiembre (-0.42) explicaron muy bien el inicio del ciclo reproductivo de E. retusa. El fin se correlacionó positivamente con las temperaturas mínimas del mes de enero (0.65). Esta especie es la única en la cual el largo del ciclo reproductivo estuvo relacionado por el fin (0.67) y por el inicio (-0.58) (Figura 6). En 1982, por ejemplo, las lluvias de verano fueron casi tres veces mayores a la media, las temperaturas mínimas de septiembre fueron 4 °C superiores al promedio y el inicio de la fenofase reproductiva comenzó 56 días antes de la media. En 1983, cuando la mínima de enero fue de 3 °C más elevada que el promedio de los últimos 48 años, el fin se retrasó 62 días y el largo se incrementó en 118 días.
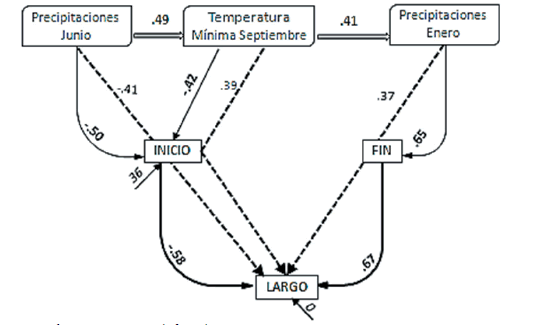
Figura 6. Relaciones fenológicas para Eustachys retusa, evaluadas mediante análisis de senderos. Flechas llenas y números en negrita=relaciones directas; flechas punteadas y números sin negrita=relaciones indirectas. Flechas dobles indican correlaciones climáticas. En cursiva se indica la residualidad en porcentaje del modelo (E).
Figure 6. Phenological relationships in Eustachys retusa, by using path analyses. Solid arrows and bold numbers=direct relationships; dotted arrows and regular numbers=indirect relationships. Double arrows indicate climatic correlations. The percentages of the residual of the models (E) are indicated in italics.
Schizachyrium condensatum
El inicio del ciclo reproductivo de esta especie estuvo relacionado con las temperaturas de octubre y noviembre (-0.54 y -0.51, respectivamente), mientras que el fin del ciclo reproductivo estuvo determinado por las lluvias de enero (0.59) (Figura 7). Si bien el largo del ciclo reproductivo está en gran medida determinado por el fin (0.80; P<0.001), también está relacionado en forma directa a las precipitaciones estivales (0.38). En 1982, por ejemplo, las temperaturas mínimas de octubre y noviembre fueron 2 °C menor que el promedio histórico, y el inicio de la floración se vio retrasado en 33 días respecto a la media. En enero de 1983 llovió 125% más que la media, y el fin del ciclo reproductivo se extendió en 38 días respecto a la media. En el verano de 1979 llovió un 77% más de la media, y esta especie registró un incremento de 68 días en su ciclo reproductivo.
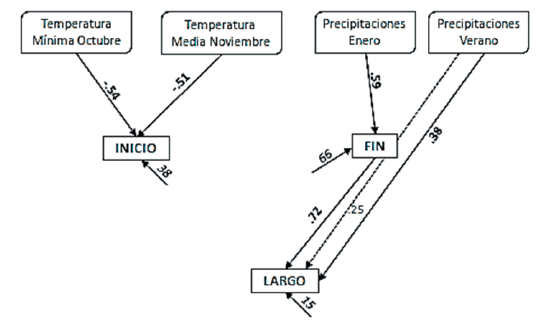
Figura 7. Relaciones fenológicas para Schizachyrium condensatum, evaluadas mediante análisis de senderos. Flechas llenas y números en negrita=relaciones directas; flechas punteadas y números sin negrita=relaciones indirectas. Flechas dobles indican correlaciones climáticas. En cursiva se indica la residualidad en porcentaje del modelo (E).
Figure 7. Phenological relationships in Schizachyrium condensatum, by using path analyses. Solid arrows and bold numbers=direct relationships; dotted arrows and regular numbers=indirect relationships. Double arrows indicate climatic correlations. The percentages of the residual of the models (E) are indicated in italics.
DISCUSIÓN
En las cuatro especies estudiadas, el inicio del ciclo reproductivo fue menos variable que el final, por lo que el final definió más fuertemente el largo total del ciclo. Esto sugiere que el inicio estaría controlado por factores externos poco variables entre años como, por ejemplo, las horas de luz o controladores internos de regulación genotípica (e.g., fitohormonas). Por el contrario, el fin y por lo tanto el largo de la estación reproductiva, podrían estar regulados en mayor medida por factores que varían entre años, como las precipitaciones y las temperaturas.
El ciclo reproductivo de las dos especies C4 fue más tardío y extenso que el de las especies C3. Este desfasaje temporal entre gramíneas C3 y C4 coincide con lo observado en otros pastizales templados (Craine et al. 2011). En dos de las cuatro especies (P. napostaense y S. condensatum), el fin y el largo del ciclo reproductivo mostraron una relación negativa con el largo del ciclo anterior. Esto podría indicar cierta compensación temporal de los recursos destinados por las plantas a la reproducción (un año de gran inversión energética seguido por otro de escasa).
Un patrón interesante que puede estar reflejando las diferencias metabólicas que existen entre especies es que el inicio del ciclo reproductivo de las C3 se relacionó en forma positiva con las temperaturas de primavera, pero las dos especies C4 lo hicieron en forma negativa (primaveras “frías” demoran el comienzo reproductivo, y viceversa). Este patrón posiblemente se deba a que las C4 aumentan considerablemente la tasa fotosintética con altas temperaturas (Shuli et al. 2005), por lo que quedan más tempranamente fotosintatos disponibles para el inicio de la floración en años con primaveras cálidas.
Un resultado no esperado fue que el inicio de la floración estuvo relacionado con las precipitaciones de invierno y no con las de primavera. En dos de las especies estudiadas (P. ligularis y E. retusa), el inicio del ciclo reproductivo se adelantó en años con inviernos lluviosos y se retrasó con los secos. Este es un aspecto a tener en cuenta en el manejo ganadero de estos pastizales, ya que, en general, los productores desestiman a las lluvias de invierno por su bajo impacto sobre la producción forrajera. En otros estudios realizados en el hemisferio norte, las precipitaciones de invierno también actúan como principales controles de la abundancia de gramíneas (Paruelo and Laurenroth 1996; Shuli et al. 2008).
Las diferencias observadas en este trabajo entre estos dos tipos metabólicos pueden tener consecuencias en un contexto de cambio climático más acentuado para esta región. Si nos basamos en las predicciones de modelos climáticos, un aumento de las temperaturas de invierno disminuiría la vernalización de las especies aumentando las posibilidades de daños severos por heladas (Yu et al. 2010). Debido a que las gramíneas C3 y C4 responden de manera diferencial a las temperaturas de primavera, un aumento en la temperatura puede adelantar la floración en las C4 y atrasarla en las C3, y así solapar los ciclos reproductivos de ambos grupos funcionales (Shuli et al. 2008). Además, los aumentos de la temperatura en pastizales mixtos pueden favorecer la expansión de las C4 en detrimento de las C3 (Fitter 2002; Winslow et al. 2003). Este reemplazo de pastos C3 por C4 puede afectar la funcionalidad de los ecosistemas (e.g., la ocupación de nuevos nichos ecológicos [Shuli et al. 2008], el relajamiento de la competencia [Shuli et al. 2005] e, incluso, conducir a alteraciones en los ciclos del agua, del carbono y nitrógeno [Epstein 2002]).
La falta de respuestas fenológicas al largo plazo (35 años) en tres de las cuatro especies puede deberse al alto coeficiente de variación interanual de las precipitaciones entre estaciones (71% invierno, 30% verano), en contraposición con la baja variabilidad interanual total (21%). La precipitación media anual del área de estudio aumentó durante el periodo analizado, pero no de manera significativa. Aun cuando los análisis regionales a partir de registros climáticos de más de 100 años muestran importantes contrastes entre períodos secos y húmedos (Demaría 2008), pueden haber resultado no suficiente para determinar cambios significativos en la fenología reproductiva de las especies estudiadas.
El atraso del inicio y fin del ciclo reproductivo de P. Ligularis en la ventana temporal entre 1976 y 2010 podría ser explicado por el aumento de 2.8 °C en las temperaturas máximas de octubre durante el mismo periodo (recordar que dicha variable climática se relaciona positivamente (+) con el inicio reproductivo). Este atraso en el ciclo reproductivo coincide con trabajos realizados a mayor escala espacial y temporal (McCarty 2001; Fitter and Fitter 2002), pero se contrapone con aquellos trabajos en los que la floración se adelantó con el aumento de la temperatura (McCarty 2001; Cleland et al. 2006; Khanduri 2008).
Las alteraciones en los momentos en que comienzan y terminan la floración, la fructificación, la producción y la diseminación de semillas implican cambios en la reproducción de la especie y en la funcionalidad del ecosistema (Craine et al. 2011). La modificación de estos eventos puede afectar la fenología y ecología de otros organismos relacionados (e.g., hongos, micro y meso fauna [nematodos, colémbolos, etc.]) o de aquellos que se alimentan de flores (o de partes de ellas) y de semillas (Aizen 2003). Asimismo, los cambios en las interacciones mutualistas entre las plantas y sus polinizadores pueden derivar a la extinción de especies, no sólo vegetales, sino de otros organismos con distintos grados de asociación con ellas (Aizen 2007). Si bien este trabajo no evaluó la fenología vegetativa (e.g., rebrote, reposo), ésta guarda una estrecha relación con la fenología reproductiva (Shuli et al. 2005). De este modo, los resultados obtenidos en este trabajo pueden servir de base a la formulación de hipótesis en trabajos que examinen fenología vegetativa, como así también para alimentar modelos dinámicos fenológicos de vegetación. De igual modo, las correlaciones significativas entre algunos factores climáticos y las distintas fenofases se pueden usar para predecir las fechas de inicio y finalización del ciclo reproductivo. Esto puede ser tenido en cuenta al momento planificar el manejo del pastizal.
AGRADECIMIENTOS
A David Lee Anderson y al equipo de pastizales naturales del INTA San Luis de la década del 70 por el esfuerzo y trabajo inconmensurable realizado. A la ayuda invalorable en campo de Daniel Arroyo y Karina Frigerio en los análisis estadísticos.
REFERENCIAS
1. Abbot, L., S. Pistorale, and O. Filippini. 2007. Análisis de coeficientes de sendero para el rendimiento de semillas en Bromus catharticus. Ciencia e Investigación Agraria 34:141-149. [ Links ]
2. Aizen, M. A. 2003. Influences of animal pollination and seed dispersal on winter flowering in temperate mistletoe. Ecology 84:2613-2627. [ Links ]
3. Aizen, M. A. 2007. Enfoques en el estudio de la reproducción sexual de las plantas en ambientes alterados: limitaciones y perspectivas. Ecología Austral 17:7-19. [ Links ]
4. Aldridge, G. D., W. Inouye, J. R. K. Forrest, W. A. Barr, and A. J. Miller-Rushing. 2011. Emergence of a mid-season period of low floral resources in a montane meadow ecosystem associated with climate change. Journal of Ecology 99:905-913. [ Links ]
5. Anderson, D. L. 1976. Observaciones fenológicas en la pastura natural del centro-este de la provincia de San Luis desde 1965 a 1986. Informe de plan de trabajo Nº 10:0428. [ Links ]
6. Anderson, D. L., J. A. Del Águila, and A. E. Bernardón. 1970. Las formaciones vegetales de la provincia de San Luis. Rev. Inv. Agropecuaria INTA, serie 2. Biología y Producción Vegetal 7:83-153. [ Links ]
7. Badeck, F. W., A. Bondeau, K. Bottcher, D. Doktor, W. Lucht, J. Schaber, and S. Sitch. 2004. Responses of spring phenology to climate change. New Phytologist 162:295-309. [ Links ]
8. Bertón, J. A., J. C. Echeverría, and E. G. Jobbágy. 2006. Cambio Climático. Pp. 94-105 en Echeverría, J. C., E. G. Jobbágy and A. D. Collado (eds.). Aptitud forestal de la provincia de San Luis. Convenio de Cooperación Técnica entre el INTA E.E.A. San Luis y el Gobierno de la provincia de San Luis. Editorial Payne, San Luis, Argentina. [ Links ]
9. Carballo, S. M., and T. Hartmann, 1996. La evolución del clima y la actual campaña agrícola. AgroMercado 11:2-26. [ Links ]
10. Cleland, E. E., N. R. Chiariello, S. R. Loarie, H. A. Mooney, and C. B. Field. 2006. Diverse responses of phenology to global changes in a grassland ecosystem. Proceedings of the National Academy of Sciences 103:13740-13744. [ Links ]
11. Cleland, E. E., I. Chuine, A. Menzel, and H. A. Mooney. 2007. Shifting plant phenology in response to global change. Trends in Ecology and Evolution 22:357-365. [ Links ]
12. Craine, M. J., E. M. Wolkovich, E. G. Towne, and S. W. Kembel. 2011. Flowering phenology as a functional trait in a tallgrass prairie. New Phytologist 193:673-682. [ Links ]
13. Demaría, M. R., I. Aguado Suárez, and D. F. Steinaker. 2008. Reemplazo y fragmentación pastizales pampeanos semiáridos en San Luis, Argentina. Ecología Austral 18:55-70. [ Links ]
14. Echeverría, J. C., and J. D. Giulietti. 2006. Precipitación media anual. En Echeverría, J. C., E. G. Jobbágy and A. D. Collado (eds.). Aptitud forestal de la provincia de San Luis. Convenio de Cooperación Técnica entre el INTA E.E.A. San Luis y el Gobierno de la provincia de San Luis.
15. Epstein, H. E., R. A. Gill, J. M. Paruelo, W. K. Lauenroth, G. J. Jia, and I. C. Burke. 2002. The relative abundance of three plant functional types in temperate grasslands and shrublands of North and South America: Effects of projected climate change. Journal of Biogeography 29:875-888. [ Links ]
16. Fitter, A. H., and R. S. Fitter. 2002. Rapid changes in flowering time in British plants. Science 296:1689-1691. [ Links ]
17. Fitter, A. H., R. S. Fi��er, I. T. Harris, and M. H. Williamson. 1995. Relationships between first flowering date and temperature in the flora of a locality in central England. Functional Ecology 9:55-60.
18. Forte Lay, A. J., and S. L. Falasca. 1991. Aspectos agrohidrológicos y bioclimáticos de la región subhúmeda-húmeda y húmeda oriental de la Argentina. Anales del VI Congreso de Meteorología, Centro Argentino de Meteorólogos. Pp. 131-135. [ Links ]
19. Gordo, O., and J. J. Sanz. 2010. Impact of climate change on plant phenology in Mediterranean ecosystems. Global Change Biology 16:1082-1106. [ Links ]
20. Hoffmann, J. A. 1988. Las variaciones climáticas ocurridas en la Argentina desde fines del siglo pasado hasta el presente. En FECIC (ed.). El Deterioro del Ambiente en la Argentina FECIC, Buenos Aires, Pp. 275-290. [ Links ]
21. Khanduri, V. P., C. M. Sharma, and S. P. Singh. 2008. The effects of climate change on plant phenology. Environmentalist 28:143-147. [ Links ]
22. Kudo, G., and A. S. Hirao. 2006. Habitat-specific responses in the flowering phenology and seed set of alpine plants to climate variation: implications for global-change impacts. Population Ecology 48:49-58. [ Links ]
23. Lambers, H., F. S. Chapin III, and T. L. Pons. 1998. Photosynthesis, respiration, and long-distance transport. In Plant physiological ecology. Pp. 10-153. [ Links ]
24. López Gay, E., F. J. Babinec, G. A. Casagrande, and E. F. Viglizzo. 1996. Análisis temporal y espacial del almacenaje de agua en el suelo en la pampa central durante el presente siglo. Rev Invest Agropecuarias 27:215-225. [ Links ]
25. Marion, G. M., G. H. Henry, D. W. Freckman, et al. 1997. Open-top designs for manipulating field temperature in high-latitude ecosystems. Global Change Biology 3:20-32. [ Links ]
26. McCarty, J. P. 2001. Ecological consequences of climate change. Conservation Biology 15:320-331. [ Links ]
27. Menzel, A., and P. Fabian. 1999. Growing Season Extended in Europe. Nature 397(6721):659. [ Links ]
28. Menzel, A., T. H. Sparks, N. Estrella, E. Koch, A. Aasa, R. Ahas, K. Alm-Kubler, P. Bissolli, O. G. Braslavska, A. Briede, et al. 2006. European phenological response to climate change matches the warming pattern. Global Change Biology 12:1969-1976. [ Links ]
29. Moore, L. M., W. K. Lauenroth, D. M. Bell, and D. R. Schlaepfer. 2015. Soil water and temperature explain canopy phenology and onset of spring in a semiarid steppe. Great Plains Research 25(2):121-138. [ Links ]
30. Munson, S. M., and A. L. Long. 2017. Climate drives shifts in grass reproductive phenology across the western USA. New Phytologist 213(4):1945-1955. [ Links ]
31. Paruelo, J. M., and W. K Lauenroth. 1996. Relative abundance of plant functional types in grasslands and shrublands of North America. Ecological Applications 6:1212-1224. [ Links ]
32. Peña Zubiate, C. A., D. L. Anderson, M. A. Demmi, J. L. Saenz, and A. D'Hiriar. 1998. Carta de suelos y vegetación de la provincia de San Luis. Payne Publishing, San Luis, Argentina. [ Links ]
33. Peñuelas, J., C. Gordon, L. Llorens, T. Nielsen, A. Tietema, C. Beier, P. Bruna, B. Emmett, M. Estiarte, and A. Gorissen. 2004. Nonintrusive field experiments show different plant responses to warming and drought among sites, seasons, and species in a north-south European gradient. Ecosystems 7:598-612. [ Links ]
34. Price, M. V., and N. M. Waser. 1998. Effects of experimental warming on plant reproductive phenology in a subalpine meadow. Ecology 79:1261-1271. [ Links ]
35. Shuli, N., W. Liu, and S. Wan. 2008. Different growth responses of C3 and C4 grasses to seasonal water and nitrogen regimes and competition in a pot experiment Journal of Experimental Botany 59:1431-1439. [ Links ]
36. Shuli, N., Y. Yanfang, L. Weixeing, Z. Lei, H. Jianhui, and S. Wan. 2005. Photosynthetic responses of C3 and C4 species to seasonal water variability and competition. Journal of Experimental Botany 56:2867-2876. [ Links ]
37. Sparks, T. H., E. P. Jeffree, and C. E. Jeffree. 2000. An examination of the relationship between flowering times and temperature at the national scale using long-term phenological records from the UK. International Journal of Biometeorology 44:82-87. [ Links ]
38. Steinaker, D. F., and S. D. Wilson. 2008. Phenology of fine roots and leaves in forest and grassland. Journal of Ecology 96:1222-1229. [ Links ]
39. Steinaker, D. F., S. D. Wilson, and D. A. Peltzer. 2010. Asynchronicity in root and shoot phenology in grasses and woody plants. Global Change Biology 16:2241-2251. [ Links ]
40. Viglizzo, E. F., Z. E. Roberto, F. A. Lértora, E. López Gay, and J. Bernardos. 1997. Climate and land-use change in fieldcrop ecosystem of Argentina. Agric Ecosyst Environ 66:61-70. [ Links ]
41. Winslow, J. C., E. R. Hunt Jr., and S. C. Piper. 2003. The influence of seasonal water availability on global C3 versus C4 grassland biomass and its implications for climate change research. Ecological modeling 163:153-173. [ Links ]
42. Yu, H., E. Luedeling, and J. Xu. 2010. Winter and spring warming result in delayed spring phenology on the Tibetan Plateau. Ecology 107:22151-22156. [ Links ]














