Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Ecología austral
versión On-line ISSN 1667-782X
Ecol. austral vol.28 no.3 Córdoba dic. 2018
ARTÍCULO
Distribución de epífitas vasculares sobre cuatro especies arbóreas en un bosque xerofítico del Chaco Húmedo, Argentina
Eugenio Alvarez Arnesi1,*; Ignacio M. Barberis1,2 & José L. Vesprini1,2
1 Facultad de Ciencias Agrarias, Universidad Nacional de Rosario, Zavalla, Santa Fe.
2 Instituto de Investigaciones en Ciencias Agrarias de Rosario-Universidad Nacional de Rosario-Consejo Nacional de Investigaciones Científicas y Técnicas. Zavalla, Santa Fe.
* eugenio.alvarez.arnesi@gmail.com
RESUMEN
Las epífitas aportan una gran diversidad específica y brindan numerosos servicios ecosistémicos en los bosques. En el Chaco Húmedo, los estudios sobre epífitas son muy escasos, por lo cual se realizó una descripción de la comunidad de epífitas vasculares de cuatro especies arbóreas deciduas representativas de un quebrachal de la Cuña Boscosa Santafesina. Dos especies pertenecen al estrato superior (Schinopsis balansae y Sideroxylon obtusifolium) y dos al inferior (Prosopis spp. y Acacia praecox). En invierno se seleccionaron al azar ocho individuos de cada especie y cada uno fue dividido en cuatro zonas (Zona I-II: tronco principal; Zona III: bases de las ramas; Zona IV: parte media de las ramas; Zona V: ramas más finas). En cada zona se contaron e identificaron a nivel de especie todas las epífitas vasculares. En la Zona V se diferenciaron ramas vivas y secas. Los datos se analizaron estadísticamente con modelos lineales generalizados mixtos y análisis multivariados. Se registraron 14 especies (nueve holoepífitas, dos facultativas y tres accidentales) de cuatro familias (Bromeliaceae, Cactaceae, Polypodiaceae y Anacardiaceae). La familia Bromeliaceae fue la más rica, con siete especies del género Tillandsia y Aechmea distichantha. La especie más abundante fue Tillandsia recurvata. Prosopis spp. tuvo la mayor abundancia de epífitas y S. obtusifolium la mayor riqueza. La Zona V tuvo mayor abundancia y riqueza de epífitas en promedio que las otras zonas. Se observaron diferencias cuantitativas entre forófitos en la composición de especies: A. distichantha y T. loliacea estuvieron asociadas positivamente con S. obtusifolium. Prosopis spp. tuvo mayor abundancia y riqueza de epífitas en ramas secas, y los forófitos del estrato superior, en ramas vivas. Las diferencias en abundancia, riqueza, composición específica y distribución vertical de epifitas entre forófitos podrían atribuirse a sus características morfológicas y a la variedad de microhábitats en el tronco y las ramas.
Palabras clave: Abundancia; Bromeliaceae; Quebrachal; Riqueza; Tillandsia.
ABSTRACT
Distribution of vascular epiphytes on four tree species in a xerophytic forest of the Wet Chaco, Argentina.
In numerous forests, the vascular epiphytes contribute substantially to species diversity. Studies about vascular epiphytes in the Wet Chaco region are very scarce. We carried out a description of the epiphyte community in four deciduous tree species, representative of a quebrachal of the Cuña Boscosa Santafesina: two of them from the upper stratum (Schinopsis balansae and Sideroxylon obtusifolium) and two from the lower one (Acacia praecox and Prosopis spp.). Eight individuals of each tree species were selected, and each individual was divided in four zones (Zone I-II: main trunk; Zone III: basal branches; Zone IV: middle branches; Zone V: thinnest branches). For each zone, all the vascular epiphytes were counted and identified at species level. In Zone V, living and dead branches were differentiated. Data were analyzed with general linear mixed models and multivariate analysis. Fourteen species of vascular epiphytes were recorded (nine holoepiphytes, two facultative and three accidental epiphytic species) of four families (Bromeliaceae, Cactaceae, Polypodiaceae and Anacardiaceae). The richest family was Bromeliaceae, with seven species of the genus Tillandsia and Aechmea distichantha. The most abundant species was Tillandsia recurvata. Prosopis spp. had the highest abundance of epiphytes and S. obtusifolium the highest richness. Zone V had the highest average abundance and richness of vascular epiphytes. There were quantitative differences in species composition between phorophytes: A. distichantha and T. loliacea were positively associated with S. obtusifolium. Prosopis spp. had the highest abundance and richness in dead branches and the phorophytes of the upper stratum in the living ones. The differences in abundance, richness, specific composition and vertical distribution of vascular epiphytes between phorophytes could be attributed to their morphological characteristics and the microhabitats conditions in the trunk and branches.
Keywords: Abundance; Bromeliaceae; Quebrachal; Richness; Tillandsia.
Recibido: 2 de enero de 2018
Aceptado: 11 de mayo de 2018
Editor asociado: Fernando Milesi
INTRODUCCIÓN
El epifitismo es una forma de vida en la que evolucionaron algunas especies de algas, briófitas, líquenes y plantas vasculares. Estas especies desarrollan su ciclo de vida sobre otra planta sin extraer de ellas agua ni nutrientes, por lo que no son parásitas en un sentido estricto (Zotz 2016). Sin embargo, hay evidencias de que estas plantas pueden actuar como “parásitos estructurales” cuando se encuentran en gran cantidad sobre las ramas de los árboles, al afectar su crecimiento normal; por ejemplo, al impedir la producción de hojas o al dificultar el intercambio gaseoso (Aguilar- Rodríguez et al. 2007; Flores-Palacios et al. 2014; Soria et al. 2014). Según su relación con el hospedero, las epífitas pueden clasificarse en “verdaderas u holoepífitas”, “facultativas” y “accidentales”. Las primeras son plantas que cumplen todo su ciclo de vida sobre forófitos (denominación que se le otorga a las plantas que portan epífitos sobre ellas) (Zotz 2016). Las segundas son plantas que suelen vivir en el suelo, y que también pueden hacerlo sobre las ramas de otros árboles, ya que poseen ciertas adaptaciones que les permiten vivir como epífitas. Finalmente, las epífitas accidentales no poseen adaptaciones que les permitan crecer sobre forófitos, aunque en ocasiones, las semillas depositadas sobre una planta encuentran condiciones para crecer (Benzing 1990; Bader 1999; Benzing 2000; Granados-Sánchez et al. 2003; Bataghin et al. 2010; Casañas Suárez and Jáuregui 2011; Zotz 2016).
Zotz y Andrade (2002) mencionan que la riqueza y la abundancia de epífitas en distintos ambientes están determinadas en parte por las condiciones macro y microclimáticas (e.g., disponibilidad de agua, luz y temperatura). En una escala de paisaje, el ensamble de epífitas presente será resultado de las condiciones macroclimáticas que predominan en una región. A una escala de mayor detalle, los microclimas presentes sobre un forófito están generados por sus características morfológicas (Brown 1990; Flores-Palacios and García- Franco 2006; Zotz and Schultz 2008). Como generalidad, en un árbol la humedad relativa disminuye desde la base hacia el dosel, mientras aumenta la intensidad de luz (Acebey and Krömer 2001). Este gradiente será más o menos marcado según el tipo de bosque: es mayor en los bosques cerrados (e.g., bosques tropicales húmedos) y menor en los abiertos (e.g., bosques secos estacionales). También es posible establecer “escalas ecológicas” (zona, árbol y stand) donde las características intrínsecas del forófito como su tamaño (altura y diámetro), su tasa de crecimiento, la morfología de su corteza y sus compuestos alelopáticos (Valencia-Díaz et al. 2010), el tipo de follaje (perennifolio o caducifolio) y la inclinación, el grosor y la longevidad de las ramas afectan de forma diferente el ensamble de epífitas vasculares (Mendieta-Leiva and Zotz 2015; Zotz 2016; Cortes-Anzures et al. 2017). Si bien es raro encontrar relaciones de especificidad entre una especie de epífita y un forófito determinado (i.e., una especie que crezca sólo en una especie de forófito), algunos autores destacan la posibilidad de que se formen relaciones de preferencia entre ciertos grupos de epífitas y forófitos gracias a las condiciones que imponen estos últimos (Callaway et al. 2002; Malizia 2003). Las epífitas, por su parte, también poseen adaptaciones morfo-fisiológicas variadas que les permiten colonizar diferentes sitios del forófito de acuerdo a las condiciones microclimáticas y morfológicas del árbol hospedero. Como ejemplos se pueden mencionar el velamen de las orquídeas, los tanques denominados “fitotelmata” de algunas bromelias, los tricomas especializados en la absorción de agua y nutrientes de la atmósfera, las distintas formas de dispersión de las semillas (anemócoras o endozoócoras) (Benzing 2000), las hojas suculentas y la cutícula engrosada (Jiménez-López et al. 2017), o el metabolismo CAM que les permite regular la pérdida de agua bajo las condiciones xéricas del dosel (Cach-Pérez et al. 2014).
La asociación entre las variadas condiciones microclimáticas que ofrece el forófito y las características de las epífitas puede resultar en una distribución vertical de epífitas en la que cada estrato o zona del árbol posee una composición de especies particular. Muchos autores notaron que la distribución de epífitas no era al azar y propusieron diferentes formas de subdividir al forófito con el fin de caracterizar y contar las epífitas sobre el mismo (Zotz 2007). Actualmente, la zonificación que más se usa es la de Johansson (1974), que divide al forófito en cinco zonas en función de la estructura del árbol (y no de su altura), lo que permite comparar entre diferentes tipos de bosques (Zotz 2016). A medida que se asciende por el eje vertical del forófito disminuyen la longevidad del sustrato y, por lo tanto, la disponibilidad temporal para la colonización (Zotz 2007). También disminuyen el grosor de las ramas, la cantidad de sustrato, la rugosidad de la corteza y la capacidad para almacenar agua, lo cual aumenta las diferencias en disponibilidad hídrica impuestas por el gradiente microclimático (Zotz 2007).
Las epífitas vasculares son un componente fundamental de los ecosistemas de los cuales forman parte. Este hecho motivó a realizar numerosos trabajos con epífitas, sobre todo en zonas tropicales, donde se encuentra su mayor diversidad (Zotz 2016). En Latinoamérica es elevado el número de estudios sobre comunidades de epífitas vasculares en bosques subtropicales húmedos (e.g., Mata Atlántica, Yungas, Selva Paranaense) (Eskuche 1986; Brown 1990; Drehwald 1995, citado por Navarro 2001; Malizia 2003; Ceballos et al. 2016), pero mucho menor en bosques subtropicales xéricos (Cach-Pérez et al. 2013; de la Rosa-Manzano et al. 2014). Para la región Chaqueña existen estudios sobre la composición de la comunidad de epífitas no vasculares (Estrabou et al. 2005, 2014) y vasculares (Eskuche 1986; Cabido et al. 1994; Drehwald 1995; Bach et al. 1999; Acebey and Krömer 2001; Navarro 2001; Mereles 2005; Giorgis et al. 2011; Cantero et al. 2017). Sin embargo, son escasos los estudios que describen la composición de epífitas vasculares y su relación con los forófitos en bosques xerofíticos del Chaco Seco (Acebey and Krömer 2001; Navarro 2001), y para el Chaco Húmedo no hay ningún estudio.
Este trabajo tiene como objetivo caracterizar la comunidad de epífitas vasculares de un quebrachal de la porción más austral del Chaco Húmedo (i.e., Cuña Boscosa Santafesina). Para ello se registraron todas las especies de epífitas vasculares del lugar y se contaron las epífitas sobre cada una de cuatro especies de forófitos arbóreos para determinar 1) si la abundancia, la riqueza y la distribución de epífitas son forófito-dependientes y 2) si existe un gradiente vertical en la composición de epífitas.
MATERIALES Y MÉTODOS
Sitio de estudio El estudio se realizó en un quebrachal de la Cuña Boscosa Santafesina (Las Gamas, 29°27’ S - 60°23’ O, 58 m s. n. m.). El clima es templadocálido húmedo, con lluvias principalmente estivales que oscilan entre 800 y 1000 mm/año. Por su parte, los suelos son halo-hidromórficos (Barberis et al. 2005).
El microrelieve está generado por erosión hídrica y por la formación de grandes hormigueros creados por la hormiga cortadora de hojas (Atta vollenweiderii Forel) (Lewis 1991). Las zonas más elevadas tienen una cobertura arbórea continua con dos estratos arbóreos más o menos marcados. El estrato superior tiene más de 10 m de altura y está dominado por el quebracho colorado (Schinopsis balansae Engl.), asociado con quebracho blanco (Aspidosperma quebracho-blanco Schlecht.), guaraniná (Sideroxylon obtusifolium (Roem. and Schult.) T.D. Penn.) y, en menor proporción, el guayacán (Caesalpinia paraguariensis (D. Parodi) Burkart). El estrato inferior se compone de especies de ~5 m de altura como los algarrobos (Prosopis alba Griseb., Prosopis nigra [Griseb.] Hieron. y sus híbridos), el garabato (Acacia praecox Griseb.), el chañar (Geoffroea decorticans [Gill. ex Hook. et Arn.] Burkart) y el tala negro (Achatocarpus praecox Griseb.) (Lewis and Pire 1981). Además, se distinguen arbustos como Celtis pallida Torr., Cynophalla retusa (Griseb.) X. Cornejo and H.H. IItis y Grabowskia duplicata Arn, y plantas herbáceas como Bromelia serra Griseb. y Aechmea distichantha Lem. (Barberis et al. 2002).
En las zonas más bajas se pueden distinguir dos sectores: uno que permanece seco y otro que se inunda parcialmente. En el primero crecen de forma aislada quebrachos colorados, algarrobos y chañares rodeados por un pastizal dominado por flechillas (Nasella). El segundo, ubicado en un relieve más bajo, sufre inundaciones temporales durante las precipitaciones estivales por lo cual tiene escasos árboles y una vegetación herbácea adaptada a esas condiciones de humedad (Lewis and Pire 1981; Marino and Pensiero 2003).
Especies estudiadas
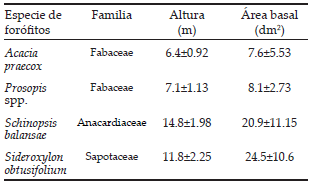
Se trabajó con forófitos adultos de cuatro especies arbóreas representativas del quebrachal: el quebracho colorado (Schinopsis balansae [Anacardiaceae]), el guaraniná (Sideroxylon obtusifolium [Sapotaceae]), el garabato (Acacia praecox [Fabaceae]) y el algarrobo (Prosopis spp. [Fabaceae]). Schinopsis balansae y A. praecox son las especies arbóreas más abundantes del quebrachal (Lewis et al. 1997). La primera especie domina el estrato arbóreo superior junto a S. obtusifolium, mientras que la segunda, acompañada por Prosopis spp., pertenece al estrato arbóreo inferior. Estas especies arbóreas deciduas se diferencian en la rugosidad y profundidad de las grietas de la corteza, en el tamaño (altura y diámetro a la altura del pecho, DAP), en la arquitectura (ramificación más erecta o más péndula, cantidad de ramas finas) y, por consiguiente, en el autosombreo (Figura 1, Tabla 1). Estas características posiblemente condicionan la abundancia, riqueza y composición específica de la comunidad de epífitas vasculares.

Figura 1. Fotografía de ejemplares de las especies de forófitos durante el período de estudio, con detalle de la morfología de sus cortezas. a) Sideroxylon obtusifolium, b) Schinopsis balansae, c) Prosopis spp., d) Acacia praecox.
Figure 1. Photograph of each phorophyte species during the sampling period, with insets showing the morphology of their barks. a) Sideroxylon obtusifolium, b) Schinopsis balansae, c) Prosopis spp., d) Acacia praecox.
Tabla 1. Valores promedio (±desvío estándar) de la altura y el área basal de ocho árboles para cada una de las cuatro especies de forófitos estudiados. Los mismos eran adultos, no senescentes, mayores o igual a 4 m para las especies del estrato inferior (Acacia praecox y Prosopis spp.) y mayores o igual a 10 m para las especies del estrato superior (Schinopsis balansae y Sideroxylon obtusifolium).
Table 1. Mean values (±standard deviation) of the height and basal area of eight trees for each of the four studied phorophyte species. All the phorophytes were adults and healthy. Those from the lower stratum (Acacia praecox and Prosopis spp.) were taller than 4 m height, and those from the upper stratum (Schinopsis balansae and Sideroxylon obtusifolium) were taller than 10 m.
Toma de datos
El censo se realizó en invierno (agosto de 2016), cuando las especies arbóreas elegidas carecían de hojas, lo que facilitó divisar las epífitas que permanecen siempre verdes. Se preseleccionaron 16 individuos de cada especie de forófito focal cuya apariencia general indicara buen estado de salud y que no estuvieran superpuestos con otros árboles, ya que esto dificultaría la observación de las epífitas. Para evitar problemas asociados a diferencias ontogenéticas entre forófitos de una misma especie (Flores-Palacios and García-Franco 2006), todos los individuos preseleccionados habían alcanzado su tamaño adulto y no estaban decrépitos. La altura para las especies del estrato inferior fue mayor a 4 m y para las especies del estrato superior fue mayor a 10 m. Dado que los individuos fueron preseleccionados existen marcadas diferencias en altura entre especies de forófitos, pero no entre individuos de la misma especie. Luego, al azar, se seleccionaron ocho de esos 16 individuos de cada especie, constituyendo un total de 32 árboles, a los que se les estimó de manera visual la altura, se les midió el diámetro a la altura del pecho (DAP) del tronco principal y se calculó el área basal. En aquellos forófitos que se ramificaban por debajo de la altura del pecho se midieron los DAP de las ramas secundarias, se calculó el área basal para cada una de ellas y luego se sumaron para obtener el área basal del forófito. Finalmente, se tomaron fotografías del árbol completo y de los distintos tipos de corteza a fin de caracterizarlos (Figura 1).
Cada árbol fue dividido en cuatro zonas de acuerdo a la clasificación de Johansson (1974). La Zona I-II está representada por el tronco principal del árbol, aunque en algunos individuos (especialmente en A. praecox) suele estar dividido en varios troncos principales de menor diámetro. Se decidió unificar ambas zonas, ya que la base del tronco que corresponde a la Zona I de Johansson prácticamente carece de epífitas y, además, no existen diferencias morfológicas entre ambas zonas. La Zona III abarca las bases de las primeras ramas que se dividen del tronco principal. La Zona IV comprende la parte media de las ramas, que —por lo tanto— poseen un diámetro menor que las de la zona anterior, y la Zona V corresponde a las ramas más finas que se extienden hasta el exterior de la copa del árbol. En cada zona se identificaron y contaron todos los individuos de las distintas especies de epífitas vasculares mediante el uso de binoculares (Canon Co. 16×50, Tokio, Japón), con la ayuda de una escalera que permitió tener una mejor perspectiva del árbol y una tijera de largo alcance para colectar sólo aquellos individuos cuya identidad no pudiera determinarse a distancia. La delimitación de las plantas individuales suele ser difícil en las epífitas vasculares, por lo que se definió a un ‘individuo’ como un grupo de rizomas y hojas que pertenecen a una misma especie y que forman un genet claramente delimitado (Zotz 2016). Se registró el estado fenológico de las epífitas separándolas en “Vegetativas”, cuando no tenían caracteres reproductivos, o “Reproductivas”, cuando tenían flor o fruto. En la Zona V se distinguió si las epífitas se encontraban sobre ramas vivas o secas. Las especies epífitas vasculares encontradas fueron clasificadas en verdaderas, facultativas o accidentales (Johansson 1974; Benzing 1990; Granados-Sánchez et al. 2003; Zotz 2016) y se constató el tipo de dispersión de sus propágulos (Smith and Downs 1977, 1979). Se colectaron ejemplares típicos de cada especie, que fueron herborizados y depositados en el herbario “Juan Pablo Lewis” de la Facultad de Ciencias Agrarias, Universidad Nacional de Rosario.
Análisis estadísticos
Para evaluar las diferencias en la abundancia y riqueza promedio de epífitas vasculares entre especies de forófitos, entre zonas de la misma especie de forófito y entre ramas secas y vivas de la Zona V de los forófitos se emplearon modelos lineales mixtos generalizados, con distribución de error tipo quasipoisson (ya que los residuos mostraban sobredispersión con respecto a lo esperado por la distribución Poisson) y función de ligamiento ‘log’. Para los análisis entre zonas (y entre tipos de ramas) se consideraron como factores fijos cruzados a la especie de forófito y a la zona (o tipos de ramas) del árbol. Los árboles (bloques aleatorios) fueron considerados un factor aleatorio y las zonas (o tipos de ramas) se consideraron niveles fijos anidados (factores “dentro”) en cada bloque (árbol). Se modeló que el valor promedio de la variable respuesta (i.e., abundancia o riqueza) variara entre árboles (i.e., 1|árbol). Todos los modelos y análisis estadísticos se hicieron con el programa R (The R Core Team 2017). Para analizar las diferencias entre especies de forófito se utilizó la función GLM (Generalized Linear Models) del paquete lme4 (Linear Mixed- Effects Models using ‘Eigen’ S4) y las pruebas de hipótesis de cada modelo se llevaron a cabo mediante el estadístico “F”. Para analizar las diferencias entre zonas y entre tipos de ramas de cada forófito se utilizó la función GLMMPQL (Generalized Linear Mixed Models via Penalized QuasiLikelihood) del paquete MASS (Modern Applied Statistics with S), ya que permite realizar análisis anidados ajustando el error tipo quasipoisson, y las pruebas de hipótesis de cada modelo se realizaron mediante el estadístico Chi-cuadrado (The R Core Team 2017). En todos los casos, las pruebas de hipótesis fueron realizadas mediante comparaciones múltiples de Tukey, con un nivel de significancia global (en cada análisis) de P<0.05.
Para examinar las variaciones en la composición florística de las epífitas se realizó un análisis de correspondencia usando una matriz con los valores de abundancia de cada especie de epífita en cada uno de los forófitos. Para evaluar si existían diferencias en la composición específica de epífitas entre especies de forófitos se hizo un análisis de la varianza multivariado por permutaciones (Multi Response Permutation Procedure, MRPP). Para evaluar si existían asociaciones entre las especies de epífitas y los forófitos sobre los que se encuentran se utilizó un análisis multivariado del valor indicador de especies (Dufrêne and Legendre 1997). Para cada especie epífita que no está presente en todos los forófitos, este análisis calcula la abundancia relativa de individuos epífitos entre especies de forófitos y la frecuencia relativa de epífitos dentro de cada especie de forófitos. A partir del producto de la abundancia relativa y la frecuencia relativa se obtiene el valor indicador de cada especie de epífita, que señala la asociación de una especie de epífita con un determinado forófito. Para obtener el valor de significancia se constata ese valor indicador con una curva de valores indicadores obtenida mediante 999 combinaciones de abundancia y frecuencia relativas a partir de un modelo nulo que asigna a los individuos registrados de las epífitas al azar entre los distintos forófitos. Todos los análisis multivariados fueron realizados con el paquete estadístico PC-ORD (McCune and Mefford 2011).
RESULTADOS
Sobre los 32 forófitos censados se registraron 8885 individuos de 14 especies de epífitas vasculares que pertenecían a cuatro familias (Tabla 2). La familia mejor representada en el quebrachal fue Bromeliaceae, con ocho especies de epífitas. La familia Cactaceae presentó cuatro especies (una epífita verdadera, una facultativa y dos accidentales), mientras que la familia Polypodiaceae sólo tuvo una única epífita verdadera. Finalmente, se registró una plántula de S. balansae creciendo de forma accidental sobre un algarrobo (Tabla 2).
Tabla 2. Lista de especies de epífitas vasculares encontradas en los 32 forófitos censados en el quebrachal, cada una con los valores de abundancia total y relativa, frecuencia relativa y valor indicador de las especies. Además, se indica el tipo de epífita de acuerdo a la relación con el forófito (V: verdadera, F: facultativa, A: accidental), el medio de dispersión (A: anemócora, Z: zoócora) y el porcentaje de individuos reproductivos. Dentro de cada familia las especies de epífitas fueron ordenadas de mayor a menor abundancia. Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae y So=Sideroxylon obtusifolium.
Table 2. List of the vascular epiphyte species recorded in the 32 phorophytes analyzed in the quebrachal, each one with the total and relative abundance values, relative frequency and the species indicator value. Also, for each epiphytic species it is indicated the type of epiphyte according to their relationship with the phorophyte (V: true, F: facultative, A: accidental), the dispersal mode (A: wind [anemochorous], Z: animals [zoochorous]) and the percentage of reproductive individuals. The species were ordered from the highest to the lowest abundance inside each family. Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae y So=Sideroxylon obtusifolium.

El género más representativo del quebrachal fue Tillandsia, con siete especies epífitas, y la especie más abundante fue Tillandsia recurvata, con el 68.88% del total de individuos censados, seguida por Tillandsia bandensis y Tillandsia meridionalis (Tabla 2). Todas las epífitas verdaderas, excepto T. meridionalis, tuvieron un porcentaje elevado de individuos en estado reproductivo, mientras que todos los individuos de las especies facultativas o accidentales estuvieron en estado vegetativo (Tabla 2). Los propágulos de la mayoría de las epífitas censadas son dispersados por el viento, excepto Aechmea distichantha y las cuatro especies de Cactaceae que son dispersadas por animales.
Análisis de la abundancia y la riqueza de epífitas Vasculares
Se registraron diferencias marcadas en la abundancia promedio (F3,28=3.51, P=0.028) y en la riqueza (F3,28=12.77, P<0.001) de epífitas vasculares sobre las distintas especies de forófitos (Figura 2). La mayor abundancia de epífitas se registró sobre Prosopis spp. (estratobajo) y la mayor riqueza de epífitas sobre S. obtusifolium (estrato alto) (Figura 2).

Figura 2. Abundancia y riqueza de epífitas vasculares para cada especie de forófito. Letras distintas indican diferencias significativas entre las especies de forófitos (Tukey, P<0.05). La caja abarca los percentiles 25-75%, la línea oscura indica la mediana, y los bigotes indican el rango exceptuando los puntos atípicos (valores 1.5 veces mayores que el rango intercuartil). Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae y So=Sideroxylon obtusifolium. Las especies están ordenadas según estratos: Ap y Pr (estrato inferior), Sb y So (estrato superior).
Figure 2. Abundance and richness of vascular epiphytes for each phorophyte species. Different letters indicate significant differences between the phorophyte species (Tukey, P<0.05). The box indicates the 25-75% percentiles, the thick line indicates the median and the whiskers indicate the range except for outliers (values 1.5 times bigger than the interquartile range). Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae and So=Sideroxylon obtusifolium. Phorophyte species are ordered by stratum: Ap and Pr (lower stratum), Sb and So (upper stratum).
Para cada una de las cuatro especies de forófitos, se registraron diferencias significativas en la abundancia y en la riqueza de epífitas vasculares entre zonas (Tabla 3). La mayor abundancia promedio de epífitas se registró en la Zona V para todas las especies de forófitos (Figura 3a). Un patrón similar se observó para la riqueza, aunque con ligeras diferencias entre especies de forófitos (Figura 3c).
Tabla 3. Resultados de los modelos mixtos lineales generalizados de la abundancia y riqueza de epífitas vasculares entre a) zonas del forófito y b) tipos de ramas (secas o vivas) de la Zona V para las cuatro especies de forófitos. Valores con asteriscos indican diferencias significativas (P<0.05).
Table 3. Results of the generalized linear mixed models of epiphyte abundance and richness between a) phorophyte zones and b) types of branches of the Zone V (living or dead) for the four studied phorophytes. Asterisks denote significant differences (P<0.05).

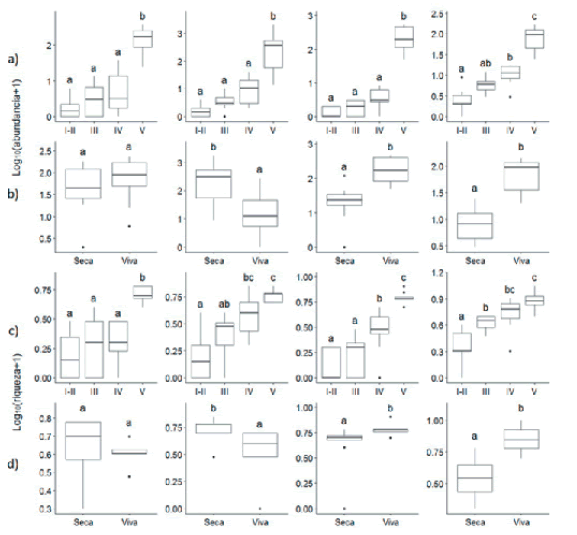
Figura 3. Abundancia y riqueza de epífitas vasculares en a) cada Zona (I-II, III, IV, V) y b) tipo de rama para las cuatro especies de forófitos. Letras diferentes indican diferencias significativas entre las zonas y los tipos de ramas (Tukey, P<0.05). La caja abarca los percentiles 25-75%, la línea oscura indica la mediana, y los bigotes indican el rango exceptuando los puntos atípicos (valores 1.5 veces mayores que el rango intercuartil).
Figure 3. Abundance and richness of vascular epiphytes in a) each Zone (I-II, III, IV, V) and b) branch type (“viva”: living or “seca”: dead) for the four phorophyte species. Different letters indicate significant differences between zones and branches types (Tukey, P<0.05). he box indicates the 25-75% percentiles, the thick line indicates the median and the whiskers indicate the range except for outliers (values 1.5 times bigger than the interquartile range).
Las especies de forófitos difirieron en los patrones de abundancia y riqueza de epífitas vasculares registradas entre ramas vivas y secas de la Zona V, con excepción de A. praecox (Tabla 3). Prosopis spp. tuvo mayor abundancia y riqueza de epífitas sobre las ramas secas que vivas, mientras que los forófitos del estrato superior (S. balansae y S. obtusifolium) tuvieron mayor abundancia y riqueza de epífitas sobre las ramas vivas que sobre las secas (Figura 3b y 3d).
Composición de epífitas vasculares
Sólo tres especies de epífitas (T. recurvata, T. duratii y T. meridionalis) fueron registradas sobre los ocho ejemplares censados de cada una de las cuatro especies de forófitos (Tabla 2). La composición de especies epífitas vasculares sobre S. obtusifolium fue significativamente diferente a la registrada sobre los otros forófitos (MRPP, A=0.11, P<0.01; Tabla 2). En el diagrama del análisis de correspondencia (Figura 4), los individuos de S. obtusifoliumse separaron de los demás forófitos por su asociación positiva con A. distichantha y T. loliacea (valor indicador: P=0.01) y porque sobre este forófito, además, se registraron individuos de M. vacciniifolia, R. aculeata y tres especies de la familia Cactaceae. Los individuos de S. balansae se distinguieron por la abundancia de T. duratii y T. bandensis. En cambio, los individuos de A. praecox y Prosopis spp. se superpusieron ya que compartieron altos valores de T. recurvata (Figura 4).

Figura 4. Diagrama de dispersión sobre el plano de los dos primeros ejes del análisis de correspondencia de los forófitos de las distintas especies arbóreas (círculos y cuadrados blancos y negros) y las especies de epífitas vasculares (rombos negros). Los centroides de cada especie de forófito están representados por las letras iniciales del nombre específico correspondiente: Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae y So=Sideroxylon obtusifolium.
Figure 4. Dispersion diagram on the first two axes of the corresponding analysis based on the phorophytes of different tree species (circles and squares white and black) and the epiphytic species (black diamonds). The centroids of each phorophyte species are represented by the initial letters of the specific name: Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae and So=Sideroxylon obtusifolium.
La mayoría de las epífitas (T. recurvata, T. bandensis, T. duratii, T. meridionalis T. loliacea y T. tricholepis) tuvieron más individuos en las ramas externas (Zona V) que en el resto del árbol; este patrón se repitió en todas las especies de forófitos (Figura 5). Por el contrario, A. distichantha, R. aculeata y T. ixioides tuvieron un mayor número de individuos en la Zona IV, principalmente en S. obtusifolium (Figura 5).

Figura 5. Abundancia de especies de epífitas vasculares para cada zona en las cuatro especies de forófitos. El diagrama consiste en una caja que abarca el percentil 25%, la mediana y el percentil 75%, los bigotes (superior e inferior) en cuyos extremos se encuentran los puntos mínimos y máximos y los puntos aislados que son valores atípicos (valores 1.5 veces mayores que el rango intercuartil). Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae y So=Sideroxylon obtusifolium. No se tuvieron en cuenta aquellas especies cuya abundancia era menor a dos, inclusive. Notar que las escalas del eje “y” difieren entre las especies de epífitas. Las especies de forófitos están ordenadas según estratos: Ap y Pr (estrato inferior), Sb y So (estrato superior).
Figure 5. Abundance of vascular epiphyte species for each zone in the four phorophyte species. The boxplot consists of a box that includes the 25% percentile, the median and the 75% percentile, the whiskers (higher and lower) in whose extremes there are the minimum and maximum dots, and the outliers (values 1.5 times bigger than the interquartile range). Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae and So=Sideroxylon obtusifolium. Species with an abundance equal or lower than two individuals were not considered. The phorophyte species are ordered by stratum: Ap and Pr (lower stratum), Sb and So (upper stratum).
Cuando se comparó la abundancia de cada especie de epífita en ramas secas y vivas de la Zona V, Prosopis spp. mostró un patrón opuesto a S. balansae y S. obtusifolium. En el primer forófito, las especies T. recurvata, T. bandensis, T. meridionalis, T duratii y T. tricholepis tuvieron mayor abundancia en ramas secas, mientras que en los otros dos forófitos tuvieron mayor abundancia en ramas vivas (Figura 6). Sobre S. obtusifolium apareció también T. loliacea, principalmente en ramas vivas (Figura 6).
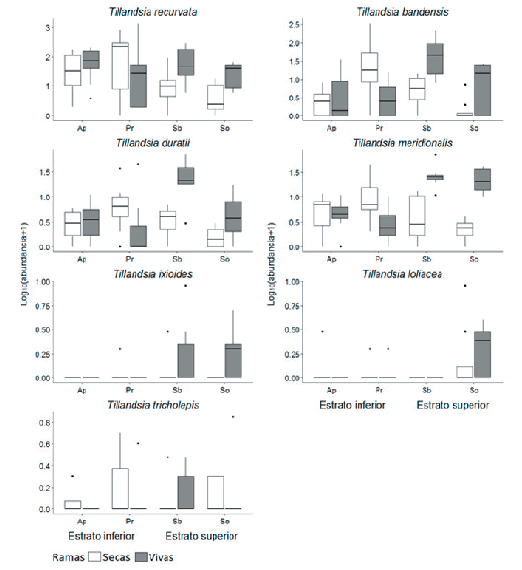
Figura 6. Abundancia de especies de epífitas vasculares para ramas vivas y secas de la Zona V en las cuatro especies de forófitos. El diagrama consiste en una caja que abarca el percentil 25%, la mediana y el percentil 75%, los bigotes (superior e inferior) en cuyos extremos se encuentran los puntos mínimos y máximos y los puntos aislados que son valores atípicos (valores 1.5 veces mayores que el rango intercuartil). Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae y So=Sideroxylon obtusifolium. No se tuvieron en cuenta aquellas especies cuya abundancia era menor a dos, inclusive.
Figure 6. Abundance of vascular epiphyte species for living and dead branches in the four phorophyte species. The boxplot consists of a box that includes the 25% percentile, the median and the 75% percentile, the whiskers (higher and lower) in whose extremes there are the minimum and maximum dots, and the outliers (values 1.5 times bigger than the interquartile range). Ap=Acacia praecox, Pr=Prosopis spp., Sb=Schinopsis balansae and So=Sideroxylon obtusifolium. Species with an abundance equal or lower than two individuals were not considered. The phorophyte species are ordered by stratum: Ap and Pr (lower stratum), Sb and So (upper stratum).
DISCUSIÓN
La riqueza de epífitas vasculares encontrada sobre cuatro especies de forófitos arbóreos de un quebrachal de la Cuña Boscosa Santafesina es baja (14 especies) en relación a la observada en bosques tropicales húmedos, que suelen superar las 100 especies (Barthlott et al. 2001; Arévalo and Betancur 2004; Zotz and Schultz 2008). Sin embargo, es similar a la encontrada en bosques tropicales secos ya que, por ejemplo, Gentry y Dodson (1987) y Vergara- Torres et al. (2010) encontraron 13 y 10 especies de epífitas, respectivamente. En la Argentina, relevamientos realizados en latitudes más bajas del Chaco Húmedo, en bosques subtropicales de Schinopsis balansae - Astronium balansae de las provincias de Formosa y Chaco, registraron 19 y 21 especies de epífitas vasculares, respectivamente (Eskuche 1986; Contreras et al. 2015). En otro bosque subtropical abierto de Prosopis hassleri - affinis, el número de especies fue menor (Eskuche 1986), similar al del quebrachal estudiado. En los dos primeros estudios se registraron especies de bromeliáceas, orquídeas, piperáceas y helechos, características de bosques más cerrados y húmedos, mientras que en el bosque abierto se encontraron en su mayoría especies del género Tillandsia, acompañadas de Microgramma vacciniifolia y Cereus sp. (Eskuche 1986). En estudios realizados en el Chaco Seco, en las provincias de Córdoba y Catamarca, donde las precipitaciones son aun menores, la riqueza de epífitas encontrada fue muy baja; en su mayoría, las especies pertenecieron al género Tillandsia (Cabido et al. 1994; Giorgis et al. 2011; Jiménez-Escobar 2015). Este género es característico de ambientes xéricos debido que posee adaptaciones que le permiten tolerar condiciones rigurosas como las que predominan en el Chaco Seco.
Es común considerar que el tamaño del forófito (i.e., su altura y área basal) condiciona el establecimiento de las epífitas sobre el mismo (Zotz 2016). Los árboles más grandes poseen mayor superficie y mayor tiempo de colonización, por lo que tendrían mayor abundancia y riqueza de epífitas que los árboles más chicos, es decir, de menor altura y menor superficie para ser colonizados (Flores- Palacios and García-Franco 2006; Woods et al. 2015; Jiménez-López et al. 2017; Toledo-Aceves et al. 2017; Wang et al. 2017). Sin embargo, en el presente estudio, la mayor abundancia de epífitas vasculares fue registrada sobre Prosopis spp., un forófito del estrato inferior. A su vez, si bien la mayor riqueza fue registrada sobre un forófito del estrato superior (S. obtusifolium), la otra especie de ese estrato (S. balansae) tuvo valores de riqueza similares a las del estrato inferior. Por lo tanto, cuando se comparan especies de forófitos diferentes, el tamaño de los individuos no explica la abundancia y riqueza de epífitas vasculares encontradas, sino que estas variables estarían asociadas con otras características del forófito, como su arquitectura, el grosor y la inclinación de las ramas, la longevidad de las ramas (o cantidad de ramas muertas), la rugosidad de la corteza, el tipo de hoja y su caducidad, etc. (Zotz 2016). Estas características crean condiciones de microhábitat variadas (e.g., variaciones en la humedad, la temperatura, la cantidad de luz y de viento, etc.) que forman nichos con diferentes características aprovechables por muchas especies de epífitas (Jiménez-López et al. 2017).
Cuando los árboles pierden sus hojas durante la estación seca de bosques estacionales como el quebrachal, la luz incide con elevada intensidad tanto en las zonas altas como en las zonas más bajas del dosel, mientras que durante la estación húmeda las zonas más bajas permanecen más sombrías y húmedas (Murphy and Lugo 1986). Estas diferencias generan una distribución vertical particular de las epífitas en los bosques estacionales, donde cada especie de epífita ocupa una zona del árbol en la que tolera las condiciones de microhábitat dominantes (Joanitti et al. 2017). En el quebrachal estudiado se observaron diferencias en la abundancia, riqueza y composición de epífitas vasculares entre zonas del dosel. En la Zona I-II se registró una muy baja abundancia y riqueza de epífitas, lo cual se contrapone con lo observado en algunos bosques húmedos tropicales (Krömer et al. 2007). En las Zonas intermedias III y IV se registraron las epífitas de mayor tamaño y con más requerimientos de humedad como A. distichantha, T. ixioides, R. aculeata y M. vacciniifolia. Estas especies se localizaron sobre ramas más gruesas, donde la radiación y el viento son menores y por lo tanto la humedad mayor (ter Steege and Cornelissen 1989; de la Rosa-Manzano et al. 2014). La Zona V, caracterizada por su mayor abundancia y riqueza de epífitas vasculares, se encuentra en la parte superior de los forófitos, posee ramas delgadas y recibe mayor incidencia de luz y viento. Patrones similares se han observado en sabanas de Brasil (Joanitti et al. 2017). La dominancia de las epífitas del género Tillandsia en la zona superior se debería a su tamaño reducido, lo que le permite crecer sobre ramas delgadas. Además, estas plantas atmosféricas (Pittendrigh 1948; Benzing 2000) poseen adaptaciones morfo-fisiológicas (i.e., plantas heliófilas pequeñas, hojas con cutícula engrosada y presencia de tricomas, capacidad de absorber los nutrientes y el agua de la atmósfera, vía metabólica CAM) que les permiten tolerar las condiciones de sequía, las altas temperaturas y la elevada intensidad de luz presentes en los estratos más altos del dosel (Chaves et al. 2016).
También se registraron diferencias entre especies de forófitos en la composición de especies de epífitas vasculares. La mayor abundancia de Tillandsia duratii y T. bandensis sobre S. balansae podría atribuirse a que las ramas de la Zona V de este forófito son lo suficientemente resistentes para soportar el peso de estas epífitas, que en estado adulto son relativamente grandes (e.g., T. bandensis forma grandes matas). Tillandsia recurvata, una especie de tamaño pequeño, fue en especial abundante sobre las ramas delgadas y secas de A. praecox y Prosopis spp., que difícilmente puedan soportar el peso de epífitas de mayor tamaño. Aechmea distichantha y T. loliacea se asociaron de manera significativa a S. obtusifolium, por lo que podría existir una relación de preferencia entre ellos (sensu Krömer et al. 2007). Es difícil explicar la asociación entre S. obtusifolium y T. loliacea, ya que las características de T. loliacea (pequeña, con dispersión anemófila, que absorbe los nutrientes y el agua de la precipitación atmosférica) indicaría que se trata de una especie epífita que potencialmente podría crecer sobre cualquier especie de forófito, como todas las otras especies de Tillandsia. Se deberían realizar estudios específicos para descubrir la naturaleza de esta asociación. En el caso de A. distichantha, su presencia preferencial sobre S. obtusifolium se podría atribuir a la arquitectura del forófito y a las características morfológicas de esta epífita facultativa. Este forófito de gran tamaño presenta horquetas y ramas gruesas de corteza agrietada, a menudo dispuestas de forma casi horizontal. Estas características morfológicas brindan un buen sustrato para el establecimiento de A. distichantha, ya que permiten retener la humedad y materia orgánica necesarias para esta epífita facultativa que, en esta región fitogeográfica, suele vivir en el suelo (Barberis et al. 2014). Aechmea distichantha es una planta de gran tamaño y peso dado que las vainas de sus hojas forman un tanque en el que se retienen agua y materia orgánica (Cavallero et al. 2009; Montero et al. 2010), lo que le permite independizarse del suelo y adaptarse a la vida epífita. A su vez, tanto las semillas de A. distichantha como las de S. obtusifolium son dispersadas por aves (Noguchi et al. 2009; Blendinger et al. 2015), por lo que las aves que se alimentan de los frutos de la epífita también podrían verse atraídas por los frutos del forófito, dispersando de manera selectiva las semillas de A. distichantha sobre éste. Se ha propuesto que las especies dispersadas por animales tenderían a ser generalistas, ya que las semillas, al estar envueltas en las heces del animal (i.e., rodeadas de materia orgánica), interactúan menos con el forófito y pueden establecerse más fácilmente (Martínez- Melendez et al. 2008). Sin embargo, esto se contrapone a la distribución de A. distichantha, que se registró preferentemente en las Zonas III y IV sobre S. obtusifolium. Un patrón de distribución similar se observó en una sabana del Cerrado brasileño con la epífita Billbergia zebrina (Herb.) Lindl., una bromelia tanque dispersada por aves que crece en estratos bajos donde la intensidad de la luz es menor y la humedad mayor (Joanitti et al. 2017).
En este quebrachal se registró que Prosopis spp. tiene mayor abundancia y riqueza de epífitas vasculares en las ramas secas, sobre todo de T. recurvata y T. bandensis, mientras que S. balansae y S. obtusifolium las tienen en las ramas vivas. De hecho, son las mismas especies las que sobre Prosopis spp. se ubican en ramas secas, pero en S. obtusifolium y S. balansae lo hacen sobre ramas vivas. Es posible que las ramas sombreadas de Prosopis spp. tiendan a secarse rápidamente y permanezcan más tiempo en el árbol de lo que lo hacen las ramas secas de los otros forófitos, o que debido a su arquitectura y forma de crecimiento éste produzca un autosombreo mayor que los otros. Cortez-Anzures et al. (2017) argumentan que las ramas secas y viejas podrían tener mayor tiempo de colonización que las ramas más jóvenes y verdes y, por ello, una cantidad de epífitas mayor. A su vez, podría haber especies epífitas que por su tamaño pequeño y su ciclo de vida corto se puedan establecer con facilidad sobre cualquier tipo de rama (e.g., T. recurvata, T. bandensis o T. meridionalis), mientras que aquellas de mayor tamaño precisen ramas vivas más gruesas, longevas y estables (i.e., T. ixioides o A. distichantha). De manera similar a lo que ocurre en este trabajo, Flores-Palacios et al. (2014) mencionan que T. recurvata se encuentra en altas densidades sobre las ramas muertas de Prosopis laevigata, y puede ejercer un efecto negativo sobre ellas. En otro trabajo que estudió esa interacción se concluyó que T. recurvata modifica la corteza de las ramas y puede causarles daños al, por ejemplo, impedir el normal intercambio gaseoso o dificultar la conducción de fluidos (Aguilar-Rodríguez et al. 2007).
En conclusión, en este quebrachal se encontraron pocas epífitas, la mayoría de ellas holoepífitas del género Tillandsia, acompañadas por una especie de helecho y otra de cactus, todas adaptadas a las condiciones rigurosas del lugar. Además, se encontraron dos epífitas facultativas: A. distichantha y C. baumanii. Las epífitas del género Tillandsia, que producen gran cantidad de semillas plumosas que son dispersadas por el viento (Jiménez-López et al. 2017), se encontraron principalmente en las zonas más altas del dosel, donde durante el día llega más radiación y la humedad es menor, y a la noche y al amanecer reciben mayores aportes del rocío. En las zonas intermedias o bajas se encontraron aquellas epífitas con mayores requerimientos de espacio o humedad. En los forófitos del estrato inferior predominaron las ramas secas, sobre todo en Prosopis spp., y sobre ellas se encontraron aquellas epífitas de tamaño pequeño y rápido desarrollo, mientras que sobre las ramas vivas más resistentes de los forófitos del estrato superior se ubicaron las epífitas vasculares de mayor tamaño. No obstante, se debe tener en cuenta que en ciertas ocasiones numerosas especies consideradas “generalistas” (i.e., que podrían colonizar cualquier zona de un forófito) en realidad podrían preferir determinadas zonas, pero debido a la presión constante de propágulos (efecto masa) muchas de ellas se encuentran en más de una zona, dando la impresión de no tener preferencias (Krömer et al. 2007).
La baja riqueza de epífitas vasculares de este quebrachal, principalmente del género Tillandsia, podría atribuirse al clima seco y estacional, así como a la fisonomía de bosque abierto, tal como fuera reportado para sabanas y bosques xerofíticos de Brasil (Breier 2005; Bataghin et al. 2012; Joanitti et al. 2017). Se debe destacar que la Cuña Boscosa Santafesina se ubica en la porción más austral del Chaco Húmedo, por lo que si bien su clima es templado-cálido húmedo, presenta heladas invernales más frecuentes que en los quebrachales ubicados a menores latitudes. Asimismo, si bien las lluvias pueden alcanzar los 1000 mm anuales, durante el verano son frecuentes los períodos de sequía pronunciados y de duración variable. Por lo tanto, estos pulsos ambientales, aunque temporales, serían los factores que estarían restringiendo la diversidad de epífitas vasculares del quebrachal estudiado de dos modos: 1) las bajas temperaturas invernales reducirían el número de taxa que pueden establecerse y 2) las condiciones de aridez impondrían el predominio del género Tillandsia.
AGRADECIMIENTOS
Los comentarios y sugerencias del editor y los revisores ayudaron a mejorar la calidad de este trabajo. Agradecemos la colaboración de Antonella Santone y Agostina Colosimo por su ayuda en el trabajo de campo, a Sabina Donadío por su ayuda en la identificación de epífitas y al ministerio de producción de la provincia de Santa Fe por facilitarnos el acceso al establecimiento de Las Gamas. También agradecemos el financiamiento recibido por la Universidad Nacional de Rosario (AGR- 290: ‘Estructura y dinámica de comunidades chaco-pampeanas’) y del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) (P-UE 2016: 22920160100043-CO: ‘Agricultura Sustentable en Ecosistemas de la Región Chaco-Pampeana).
REFERENCIAS
1. Acebey, A., and T. Krömer. 2001. Diversidad y distribución vertical de epífitas en los alrededores del campamento río Eslabón y de la laguna Chalalán, Parque Nacional Madidi, Dpto. La Paz, Bolivia. Revista de la Sociedad Boliviana de Botánica 3:104-123. [ Links ]
2. Aguilar-Rodríguez, S., T. Terrazas, E. Aguirre León, and M. E. Huidobro Salas. 2007. Modificaciones en la corteza de Prosopis laevigata por el establecimiento de Tillandsia recurvata. Boletín de la Sociedad Botánica de México 81:27-35. [ Links ]
3. Arévalo, R., and J. Betancur. 2004. Diversity of vascular epiphytes in four forests of Southeastern region of the Serranía de Chiribiquete, Colombian Guayana. Caldasia 26:359-380. [ Links ]
4. Bach, K., M. Kessler, and J. Gonzales. 1999. Caracterización preliminar de los bosques deciduos andinos de Bolivia en base a grupos indicadores botánicos. Ecología en Bolivia 32:7-22. [ Links ]
5. Bader, M. 1999. A study on the distribution of vascular epiphytes in a secondary cloud forest, Central Cordillera, Colombia. Tesis Doctoral. Wageningen University and Research, Wageningen, Holanda. Pp. 110. [ Links ]
6. Barberis, I. M., W. B. Batista, E. F. Pire, J. P. Lewis, and R. J. C. León. 2002. Woody population distribution and environmental heterogeneity in a Chaco forest, Argentina. Journal of Vegetation Science 13:607:614. [ Links ]
7. Barberis, I. M., J. P. Lewis, and W. B. Batista. 2005. Heterogeneidad estructural de los bosques de la Cuña Boscosa de Santa Fe en distintas escalas espaciales. Pp. 43-58 en M. Oesterheld, M. R. Aguiar, C. M. Ghersa and J. M. Paruelo (eds.). La heterogeneidad de la vegetación de los agroecosistemas. Un homenaje a Rolando León. Facultad de Agronomía, Universidad de Buenos Aires, Buenos Aires, Argentina. [ Links ]
8. Barberis, I. M., P. S. Torres, W. B. Batista, G. Magra, L. Galetti, and J. P. Lewis. 2014. Two bromeliad species with contrasting functional traits partition the understory space in a Southamerican xerophytic forest: correlative evidence of environmental control and limited dispersal. Plant Ecology 215:143-153. [ Links ]
9. Barthlott, W., V. Schmit-Neuerburg, J. Nieder, and S. Engwald. 2001. Diversity and abundance of vascular epiphytes: a comparison of secondary vegetation and primary montane rain forest in the Venezuelan Andes. Plant Ecology 152:145-156. [ Links ]
10. Bataghin, F. A., F. De Barros, and J. S. Rodrigues Pires. 2010. Distribution of the community of vascular epiphytes in sites under different degrees of disturbance in the Ipanema National Forest, Sao Paulo, Brazil. Revista Brasileira de Botânica 33:501-512. [ Links ]
11. Bataghin, F. A., A. Muller, J. S. Rodrigues Pires, F. De Barros, A. Terumi Fushita, and E. C. Scariot. 2012. Riqueza e estratificação vertical de epífitas vasculares na Estação Ecológica de Jataí - área de Cerrado no Sudeste do Brasil. Hoehnea 39:615-626. [ Links ]
12. Benzing, D. H. 1990. Vascular epiphytes. General biology and related biota. Cambridge University Press, Cambridge, Inglaterra. [ Links ]
13. Benzing, D. H. 2000. Bromeliaceae: profile of an adaptive radiation. Cambridge University Press, Cambridge, Inglaterra. [ Links ]
14. Blendinger, P. G., N. P. Giannini, I. C. Zampini, R. Ordoñez, S. Torres, S. Sayago, J. E. Sayago, R. A. Ruggera, and M. I. Isla. 2015. Nutrients in fruits as determinants of resource tracking by birds. Ibis 157:480-495. [ Links ]
15. Breier, T. B. 2005. O epifitismo vascular em florestas do sudeste do Brasil. Tesis doctoral. Instituto de Biologia, Universidade Estadual de Campinas, Campinas, Brasil. Pp. 139. [ Links ]
16. Brown, D. A. 1990. El epifitismo en las selvas montanas del Parque Nacional ‘El Rey’ Argentina: Composición florística y patrón de distribución. Revista de Biología Tropical 38:155-166.
17. Cabido, M., A. Manzur, L. Carranza, and C. González Albarracín. 1994. La vegetación y el medio físico del Chaco Árido en la provincia de Córdoba, Argentina Central. Phytocoenologia 24:423-460. [ Links ]
18. Cach-Pérez, M. J., J. L. Andrade, N. Chilpa-Galván, M. Tamayo-Chim, R. Orellana, and C. Reyes-García. 2013. Climatic and structural factors influencing epiphytic bromeliad community assemblage along a gradient of water-limited environments in the Yucatan Peninsula, Mexico. Tropical Conservation Science 6:283-302. [ Links ]
19. Cach-Pérez, M. J., J. L. Andrade, and C. Reyes-García. 2014. La susceptibilidad de las bromeliáceas epífitas al cambio climático. Botanical Sciences 92:157-168. [ Links ]
20. Callaway, R. M., K. O. Reinhart, G. W. Moore, D. J. Moore, and S. C. Pennings. 2002. Epiphyte host preferences and host traits: Mechanisms for species-specific interactions. Oecologia 132:221-230. [ Links ]
21. Cantero, J. J., J. Mulko, C. Núñez, G. E. Zeballos, S. R. Sfragulla, J. A. Amuchastegui, A. Barboza, F. Chiarini, L. A. Espinar, A. A. Bonalumi, P. Brandolin, and M. Cabido. 2017. Heterogeneidad de la vegetación en ambientes basálticos del centro de Argentina. Boletín de la Sociedad Argentina de Botánica 52:153-183. [ Links ]
22. Casañas Suárez, O. L., and D. Jáuregui. 2011. Morfoanatomía foliar de epífitas presentes en un bosque nublado, Altos de Pipe, Estado Miranda, Venezuela. Acta Botanica Venezuelica 34:153-175. [ Links ]
23. Cavallero, L., D. López, and I. M. Barberis. 2009. Morphological variation of Aechmea distichantha (Bromeliaceae) in a Chaco forest: habitat and size-related effects. Plant Biology 11:379-391. [ Links ]
24. Ceballos, S. J., N. P. Chacoff, and A. Malizia. 2016. Interaction network of vascular epiphytes and trees in a subtropical forest. Acta Oecologica 77:152-159. [ Links ]
25. Chaves, C. J. N., J. C. Dyonisio, and D. R. Rossatto. 2016. Host trait combinations drive abundance and canopy distribution of atmospheric bromeliad assemblages. AoB Plants 8:1-13. [ Links ]
26. Contreras, S. A., F. I. Contreras, A. I. Lutz, and A. F. Zucol. 2015. Contribución al conocimiento florístico del Chaco Oriental, sudeste de la provincia de Formosa, Argentina. Boletín de la Sociedad Argentina de Botánica 50:531-574. [ Links ]
27. Cortes-Anzures, B. O., A. M. Corona-López, V. H. Toledo-Hernández, S. Valencia-Díaz, and A. Flores-Palacios. 2017. Branch mortality influences phorophyte quality for vascular epiphytes. Botany 95:709-716. [ Links ]
28. Drehwald, U. 1995. Epiphytische Pflanzengesellschaften in NO-Argentinien. Dissertationes Botanicae 250:1-175. [ Links ]
29. Dufrêne, M., and P. Legendre. 1997. Species assemblages and indicator species: the need for a flexible asymmetrical approach. Ecological Monographs 67:345-366. [ Links ]
30. Eskuche, U. 1986. Bericht über die 17. Internationale Pflanzengeographische Exkursion durch Nordargentinien (1983). Veroffentlichungen des Geobotanischen Institutes der Eidgenossischen Technischen Hochschule Stiftung Rubel 91: 12-117. [ Links ]
31. Estrabou, C., C. Quiroga, and J. M. Rodríguez. 2014. Lichen community diversity on a remnant forest in south of Chaco region (Cordoba, Argentina). Bosque (Valdivia) 35:49-55. [ Links ]
32. Estrabou, C., L. Stiefkens, M. Hadid, J. M. Rodríguez, and A. Pérez. 2005. Estudio comparativo de la comunidad liquénica en cuatro ecosistemas de la provincia de Córdoba. Boletín de la Sociedad Argentina de Botánica 40:1-10. [ Links ]
33. Flores-Palacios, A., and J. G. García-Franco. 2006. The relationship between tree size and epiphyte species richness: Testing four different hypotheses. Journal of Biogeography 33:323-330. [ Links ]
34. Flores-Palacios, A., C. L. Barbosa-Duchateau, S. Valencia-Díaz, A. Capistrán-Barradas, and J. G. García-Franco. 2014. Direct and indirect effects of Tillandsia recurvata on Prosopis laevigata in the Chihuahua desert scrubland of San Luis Potosi, Mexico. Journal of Arid Environments 104:88-95. [ Links ]
35. Gentry, A. H., and C. H. Dodson. 1987. Diversity and biogeography of neotropical vascular epiphytes. Annals of the Missouri Botanical Garden 74:205-233. [ Links ]
36. Giorgis, M. A., A. M. Cingolani, F. Chiarini, J. Chiapella, G. Barboza, L. Ariza Espinar, R. Morero, D. E. Gurvich, P. A. Tecco, R. Subils, and M. Cabido. 2011. Composición florística del Bosque Chaqueño Serrano de la provincia de Córdoba, Argentina. Kurtziana 36:9-43. [ Links ]
37. Granados-Sánchez, D., G. F. López-Ríos, M. Á. Hernández-García, and A. Sánchez-González. 2003. Ecología de las plantas epífitas. Chapingo: Serie Ciencias Forestales y del Ambiente 9:101-111. [ Links ]
38. Jiménez-Escobar, D. N. 2015. Entre ‘azahares’ y ‘chaguares’: Las bromelias forrajeras en las Sierras de Ancasti, Catamarca, Argentina. Gaia Scientia 9:1-6.
39. Jiménez-López, D. A., R. de J. Roblero-Velasco, N. Martínez-Meléndez, G. Ocampo, and J. A. Gallardo-Cruz. 2017. Relación entre variables del forófito y la riqueza de epífitas vasculares en los Pantanos de Centla, Tabasco, México. Acta Botánica Mexicana 121:125-137. [ Links ]
40. Joanitti, S. A., V. de Lara Weiser, O. Cavassan, and A. L. Giles. 2017. Vascular epiphytes in a woodland savanna forest in southeastern Brazil. The Journal of the Torrey Botanical Society 144:439-449. [ Links ]
41. Johansson, D. 1974. Ecology of vascular epiphytes in West African rain forest. Acta Phytogeographica Suecica 59: 1-136. [ Links ]
42. Krömer, T., S. Gradstein, and A. R. Acebey. 2007. Diversidad y ecología de epífitas vasculares en bosques montanos primarios y secundarios de Bolivia. Ecología en Bolivia 42:23-33. [ Links ]
43. Lewis, J. P. 1991. Three levels of floristical variation in the forests of Chaco. Journal of Vegetation Science 2:125-130. [ Links ]
44. Lewis, J. P., and E. F. Pire. 1981. La vegetación de la República Argentina. Reseña sobre la vegetación del Chaco Santafesino. Instituto Nacional de Tecnología Agropecuaria. Buenos Aires, Argentina [ Links ]
45. Lewis, J. P., E. F. Pire, and I. M. Barberis. 1997. Structure, physiognomy and floristic composition of a Schinopsis balansae (Anacardiaceae) forest in the Southern Chaco, Argentina. Revista de Biología Tropical 45:1013-1020. [ Links ]
46. Malizia, A. 2003. Host tree preference of vascular epiphytes and climbers in a subtropical montane cloud forest of Northwest Argentina. Selbyana 24:196-205. [ Links ]
47. Marino, G. D., and J. F. Pensiero. 2003. Heterogeneidad florística y estructural de los bosques de Schinopsis balansae (Anacardiaceae) en el sur del Chaco Húmedo. Darwiniana 41:17-28. [ Links ]
48. Martínez-Meléndez, N., M. A. Pérez-Farrera, and A. Flores-Palacios. 2008. Vertical stratification and host preference by vascular epiphytes in a Chiapas, Mexico, cloud forest. Revista de Biología Tropical 56:2069-2086. [ Links ]
49. McCune, B., and M. J. Mefford. 2011. PC-ORD. Multivariate analysis of ecological data. Versión 6.0. MjM Software, Gleneden Beach, USA. [ Links ]
50. Mendieta-Leiva, G., and G. Zotz. 2015. A conceptual framework for the analysis of vascular epiphyte assemblages. Perspectives in Plant Ecology, Evolution and Systematics 17:510-521. [ Links ]
51. Mereles, M. F. 2005. Una aproximación al conocimiento de las formaciones vegetales del Chaco Boreal, Paraguay. Rojasiana 6:5-48. [ Links ]
52. Montero, G., C. Feruglio, and I. M. Barberis. 2010. The phytotelmata and foliage macrofauna assemblages of a bromeliad species in different habitats and seasons. Insect Conservation and Diversity 3:92-102. [ Links ]
53. Murphy, P. G., and A. E. Lugo. 1986. Ecology of tropical dry forest. Annual Review of Ecology and Systematics 17: 67-88. [ Links ]
54. Navarro, G. 2001. Contribución al conocimiento fitosociológico de la vegetación de epífitos vasculares del centro y sur de Bolivia. Revista Boliviana de Ecología 10:59-79. [ Links ]
55. Noguchi, D. K., G. P. Nunes, and Â. L. B. Sartori. 2009. Florística e síndromes de dispersão de espécies arbóreas em remanescentes de Chaco de Porto Murtinho, Mato Grosso do Sul, Brasil. Rodriguésia 60:353-365. [ Links ]
56. Pittendrigh, C. S. 1948. The Bromeliad-Anopheles-Malaria complex in Trinidad. I-The Bromeliad Flora. Evolution 2: 58-89. [ Links ]
57. de la Rosa-Manzano, E., J. L. Andrade, G. Zotz, and C. Reyes-García. 2014. Epiphytic orchids in tropical dry forests of Yucatan, Mexico - Species occurrence, abundance and correlations with host tree characteristics and environmental conditions. Flora: Morphology, Distribution, Functional Ecology of Plants 209:100-109. [ Links ]
58. Smith, L. B., and R. J. Downs. 1977. Tillandsioideae (Bromeliaceae). Flora Neotropica 14:663-1492. [ Links ]
59. Smith, L. B., and R. J. Downs. 1979. Bromeliaceae, subfamily Bromelioideae. Flora Neotropica 14:1493-2142. [ Links ]
60. Soria, N. F., C. Torres, and L. Galetto. 2014. Experimental evidence of an increased leaf production in Prosopis after removal of epiphytes (Tillandsia). Flora - Morphology, Distribution, Functional Ecology of Plants 209:580-586. [ Links ]
61. ter Steege, H., and J. H. C. Cornelissen. 1989. Distribution and ecology of vascular epiphytes in lowland rain forest of Guyana. Biotropica 21:331-339. [ Links ]
62. The R Core Team. 2017. R: A language and environment for statistical computing. R version 3.3.3. The R. Foundation for Statistical Computing, Viena, Austria. [ Links ]
63. Toledo-Aceves, T., J. G. García-Franco, and A. Flores-Palacios. 2017. Do cloud forest tree species differ in their suitability as a substrate for epiphytic bromeliads? Plant Ecology 218:541-546. [ Links ]
64. Valencia-Díaz, S., A. Flores-Palacios, V. Rodríguez-López, E. Ventura-Zapata, and A. R. Jiménez-Aparicio. 2010. Effect of host-bark extracts on seed germination in Tillandsia recurvata, an epiphytic bromeliad. Journal of Tropical Ecology 26:571-581. [ Links ]
65. Vergara-Torres, C. A., M. C. Pacheco-Álvarez, and A. Flores-Palacios. 2010. Host preference and host limitation of vascular epiphytes in a tropical dry forest of central Mexico. Journal of Tropical Ecology 26:563-570. [ Links ]
66. Wang, Q., W. B. Guan, M. H. Gi Wong, S. Ranjitkar, W. N. Sun, Y. Pan, Y. A. El-Kassaby, and L. X. Shen. 2017. Tree size predicts vascular epiphytic richness of traditional cultivated tea plantations in Southwestern China. Global Ecology and Conservation 10:147-153. [ Links ]
67. Woods, C. L., C. L. Cardelús, and S. J. Dewalt. 2015. Microhabitat associations of vascular epiphytes in a wet tropical forest canopy. Journal of Ecology 103:421-430. [ Links ]
68. Zotz, G. 2007. Johansson revisited: the spatial structure of epiphyte assemblages. Journal of Vegetation Science 18: 123-130. [ Links ]
69. Zotz, G. 2016. Plants on plants - The biology of vascular epiphytes. Springer, Suiza. [ Links ]
70. Zotz, G., and J. L. Andrade. 2002. La ecología y la fisiología de las epífitas y las hemiepífitas. Pp. 271-296 en M. R. Guariguata and G. H. Kattan (eds.). Ecología y conservación de bosques neotropicales. IICA, San José, Costa Rica. [ Links ]
71. Zotz, G., and S. Schultz. 2008. The vascular epiphytes of a lowland forest in Panama-species composition and spatial structure. Plant Ecology 195:131-141. [ Links ]














