Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agriscientia
versión On-line ISSN 1668-298X
Agriscientia v.25 n.2 Córdoba jul./dic. 2008
Aplicación de electroforesis capilar para la caracterización de gliadinas de trigos argentinos
Colombo A.; P.D. Ribotta y A.E. León
A. Colombo, P.D. Ribotta y A. E. León. CONICET - Facultad de Ciencias Agropecuarias, UNC, CC 509, 5000 Córdoba, Argentina. Correspondencia a A. E. León: aeleon@agro.uncor.edu
RESUMEN
Las gliadinas son proteínas del trigo que desempeñan un papel central en la formación del gluten, ya que son las responsables de la viscosidad de la red. Pese a su importancia han sido menos estudiadas que las gluteninas, debido a que sus inusuales propiedades de solubilidad e hidrofobicidad dificultan su caracterización. Los objetivos de este trabajo fueron estudiar el perfil proteico de las gliadinas de cultivares de trigos argentinos mediante electroforesis capilar, y evaluar la capacidad de esta técnica para discriminar entre los diferentes cultivares. Para ello se trabajó con 12 cultivares de trigo de las diferentes categorías de calidad asignadas por el INTA, a los que se caracterizó en cuanto a su composición y calidad tecnológica y se les extrajo las gliadinas para estudiarlas por electroforesis capilar. Los resultados obtenidos confirman el potencial de esta técnica para lograr separaciones de gliadinas, con la ventaja de requerir poca preparación y poca cantidad de la muestra analizada y sencillos protocolos de limpieza y mantenimiento de capilar, permitiendo el análisis de gran cantidad de muestras. Asimismo, se demostró la capacidad de la electroforesis capilar para discriminar diferentes cultivares sobre la base de su perfil de gliadinas, lo que permite la diferenciación de genotipos.
Palabras clave: Gliadinas; Trigo; Electroforesis capilar.
Colombo A.; P.D. Ribotta and A.E. León, 2008.Use of capillary electrophoresis for characterization of Argentinean wheat gliadins. Agriscientia XXV (2): 57-64
SUMMARY
Gliadins are a group of wheat proteins that play a major role in gluten development since they account for net viscosity. Despite this fact, gliadins have not been studied as deeply as glutenins because of their unusual solubility properties and their high hydrophobicity. The objectives of this work were to study the gliadin profile of Argentinean wheats comprising a broad quality range by means of capillary electrophoresis and to assess the suitability of this technique for wheat cultivar discrimination. For this purpose, chemical compositions of twelve wheat cultivars belonging to different quality groups were determined. Besides, flour quality was assessed and wheat gliadins were extracted and analyzed by capillary electrophoresis. The results obtained corroborate the potential of free zone capillary electrophoresis for wheat gliadin separation. Additionally, only small amounts of sample are required and sample preparation is simple. Moreover, this technique involves straightforward protocols for capillary column cleaning and maintenance. These factors enable many of sample analyses in a relatively short time. Suitability of free zone capillary electrophoresis for cultivar discrimination based on gliadin profile was demonstrated, since both qualitative and quantitative differences among protein electrophoresis patterns were found. These distinctions allowed differentiation among several genotypes.
Key words: Gliadins; Wheat; Capillary electrophoresis.
Fecha de recepción: 28/10/08;
fecha de aceptación: 17/12/08
INTRODUCCIÓN
Las proteínas de los cereales constituyen un grupo importante, debido al aporte nutricional y funcional que realizan en muchos alimentos. Las proteínas del gluten son uno de los principales componentes del endospermo del trigo; su cantidad y calidad influyen directamente en las características tecnológicas de un cultivar (Finney et al., 1982).
El gluten está formado en su mayoría por gliadinas y gluteninas. Las gliadinas constituyen un amplio grupo de proteínas monoméricas con propiedades físico-químicas similares (Field et al., 1983) y se clasifican en cuatro tipos de acuerdo a su movilidad electroforética en medio ácido: α-gliadinas, β-gliadinas, γ−gliadinas y ω−gliadinas (Jones et al., 1959). Aunque la importancia de las gliadinas en las propiedades de la masa es menor que la de las gluteninas (Wieser & Kieffer, 2001), su influencia en la funcionalidad de las harinas de trigo ha sido constantemente debatida. Algunos investigadores proponen que son las responsables de la cohesividad de las masas (Hoseney, 1994), aunque otros sugieren que controlan el potencial de volumen de pan (Khatkar et al., 2002), por lo que cobra interés el estudio de la composición y la estructura de esta fracción proteica. Asimismo, mediante el análisis de cierto grupo de proteínas, se pueden generar perfiles únicos que generen una "huella dactilar" característica de un determinado cultivar y permitan identificar distintos genotipos (Jones et al., 1982; Lookhart & Bietz, 1990). Esta información puede ser de suma utilidad en los planes de mejoramiento genético, ya que permite seleccionar líneas, así como también en otras situaciones, como por ejemplo durante la comercialización de granos y harina (Bean et al., 1998; Bonetti et al., 2004).
El estudio del gluten de trigo conlleva generalmente diversos problemas debido a que está conformado por una mezcla compleja de componentes y a sus inusuales propiedades de solubilidad y su tendencia a formar redes poliméricas extensas (Bietz & Schmalzried, 1995; Shewry, 2003). La cromatografía líquida de alta presión en fase reversa (RPHPLC) ha sido la técnica más eficiente para el estudio de las proteínas del gluten (Wieser et al., 1994), aunque mediante las técnicas electroforéticas se logran mejores separaciones (Bean et al., 1998). La electroforesis en gel de poliacrilamida (PAGE), como SDS-PAGE y A-PAGE, es el sistema de electroforesis más usado para el análisis de proteínas (Piergiovanni & Volpe, 2003), aunque no se logra una buena eficiencia durante la separación de la fracción de gliadinas (Bean & Lookhart, 2000a). Una alternativa a la electroforesis en geles es la electroforesis capilar (EC). Diversos estudios ponen de manifiesto las ventajas de EC en el análisis de gliadinas (Lookhart & Bean, 1995; Capelli et al., 1998; Rumbo y Giorgieri 1998; Rumbo et al., 1999; Bean & Lookhart, 2000b); la resolución alcanzada con esta técnica es mayor que la obtenida con los métodos de electroforesis en geles (Bietz & Schmalzried, 1995).
El Índice de sedimentación en dodecil sulfato de sodio (IS-SDS) (AACC, 2000) es una prueba comúnmente utilizada para predecir la calidad de una harina para elaborar pan. En distintos estudios se ha demostrado la capacidad de esta técnica para discriminar trigos con diferente aptitud panadera (Axford et al., 1979; Dick & Quick, 1983; Wang & Kovacs, 2001; Moiraghi et al., 2005) y para seleccionar trigos en programas de mejoramiento genético (Carter et al., 1999).
Actualmente, la calidad es un factor decisivo en las transacciones comerciales de granos y harinas de trigo. El mercado internacional demanda insumos que posean atributos específicos; por lo tanto, resulta necesario la clasificación de cultivares a fin de poder ofrecer información consistente relacionada con la calidad y la aptitud de un determinado trigo (Cuniberti, 2004). A pesar de que la Argentina es uno de los principales países productores y exportadores de este cereal, no cuenta con un sistema generalizado para su clasificación. Por consiguiente, es de suma importancia poseer herramientas que permitan la discriminación de diferentes genotipos.
Los objetivos de este trabajo fueron estudiar el perfil proteico de cultivares de trigos argentinos de diferente calidad mediante electroforesis capilar, y evaluar la capacidad de esta técnica para discriminar entre los diferentes cultivares.
MATERIALES Y MÉTODOS
Muestras de harinas
Se trabajó con 12 cultivares de trigos argentinos cultivados en el Campo Escuela de la Facultad de Ciencias Agropecuarias de la Universidad Nacional de Córdoba, Argentina (31º 29' S; 64º 00' O, altitud 425 msm). La selección de cultivares cubrió las tres categorías de calidad de los trigos propuesta por el INTA (Cuniberti, 2004) (Tabla 1). Los granos fueron acondicionados a un 15 % de humedad y se molieron en un molino Agromatic AG AQC 109. Se analizó la composición química de las harinas. Se determinó el porcentaje de humedad (Método, 40- 01, AACC 2000), proteínas (Método 46-10, AACC 2000), y gluten (Método 38-10, AACC 2000). Asimismo, se evaluó el porcentaje de gliadinas y gluteninas determinando el contenido de nitrógeno de las fracciones proteicas obtenidas mediante el fraccionamiento de Lupano y Añon (1985).
Tabla 1. Clasificación de los cultivares estudiados de acuerdo a las categorías de calidad propuestas por el INTA (Cuniberti, 2004).
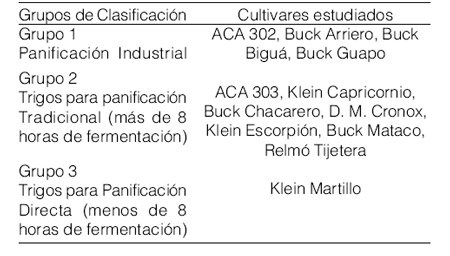
La calidad panadera de los cultivares estudiados fue evaluada mediante el índice de sedimentación en dodecil sulfato de sodio (IS-SDS) (Método 56-70, AACC 2000).
Extracción de proteínas
Las gliadinas fueron extraídas de acuerdo al protocolo propuesto por Bean et al. (1998). En una primera etapa se extrajo la fracción proteica correspondiente a albúminas. Para esto, se mezclaron 200 mg de harina con 1 mL de agua milli-Q; la mezcla fue agitada durante 5 min en vortex y centrifugada por 5 min a 1600 g. El sobrenadante fue descartado (albúminas) y el precipitado se resuspendió en 1 mL de solución tampón de TRIS/HCl 50 mM (pH = 7,8) que contenía KCl 100 mM y EDTA 5 mM, con el objetivo de extraer la fracción de globulinas. La mezcla fue agitada durante 5 min en vortex y centrifugada por 5 min a 1600 g. El sobrenadante fue descartado (globulinas) y el precipitado se resuspendió en 1 mL de agua milli-Q, se agitó por 5 min y se centrifugó 5 min a 1600 g. Esta etapa permitió extraer las sales solubles en agua que pudieron haber quedado en la muestra como consecuencia de las extracciones anteriores ya que estas especies modifican la fuerza iónica del medio y pueden afectar la separación por electroforesis. El precipitado obtenido luego de la centrifugación fue resuspendido en 1 mL de solución de isopropanol 50% con el objetivo de extraer la fracción de gliadinas. Luego, la mezcla fue agitada durante 5 min en vortex y centrifugada por 5 min a 1600 g. El sobrenadante (gliadinas) fue filtrado (0,45 μm) para su análisis.
Electroforesis capilar
Las separaciones fueron llevadas a cabo con un equipo Beckman P/ACE MDQ. Se utilizó un capilar de sílica de 50 μm de diámetro interno y 27 cm de largo (20 cm del capilar hasta el detector). Los capilares fueron acondicionados mediante lavados con las siguientes soluciones (en el orden indicado): metanol (grado HPLC) durante 30 s a 25 psi, HCl 0,1 M por 2 min a 20 psi, agua milli-Q durante 30 s a 20 psi, NaOH 1 M por 2 min a 20 psi, agua milli-Q durante 30 s a 20 psi y buffer de separación por 30 min a 20 psi.
Diariamente, antes de su utilización, los capilares fueron equilibrados con agua milli-Q durante 5 min a 20 psi y con buffer de separación durante 30 min a 20 psi. Además, entre cada corrida, se llevó a cabo un lavado con buffer de separación (10 min a 20 psi). Luego de su utilización, los capilares fueron lavados con ácido acético 0,5 M (10 min a 20 psi) seguido de agua milli-Q a 20 psi durante 5 min y finalmente secados con aire por 2 min (a 20 psi). En el presente estudio, se utilizó como buffer de separación una solución tampón que contenía ácido iminodiacético (IDA) 0,05 M (pH = 2,7), 20% de acetonitrilo (ACN) y 0,05 % de hidroxipropilmetilcelulosa (HPMC) (Bean & Lookhart, 2000b).
Todas las soluciones utilizadas fueron filtradas mediante filtros de 0,45 μm antes de su inyección en el capilar. Las muestras fueron inyectadas mediante presión (0,5 psi) durante 3 s y la absorbancia se midió a 200 nm.
Análisis estadístico
En todos los casos se realizaron las determinaciones por duplicado y los resultados se informaron como el valor promedio. Los datos obtenidos se trataron estadísticamente mediante un análisis de varianza y los resultados fueron comparados por el método de la mínima diferencia significativa (LSD) de Fisher a un nivel de significación de 0,05. El análisis estadístico se realizó mediante el programa Infostat (Infostat, 2002).
RESULTADOS Y DISCUSIÓN
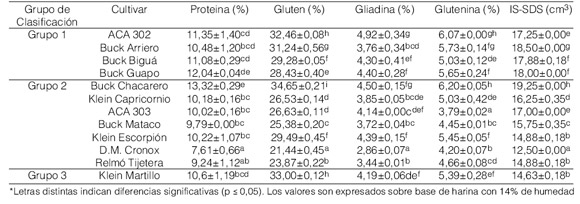
El contenido proteico varió entre 7,61% y 13,32% y el contenido de gluten, entre 21,44% y 34,65% (Tabla 2). Los contenidos proteicos más altos correspondieron a los cultivares que integran el Grupo 1 de las categorías de calidad propuestas por el INTA, excepto por el cultivar Buck Chacarero, que pertenece al Grupo 2 y mostró el mayor contenido proteico. El porcentaje de gluteninas varió entre 3,79% y 6,20%. Valores similares fueron obtenidos en un estudio con trigos argentinos (Moiraghi et al., 2005). El contenido de gliadinas mostró un estrecho rango de variación (2,86%-4,92%). Mediante el IS-SDS se evalúa la capacidad de las proteínas del gluten para formar una red, lo que permite estimar la aptitud de una harina para formar un producto esponjoso. Los valores obtenidos de IS-SDS variaron entre 12,50 cm3 y 19,25 cm3 (Tabla 2). Estos resultados son superiores a los reportados en otros estudios realizados con trigos pan (Primard et al., 1991; Slaughter et al., 1992) y ponen de manifiesto que las harinas de los trigos estudiados tienen una amplia variedad en su calidad panadera. Un resultado similar al obtenido para los contenidos proteicos se obtuvo para el IS-SDS, correspondiendo los valores mayores del índice a los cultivares del Grupo 1 de calidad, excepto por el cultivar Buck Chacarero que mostró el mayor valor de IS-SDS y no pertenece a este grupo. Similarmente, en un estudio con trigos argentinos (Moiraghi et al., 2005), también se informó que los valores más altos de IS-SDS pertenecieron a los cultivares del Grupo 1 de las categorías de calidad propuestas por el INTA.
Tabla 2. Composición química y valores de IS-SDS de las harinas estudiadas*
En la Figura 1 se muestra uno de los perfiles de gliadinas obtenidos, correspondiente al cultivar Buck Mataco. Se puede observar que se logró una buena separación de las gliadinas en un tiempo menor a 10 minutos. El orden de migración de las diferentes fracciones de gliadinas en EC es α−, β−, γ− y ω−. Este orden se corresponde con la movilidad electroforética decreciente de cada fracción y es análogo al que se obtiene mediante las separaciones en A-PAGE (Lookhart & Bean, 1995). De acuerdo a Bean y Lookhart (2000b), el cuerpo principal de gliadinas (rango 1,5 - 3,2 min) corresponde a las frac- ciones α−, β− y γ− (Figura 1B) y los picos restantes (más allá de 3,2 min) corresponden a la fracción ω− (Figura 1C).
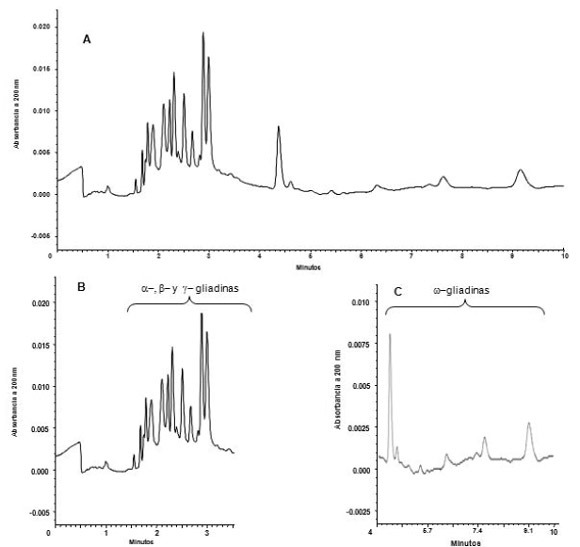
Figura 1. Perfil de gliadinas del cultivar Buck Mataco: (A) electroforegrama completo; (B) cuerpo principal de gliadinas; (C) perfil de la fracción de ω− gliadinas
En la Figura 2 se muestran los electroforegramas correspondientes a las gliadinas de los 12 cultivares estudiados. La separación de gliadinas se logró en tiempos que oscilan entre 8,5 y 9 min con excelente resolución para todas las muestras. Bean y Lookhart (2000b) obtuvieron resultados similares en la separación de gliadinas de trigos estadounidenses bajo las mismas condiciones de separación que las llevadas a cabo en este trabajo. Por otro lado, Rumbo et al. (1999) informaron tiempos de separación de aproximadamente 20 min en un estudio en el que se utilizó una variedad de trigo argentino y con un sistema buffer fosfato que contenía acetonitrilo 20% e hidroxipropilmetilcelulosa 0,03%. Similarmente, en otros trabajos se reportaron tiempos mayores a los obtenidos en el presente estudio (Werner et al., 1994; Yan et al., 1999, Piergiovanni & Volpe, 2003). No se observó ninguna asociación entre los perfiles de los electroforegramas y los grupos de calidad al que pertenecen las muestras analizadas. Buck Guapo, Klein Capricornio y Klein Martillo mostraron dos picos alrededor de 5 y 6,2 min, en la región de las ω− gliadinas (Figura 2). Estas muestras poseen la translocación de centeno 1BL/1RS por lo que los picos mencionados podrían asociarse a las secalinas de estas variedades. Los perfiles obtenidos muestran algunos picos intensos, como los que aparecen alrededor de 6 min en el perfil de ACA 302 y alrededor de 4,5 min en los perfiles de los cultivares Buck Biguá y Relmó Tijetera. Estas diferencias relacionadas con la presencia y ausencia de picos intensos permiten la discriminación entre los distintos cultivares. Otra característica importante es que el cuerpo principal de gliadinas aparece en 3- 4 min; el análisis de esta porción del electroforegramas permite una clara diferenciación entre los diferentes genotipos.
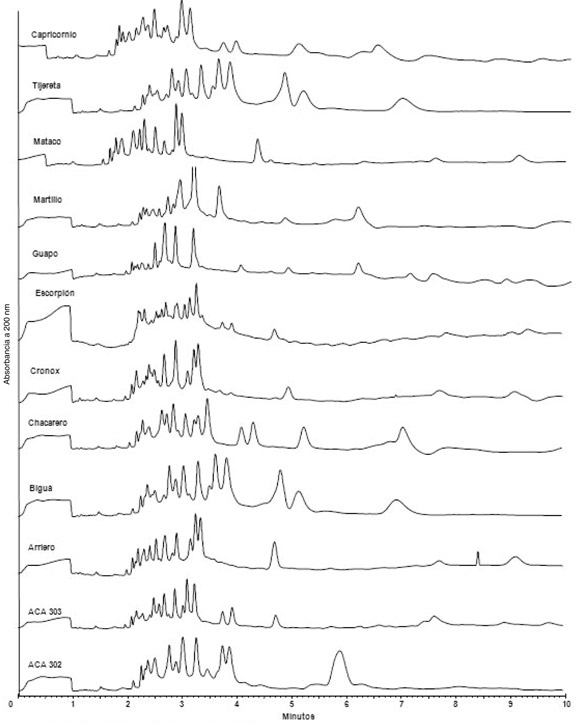
Figura 2. Perfil de gliadinas de los cultivares estudiados.
CONCLUSIONES
Se optimizaron las condiciones para la separación de las gliadinas de trigos argentinos. Esto permite la introducción de una técnica alternativa y complementaria a la electroforesis convencional y a HPLC, las cuales son más comúnmente utilizadas.
Los resultados obtenidos confirman el potencial de electroforesis capilar de zona libre para lograr separaciones de gliadinas con poca preparación y cantidad de la muestra analizada, y con sencillos protocolos de limpieza y mantenimiento de capilar. Adicionalmente, una ventaja fundamental radica en los tiempos relativamente cortos que requieren las separaciones, así como también porque ofrece la posibilidad de automatización. Todos estos factores permiten el análisis de gran cantidad de muestras.
Asimismo, se demostró la capacidad de esta técnica para discriminar diferentes cultivares sobre la base de su perfil de gliadinas. Esto pudo lograrse debido a las diferencias cualitativas y cuantitativas existentes entre los diferentes perfiles, lo que permite la diferenciación de genotipos.
BIBLIOGRAFÍA
1. AACC. American Association of Cereal Chemists, 2000. Approved Methods of the AACC. 10th Edition the Association. USA. [ Links ]
2. Axford, D.W.E.; E.E. McDermott and D. G. Redman, 1979. Note on the sodium dodecyl sulfate test of breadmaking quality: comparison with Pelshenke and Zeleny tests. Cereal Chem. 56:582-584. [ Links ]
3. Bean, R.; J. A. Bietz and G. L. Lookhart, 1998. High-performance capillary electrophoresis of cereal proteins. J. Chromatogr. A. 814: 25-41. [ Links ]
4. Bean, S. R. and G. L. Lookhart, 2000a. Electrophoresis of cereal storage proteins. J. Chromatogr. A. 881: 23-36. [ Links ]
5. Bean, S. R. and G. L. Lookhart, 2000b. Ultrafast capillary electrophoretic analysis of cereal storage proteins and its applications to protein characterization and cultivar differentiation. J. Agric. Food Chem. 48: 344-353. [ Links ]
6. Bietz, J. A. and E. Schmalzried, 1995. Capillary electrophoresis of wheat gliadin: initial studies and application to varietal identification. Lebensm.-Wiss. u.Technol. 28: 174-184. [ Links ]
7. Bonetti, A.; I. Marotti, P. Catizone, G. Dinelli, A. Maietti, P. Tedeschi and V Brandolini, 2004. Compared use of HPLC and FZCE for cluster analysis of Triticum spp and for the identification of T. durum adulteration. J. Agric. Food Chem. 52: 4080-4089. [ Links ]
8. Capelli, L.; F. Forlani, F. Perini, N. Guerrieri, P. Cerletti, and P. G. Righetti, 1998. Wheat cultivar discrimination by capillary electrophoresis of gliadins in isoelectric buffers. Electrophoresis 19: 311-318. [ Links ]
9. Carter, B. P.; C. F. Morris, and J. A. Anderson, 1999. Optimizing the SDS sedimentation test for end-use quality selection in a soft white and club wheat breeding program. Cereal Chem. 76: 907-911. [ Links ]
10. Cuniberti, M., 2004. Propuesta de clasificación del Trigo Argentino. Revista IDIA INTA 6:21-25. [ Links ]
11. Dick, J. and J. Quick, 1983. A modified screening test for rapid estimation of gluten strength in early-generation durum wheat breeding lines. Cereal Chem. 60:315-318. [ Links ]
12. Field, J. M.; P. R. Shewry and B. J. Miflin, 1983. Solubilization and characterization of wheat gluten proteins; correlations between the amount of aggregated proteins and baking quality. J. Sci. Food Agric. 34: 370-377. [ Links ]
13. Finney, K. F.; B. L. Jones and M. D. Shogren, 1982. Functional (breadmaking) properties of wheat protein fractions obtained by ultracentrifugation. Cereal Chem. 59: 449-453. [ Links ]
14. Hoseney, R.C., 1994. Principles of cereal science and technology. 2º Edition. American Association of Cereal Chemists Inc., St. Paul, Minnesota, p. 201. [ Links ]
15. InfoStat, 2002. InfoStat/Profesional, versión 1.1. Grupo InfoStat, Facultad de Ciencias Agropecuarias, Universidad Nacional de Córdoba, Argentina. [ Links ]
16. Jones, B. L.; G. L. Lookhart, S. B. Hall and K. E. Finney, 1982. Identification of wheat cultivars by gliadin electrophoresis: electrophoregrams of the 88 wheat cultivars most commonly grown in the United States in 1979. Cereal Chem. 59: 181-188. [ Links ]
17. Jones, R. W.; N. W. Taylor and F. R. Senti, 1959. Electrophoresis and fractionation of wheat gluten. Arch. Biochem. Biophys. 84: 363-376. [ Links ]
18. Khatkar, B. S.; R. J. Fido, A. S. Tatham and J. D. Schofield, 2002. Functional properties of wheat gliadins. I. Effects on mixing characteristics and bread making quality. J. Cereal Sci. 35: 299-306. [ Links ]
19. Lookhart, G. L. and S. R. Bean, 1995. A fast method for wheat cultivar differentiation using capillary zone electrophoresis. Cereal Chem. 72: 42-47. [ Links ]
20. Lookhart, G. L. and J. A. Bietz, 1990. Practical wheat varietal identification in the United States. Cereal Food. World 35: 404-407. [ Links ]
21. Lupano, C. and M. C. Añon, 1985. Characterization of triticale protein. Cereal Chem. 62, 174-178. [ Links ]
22. Moiraghi, M.; P. D. Ribotta, A. Aguirre, G. T. Pérez y A. E. León, 2005. Análisis de la aptitud de trigos pan para la elaboración de galletitas y bizcochuelos. Agriscientia XXII (2): 47-54. [ Links ]
23. Piergiovanni, A. R. and N. Volpe, 2003. Capillary electrophoresis of gliadins as a tool in the discrimination and characterization of hulled wheats. (Triticum dicoccon Schrank and T. spelta L.). Cereal Chem. 80: 269-273. [ Links ]
24. Primard, S.; R. Graybosch, C. J. Peterson and J. H. Lee, 1991. Relationship between gluten protein composition and quality characteristics in four populations of highprotein, hard red winter wheat. Cereal Chem. 68: 305-312. [ Links ]
25. Rumbo, M.; F.G. Chirdo, S.A. Giorgieri, C.A. Fossati and M.C. Añón, 1999. Preparative fractionation of gliadins by electrophoresis at pH 3.1 (A-PAGE). J Agric Food Chem. 47(8):3243-7. [ Links ]
26. Rumbo, M. and S.A. Giorgieri, 1998. Comparative studies of the relative mobility of gliadin at low pH by capillary electrophoresis and conventional electrophoretic techniques. J Capillary Electrophor.5 (1-2):39-44. [ Links ]
27. Shewry, R., 2003. Wheat gluten proteins. En: Wheat gluten protein analysis, Shewry, R.; Lookhart, G. L. editors. American Association of Cereal Chemist, St. Paul, Minnesota USA. 1-13. [ Links ]
28. Slaughter, D. C.; K. H. Norris and W. R. Hruschka, 1992. Quality and classification of hard red wheat. Cereal Chem. 69: 428-432. [ Links ]
29. Wang, C. and M. I. P. Kovacs, 2001. Swelling index of glutenin test. 1. Method and comparison with sedimentation, gel-protein, and insoluble glutenin tests. Cereal Chem. 79:183-189. [ Links ]
30. Werner, W. E.; J. E. Wiktorowicz and D. D. Kasarda, 1994. Wheat varietal identification by capillary electrophoresis of gliadins and high molecular weight glutenin subunits. Cereal Chem. 71: 397-402. [ Links ]
31. Wieser, H.; W. Seilmeie and H. D. Belitz, 1994. Use of RPHPLC for a better understanding of the structure and functionality of wheat gluten proteins. En: HPLC of Cereal and Legume proteins. J. E. Kruger and J. A. Bietz, eds. Am. Assoc. Cereal Chem. St. Paul, MN. 235- 272 [ Links ]
32. Wieser, H. and R. Kieffer, 2001. Correlations of the amount of gluten protein types to the technological properties of wheat flours determined on a micro-scale. J.Cereal Sci. 34, 19-27 [ Links ]
33. Yan, Y.; G. Surlan-Momirovic, S. Prodanovic, D. Zoric, and G. Liu, 1999. Capillary zone electrophoresis analysis of gliadin proteins from Chinese and Yugoslav winter wheat cultivars. Euphytica 105: 197-204. [ Links ]














