INTRODUCCION
La papa (Solanum tuberosum L.) es un cultivo de amplia distribución mundial y representa un alimento de alto valor nutricional (Argenpapa, 2018). La multiplicación vegetativa de este tubérculo es una forma de mantener las características varietales por generaciones sucesivas. Sin embargo, es un medio de transporte y diseminación de enfermedades que ocasionan pérdidas en la calidad sanitaria y el rendimiento alcanzado (García Crespo, Arcia Montesuma, Pérez Tortolero y Riera, 2012). Entre las enfermedades en papa, se destaca por su importancia la rhizoctoniasis o costra negra, provocada por Rhizoctonia solani Kühn. Éste patógeno ocasiona fallas en la emergencia de plantas, disminución del rendimiento y malformaciones en los tubérculos, con la particularidad de presentar numerosos hospedantes y al no implementarse métodos de control eficiente, se acumula en el suelo en forma de esclerocios (Beltrán Acosta, Moreno Velandia y Cotes, 2011; Mantecón, 2015; Osorio Hernández et al., 2016; Alarcón Flor, 2019). La aplicación de fungicidas al suelo o como desinfectantes de tubérculos para el control de la rhizoctoniasis en papa beneficia su calidad sanitaria con niveles de incidencia aceptables del 5 %, sin aumentar el rendimiento (Mantecón, 2015). El control químico de la enfermedad no ha sido eficaz, por lo que la búsqueda de agentes nativos de control biológico para disminuir la carga infectiva del agente causal e incorporarse al manejo de la enfermedad, constituirá una alternativa más para reducir las pérdidas, los costos de producción y los niveles de contaminación ambiental (Osorio Hernández et al, 2016).
Entre los microorganismos propuestos para el manejo de enfermedades se menciona a Trichoderma, un hongo anaerobio facultativo, potencialmente antagonista de fitopatógenos y colonizador de la rizósfera (Beltrán Acosta, Moreno Velandia y Cotes, 2011; Osorio Hernández et al., 2016; Companioni González, Domínguez Arizmendi y García Velasco, 2019; Gakegne y Martínez Coca 2019; Infante y Martínez Coca, 2019). Numerosas especies y cepas de Trichoderma han sido identificadas a nivel mundial, sin embargo, no todas han sido eficientes agentes de biocontrol, por lo que se requiere un trabajo minucioso que permita evaluar diferentes aislamientos y seleccionar el que presente mayor eficacia (Cotes, 2018; Companioni González etal., 2019).
En particular existen estudios acerca de la acción de diferentes especies de Trichoderma sobre la rhizoctoniasis (Beltrán Acosta, Moreno Velandia y Cotes, 2011; García et al., 2012; Alarcón Flor, 2019; Infante y Martínez Coca, 2019), pero hay que destacar que su efecto no es el mismo,según la región agrícola. Debido a lo expuesto, resulta importante la búsqueda y evaluación de cepas nativas de Trichoderma, para el control de hongos patógenos en las condiciones ambientales de producción y poder identificar los mecanismos de acción a fin de lograr bioformulados de alta eficacia (Castro, 2015; Companioni Gonzalez et al., 2019). Al respecto, Martínez, Infante y Reyes (2013) y Cotes (2018) mencionan como mecanismos de acción del género Trichoderma la competencia por espacio y nutrientes, micoparasitismo y la producción de metabolitos antibióticos de naturaleza volátil y no volátil.
A pesar de la potencialidad de Trichoderma como biocontrolador, su adopción en Argentina como parte del manejo de enfermedades en papa no ha sido relevante, posiblemente debido a los resultados variables que se han obtenido, la cepa incorporada y/o a la calidad del producto aplicado.
El objetivo de este trabajo fue seleccionar aislamientos de Trichoderma spp. in vitro como potenciales biofungicidas para el control de Rhizoctonia solani Kühn en papa.
MATERIALES Y MÉTODOS
Muestreo de suelos para la obtención de aislamientos nativos de Trichoderma spp.
Para la prospección de nuevos aislamientos, se tomaron muestras de suelo de los departamentos Calamuchita, Río Primero, Punilla, San Javier y Córdoba Capital (cinturón verde) en la provincia de Córdoba, Argentina. El muestreo se realizó en zonas de monte y campos cultivados sin aplicaciones previas de Trichoderma spp. De cada ecosistema, se recolectaron con barreno cuatro submuestras de los primeros 20 cm de profundidad, tomadas en diferentes posiciones del lote, para totalizar 1 kg de suelo de cada sitio, eliminando la materia orgánica superficial. Cada muestra se acondicionó en conservadora y se trasladó al laboratorio para ser procesada.
Aislamiento e identificación
Luego de homogeneizar cada muestra de suelo, se tomó una submuestra de 10 g, colocándola en 90 ml de agua destilada estéril y se agitó durante 20 a 30 min en agitador orbital a 170 rpm. De dicha dilución se tomó un ml y se diluyó en nueve ml de agua destilada esterilizada.
El aislamiento de Trichoderma del suelo se realizó de acuerdo al método de dilución propuesto por Nelson, Toussoun y Marasas (1983) en placas Petri con medio de cultivo agar papa glucosado (APG), más antibiótico Cloranfenicol al 0,01 %, para inhibir la proliferación bacteriana. Se realizaron siembras sobre las placas con 0,5 |uL de suspensión de suelo en agua destilada estéril 1/1000 p/v de cada muestra. Las cajas se incubaron a 25 °C, con alternancia luz/oscuridad de 12 h. Las observaciones fueron diarias hasta los 6 días desde la siembra seleccionando todas las colonias correspondientes al género Trichoderma, de acuerdo a sus características morfológicas: micelio, conidióforos, fiálides, conidios, tipo, textura y color de la colonia (Gams y Bisset, 1998).
Para la identificación y el establecimiento de una colección de cepas puras de Trichoderma, se desarrollaron cultivos monospóricos en diluciones 1/1000 a 1/10000 p/v mediante barridos en placas Petri con agar agua (AA). A las 24 h desde la siembra se transfirieron esporas individuales germinadas a placas con agar malta (AM), de acuerdo al método de Cañedo y Ames (2004). Para asegurar la viabilidad e integridad morfológica, fisiológica y genética de las cepas, se conservaron a través de métodos de corto plazo (placas Petri con AM), mediano plazo (tubos rectos con AM y vaselina esterilizada) y largo plazo (liofilización).
Se corroboró la identidad de cada cepa por PCR (Polymerase Chain Reaction), llevándose a cabo con el par de primers ITS1/ITS4 siguiendo el protocolo de White, Bruns, Lee y Taylor (1990). Se amplificó, el factor de elongación de la transcripción (tef1) con el par de primers Ef-728M/Ef2 siguiendo la metodología de Chaverri, Castlebury, Samuels, y Geiser (2003). Las amplificaciones de la región tef1 se llevaron a cabo con Taq 2X Master Mix (New England Biolabs, Estados Unidos) y para las reacciones con ITS1/4 se utilizó Taq Polymerase (INVITROGEN). Para ITS (espaciadores internos transcriptos), en un volumen de reacción de 50 |ul se agregaron 20 mM Tris-HC1 (pH 8,4), 50 mM KC1, 0,2 mM dNTPs, 0,2 |uM primers ITS1 e
ITS4, 3 mM MgC1 2, 1 unidad TAQ polimerasa (Invitrogen life technologies, Brasil) y 10 a 100 ng de ADN. El programa de amplificación utilizado fue el siguiente: 1 ciclo de 1 min a 94 °C seguido de 30 ciclos de 15 s a 94 °C, 15 s a 58 °C y 15 s a 72 °C. En cuanto a tefl (factor de elongación de la transcripción) en un volumen de reacción de 20 pl con buffer IxMaster Mix (New England Biolabs), 1,25 mM MgCl 2 y 50 a 100 ng/pl de ADN genómico. El programa de amplificación fue el siguiente: 1 ciclo de 1 min a 94 °C durante 1 min, 30 ciclos de 1 min a 94 °C, 1 min a 55 °C, 1 min a 72 °C con un paso final de elongación de 3 min a 72 °C (Barrera, 2012).
Las determinaciones por PCR se realizaron en el Instituto de Microbiología y Zoología Agrícola (IMyZA) del Instituto Nacional de Tecnología Agropecuaria (INTA) Castelar, Argentina. Las secuencias de ITS fueron comparadas con las depositadas en la base de datos del National Center for Biotechnology Information (NCBI) para confirmar los agrupamientos observados.
Evaluación in vltro del efecto antagónico de aislados de Trichoderma spp. sobre Rhizoctonia solani Kühn
Se estableció el efecto antagónico de cada aislado de Trichoderma spp. al enfrentarse a Rhizoctonia solani Kühn (CBga3) proveniente del cepario del Laboratorio de Fitopatología de la Facultad de Ciencias Agropecuarias (FCA), Universidad Nacional de Córdoba (UNC). El ensayo se llevó a cabo de acuerdo al método para el cultivo dual modificado al propuesto por Martínez y Solano (1995). En placas de Petri de 9 cm de diámetro, que contenían papa dextrosa agar (PDA) marca Britania, se colocó en cada extremo un disco de agar de 5 mm de diámetro con micelio de Rhizoctonia solani y en el extremo opuesto otro disco de agar de cada aislado de Trichoderma spp.
Se realizaron cinco repeticiones por tratamiento incluyendo testigos de Rhizoctonia solani y Trichoderma spp., en un diseño completamente aleatorizado. Las cajas se mantuvieron en cámara de incubación a 25 +/- 2 °C y 12 h de luz blanca. Las determinaciones se realizaron cada 24 h para evaluar los siguientes mecanismos:
Competencia por el sustrato: las evaluaciones en cultivos duales, se realizaron en dos etapas de 96 y 120 horas. La clasificación como antagonista de los aislamientos se llevó a cabo teniendo en cuenta la escala de clase de cinco grados propuesta por Bell, Wells y Markham (1982).
Micoparasitismo: para establecer el tipo de interacción hifal (adhesión, enrollamiento, penetración, vacuolización, granulación del citoplasma, lisis) se tomaron tres muestras de la zona de interacción de ambos hongos por cada réplica en los cultivos duales y se colocaron en portaobjetos sobre una gota de lactofenol. Las observaciones se realizaron en microscopio óptico binocular a aumento 400x. Además, se realizaron observaciones en el microscopio electrónico de barrido (MEB) de la Facultad de Ciencias Exactas, Físicas y Naturales (UNC).
El parasitismo de los aislamientos de Trichoderma spp. medido como el sobrecrecimiento sobre el patógeno, se evaluó a los 5 días desde la siembra del antagonista y se estableció la superficie ocupada (Infante, Martínez, Peteira, Reyes y Herrera, 2013). Los resultados se expresaron como porcentaje del área ocupada por Trichoderma sobre el área del patógeno.
Antibiosis: para la comprobación del efecto antibiótico de los aislamientos de Trichoderma spp. sobre el agente patógeno, se evaluó el porcentaje de inhibición del crecimiento radial (PICR) en cultivo dual desde las 24 h hasta el momento en que se estableció contacto físico entre el antagonista y el patógeno (Pérez Torres et al., 2017). Se empleó la fórmula PICR= [(R1-R2)/ R1] x100; donde R1 es el crecimiento radial del testigo y R2 el crecimiento radial del patógeno en los tratamientos (Samaniego Fernández, Harouna, Corbea, Rondón Castillo y Placeres Espinosa, 2018).
Diseño y análisis estadístico
El experimento se realizó bajo un diseño completamente aleatorizado. Los valores porcentuales se transformaron mediante el cálculo de 2arcoVp. Con el procesador estadístico InfoStat (Di Rienzo et al., 2014) se realizó el análisis de varianza y las medias fueron comparadas con la prueba de Tukey (p< 0,05).
Para la identificación de grupos funcionales se realizó el análisis de conglomerados por el método de encadenamiento jerárquico de Ward. Se utilizaron como atributos funcionales la actividad antagónica medida como el porcentaje de sobrecrecimiento de Trichoderma sobre el patógeno, la antibiosis en términos de PICR y el micoparasitismo de acuerdo al número y tipo de interacciones hifales.
RESULTADOS Y DISCUSIÓN
De la prospección realizada se obtuvieron 18 aislamientos de Trichoderma de las áreas geográficas muestreadas. De acuerdo a la comparación de las secuencias ITS obtenidas con las depositadas en la bases de datos del NCBI se identificaron las cepas aisladas por especie (Tabla 1). La mayor cantidad de cepas correspondieron a T. koningiopsis (seis cepas), seguidas de T. harzlanum (cuatro cepas) y T. atrovlrlde (tres cepas).
Competencia por el sustrato
La respuesta del crecimiento de Trichoderma en cultivos duales al enfrentarse a R. solani, se presenta en la Figura 1.
A las 96 h de crecimiento in vitro (Tabla 1), el 88 % de las cepas en estudio mostraron un crecimiento sobre el patógeno, cubriendo entre el 75 % al 100 % de la superficie de la caja (Clase 2 y Clase 1 respectivamente) de acuerdo a la escala de Bell et al. (1982). La detención del crecimiento de ambos hongos (Clase 3) solo se detectó en el caso de T. gamsii cepa CBg1. Mientras que T. virens cepa CBvs1 no mostró efecto control (Clase 4) ante el avance de R. solani que se extendió sobre toda la superficie del medio de siembra. A las 120 h desde la siembra, el 88,8 % de las cepas se identificaron como Clase 1 y 2, manteniendo su bajo nivel de competencia T. gamsii CBg1 (Clase 3) y T. virens CBvs1 (Clase 4). Cabe destacar que el testigo de Rhizoctonia alcanzó su máximo crecimiento a las 96 h, iniciando la formación de esclerocios a partir de las 48 h desde la siembra.
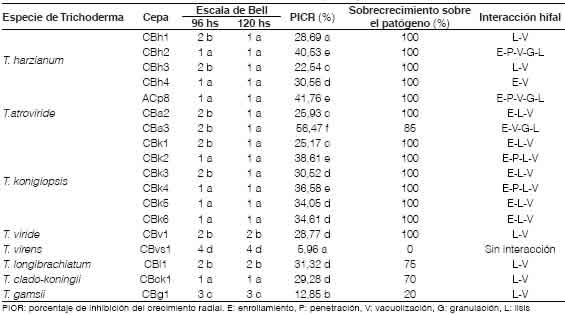
Tabla 1: Evaluación in vitro de cepas nativas de Trichoderma spp. para el biocontrol de Rhizoctonia solani Kühn. Valores en una misma columna seguidos de diferente letra difieren significativamente segúún Tukey (p≤ 0,05)
Estos resultados demuestran que la capacidad de competencia en las cepas evaluadas se mantiene, aún cuando requieran de más tiempo para alcanzar el mismo efecto, de acuerdo a lo propuesto por Martínez et al. (2008). Además, se puso en evidencia el gran potencial de competencia que presenta Trichoderma dado fundamentalmente por su velocidad de crecimiento que es superior a la del patógeno en las cepas evaluadas, a excepción de los aislamientos identificados como T. virens CBvs1 y T. gamsii CBg1.
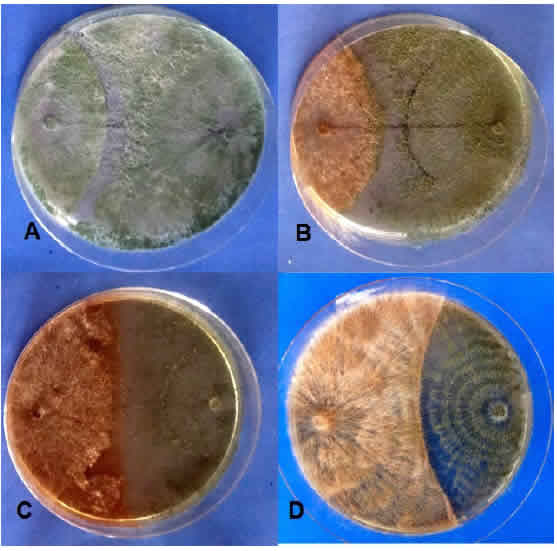
Figura 1: Competencia por el sustrato in vitro de Trichoderma y R. solani. A: Clase 1; B: Clase 2; C: Clase 3; D: Clase 4 de acuerdo a Escala de Bell.
Los resultados obtenidos en este estudio concuerdan con los informados por diferentes autores, quienes han establecido el comportamiento de Trichoderma como Clase 1. De este modo, el alto grado de competencia de las cepas de T. harzianum sobre patógenos asociados a semillas, fue informado por Siameto, Okoth, Amugune y Chege (2011) quienes observaron un crecimiento rápido sobre Pythium sp. Por su parte, Bell et al. (1982), registraron como Clase 1 a diferentes aislados de Trichoderma spp. frente a los grupos AG-3 y AG-2 de R. solani. También Reyes, Martínez e Infante (2008) en su trabajo con hongos perjudiciales en arroz, identificaron 47 aislamientos de Trichoderma spp. en las Clases 1 y 2 lo que refleja su gran potencial de competencia establecido por su alta velocidad de crecimiento que supera al de los patógenos. Mientras que Sánchez García, Espinosa Huerta, Villordo Pineda, Rodríguez Guerra y Mora Avilés (2017) informaron como Clase 1 a las cepas de Trichoderma evaluadas al enfrentarlas a R. soiani en poroto.
Micoparasitismo
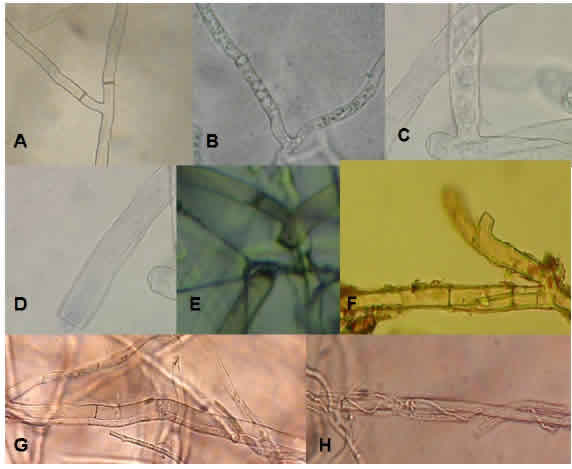
En la Figura 2 se presentan las fotografías correspondientes a los preparados microscópicos realizados. Es de destacar las características morfológicas en cuanto a la integridad y compartamentalización de las estructuras de hifas de R. soiani en el testigo respecto a lo observado en el cultivo dual. Mientras que, al enfrentarse se pudo identificar, en la zona de contacto de los microorganismos, adhesión, enrollamiento hifal y con la penetración de hifas de Trichoderma en las hifas del patógeno, se detectó degradación parcial o total (lisis), granulación y vacuolización del contenido citoplasmático.

Figura 3: Interacciones hifales ejercidas por Trichoderma sobre Rhizoctonia solani detectadas con microscopioelectrónico de barrido. A: adhesión, lisis y penetración, B: enrollamiento, C: penetración y lisis, D: lisis.
En la Figura 3 se muestran las interacciones hifales de Trichoderma sobre Rhizoctonia soiani mediante MEB, donde se observó con mayor detalle la adhesión, penetración, enrollamiento y procesos líticos a nivel del citoplasma.
Los resultados de interacción hifal con R. soiani presentados (Tabla 1), indican que el 94,4 % de las cepas en estudio mostraron al menos dos tipos de mecanismos. Solo T. harzianum CBh2 y T. atroviride ACp8 presentaron los cinco tipos de interacción hifal detectados: enrollamiento, penetración,
vacuolización, granulación del citoplasma y lisis. Mientra que T. atroviride CBa3, T. konigiopsis CBk2 y CBk4, exhibieron cuatro tipos de interacción hifal. Solo T virens CBvs1 no evidenció ningún tipo de interacción con el patógeno, en concordancia con la ausencia de crecimiento sobre R. solani. Se ha descripto que la multiplicidad de mecanismos con relación al micoparasitismo, favorece la acción de biocontrol sobre el fitopatógeno (Pérez Torres et al., 2017; Companioni González et al., 2019). Sin embargo, no todos las formas de interacción se manifiestan, ya que depende de la cepa de Trichoderma evaluada y de las condiciones ambientales (Martínez Coca, 2017).
Según investigaciones previas (Guédez, Cañizalez, Castillo y Olivar, 2012; Martínez et al., 2013) el proceso de micoparasitismo ejercido por Trichoderma se inicia al ponerse en contacto con la hifa del hospedante, formándose apresorios que permiten la penetración. Sobre la base de las observaciones realizadas en nuestro trabajo, solo en cuatro cepas de las evaluadas se detectó la mencionada estructura.
El fenómeno de enrollamiento se presentó en más de la mitad de las cepas evaluadas (61 %). Este aspecto es relevante, ya que la adhesión y posterior enrollamiento de las hifas de Trichoderma sobre el patógeno provoca su debilitamiento, de acuerdo a lo sugerido por Eraso Insuasty, Acosta Rodríguez, Salazar González y Betancourth García (2014) en el control de Fusarium en arveja y Garrido y Vilela (2019) en arroz.
Por su parte, el fenómeno de lisis fue observado en todos los aislamientos, a excepción de T. harzianum CBh4 y T. virens CBvs1. Estos cambios estructurales pueden ser atribuidos a la acción de enzimas hidrolíticas que actúan debilitando y desintegrando las paredes del patógeno (Martínez, Infante y Reyes, 2013; Companioni González et ai., 2019; Infante y Martínez, 2019). Es importante destacar que la capacidad lítica desarrollada por Trichoderma depende más de la cepa y el hospedante que de la especie (Martínez et ai., 2013).
En investigaciones realizadas en banana y poroto Golam y Llag (1999) y Gonzales (2001) informaron cambios morfológicos (acortamiento y/o deformaciones) en las hifas de R. soiani micoparasitadas por Trichoderma, sin embargo en este trabajo tales cambios no fueron observados.
Cabe destacar que las cepas en estudio mostraron diferencias en su capacidad de sobrecrecimiento sobre R. soiani (Tabla 1) como indicador de su actividad antagónica. Todas las cepas pertenecientes a T. harzianum, T. atroviride, T. konigiopsis, T. viride y T. iongibrachiatum alcanzaron Grado 1 (crecimiento superior al 75 % del área cubierta por el patógeno), observándose Grado 2 en el caso de T. ciado-koningii CBck1 (70 %) y Grado 4 para T. gamsii CBg1 (20 %). Mientras que solo para T. virens CBvs1 se asignó Grado 5, ya que no hubo crecimiento sobre el patógeno.
Antibiosis
La evaluación de la antibiosis a las 24 h, cuando aún no había contacto entre ambos hongos medido en términos de PICR se presenta en la Figura 4. La respuesta observada fue diferente entre las cepas evaluadas en cultivo dual (Tabla 1). Así, T. atroviride CBa3 alcanzó el mayor valor de PICR (56,47 %); mientras que para T. virens CBvs1 se determinó el menor porcentaje (5,96 %). Entre las cepas agrupadas en Clase 1 según la escala propuesta por Bell et ai. (1982), el 22 % de ellas alcanzaron un valor de PICR cercano a 40 (39,38 %) lo que las destaca en su acción antibiótica frente a R. soiani, de acuerdo lo propuesto por Osorio Hernández et ai. (2016).
Los porcentajes establecidos en este trabajo no se acercan a los informados por Pérez Torres et ai. (2018) al confrontar T. harzianum A34 con R. soiani en arroz (PICR=70 al 90 %); ni a los registrados por Rodríguez y Flores (2018) quienes evaluaron T. crosem 06142 y T. koningii Santa Lucía en maíz (PICR=50 %); como tampoco a lo reportado por Santander (2012) en mango (PICR=70 %). De lo que se deduce la importancia de la evaluación de cepas nativas para poder establecer el control efectivo de R. solani en condiciones locales y así diseñar formulaciones de amplia aplicación en la producción de papa.
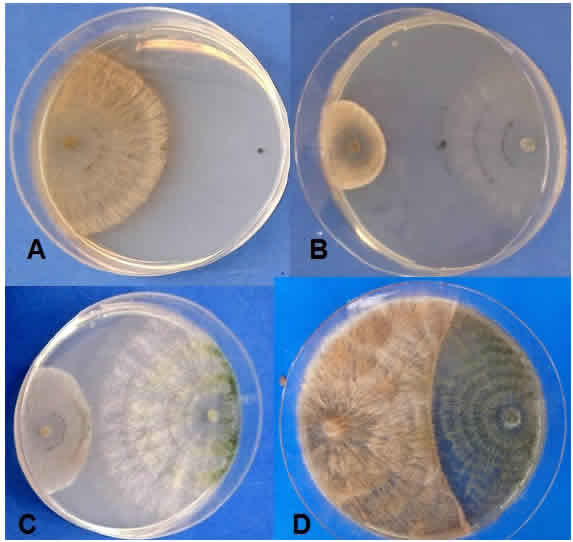
Figura 4: Antibiosis medida como PICR de Trichoderma en cultivo dual con Rhizoctonia solani. A: Testigo R. solani, B: inhibición de Rhizoctonia sp. mayor al 50 % al enfrentarse a la cepa Cba3, C: inhibición de Rhizoctonia sp. cercano all 40 % al enfrentarse a la cepa Cbh2, D: inhibición. de Rhizoctonia sp. menor al 5 % al enfrentarse a la cepa CBvs1.
De acuerdo a las observaciones y resultados presentados (Figura 3 y Tabla 2) se infiere que las cepas evaluadas de Trichoderma, que han demostrado capacidad de antibiosis, han excretado al medio metabolitos con acción fungistática sobre el patógeno inhibiendo su crecimiento de acuerdo a lo sugerido por Infante etal. (2013) y Reyes etal. (2008). Al respecto, Osorio Hernández et sil. (2016) proponen que el antagonista excreta antibióticos volátiles antimicóticos, que debilita al patógeno y lo hace más sensible a los metabolitos solubles. Con relación a ello, se puede comentar que la cepa T atroviride ACp8, produjo un marcado aroma a coco, lo que ha sido relacionado a la producción de alfa pirona o seis pentil pirona, compuesto que inhibe el crecimiento de hongos (Rocha Valadez et al, 2005; Vinale et al, 2014).
El dendrograma derivado del análisis de Promedio (Average linkage)
Distancia: (Euclidea) conglomerados elaborado en base a la actividad antagónica (porcentaje de sobrecrecimiento), antibiosis (PICR) y micoparasitismo (interacciones hifales) permitieron la identificación de tres grupos, tomando como base la distancia euclidiana de 2,15. El primer grupo quedó compuesto por T. atroviride ACp8 y CBa3, T. konigiopsis CBk2 y CBk4 y T. harzianum CBh2 cepas que demostraron alta actividad antagónica, valores PICR mayores al 35 % y al menos cuatro mecanismos de interacción hifal. El tercer grupo representado por T. virens CBvs1 y T. gamsii CBg1, fue identificado como el menos eficiente en el control de R. solani, ya que estas cepas mostraron bajos valores de sobrecrecimiento (0 y 20 %) y PICR (5,96 y 12,85 % respectivamente) y en el caso de T. virens CBvs1 ausencia de interacción hifal. Como grupo intermedio se ubicaron 11 aislamientos con excelente actividad antagónica (100 % de sobrecrecimiento sobre el patógeno), de respuesta variable en cuanto a su capacidad de antibiosis (22,54 a 34,61 %), exhibiendo entre dos y tres mecanismos de micoparasitismo. En este grupo se ubicó T. viride CBv1, aún cuando este género ha sido propuesto como de alta eficiencia (Verma, Brar, Tyagi, Surampalli y Valero, 2007).

Figura 5: Dendrograma de clasificación de 18 cepas nativas de Trichodermasobre la base de variables indicadoras de actividad antagónica (sobrecrecimiento sobre el patógeno), antibiosis (PICR) y micoparasitismo (interacción hifal), utilizando el algoritmo Ward y la distancia métrica Euclidiana.
Mediante el análisis de conglomerados se logró establecer la mayor homogeneidad dentro de cada grupo identificado y la mayor diferencia entre grupos, lo que permitió la selección de aquellas cepas más eficientes en el control de R. solani para lograr una formulación exitosa y poder ser utilizada en el campo. Los resultados encontrados Indicaron que las cepas nativas de T. atrovlrlde ACp8 y CBa3, T. harzlanum CBh2, T. konigiopsis CBk2 y CBk4 fueron las más eficientes en el control de R. sotaní, con máxima potencialidad en su actividad antagónica y de antibiosis. Su activo crecimiento y su probable capacidad de producir metabolitos antifúngicos, se combina con los mecanismos de interacción hifal lo que favorece su acción sobre R. sotaní.
Disponer de estas cepas nativas de mayor especificidad y mejor adaptación edafoclimática, no solo beneficiará su persistencia en el suelo sino que además, contribuirán al desarrollo de bioformulados para mejorar el sistema sustentable de producción de papa de mejor calidad.