INTRODUCCION
Las enfermedades provocadas por orthotospovirus causan importantes daños en diversos cultivos en todo el mundo generando graves pérdidas económicas (Goldbach y Kuo, 1996; Mumford, Barker y Wood, 1996; Pappu, Jones y Jain, 2009).
Estos virus infectan principalmente cultivos ornamentales y hortícolas, siendo Orthotospovirus el único género de la familia Tospoviridae (Maes et al., 2019) cuyos miembros infectan plantas, mientras que los integrantes de los demás géneros de esta familia infectan invertebrados (Holkar, Mandal, Reddy y Jain, 2019). Se transmiten exclusivamente por trips (Thysanoptera: Thripidae) de manera persistente y propagativa (Jones, 2005), por lo que el virus se replica en el insecto, circula a través del cuerpo y persiste a través de las diferentes etapas de desarrollo. La adquisición del virus depende de la etapa de desarrollo del vector; solo los trips que adquieren el virus en el primer estadio larvario son capaces de transmitirlo y a medida que se desarrollan, la eficiencia de la adquisición disminuye (Rotenberg, Jacobson, Schneweis y Whitfield, 2015). De las 1710 especies conocidas de Thripidae, se conocen hasta la actualidad solo 14 especies que son capaces de transmitir orthotospovirus (Riley, Joseph, Srinivasan y Diffie, 2011).
El genoma de los orthotospovirus tiene una organización conservada compuesta por tres segmentos clasificados como pequeño (S), medio (M) y grande (L). El segmento S codifica la proteína de la nucleocápside (N) y la proteína no estructural (NS) (Turina, Tavella y Ciuffo, 2012). Tanto la proteína N como la NSs, juegan un importante rol en la infección viral, la patogénesis y el ensamblaje de la partícula viral (Olaya, Adhikari, Raikhy, Cheng y Pappu, 2019).
Las distintas especies de Orthotospovirus se diferencian por la especificidad del vector, su rango de hospedante, las relaciones serológicas de la proteína N y la secuencia genómica del gen que codifica esta proteína, que debe mostrar menos del 90 % de identidad con la de cualquier otra especie descrita para este género según el International Committee on Taxonomy of Viruses (ICTV) (Plyusnin et al, 2011).
En el mundo se han reportado varias especies del género Orthotospovirus que infectan cucurbitáceas: watermelon silver mottle orthotopovlrus (WSMoV) (Rao, Liu, Wu y Li, 2011), tomato spotted wilt orthotospovirus (TSWV) (Yeh et al., 1992), zucchini lethal chlorosis orthotospovirus (ZLCV) (Bezerra et al., 1999), watermelon bud necrosis orthotospovirus (WBNV) (Jain, Pappu, Pappu, Reddy y Vani, 1998), melon yellow spot orthotospovirus (MYSV) (Kato, Handa y Kameya- Iwaki, 2000), melon severe mosaic orthotospovirus (MeSMV) (Ciuffo et al., 2009) y groundnut ringspot orthotospovirus (GRSV) (Spadotti, Leao, Rocha, Pavan y Krause-Sakate, 2014).
EL GRSV ha sido detectado en Brasil, recientemente reportado en infecciones naturales en sandía y pepino (Spadotti et al., 2014; Leao et al., 2015). En Argentina este virus ha sido reportado en pimiento, tomate, tabaco, maní (Dewey, Semorile y Grau, 1996; de Breuil et al., 2007). Este patógeno ha mostrado una amplia distribución geográfica y extenso rango de hospedantes (Lecoq y Katis, 2014).
Como vectores de GRSV han sido citados Frankliniella schultzei, que transmite muy eficientemente el virus, y F. occidentalis, con menor eficiencia (Wijkamp, Almarza, Goldbach y Peters, 1995; Nagata, Almeida, Resende y De Ávila, 2004). Estos insectos han sido reportados en Argentina en diversos cultivos (SINAVIMO, 2019 a, b).
Se encontró que los orthotospovirus estaban vinculados en clados al grupo de origen geográfico en función de la similitud de secuencia genómicas y tienden a compartir distribuciones geográficas y vectores (Oliver y Whitfield, 2016).
En Argentina se han detectado potyvirus y cucumovirus en cucurbitáceas (Nome, March y Giorda, 1974; Gracia y Feldman, 1986; Perotto, Celli, Pozzi, Luciani y Conci, 2016; Perotto et al., 2017) y se ha hecho reporte de la presencia de un orthotospovirus (el ZLCV) en zapallos (Pozzi, Luciani, Celli, Conci y Perotto, 2019). Los objetivos de este trabajo fueron identificar el agente causante de los síntomas observados en sandía en lotes de producción de Santiago de Estero y analizar su filogenia.
MATERIALES Y MÉTODOS
Se realizaron muestreos durante la campaña 2017/2018 en la provincia de Santiago del Estero y se recolectaron muestras (hojas) de un total de 90 plantas de sandía (Citrullus lanatus). El material presentaba síntomas de deformaciones, reducción de la lámina foliar, manchas amarillas y puntos necróticos. Esta llamativa sintomatología de daños necróticos en el tejido foliar ya mencionados para orthotospovirus en cucúrbitas (Leao et al., 2015) nos daba indicios de la presunta presencia de algún virus que se encuentre dentro de este género (Figura 1).
La observación de partículas virales se efectuó en cortes ultrafinos de tejido infectado; para ello se cortaron pequeños trozos de hojas con síntomas y se fijaron en paraformaldehido/ glutaldehido seguido de tetróxido de osmio 1 %. Para la deshidratación del tejido se empleó serie de acetona (10-100 %) y se incluyó en resina de baja viscosidad. Se realizaron cortes con ultramicrotomo y se contrastó con citrato de plomo pH12 en caja de Petri con perlas de hidróxido de sodio para evitar la precipitación de sales y luego con acetato de uranilo 2 %. Las observaciones se hicieron en microscopio electrónico de transmisión JOEL 1220 EXII.
Se realizó una prueba inmuno enzimática de doble sándwich de anticuerpo (DAS-ELISA), según Clark y Adams (1977), utilizando antisuero de amplio espectro para la detección de orthotospovirus (BIOREBA SRL Latin América, Mar del Plata, Argentina), siguiendo la metodología descripta por el fabricante. Las especies de este género se han clasificado en serogrupos utilizando anticuerpos contra la proteína nucleocápside (N). Este reactivo reconoce los serogrupos I, II y III dentro del género Orthotospovirus.
La detección específica se realizó mediante la reacción en cadena de la polimerasa previa transcripción inversa (RT-PCR). El ARN total fue extraído de hojas de plantas con síntomas mediante el protocolo de Gambino, Perrone y Gribaudo (2008) modificado. Las modificaciones realizadas fueron: en la primera extracción, la mezcla cloroformo:alcohol isoamílico se agitó vigorosamente durante 10 min hasta obtener una emulsión. En la segunda extracción con cloroformo:alcohol isoamílico se mezcló la muestra durante 5 min vigorosamente hasta obtener una emulsión y luego del agregado de ClLi se incubó la muestra a -20° C. Se usaron cebadores específicos para GRSV reportados por Boari et al. (2002). Se purificaron los productos de PCR de dos muestras con el kit Zymo (DNA clean & concentrator, Zymo Research Corp., Irvine, California, Estados Unidos) y fueron enviados para secuenciar a la Unidad de Genómica del Instituto de Biotecnología - INTA (Argentina). Las alineaciones de secuencia se realizaron utilizando Clustal W. Todos los análisis moleculares se hicieron utilizando el programa MEGA versión 7 (Kumar, Stecher y Tamura, 2016) usando el método de distancias estadística Neighbor-Joining nearest-neighbor con el modelo Tamura-Nei con G (distribución gamma, 5 categorías) y 1000 réplicas para los análisis filogenéticos. Las secuencias obtenidas fueron comparadas con 20 secuencias parciales de nucleótidos de la proteína N de GRSV publicadas en GenBank (National Center for Biotechnology Information, Bethesda, MD, USA), utilizando BLAST (Basic Local Alignment Search Tool).
RESULTADOS Y DISCUSIÓN
Los orthotospovirus causan graves daños económicos a una amplia gama de cultivos en muchas partes del mundo (Bag, Mitter, Eid y Pappu, 2012), siendo una limitación importante para la productividad y calidad (Yin et al., 2014). Síntomas como mosaicos y lesionesecróticas en las hojas, malformaciones foliares y manchas necróticas en los frutos hicieron sospechar que el cultivo de sandía (C. lanatus) podía estar infectado con GRSV, como ya fuera observado (Leao et al., 2015) y esto es una limitación para la calidad y la comercialización del producto.
Los resultados de este trabajo mostraron
del GRSV ya que se logró amplificar un fragmento del tamaño esperado (780 pb) con los iniciadores específicos para la detección de este virus (Figura 2).
Se lograron secuenciar los productos de RT- PCR y se obtuvieron las secuencias genómicas provenientes de un fragmento del gen N de dos aislamientos virales. Estas secuencias fueron publicadas en GenBank con número de acceso MK680832 y MK680833.
Las secuencias de nucleótidos y aminoácidos para el aislamiento MK680832, en comparación con otros aislamientos de GRSV depositados en GenBank, revelaron que comparten el 97,62 % de identidad de nucleótidos con un aislamiento de Brasil (MG797643) y el 98,74 % de identidad de aminoácidos con un aislamiento de Estados Unidos (YP004421857.1). El segundo aislamiento obtenido, cuyo número de acceso fue MK680833, reveló identidades de secuencia de nucleótidos de 97,36 % y de aminoácidos de 98,33 %, con el mismo aislamiento mencionado para MK680832. Las restantes relaciones de identidades para nucleótidos y aminoácidos no se muestran.
El análisis filogenético de las secuencias parciales de nucleótidos de la proteína N mostró que los dos aislamientos de GRSV provenientes de muestras de sandía de Argentina fueron agrupados con un máximo nivel de confianza (Figura 3).

Figura 1: Lesiones necróticas y mosaico en las hojas de sandía en el campo causadas por groundnut ringspot orthotospovirus (GRSV).
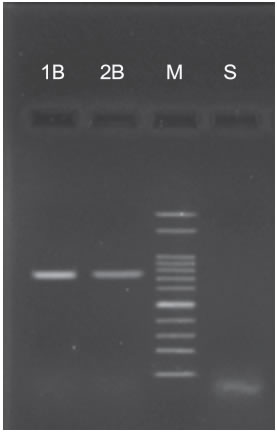
Figura 2: Corrida de electroforesis de producto de RT-PCR con cebadores específicos en gel de agarosa 2 % para groundnut ringspot orthotospovirus (GRSV). (S) Planta de cucurbita utilizada como control sano; (M) marcador de peso molecular de 100 pb (Ladder 100 pb precision, Embiotec S.R.L, Argentina); (1B y 2B) Plantas de C. lanatus (sandía) infectadas con groundnut ringspot orthotospovirus, mostrando amplificación de ragmento de 780 pb.

Figura 3: Árbol filogenético Maximun Likelihood basado en modelo Tamura-Nei construido con las secuencias rciales de nucleótidos de la proteína N de groundnut ringspot orthotospovirus (GRSV). En el árbol se observan los aislamientos de sandía argentinos (resaltados), secuencias de otros GRSV reportados (ZAF: Sudáfrica; GH: Ghana; USA: Estados Unidos; BRA: Brasil y ARG: Argentina), hospedantes de donde fueron aislados (cuando se cuenta con el mismo) y N° de acceso (1000 bootstrap).
El hallazgo de GRSV en plantas de sandía podría indicar que este patógeno está aumentando el número de huéspedes infectados en nuestro país. La presencia de reservorios que actúen como hospedantes, para posibilitar que el patógeno sobreviva cuando el cultivo no está en producción, y un insecto vector, que se alimente tanto del reservorio como del cultivo, serían factores que permitirían la expansión del virus en las producciones anuales (Webster etal., 2015).
La presencia de trips fue detectada en el campo durante el muestreo en flores de sandía, si bien no se ha llevado a cabo la identificación de estas especies, se sabe que ambas especies de trips (F. schultzei y F. occidentalis) se encuentran frecuentemente alimentándose de las partes florales y F. schultzei es una especie polifágica (Milne, Khumlekhasing y Walter, 1996) por lo que podría ser responsable de la propagación de GRSV.
En Argentina el virus fue reportado en numerosas hortalizas y también en cultivos extensivos (SINAVIMO, 2019 c). En este trabajo se demuestra su presencia en los cultivos de sandía en el país, confirmando la importancia de este virus como patógeno muy polífago que puede causar importantes pérdidas del rendimiento en diversos cultivos. En Brasil el virus fue detectado en diferentes especies de cucurbitáceas (Spadotti et al., 2014; Leao et al., 2015) lo cual permite suponer que es probable que otras especies de esta familia, cultivadas en Argentina, estén igualmente afectadas por este patógeno. Esta enfermedad podría ser una potencial amenaza para otros cultivos y nuevas áreas geográficas. Además, se considera que la aparición de las enfermedades causadas por orthotospovirus es un proceso multifactorial que incluye virus, vectores, huéspedes, medio ambiente y comportamiento humano (Yin etal., 2014).
El manejo de estas enfermedades podría considerarse fácil debido a que se transmiten de manera persistente y un adecuado control químico del vector limitaría su dispersión, pero la alta capacidad para reproducirse en las zonas agrícolas, hace que las aplicaciones no sean altamente efectivas (Michelotto et al., 2019). Además, los trips pueden adquirir orthotospovirus sólo durante los estadios larvarios, mientras que tanto las larvas en estadios más avanzados, como los adultos, son capaces de transmitirlos (Loebenstein y Lecoq, 2012). Por otro lado, se ha reportado que algunos trips disminuyen la capacidad para transmitir los virus durante el desarrollo de adultos (German, Ullman y Moyer, 1992).
Estos conocimientos son de suma utilidad, para analizar el sistema agrícola en su conjunto y tomar decisiones acertadas al momento de su manejo. Prácticas como la utilización de agroquímicos para el control total y semanal de vectores trae aparejado dos consecuencias importantes para tener en cuenta en el momento del manejo de la enfermedad: por un lado los excesivos gastos que se generan al realizar demasiadas aplicaciones, y por otro, es posible que los vectores (independientemente de la especie de que se trate) se tornen resistentes/tolerantes a los productos químicos utilizados, siendo esto una amenaza potencial para futuros controles de las virosis transmitidos por ellos. Se necesitan nuevos enfoques que integren los procesos biológicos y ecológicos en la producción de alimentos, minimicen el uso de aquellos insumos que causan daños al medio ambiente, salud de los agricultores y los consumidores (Pretty, 2008).
CONCLUSIONES
Este es el primer reporte de la presencia de GRSV en una cucurbitácea en Argentina. El virus fue detectado en plantas de sandía y a partir de su detección, el análisis de este virus fue incorporado como rutina para el cultivo.
Los primeros orthotospovirus que han sido detectados infectando cultivos de cucurbitáceas en nuestro país son el GRSV y el ZLC . El primero ha sido reportado en numerosas especies y países, mientras que el segundo sólo fue identificado en Brasil y en Argentina.
La identificación del GRSV en un nuevo hospedante (sandía) en nuestro país puede impactar sobre las estrategias de manejo en los cultivos hortícolas, debido a que este cultivo también podría estar actuando como un reservorio para la diseminación de la enfermedad. Por ello se considera de gran importancia continuar con estudios de prospección con el objeto de constatar si el virus está afectando otras de las especies de cucurbitáceas y en otras regiones del país.
Además, es necesario desarrollar estudios epidemiológicos de GRSV en sandía, ya que evaluar los riesgos de una nueva enfermedad es un punto importante para el futuro en el cultivo de cucurbitáceas.
AGRADECIMIENTOS
Este trabajo fue realizado con fondos provenientes de proyectos INTA y CONICET, quienes además pagaron el sueldo para los investigadores y el otorgamiento de becas para algunos de los autores del trabajo. Se agradece también especialmente a los productores agrícolas que facilitaron los muestreos en los lotes de producción y al personal de las EEA Santiago del Estero - INTA que colaboraron con la recolección de las muestras y recorridos por los cultivos.














