INTRODUCCION
El maíz (Zea mays L.) representa uno de los cultivos más importante de Argentina y es el principal cereal exportable (Fundación Agropecuaria para el Desarrollo de Argentina FADA, 2019). Córdoba es la provincia de mayor producción, con relación a las provincias productoras en nuestro país, alcanzando alrededor del 40 % del total nacional. Buenos Aires es la segunda provincia con el 30 % aproximadamente de participación y le sigue Santa Fe con un aporte de alrededor del 15 % (Sistema Nacional de Vigilancia y Monitoreo de Plagas SINAVIMO, 2020). Cabe aclarar que no solo se satisface el consumo nacional de alimentos, sino que, además, una mayor parte de la producción se destina al mercado internacional. Dada la importancia de la producción de dicho cultivo, se generaron, a lo largo del tiempo, diversas tecnologías que permitieron mejorar su proceso productivo, así como sus rendimientos. Entre esas tecnologías se destacan el control de malezas y la práctica de fertilización.
El control químico de malezas en cultivos extensivos avanzó significativamente alrededor del mundo, con los adelantos del desarrollo agrícola, lo que está estrechamente relacionado con la síntesis y aparición de nuevos tipos de herbicidas. Glifosato y Atrazina son los más utilizados habitualmente a campo para el cultivo de maíz en Argentina. Actualmente, a los fines de evitar la presión de selección de malezas tolerantes y/o resistentes a estos y su potencial fuga (Biset et al., 2011), se realizan controles con herbicidas complementarios, entre los que se destacan Acetoclor y Dicamba. Con base en esto, investigaciones realizadas en cultivos de maíz, trigo y sorgo indican que aplicaciones pos-emergentes de herbicidas hormonales como 2,4-D y MCPA, solos y en mezcla con atrazina, carfentrazone y acetoclor, controlan malezas de hoja ancha en un 90 % (Baghestani, et al., 2007; Lyon et al., 2007; Esqueda-Esquivel et al., 2008; Rosales-Robles et al., 2011; Kamaiah et al., 2014; Triveni et al., 2017; Jaybhaye et al., 2020).
El herbicida pre-emergente Acetoclor inhibe la división celular al ser absorbido por las plántulas durante la germinación. Es así que aquellas especies vegetales susceptibles comienzan su proceso de germinación, pero no logran emerger o lo hacen presentando hojas con notables deformidades y con una coloración predominantemente verde oscura. Por su parte, Dicamba es un herbicida post-emergente y actúa de forma homóloga a fitohormonas vegetales, como el ácido indol-acético (AIA). Su aplicación produce inhibición del crecimiento (aéreo y radicular) y respuestas fisiológicas, como el cierre de estomas, senescencia y muerte celular (Falcón y Papa, 2001).
La agricultura argentina se desarrolló inicialmente con muy bajo uso de fertilizantes por la alta fertilidad natural de los suelos y la rotación de cultivos anuales con pasturas perennes. Sin embargo, el deterioro progresivo de la capacidad de abastecimiento de nutrientes en el suelo, debido principalmente al desbalance entre la magnitud de extracción y aplicación, generó deficiencias de nitrógeno, fósforo y azufre que deben ser mitigadas para lograr altos rendimientos (Fertilizar, 2007; Asociación Maíz y Sorgo Argentino MAIZAR, 2015) . En el marco de una agricultura sustentable, se buscan alternativas ecológicas y económicas a los fertilizantes de síntesis química. Entre las alternativas, se encuentra la biofertilización basada en la aplicación de bacterias promotoras del crecimiento vegetal (PGPB, por sus siglas en inglés: Plant Growth Promoting Bacteria) que, al ser aplicadas en suelos, colonizan la rizósfera de los cultivos y dejan disponibles nutrientes que promueven su crecimiento y contribuyen a disminuir la contaminación ambiental. Estas bacterias, junto con la aplicación de fertilizantes tradicionales en los cultivos, pueden mejorar la eficiencia de absorción de los nutrientes del suelo, en la medida en que aumentan el volumen de suelo explorado y/o la tasa de absorción por unidad de raíz, como también pueden participar en la fijación biológica del nitrógeno atmosférico (Vejan et al., 2016).
Dentro del gran número de PGPB estudiadas, se encuentran las pertenecientes al género Azospirillum (Saharan y Nehra, 2011). En particular la cepa Azospirillum argentinense Az39 (ex cepa A. brasilense Az39, Dos Santos Ferreira, 2022), que es capaz de promover el crecimiento vegetal y aumentar el rendimiento y la productividad en cultivos de trigo y maíz, por lo que se recomienda su formulación para aplicarse en semillas de numerosos cereales y otros cultivos (Rodriguez Cáceres et al., 2008). Los mecanismos por los cuales dicha bacteria es capaz de promover el crecimiento vegetal se han descrito extensamente. Sin embargo, su capacidad para sobrevivir en presencia de herbicidas y degradar xenobióticos se encuentra aún escasamente explorada (Pedarza et al., 2010; Vacheron et al., 2013; Méndez Gómez et al., 2014; Costa et al., 2015; Mehnaz, 2015; Travaglia et al., 2015; Richard et al., 2018; Di Palma et al., 2020; Cardozo et al., 2022).
Con base en todos los antecedentes mencionados, el objetivo de este trabajo fue estudiar la interacción de A. argentinense Az39 con herbicidas pre y post-emergentes, tanto in vitro como en germinación y estadio vegetativo en plantas de maíz.
MATERIALES Y MÉTODOS
Diseño experimental in vitro con Azospirillum argentinense
Se realizaron pruebas in vitro de supervivencia a herbicidas de la cepa A. argentinense Az39 utilizando el medio de cultivo NFb (Dobereiner et al., 1976) que fue suplementado al comienzo del experimento con los herbicidas comerciales Acetoclor (Nufarm®) y Dicamba® (Atectra BASF), en diferentes concentraciones, desde 0,1 hasta 10 y 1,5 a 6 mL L-1, respectivamente. A continuación, se llevaron a cabo pruebas basadas en el uso de estos compuestos como fuente nutricional, adicionándolos al medio de cultivo en reemplazo de la fuente de carbono ácido málico y de la fuente de nitrógeno cloruro de amonio. A partir de esto, se seleccionó la concentración máxima de ambos herbicidas a las que la bacteria fue capaz de sobrevivir.
Todos los ensayos contaron con un tratamiento Control ( - ) (medio NFb con o sin todas sus fuentes nutricionales sin inoculación con Az39) y Control ( + ) (medio NFb con o sin todas sus fuentes nutricionales inoculado con Az39).
En ambos experimentos, se realizó un seguimiento del crecimiento por 72 h de incubación a través de recuento de células viables, mediante la técnica de la microgota (Somasegaran y Hoben, 1994), empleando como medio de cultivo NFb-Rojo Congo (Rodriguez Cáceres, 1982).
Diseño experimental en maíz
Ensayos de germinación
Se utilizaron semillas de maíz del híbrido DK7210 VT3P, debido a la importancia comercial en la región y los antecedentes en nuestro grupo de trabajo. Se determinó el porcentaje de germinación, donde se consideró germinada aquella semilla que desarrolló una plántula normal (International Seed Testing Association ISTA, 1999). Para ello, se emplearon bandejas de plástico con papel absorbente. En cada bandeja se colocaron ocho semillas y se añadieron 15 mL de agua destilada, solución de Acetoclor o solución de Dicamba, según el tratamiento correspondiente. Las dosis utilizadas de los herbicidas se seleccionaron luego de la evaluación de los ensayos in vitro, dentro de un rango en el que se determinó crecimiento bacteriano. Los tratamientos fueron los siguientes: C: Control con agua + semillas sin inocular; 39: agua + semillas inoculadas con Az39*; Ac: Acetoclor + semillas sin inocular; Ac39: Acetoclor + semillas inoculadas con Az39*; D: Dicamba + semillas sin inocular; D39: Dicamba + semillas inoculadas con Az39*.
El inóculo bacteriano se preparó utilizando la cepa de A. argentinense Az39, cultivada en medio líquido LB (Luria Broth, Sigma Chem. Co.), en un agitador (30 °C/80 rpm) durante 24 h y se empleó 3,33 pL de Az39 por semilla.
Se realizaron cuatro réplicas por tratamiento. Se incubaron en cámara de crecimiento con fotoperíodo, temperatura y humedad controladas (16 h luz - 8 h oscuridad; 29 °C; HR: 60 %). Transcurridas 72 h, se realizó un recuento de semillas germinadas por cada bandeja, y a las 96 h se midió la longitud del coleoptilo (Sixto et al., 1997) y la raíz principal (Becckie et al., 1990).
Ensayos de crecimiento vegetativo
Se emplearon ocho macetas de plástico de 300 cm3 por cada tratamiento, en las que se agregó una mezcla de tierra y vermiculita (1:1). Se colocaron dos semillas de maíz del híbrido mencionado anteriormente. Luego, se realizó un raleo dejando solo una plántula por maceta. Los tratamientos evaluados fueron los siguientes: C: Control con agua + semillas sin inocular; 39: agua + semillas inoculadas con Az39*; Ac: Acetoclor + semillas sin inocular; Ac39: Acetoclor + semillas inoculadas con Az39*; D: Dicamba + semillas sin inocular; D39: Dicamba + semillas inoculadas con Az39. Las dosis de los herbicidas fueron seleccionadas con base en los ensayos previos de germinación y se consideraron adicionalmente las dosis que se aplican habitualmente a campo, los que fueron para Dicamba de 150-200 mL ha-1 (PC 57.71 %) y para Acetoclor de 2 a 2,5 L ha-1 (teniendo en cuenta que se utilizan generalmente junto con el herbicida Atrazina. En ese caso las dosis recomendadas son de 2 L ha-1 de Acetoclor y 2 L ha-1 de Atrazina).
Para los tratamientos con Acetoclor, dicha solución acuosa se adicionó en pre-emergencia al momento de la siembra. Para los tratamientos con Dicamba, se realizó dicho riego en postemergencia, correspondiente a plantas de maíz con la segunda hoja expandida. Las plantas se incubaron en cámara de crecimiento con fotoperíodo, temperatura y humedad controladas (16 h luz - 8 h oscuridad; 29 °C; HR: 60 %).
El inóculo bacteriano se preparó en medio LB, según metodología detallada anteriormente. Y se empleó 3,33 pL de Az39, por semilla.
En el estadio vegetativo V5 (Ritchie y Hanway, 1982), aproximadamente 21 días posteriores a la siembra, se determinaron variables morfo-fisiológicas. El peso seco de parte aérea y radical se determinó por secado en estufa a 60 °C, hasta alcanzar un peso constante. El contenido de pigmentos fotosintéticos (clorofilas y carotenos totales) se determinó mediante extracción en etanol al 80 % de acuerdo con el método de Vernon y Mac Kinney (modificado por Joslyn y Mac Kinney, 1938). El daño de las membranas celulares se evaluó como la tasa de conductividad relativa (RCR) según Prásil y Zámecník (1998), utilizando la fórmula: TCR= (C1/C2) x 100.
Análisis estadísticoLos datos se analizaron mediante el software Prism Graph Pad (Prism, 2022). Se utilizó el análisis de la varianza (ANOVA), el análisis factorial y la prueba de Tuckey para las comparaciones múltiples de las medias (p < 0,05). Antes de la prueba de significancia, se corroboró la normalidad y homogeneidad de varianza utilizando las pruebas modificadas de Shapiro-Wilk y Levene, respectivamente. Si los datos no cumplían con dichos supuestos se transformaron, usando las funciones apropiadas.
RESULTADOS Y DISCUSIÓN
Capacidad de supervivencia de Azospirillum argentinense
En los ensayos in vitro, la cepa Az39 fue capaz de crecer en presencia del herbicida Acetoclor, en las dosis correspondientes a 0,1; 0,2; 0,5; 1 y 2 mL L-1, mientras que en las dosis 6 y 10 mL L-1 no se observó crecimiento bacteriano. Su máximo crecimiento en presencia de dicho herbicida fue a las 48 h de incubación, con recuentos de células viables del orden de 106 UFC mL-1, mientras que el tratamiento control alcanzó un recuento de 2,33 x 108 UFC mL-1 (Figura 1). Además, esta cepa fue capaz de crecer en presencia de todas las dosis del herbicida Dicamba, sin diferencias en el crecimiento respecto al control en las dosis de 1,5 y 2 mL L-1, alcanzando su máximo crecimiento a las 48 h de incubación, con recuentos del orden de 108 UFC mL-1. En las dosis de 3 y 6 mL L-1, se observó un crecimiento significativamente menor con respecto al control, con un recuento de células viables del orden de 106 UFC mL-1 (Figura 2).
Estos resultados remarcan la capacidad de A. argentinense Az39 para sobrevivir a la presencia de herbicidas, tanto pre como post-emergentes, utilizados en el cultivo de maíz. Teniendo en cuenta, además, que el tratamiento con 1,5 mL L-1 de Dicamba equivale a la dosis utilizada habitualmente a campo. Con relación a esto, Travaglia et al. (2015) demostraron que la cepa Az39 fue capaz de sobrevivir a la presencia del herbicida comercial Glifosato (Roundup), así como a su principio activo (sal monoamónica de N-fosforo metil glicina). Los experimentos de Cardozo et al. (2015) y Di Palma et al. (2020) demostraron que Az39 fue capaz de crecer frente a los herbicidas Glifosato y Atrazina, ampliamente utilizados en maíz; y la mayoría de los efectos negativos de ambos herbicidas en las plantas de maíz se atenuaron solo con la inoculación foliar de dicha cepa. Con respecto a esto, Di Palma et al. (2020) determinaron la capacidad de Az39 para sobrevivir a la aplicación de ambos compuestos y la utilización de Glifosato como única fuente de carbono, en los ensayos in vitro. Por lo tanto, los antecedentes con respecto a la capacidad de A. argentinense Az39 para sobrevivir a la presencia de diferentes herbicidas empleados en maíz adquieren importancia, dado al uso de esta bacteria como bio-inoculante de dicho cultivo. Especialmente, cuando es aplicado al momento de la siembra, periodo en el que estaría más expuesto a estos agroquímicos. Los resultados, además, aportan datos científicos novedosos acerca de la ausencia de toxicidad en la cepa nativa Az39 por parte de las dosis ensayadas de los herbicidas Acetoclor y Dicamba, usados como alternativos a las aplicaciones convencionales de Atrazina y Glifosato.
Figura 1: Curva de crecimiento bacteriano de Az39 frente al herbicida Acetoclor. Tratamientos: (•): Az39 en ausencia de herbicida; (¦): Az39 en presencia de 0,1 mL L-1 de Acetoclor; (?): Az39 en presencia de 0,2 mL L-1 de Acetoclor; (?): Az39 en presencia de 0.5 mL L-1 de Acetoclor; (0): Az39 en presencia de 1 mL L-1 de Acetoclor; (?): Az39 en presencia de 2 mL L-1 de Acetoclor; (a): Az39 en presencia de 6 mL L-1 de Acetoclor; (o): Az39 en presencia de 10 mL L-1 de Acetoclor.
Figura 2: Curva de crecimiento bacteriano de Az39 frente al herbicida Dicamba. Tratamientos: (•): Az39 en ausencia de herbicida; (¦): Az39 en presencia de 1,5 mL L-1 de Dicamba; (?): Az39 en presencia de 2 mL L-1 de Acetoclor; (o): Az39 en presencia de 3 mL L-1 de Dicamba (?): Az39 en presencia de 6 mL L-1 de Dicamba.
Herbicidas como fuente nutricional para el crecimiento de Azospirillum argentinenseEn un medio de cultivo sin fuente de carbono, Az39 fue capaz de sobrevivir en presencia del herbicida Dicamba (Figura 3). Esto indicaría el uso potencial de este compuesto por parte de la bacteria como única fuente carbonada. Por el contrario, Az39 no sobrevivió a la presencia de Acetoclor en un medio de cultivo sin fuente de carbono (Figura 3). Estos resultados son relevantes desde el punto de vista agro-ecológico, en la medida en que nos permiten proponer a A. argentinense Az39 como un efectivo boinoculante para la degradación de ciertos productos químicos, y sumar evidencia a la reportada en varios estudios que demostraron la degradación de Glifosato y de otros compuestos organofosforados por diferentes microorganismos del suelo (White y Metcalf, 2004; Funke et al., 2006; Bazot y Lebeau, 2008). Resultados similares fueron reportados por Di Palma et al. (2020), quienes demostraron la capacidad de Az39 para utilizar Glifosato como única fuente de carbono. Investigaciones relacionadas con herbicidas fueron también informadas por Moneke et al. (2010), utilizando bacterias de los géneros Pseudomonas, Escherichia, Azotobacter, Alcaligenes, Acetobacter como degradadores de Glifosato y otros compuestos químicos. De manera que, con estos resultados, surge la necesidad de continuar con estudios de biodegradación de Dicamba, en la medida en que, desde el punto de vista agroecológico, es muy beneficioso para el medio ambiente. Desde una perspectiva agronómica, esto podría ser contraproducente por la disminución del efecto del herbicida o, tal vez, simplemente no genere ningún impacto en el efecto de Dicamba sobre las malezas.
Figura 3: Curva de crecimiento bacteriano de Az39 frente a los herbicidas Acetoclor y Dicamba como única fuente de carbono. Tratamientos: (•): Az39 en medio NFb completo; (?): Az39 en medio NFb sin fuente de carbono; (?): Az39 en medio NFb sin fuente de carbono suplementado con 0,2 mL L-1 de Acetoclor; (o): Az39 en medio NFb sin fuente de carbono suplementado con 1,5 mL L-1de Dicamba
Figura 4: Curva de crecimiento bacteriano de Az39 frente al herbicida Acetoclor como única fuente de nitrógeno. Tratamientos: (•): Az39 en medio NFb completo; (?): Az39 en medio NFb sin fuente de nitrógeno; (?): Az39 en medio NFb sin fuente de nitrógeno suplementado con 0,2 mL L-1 de Acetoclor.
A su vez, no se evidenció crecimiento bacteriano durante el tiempo de incubación evaluado, cuando dicha cepa disponía del herbicida Acetoclor como única fuente de nitrógeno (Figura 4). Tampoco se evidenció la fase de muerte, sino que el cultivo permaneció en fase de latencia de la misma manera que en el tratamiento control ( - ). Esto permitiría descartar la posibilidad de utilización del Acetoclor como fuente de nitrógeno, y atribuir su viabilidad a la capacidad del género Azospirillum para fijar nitrógeno atmosférico, lo que sería un mecanismo demostrado por numerosos autores (Okon y Labandera-Gonzalez, 1994; Soto-Urzúa y Baca, 2001; Paredes, 2013). El uso del herbicida Dicamba como fuente de nitrógeno no se determinó, debido a que en su composición molecular no posee dicho elemento.
Germinación de semillas de maízSe observó que las semillas tratadas con Az39 sin aplicación de herbicidas evidenciaron un porcentaje de germinación significativamente mayor al tratamiento control sin inocular (10 %).
Además, los tratamientos con aplicación de herbicida disminuyeron el porcentaje de germinación, mientras que su combinación con Az39 demostró una tendencia a modificar este efecto, aunque sin evidenciar diferencia significativa (Figura 5 a). Estos resultados demuestran la capacidad de la cepa Az39 para promover la germinación, lo que concuerda con los datos obtenidos al inocular semillas de maíz con bacterias promotoras del crecimiento vegetal (Lovaisa et al., 2018). Resulta conocido que uno de los efectos de dichas bacterias es el de mejorar los procesos de germinación de semillas (Cassán y Díaz-Zorita, 2016). Esto apoya el empleo de inoculaciones a base de A. argentinense Az39, por su capacidad de promover el crecimiento vegetal de numerosos cultivos (Dobbelaere et al., 2001; 2002).
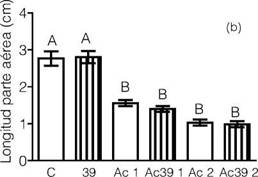
En cuanto a la longitud del coleoptile de maíz luego de 96 h de incubación, se observó que las semillas que recibieron los tratamientos con las diferentes dosis de Acetoclor mostraron un marcado descenso de la longitud del coleoptile con respecto al control. A su vez, la inoculación con Az39 no logró modificar dicho efecto negativo causado por el herbicida sobre la parte aérea de la plántula (Figura 5 b). Con respecto a la determinación de la longitud radical a las 96 h de incubación, se observó que las semillas tratadas con las diferentes dosis de Acetoclor, con y sin inoculación bacteriana, presentaron una menor longitud estadísticamente significativa con respecto al control (Figura 5 c).
Cabe mencionar que, si bien no se observan diferencias significativas a nivel de longitud radical entre semillas inoculadas y no inoculadas con Az39 (Figura 5 c), en las primeras se visualizó una mayor densidad de pelos radicales y raíces laterales (Figura 6). Con relación a esto, se conoce que dicha bacteria es capaz de promover el crecimiento de las plantas mediante la producción de auxinas, que estimulan el desarrollo de las raíces (Fukami et al., 2017; 2018). Las auxinas son importantes moduladores de la división celular. Actúan sobre la diferenciación y elongación del ápice de la raíz, el inicio y desarrollo de raíces secundarias y el desarrollo del sistema vascular (Ljung, 2013). De hecho, la inoculación con Azospirillum conduce a la promoción de raíces laterales (Akbari et al., 2007), lo que coopera con el desarrollo de la planta y aumenta la capacidad de adquirir agua y nutrientes minerales del suelo (Reece et al., 2015).
Figura 5: Porcentaje de germinación de semillas de maíz (a), longitud del coleoptile (b) y longitud radical de plántulas de maíz (c) a las 96 h de incubación. Tratamientos: C: Control; 39: Semillas de maíz inoculadas con Az39; Ac 1: Semillas de maíz tratadas con 0,1 mL L-1 de Acetoclor; Ac 2: Semillas de maíz tratadas con 0,2 mL L-1 de Acetoclor. Letras diferentes sobre cada barra indican diferencias estadísticamente significativas (p < 0,05) ? Semillas sin inocular; n Semillas inoculadas con Az39.
Figura 6: Germinación de semillas de maíz a las 96 h de incubación. Tratamientos: A: Semillas de maíz sin inocular; B: Semillas de maíz inoculadas con Az39.
Por su parte, en los ensayos con las dosis de Dicamba, utilizadas in vitro (desde 1,5 a 6 mL L-1), se observó una inhibición de la germinación y desarrollo radical. Por este motivo, se utilizaron dosis menores obteniendo respuestas en el comportamiento germinativo con las dosis de 0,2 y 0,4 mL L-1, aunque no se observaron diferencias significativas en las condiciones de inoculación (datos no mostrados).
El efecto negativo observado con la aplicación de ambos herbicidas sobre las semillas de maíz puede atribuirse a que estos compuestos se aplican generalmente en solución o suspensión acuosa, como una nube de rocío dirigida hacia el objetivo de la aplicación. En el caso de Acetoclor, la aspersión es inmediatamente después de la siembra; mientras que, para Dicamba, la aplicación se lleva a cabo cuando el cultivo presenta de 3 a 4 hojas en activo crecimiento, lo que permite un menor contacto entre las semillas de maíz con el herbicida. En este estudio, la aplicación se llevó a cabo por riego directo, lo que provocó que las semillas estuvieran en contacto directo con las soluciones de herbicidas, a diferencia de lo que ocurre por lo general, afectando así su desarrollo y crecimiento. Como lo describe Garnero (2018), al explicar el deterioro del rendimiento final en cultivos de soja y maíz debido a la fitotoxicidad que pueden causar los herbicidas sobre los cultivos.
Variables morfofisiológicas en plantas de maíz Las plantas tratadas con el herbicida Acetoclor, inoculadas y no inoculadas con Az39, mostraron un marcado descenso del peso seco de la parte aérea, con diferencia estadísticamente significativa con respecto a las plantas control. Aquellas que recibieron el tratamiento con el herbicida Dicamba presentaron valores similares al control, independientemente de la condición de inoculación. Las plantas inoculadas y no inoculadas con Az39 y tratadas con los herbicidas Acetoclor y Dicamba no presentaron diferencias estadísticamente significativas en las variables de peso seco de la parte radical, daño de membranas celulares, clorofilas totales y carotenos (Tabla 1). Con estos resultados, es evidente un efecto negativo provocado por el herbicida comercial a base de Acetoclor a nivel de biomasa en el crecimiento temprano del maíz, lo que podría deberse al sistema experimental empleado (macetas de 300 cm3 y aplicación por riego de los herbicidas) que generó una fuerte exposición de las plántulas a una gran cantidad de dicho compuesto. Con relación a esto, existen antecedentes que señalan la acumulación de herbicidas en el suelo como una problemática en los primeros estadios de cultivos de rotación tales como maíz y trigo, en donde se observan efectos adversos en el establecimiento de las plantas provocado por intoxicación (Closs y Daría, 2013).
En cuanto a la inoculación con A. argentinense, se evidenció que su presencia no fue suficiente para evitar el deterioro de las plántulas, frente al estrés generado por los herbicidas. No obstante, existen estudios que destacan esta capacidad PGPB en maíz, no solo en ensayos de laboratorio sino también a nivel de campo, tal como lo han descrito numerosos trabajos que demuestran incrementos mayores a 30 % en la producción de grano y materia seca de cultivos, entre ellos el maíz (Hamaoui et al., 2001; Dobbelaere et al., 2002; Holguín et al., 2003; Irízar et al., 2003; Aguirre-Medina, 2004). En este sentido, los resultados aquí evidenciados podrían deberse a la forma de inoculación empleada en este trabajo, en la que la densidad celular alcanzada en las semillas sería significativamente menor a lo recomendado por los productores de inoculante. Al no aplicarse solución adherente, como ocurre normalmente en la práctica, se tradujo en un efecto promotor del crecimiento vegetal solo a nivel de germinación, y no en las variables analizadas en este estudio a nivel de crecimiento temprano sobre las plantas. Por otro lado, estos resultados podrían deberse a un efecto negativo por parte de los herbicidas sobre A. argentinense Az39, como ya fue mencionado por Santos et al. (2020). En su investigación, confirmaron toxicidad por parte del plaguicida Standak ™ Top (BASF) sobre A. argentinense, y observaron un aumento de la mortalidad celular después de solo 24 h de exposición in vitro, además de un efecto negativo de este agroquímico sobre las semillas y plántulas de maíz. También, concluyeron que Azospirillum alivió dicho efecto sobre los parámetros de volumen de raíces e incidencia de pelos radicales al ser inoculada.
CONCLUSIÓN
La aplicación de A. argentinense Az39 podría constituir una práctica agrícola amigable con la agroecología. Además, puede combinarse con los herbicidas más ampliamente utilizados en los cultivos.
Para lograr una optimización de los insumos agrícolas que conlleve al incremento potencial de los rendimientos, resulta necesario considerar que las concentraciones de Az39 sean las indicadas para desempeñar sus funciones como PGPR, y las dosis de los agroquímicos sean las necesarias para cumplir con su función, sin generar un efecto fitotóxico sobre la bacteria.
Tabla 1: Peso seco (g) de parte aérea (PSPA) y radical (PSR), contenido de clorofilas totales (mg g-1 de peso fresco), contenido de carotenos (mg g-1 de peso fresco) y daño de membranas celulares (DMC %) de plantas de maíz a los 21 días post-siembra.
En las condiciones del presente estudio, comprobamos que A. argentinense Az39 fue capaz de sobrevivir in vitro a la presencia de los herbicidas pre y post-emergentes Acetoclor y Dicamba, poniendo en evidencia su capacidad promotora del crecimiento vegetal, al incrementar la tasa de germinación de las semillas de maíz. Sin embargo, en presencia de los herbicidas, la cepa no logró evitar el deterioro que generaron estos compuestos sobre las plántulas. Por esto, resulta necesario continuar con estudios para observar el comportamiento de la bacteria, las plantas de maíz y los herbicidas en distintas escalas, incluidas las condiciones naturales a campo.
Fecha de recepción: 05/10/2022
fecha de aceptación: 03/04/2023