Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet v.8 n.1 Ciudad Autónoma de Buenos Aires ene./dic. 2006
Lipoarabinomanano (LAM) de Mycobacterium spp. Respuesta inmune inducida en terneros
Jolly, A.1; Colavecchia, S.1; Jar, A.1; Fernández, E. 2; Bernardelli, A.3; Mundo S.1
1 Inmunología, Facultad de Ciencias Veterinarias, Universidad de Buenos Aires
2 Clínica de Rumiantes y cerdos. Facultad de Ciencias Veterinarias, Universidad de Buenos Aires
3 Servicio Nacional de Sanidad Animal.
Este trabajo mereció el premio Estímulo a la Investigación Científica 2005, otorgado por la Facultad de Ciencias Veterinarias, UBA
Resumen
La paratuberculosis es una enfermedad que afecta al ganado vacuno cuyo agente etiológico es el Mycobacterium avium subespecie paratuberculosis. El LAM es el principal componente antigénico de superficie de las micobacterias, y se lo considera de relevancia en la patogenia de las enfermedades que éstas causan.
Un extracto enriquecido en LAM fue obtenido a partir de un cultivo de Mycobacterium spp. y empleado para inocular terneros. Se evaluó en ellos la respuesta inmune humoral y celular inducida por la vacunación. Los resultados de este estudio demuestran que el extracto enriquecido en LAM resultó ser inmunogénico en todos los animales inoculados, obteniéndose títulos considerables de anticuerpos específicos, sin generar falsos positivos a la prueba de intradermorreacción con el derivado proteico purificado utilizado para el diagnóstico de la tuberculosis bovina. Estos hallazgos justifican continuar el trabajo en esta línea intentando finalmente establecer si el LAM es un candidato potencial para la elaboración de una vacuna a subunidades contra la paratuberculosis bovina.
Palabras clave: Ganado vacuno; Paratuberculosis; LAM; Respuesta inmune.
Summary
Paratuberculosis is a chronic enteric disease affecting cattle. The causative agent is Mycobacterium avium subspecies paratuberculosis. LAM is the main antigenic component of mycobacterial surface, and it is considered a key virulence factor involved in its pathogenicity. A LAM-enriched extract obtained from a culture of Mycobacterium spp. was prepared with incomplete Freund's adjuvant for calves inoculation. Specific antibodies response and delayed-type hypersensitivity to intradermal injection of purified protein derivative antigen (PPD) from Mycobacterium bovis were then evaluated in inoculated animals. Our results demonstrate that anti-LAM antibodies can be successfully obtained in calves immunized with LAM-enriched extract, without generating cross-reaction with PPD of M. bovis. This work could represent the initial step in order to determine the relevance of LAM as a potential candidate for elaborating a subunit vaccine against bovine paratuberculosis.
Key words: Cattle; Paratuberculosis; LAM; Immune response.
INTRODUCCION
La paratuberculosis, causada por Mycobacterium avium subsp. paratuberculosis (Map), se caracteriza por producir una enteritis granulomatosa crónica en rumiantes10.
El LAM, de naturaleza glicolipídica, es el principal componente antigénico de superficie de las micobacterias y se lo considera capaz de ejercer un efecto inmunomodulador sobre componentes de la respuesta inmune14. Esto establece su importancia en la patogenia de las enfermedades micobacterianas. El patrón estructural de este compuesto se mantiene conservado en las diferentes especies del género, existiendo grados variables de antigenicidad cruzada entre los LAMs de micobacterias distintas6, 13.
Si bien durante mucho tiempo se consideró que la inmunidad celular predominaba en los estadios tempranos de la enfermedad y que recién en estadios avanzados era detectable una respuesta humoral aunque no protectiva1,15, hoy esta teoría es controvertida y se enuncia que ciertos anticuerpos (como los específicos contra LAM) pueden tener un efecto protector tanto en esta como en otras enfermedades micobacterianas8, 9, 11, 16.
En este contexto, se plantean como objetivos de este trabajo la obtención de un extracto glicolipídico enriquecido en LAM, a partir del soma total de M. avium subsp. avium (Maa) y la evaluación de la respuesta inmune desarrollada en terneros luego de la inmunización con dicho extracto. Este trabajo constituye el primer paso en el intento de establecer si los anticuerpos específicos generados pueden influenciar el curso de la infección en bovinos.
MATERIALES Y MÉTODOS
Obtención del extracto glicolipídico enriquecido en LAM
El LAM se obtuvo a partir del cultivo de Maa (cepa R4) en Medio Dorset-Herley a 37ºC durante 3 meses. El cultivo se inactivó luego utilizando vapor fluente. Para la posterior extracción de LAM se empleó el protocolo propuesto por Hamasur y col. (1999)7. Como resultado del procedimiento se obtuvieron dos extractos, uno conteniendo Maa sonicadas (extracto S) y otro final, conteniendo LAM (extracto L).
Caracterización de los extractos obtenidos
La cuantificación de hidratos de carbono y proteínas de ambos extractos se evaluó mediante los métodos de fenol - ácido sulfúrico4 y de Bradford3 respectivamente.
La composición de las fracciones se analizó por electroforesis (SDS-PAGE) en geles de poliacrilamida al 10%. Las condiciones de corrida fueron: 2 hs. a 100 V. Luego de la fijación de los geles, se recurrió a la tinción azul de Coomasie para la identificación de proteínas y a la tinción argéntica modificada para la identificación de hidratos de carbono5. Como LAM testigo se incluyó en nuestros experimentos el extracto de LAM de M. tuberculosis, gentilmente cedido por el Dr. J. Belisle, Universidad de Colorado, Fort Collins, CO, USA.
La caracterización antigénica se realizó mediante un Enzimoinmunoensayo (ELISA) empleando un anticuerpo monoclonal anti-LAM de M. tuberculosis (Mab cs-40, anti-ErdLAM, gentilmente cedido por el Dr. J. Belisle, Universidad de Colorado, Fort Collins, CO, USA). Brevemente, se sensibilizó una placa de 96 hoyos con los distintos extractos (S y L) a una concentración de 13 mg/ml de hidratos de carbono en buffer carbonato 0,05M pH 9,6; durante 16 horas a temperatura ambiente. El LAM de M. tuberculosis se utilizó como control positivo. Luego de los lavados y el bloqueo con PBS-leche descremada al 10%, el Mab cs-40 se agregó en una dilución 1/250 y se incubó 1h a 37°C. El sistema de revelado empleado fue un anticuerpo antiinmunoglobulinas de ratón conjugado con peroxidasa (KPL), a una dilución de 1/500, usando ortofenildietilamina (OPD) como sustrato (1mg/ml en buffer citrato-fosfato).
Inmunización de terneros
Se trabajó con un grupo de 9 terneros mestizos (machos y hembras) de aproximadamente 3 meses de edad al momento de la primera inmunización. Estos animales provenían de un rodeo libre de tuberculosis y paratuberculosis y se mantuvieron durante todo el experimento bajo iguales condiciones ambientales y de manejo en el establecimiento Los Patricios, perteneciente a la Universidad de Buenos Aires.
Los animales se dividieron en 3 grupos de 3 individuos cada uno designados al azar: grupo S, inmunizado con Maa sonicadas (extracto S); grupo L, inmunizado con extracto enriquecido en LAM (extracto L); grupo control: no inmunizado. Cada ternero recibió 2 dosis de 2 mg de hidratos de carbono del antígeno formulado en suspensión con PBS y emulsionado con adyuvante de Freund incompleto por vía subcutánea en la tabla del cuello, al día 0 y al día 35. Se extrajeron muestras de sangre a los días 0 y 60. Todos los animales empleados en este experimento fueron manejados respetando los principios de bioética vigentes en la Facultad de Ciencias Veterinarias de la Universidad de Buenos Aires.
Evaluación de la respuesta inmune humoral frente a LAM por ELISA
Se utilizaron placas de 96 hoyos sensibilizadas con el extracto L, siguiendo la metodología descripta previamente. Los sueros de los terneros se evaluaron en diluciones 1/ 50, 1/250 y 1/1000. El sistema de revelado empleado fue un anticuerpo antiinmunoglobulinas bovinas conjugado con peroxidasa (KPL) en una dilución 1/300. Para la interpretación de los valores obtenidos se calculó el valor de corte para cada dilución como la densidad óptica promedio del grupo control más 2 desvíos estándares.
Detección de hipersensibilidad celular frente a Mycobacterium bovis
Con el propósito de evaluar si los extractos inoculados producen hipersensibilidad frente a M. bovis, todos los animales empleados en el experimento fueron sometidos a intradermorreacción con el Derivado Proteico Purificado (PPD) de dicho patógeno. La prueba se llevó a cabo el día 60. Siguiendo las condiciones estandarizadas por el SENASA, se inoculó 0,1ml de tuberculina bovina (concentración 1mg/ml) en el pliegue ano-caudal interno, midiendo el grosor del mismo con un calibre en forma previa a la inoculación y 72 h después. Se consideró como animal reactivo a aquél con un aumento del grosor de 3 mm o más entre la primera y la segunda medición.
RESULTADOS
Rendimiento y caracterización de los extractos obtenidos
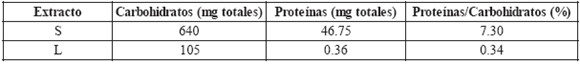
A partir del procesamiento de 5 g de extracto húmedo de bacterias se obtuvieron 105 mg totales de hidratos de carbono en la fracción L. Mediante este procedimiento se logró unadisminución del contenido en proteínas del 95.3% (Tabla 1).
Tabla 1. Rendimiento de la extracción de hidratos de carbono de los extractos de M. avium subsp. avium.
La composición de los extractos obtenidos se muestra en el SDS-PAGE de la Figura 1. La banda de mayor concentración observada en la calle 2 coincide con el patrón de migración del LAM testigo. Otras bandas visualizadas en esta calle pueden corresponder a la presencia de lipomananos y manósidos de fosfatidilinositol, según Hamasur y col. (1999)7.
Una réplica de este gel se tiñó con colorante Azul de Coomassie sin que se pudiesen detectar trazas proteicas (resultado no mostrado).
Los resultados de las pruebas de ELISA empleando un anticuerpo monoclonal anti-LAM permitieron confirmar la presencia de LAM tanto en el extracto L como en el S (Tabla 2).
Tabla 2. Identificación por ELISA del LAM presente en los extractos de M. avium subsp. avium.


Figura 1. Composición en hidratos de carbono del extracto L.
SDS-PAGE al 10% revelado con tinción argéntica modificada para hidratos de carbono.
Calle1: LAM de M. tuberculosis testigo; Calle 2: extracto L de M. avium subsp. avium.
Respuesta inmune en terneros
Los terneros inmunizados con los extractos S y L presentaron títulos de anticuerpos específicos frente a LAM superiores a 103 evaluados por ELISA. La evaluación de la inmunidad celular por intradermoreacción frente a PPD sólo pudo ser detectada en el grupo S (Tabla 3).
Tabla 3. Evaluación de la respuesta inmune inducida en terneros por la vacunación con LAM

ª Los valores se encuentran expresados como el valor promedio de densidad óptica ± desvío estándar, obtenidos por ELISA especifico a LAM. * p d» 0,05, evaluado mediante la prueba t de Student para muestras apareadas.
DISCUSIÓN
La obtención de LAM como antígeno de micobacterias para evaluar la respuesta inmune frente a paratuberculosis se realizó a partir de Mycobacterium avium subsp. avium. La utilización del Maa se fundamentó en que existe un alto grado de homología genómica entre ambos patógenos y el Maa posee una mayor velocidad de crecimiento in vitro comparado con el Map2. El procedimiento empleado para la extracción de LAM permitió obtener rendimientos comparables a los publicados por Hamasur y col. (1999)7.
Los resultados de la cuantificación de proteínas muestran una reducción considerable de las mismas en el extracto L. Estos resultados son congruentes con la ausencia de detección de hipersensibilidad celular frente al extracto proteico purificado (PPD) de M. bovis en los animales inmunizados con el LAM.
Las vacunas actualmente disponibles contra la paratuberculosis reducen el impacto de la enfermedad, pero no producen una inmunidad protectora en el 100% de la población y son potencialmente inductoras de hipersensibilidad celular frente a M. bovis12. En Argentina, donde la tuberculosis presenta una alta prevalencia en el ganado bovino, se impone la necesidad de implementar medidas preventivas contra la paratuberculosis que no interfieran con los métodos empleados de rutina para el diagnóstico y control de la tuberculosis bovina. Los resultados obtenidos en este trabajo demuestran que la inmunización con LAM induce una respuesta humoral específica sin desencadenar una reacción de hipersensibilidad frente a PPD bovina, fenómeno en el que se basa el diagnóstico de la tuberculosis.
Resta analizar el potencial de estos anticuerpos en la prevención de la infección, en el camino de establecer si es el LAM un candidato posible para la formulación de una vacuna a subunidades efectiva contra la paratuberculosis bovina.
CONCLUSIONES
El procedimiento empleado para la extracción de LAM permitió concentrar la cantidad de hidratos de carbono, reduciendo considerablemente el porcentaje de proteínas. La identidad antigénica del extracto L fue confirmada empleando un anticuerpo monoclonal anti-LAM. Todos los terneros vacunados con el extracto L desarrollaron anticuerpos específicos contra LAM en títulos superiores a 103 detectados por ELISA, mientras que en ninguno se detectó reactividad frente a PPD in vivo.
1. ALZUHERRI, H.M.; CLARKE, C.J.; WODALL C.J.; LITTLE D. -Host response to Mycobacterium avium / paratuberculosis infections. Proceedings of the 4th International Colloquium on Paratuberculosis. Cambridge, INGLATERRA, 1994, pág. 345-54. [ Links ]
2. BANNANTINE, J.P.; ZHANG, Q; LI, L.L.; KAPUR, V. 2003. Genomic homogeneity between Mycobacterium avium subsp. avium and Mycobacterium avium subsp. paratuberculosis belies their divergent growth rates. BMC Microbiol 3:10. [ Links ]
3. BRADFORD, M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal biochem 72: 248-54. [ Links ]
4. DUBOIS, M.; GILLES, K.; HAMILTON, J.K.; REBERS, P.A.; SMITH, F. 1951. Colorimetric method for the determination of sugars. Nature 168(4265): 167. [ Links ]
5. FOMSGAARD, A.; FREUDENBERG, M.A.; GALANOS, C. 1990. Modification of the silver staining technique to detect lipopolysaccharide in polyacrylamide gels. J Clin Microbiol 28(12): 262731. [ Links ]
6. GLATMAN-FREEDMAN, A.; MARTUM, J.M.; RISKA, P.F.; BLOOM, B.R.; CASADEVALL, A. 1996. Monoclonal antibodies to surface antigens of Mycobacterium tuberculosis and their use in a modified Enzyme-Linked Immunoabsorbent Spot Assay for detection of Mycobacteria. J Clin Microbiol 34(11): 2795-802. [ Links ]
7. HAMASUR, B.; KALLENIUS, G.; SVENSON, S.B. 1999. A new rapid and simple method for large-scale purification of mycobacterial lipoarabinomannan. Immunol And Med Microbiol 24(1):11-7. [ Links ]
8. HAMASUR, B.; HAILE, M.; PAWLOWSKI, A.; SCHRÖDER, U.; WILLIAMS, A.; HATCH, G.; HALL, G.; MARSH, P.; KALLENIUS, G.; SVENSON, S.B. 2003. Mycobacterium tuberculosis arabinomannan-protein conjugates protect against tuberculosis. Vaccine 21(25-26): 4081-93. [ Links ]
9. HAMASUR, B.; HAILE, M.; PAWLOWSKI, A.; SCHRÖDER, U.; KALLENIUS G.; SVENSON, S.B. 2004. A mycobacterial lipoarabinomannan specific monoclonal antibody and its F(ab')2 fragment prolong survival of mice infected with Mycobacterium tuberculosis. Clin Exp Immunol 138: 30-8. [ Links ]
10. HARRIS, N.B.; BARLETTA, R.G. 2001. Mycobaterium avium subsp. paratuberculosis in Veterinary Medicine. Clin Microbio. Rev 14(3): 489512. [ Links ]
11. HOSTETTER, J.; KAGAN, R.; STEADHAM, E.2005. Opsonization effects on Mycobacterium avium subsp. paratuberculosis-macrophage interactions. Clin Diagn Lab Immunol 12(6):.793-6. [ Links ]
12. KALIS, C.H.J.; BARKEMA, H.W.; HESSELINK, J.W. Herd certification for paratuberculosis inunsuspected dairy herds using cultures of strategically pooled faecal samples Proceedings of the 6th International Colloquium on Paratuberculosis. Melbourne, AUSTRALIA, 1999. [ Links ]
13. MUTHARIA, L.M.; MORENO, W.; RAYMOND, M. 1997. Analysis of culture filtrate and cel wall-associated antigens of Mycobacterium paratuberculosis with monoclonal antibodies. Infect Immun 65(2): 387-94. [ Links ]
14. NIGOU, J.; GILLERON, M.; PUZO, G. 2003. Lipoarabinomannans: from structure to biosinthesis. Biochimie 85(1-2): 153-66. [ Links ]
15. SIGURDARDOTTIR, O.G.; PRESS, C.M.; SAHEGAARD, F.; EVENSEN, O. 1999. Bacterial isolation, immunological response, and histopathological lesions during the early subclinical phase of experimental infection of goat kids with Mycobacterium avium subsp. paratuberculosis. Vet Pathol 36(6): 542-50. [ Links ]
16. VALLIERE, S.; ABATE, G.; BLAZEVIC, A; HEUERTZ, R.M.; HOFT, D.F. 2005. Enhancement of innate and cell-mediated immunity by antimycobacterial antibodies. Infect Immun 73(10): 6711-20. [ Links ]














