Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet v.8 n.1 Ciudad Autónoma de Buenos Aires ene./dic. 2006
Acción del veneno de Bothrops jararacussu de Argentina sobre la coagulación sanguínea
Maruñak, S.L.1; Ruíz de Torrent, R.M.2; Teibler, G.P.2; Gay, C.C.3; Leiva, L. 3; Acosta de Pérez, O.2.
1 Departamento Ciencias Básicas. Facultad de Ciencias Veterinarias- UNNE.
2 Departamento Clínicas. Facultad de Ciencias Veterinarias- UNNE. Sargento Cabral 2139. 3400 Corrientes,
Argentina. Tel. 03783-420289. E-mail patmed@vet.unne.edu.ar
3 Departamento de Bioquímica. Facultad de Ciencias Exactas y Naturales y Agrimensura- UNNE. Avda.
Libertad 5400. 3400 Corrientes, Argentina.
Recibido: junio 2005 - Aceptado: diciembre 2005 - Versión on line: diciembre 2005
Resumen
La intoxicación por mordeduras de serpientes del género Bothrops (yarará) de Argentina se caracteriza por causar efectos locales y sistémicos. Entre los sistémicos pueden generar alteraciones en la coagulación de la sangre, hemorragias, shock, insuficiencia renal. En este trabajo se estudiaron los efectos que causa el veneno de Bothrops jararacussu de Misiones, Argentina, sobre la coagulación de la sangre. Se utilizaron métodos in vitro e in vivo para evaluar la actividad coagulante, fibrinolítica y defibrinante, como así también la capacidad de degradar el fibrinógeno y la letalidad del veneno. El veneno mostró ser α-fibrinogenolítico y los resultados para las actividades ensayadas fueron: concentración coagulante mínima (CCM) 18,5 μg/ml, concentración fibrinolítica mínima (CFM) 9,5 mg/ml, dosis defibrinante mínima (DDM) 1,56 μg, DL50 43,52 μg/ratón, los que difieren de los obtenidos para otras especies de Bothrops e incluso dentro de la misma especie, pero distribuídas en otras regiones sudamericanas. Se concluye que el veneno de B. jararacussu de Argentina afecta marcadamente el sistema hemostático, y que las actividades coagulantes y anticoagulantes exhibidas por esta secreción probablemente influyan en la letalidad del veneno, dado que contribuirían a la aparición de hemorragias que, de ser severas, conducen a fallo renal y muerte de la víctima.
Palabras clave: Bothrops jararacussu; Actividad coagulante; Fibrinolítica; Defibrinante; DL50.
Activity of the venom of Bothrops jararacussu of Argentina on blood coagulation
Summary
The envenomation by snakes of the genus Bothrops of Argentina causes local and systemic signs. Among the systemic damages, bothropic venoms induce a wide variety of effects on blood coagulation, haemorrhage, shock and renal failure. In this paper the effects of Bothrops jararacussu venom from Argentina on the hemostatic system were determined. In order to estimate blood-clotting, fibrinolytic and defibrinating activities of the venom, in vitro and in vivo tests were employed. The ability to degrade fibrinogen and the lethal dosis (DL50) also were determined. The B. jararacussu venom appears to be fibrinogenolytic and the values obtained for assayed activities were minimum blood-clotting concentration 18,5 μg/ml, minimum fibrinolytic dose 9,5 mg/ml, minimum defibrinating dose 1,56 μg, LD50 43,52 μg/mouse. These results differ from those obtained for other species of genus Bothrops, or from the same species that inhabits in different South American regions. It is concluded that Bothrops jararacussu venom from Argentina largely affects blood coagulation system, and that the procoagulant and anticoagulant activities exhibited by this secretion may contribute to the lethality of the venom, since they could promote hemorrhages which could lead to renal failure and death of the victim in severe envenomation.
Key words: Bothrops jararacussu; Blood-clotting activity; Fibrinolytic; Defibrinating; Lethal dosis DL50.
INTRODUCCIÓN
La República Argentina cuenta con varias especies de ofidios venenosos, entre ellos Bothrops jararacussu que se distribuye en el noreste del país, más específicamente, en la provincia de Misiones6.
Estos animales poseen, desde el momento del nacimiento, una secreción salival que consiste en una mezcla compleja de sustancias, compuesta por una serie de enzimas y toxinas utilizada para la captura de la presa y digestión de la misma. Dicha secreción también es utilizada por el ofidio, para defenderse mordiendo ocasionalmente al hombre o animales en cuyo caso se produce el envenenamiento; el veneno afecta a los tejidos circundantes, además, por su distribución sanguínea y linfática, causa efectos tóxicos sistémicos.
Los venenos de serpientes de la familia Crotalinae pueden inducir a una variedad de alteraciones sobre la coagulación sanguínea, por contener componentes procoagulantes y anticoagulantes1, 28. Algunos venenos promueven la coagulación sanguínea por sus proteinasas tipo trombina, otros poseen activador de factor X y/o activadores de protrombina7. Por otro lado, los venenos de serpientes del género Bothrops (yarará) poseen actividades específicas tales como fibrinolítica y fibrino(geno)lítica28. Con frecuencia los envenenamientos causados por yarará afectan la hemostasia e inducen a un síndrome de defibrinación, que constituye una característica importante, entre los efectos sistémicos, causados por estos venenos 22.
La especie B. jararacussu, además de encontrarse en la región noreste de Argentina, está ampliamente distribuida en Sudamérica, abarcando sur de Bolivia, norte de Paraguay y centro y Sur de Brasil 18. Numerosos estudios acerca de las actividades tóxicas de su veneno 3, 10, 19, 23, como así también sobre el asilamiento de sus componentes 4, 5, 17, han sido realizados a partir de ejemplares que habitan regiones brasileñas, especialmente, del estado de San Pablo. Sin embargo poco es lo que se conoce acerca de la toxicidad del veneno de especimenes de la región nordeste de Argentina. Dado que ha sido demostrada la existencia de variaciones en la composición del veneno con la distribución geográfica, aún dentro de una misma especie 8, 13, es necesario estudiar el comportamiento del veneno en nuestra región. Por ello, en este trabajo se propone caracterizar aspectos tóxicos, relacionados con la letalidad y la coagulación sanguínea, del veneno de B. jararacussu que habita la provincia de Misiones.
MATERIALES Y MÉTODOS
Veneno
Un pool de veneno perteneciente a serpientes Bothrops jararacussu, fue cedido por el Museo de Ciencias Naturales e Histórico dependiente del Instituto Superior del Profesorado Antonio Ruiz de Montoya, Misiones (Argentina). Los animales medían entre 1,20 a 1,80 m, considerados adultos, sanos por no manifestar anormalidades en la muda de piel, además de alimentarse normalmente, todos ellos de la región noreste de Argentina.
Se lo extrajo, previa anestesia de los animales con dióxido de carbono, por compresión manual de las glándulas de veneno, en recipiente de vidrio esterilizado. La secreción fue luego liofilizada, con Liofilizador Alpha 1-4 LD2 CHRIST. Antes de ser utilizada, la secreción fue disuelta en solución salina buffer fosfato, pH 7.2.
Animales
Se utilizaron ratones blancos de la Cepa CF1 (18 a 20g de peso corporal) suministrados por el «Bioterio de la Facultad de Ciencias Veterinarias», Universidad Nacional del Nordeste (UNNE) (Corrientes, Argentina). Los animales fueron alimentados con dieta para ratones y con acceso constante al agua. La temperatura del bioterio fue de 23 ± 2º C y la humedad relativa entre 35 y 65%. Se utilizaron entre cuatro y seis animales por grupo, según las experiencias que se realizaron.
Actividad coagulante
Se utilizó el método de Theakston and Red (1983)28 modificado por Gené et al., 198912. Se obtuvo sangre de la vena yugular de carnero con citrato de sodio al 1% como anticoagulante. Se prepararon diferentes diluciones de veneno utilizando solución salina buffer fosfato (pH 7.2) para la dilución. Para la determinación de la actividad se utilizó una solución madre de veneno de 500 μg/ml y se efectuaron las siguientes diluciones 125, 62.5, 31.25, 15.62 y 7.81 μg/ml, de cada dilución se tomó 100 μl al que se agregaron, 200 μl del plasma de ovino previamente incubado a 37ºC, luego el tiempo de coagulación fue controlado con cronómetro. Cada determinación fue realizada por triplicado. Las concentraciones de veneno fueron relacionadas con el tiempo de coagulación para estimar la actividad. La concentración coagulante mínima (CCM) es definida como la concentración final de veneno (μg/ml) que induce a coagulación del plasma en 60 segundos en las condiciones descriptas.
Actividad defibrinante
El método usado fue descrito por Theakston and Reid (1983)28, con algunas modificaciones. Grupos de cuatro ratones (2025 g de peso corporal) fueron inyectados por vía intravenosa, se utilizó una solución madre de veneno de 500 μg/ml, seleccionándose las siguientes diluciones de veneno 2.5, 1.25, 0.62 y 0.31 μg/ml. Una hora después de la inyección del veneno, los animales fueron anestesiados con hidrato de cloral (300 mg/kg) administrado por vía intraperitoneal para extraer sangre de la vena cava posterior, la sangre colectada en tubos fue mantenida a temperatura ambiente (20 ± 2ºC) durante dos horas. La dosis defibrinante mínima (DDM) fue definida como la cantidad de veneno que inhibe la coagulación de la sangre en cuatro ratones.
Actividad fibrinolítica
Sangre de carnero citratada fue diluída en relación 1:2 con buffer conteniendo Tris 50 mM; (NH4)2SO4 70 mM; NaCl 90 mM; CaCl2 1,7 mM; MgCl2 0,70 mM pH 7.5. Se efectuó una solución madre de veneno de 20 mg/ml, utilizándose las siguientes diluciones 20, 10, 5 y 2.5 mg/ml. Veintidos mililitros fueron transferidos a recipientes plásticos (13 por 8 cm) y 3.0 ml de CaCl2 0.25 M se agregaron para producir la coagulación. Se incubó a 37º C durante 60 minutos, luego se efectuaron perforaciones de 2 mm en el coágulo y se agregaron 10 μl de las soluciones de veneno en cada hoyo. Se incubó luego a 37ºC durante 18 horas para medir el diámetro del halo de fibrinólisis causada por las distintas diluciones del veneno. La concentración fibrinolítica mínima (CFM) es la concentración de veneno (mg/ml) que causa un halo de fibrinólisis de 12 mm de diámetro. Método de Gené et al., (1989) 12
Clivaje específico de fibrinógeno
La capacidad del veneno de B. jararacussu de degradar el fibrinógeno fue ensayada por electroforesis en un gel 12% de poliacrilamida en presencia de dodecil sulfato de sodio (SDSPAGE) según el método descripto por Laemmli (1970)16 con algunas modificaciones. Cien microlitros de una solución 5 mg/ml de fibrinógeno humano (tipo I) en buffer Tris-HCl 0.1 M pH 8.0, conteniendo CaCl2 0.5 mM y NaN3 0.02%, fueron incubados con 100 μl de veneno (250 μg/ml del buffer mencionado). A diferentes intervalos de tiempo se extrajeron alícuotas de 30 μl de la mezcla de reacción, las que fueron desnaturalizadas y reducidas hirviéndolas durante 5 minutos con una solución desnaturalizante (5% urea, 4% SDS y 1% 2mercaptoethanol en 35 mM PBS, pH 7.0). Las muestras tratadas fueron corridas en el gel durante 1 hora a 40mA, el que luego fue teñido con azul Coomasie R-250. Los marcadores de peso molecular (Sigma) utilizados fueron: albúmina bovina (66 kDa), ovoalbúmina (45 kDa), gliceraldehído-3-fosfato deshidrogenasa (36 kDa), anhidrasa carbónica (29 kDa), tripsinógeno (24 kDa) e inhibidor de tripsina (20 kDa).
Actividad letal
La capacidad letal fue determinada en ratones blancos de la Cepa CF1 (18-20g de peso corporal), utilizando seis animales por dosis. Se utilizó una solución madre de veneno de 5000 μg/5 ml de PBS, administrándose los siguientes μg totales de veneno 20, 26.7, 35.6, 47.4, 63.2 y 84.3 por vía intraperitoneal vehiculizado en 0.5 ml de solución salina (buffer fosfato, PBS).La respuesta vida-muerte fue controlada hasta las 48 horas y la Dosis Letal 50% (DL50) fue calculada por el método Sperman-Karber, recomendado por la OMS (1981)27.
Estadística
Para el análisis estadístico se utilizó el programa Statistics 4.5 (statsoft Inc.USA). Todos los experimentos fueron realizados por triplicado. La concentración de proteína que causa coagulación del plasma en 60 segundos, actividad fibrinolítica y defibrinante fueron estimadas por regresión lineal, ajustado por el método del mínimo cuadrado.
RESULTADOS
El veneno de B. jararacussu de Misiones, Argentina, exhibió actividades tóxicas capaces de afectar a la coagulación sanguínea. Indujo a coagulación del plasma ovino y defibrinación en ratones, a la vez mostró actividad fibrinolítica y fibrinogenolítica in vitro. La letalidad de esta secreción fue elevada.
Actividad coagulante
El veneno posee actividad coagulante in vitro, causó coagulación del plasma de carnero, cuando fueron confrontadas las distintas dosis ensayadas. La respuesta fue proporcional (r = 0,998) al logaritmo de la dosis de veneno de cada dilución utilizada (Figura 1). La dosis coagulante mínima obtenida fue de 18.5 ± 1.5 g/ml.
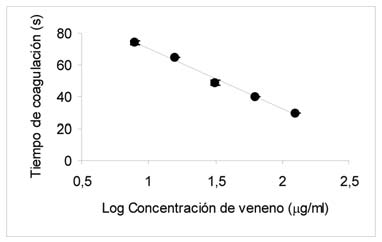
Figura 1: Actividad coagulante del veneno de B. jararacussu de Argentina, confrontado con suero de ovino. Curva dosis-respuesta, los resultados son presentados como media ± DS (n=3).
Actividad Fibrinolítica
El veneno de la serpiente B. jararacussu también exhibió actividad fibrinolítica cuando se enfrentó a un coágulo de fibrina. Los diámetros de los halos de fibrinólisis fueron proporcionales al logaritmo de las dosis de veneno utilizadas (Figura 2). La regresión lineal obtenida (r= 0.988) permitió determinar la concentración fibrinolítica mínima, con un valor de 9,5 mg/ml.
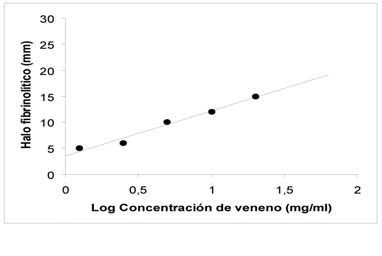
Figura 2: Actividad fibrinolítica del veneno de B. jararacussu de Argentina. Curva dosisrespuesta, 18 horas después de la incubación a 37ºC. Cada punto representa la media de tres determinaciones, correspondientes al halo de fibrinólisis causado por las distintas dosis de veneno utilizadas.
Actividad Defibrinante
El veneno de B. jararacussu de Argentina mostró actividad defibrinante, y la menor cantidad de veneno que indujo a incoagulabilidad sanguínea de los ratones fue 1.56 mg. El rango de dosis utilizadas en la experiencia fue de 0.31mg a 2.5mg.
Clivaje específico de fibrinógeno
El fibrinógeno humano fue degradado por el veneno de B. jararacussu (Figura 3). Esta secreción rápidamente digirió la cadena Aαmientras que las cadenas β y la γ permanecieron intactas aún luego de 1 hora de incubación.
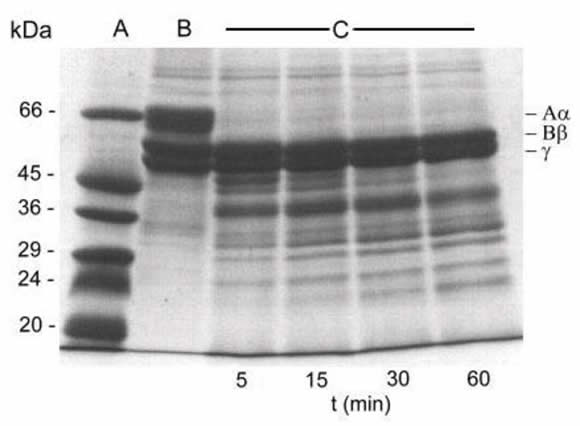
Figura 3: Análisis por SDS-PAGE del clivaje específico de fibrinógeno humano producido por el veneno de B. jararacussu. Línea A: marcadores de peso molecular. Línea B: fibrinógeno humano control, incubado a 37 ºC durante 1 h sin veneno. Las cadenas de fibrinógeno: Aα- (63 kDa), Bβ- (56 kDa) y γ (47 kDa) se indican a la derecha de la imagen. Líneas C: muestras de fibrinógeno incubadas a 37 ºC con veneno de B. jararacussu durante 5, 15, 30 y 60 min respectivamente.
Actividad Letal
La DL50 obtenida para el veneno de B. jararacussu de Argentina fue de 43.52 mg para 20g de ratón, equivalente a la cantidad de veneno que causó la muerte del 50% de los animales en 48 horas.
DISCUSIÓN
El veneno de B. jararacussu que habita el nordeste argentino, posee varias actividades tóxicas que afectan a la coagulación de la sangre. Entre tales actividades, la coagulación del plasma implica consumo de fibrinógeno, lo cual puede predisponer a hemorragias en víctimas intoxicadas por mordedura de esta serpiente, las que pueden ser severas e incluso poner en peligro la vida del paciente. Varios trabajos relacionados con mordedura de serpientes del género Bothrops han sido publicados en este sentido 15,20,24.
Es posible que este efecto pro-coagulante, por acción de enzimas del tipo trombina, sea una de las causas de la defibrinación en el paciente intoxicado. Las enzimas fueron aisladas de venenos botrópicos de especimenes de Costa Rica 14 y Brasil 26, las que inducen a incoagulabilidad sanguínea, como también se demuestra en este trabajo, al provocar defibrinación de la sangre en los ratones. El valor de la DDM obtenido para B. jararacussu de Argentina (1,56 μg), es mucho menor respecto a las serpientes del mismo género y especie que habitan la región central de Brasil (29 μg), por lo tanto es posible que menor cantidad de veneno de la serpiente de Argentina induzca a efectos más severos sobre la coagulación de la sangre, respecto a las causadas por el veneno de serpientes del vecino país. Por otro lado, nuestros resultados comparados con los obtenidos de veneno de serpientes de Centro América, demuestran que algunas especies como B. schigellii y B. godmani, poseen actividades semejantes a las de Brasil en tanto que B. asper es más activa (5μg) (Tabla 1).
Tabla 1: Actividad defibrinante y fibrinolítica de venenos de serpientes de Costa Rica (CR), Brasil (B) y Argentina (A)
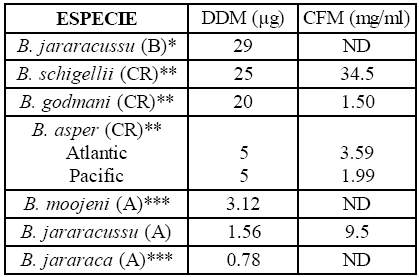
* Sánchez et al., 1992 23 , ** Gené et al., 1989 12 , *** Resultados no publicados, ND: no determinado.
La actividad defibrinante de los venenos de serpientes de Argentina (Tabla 1) no muestran grandes variaciones entre ellos, pequeñas cantidades provocan el efecto, sin embargo veneno de serpientes de la misma especie, en regiones más cálidas (Centro América) son menos activas, al inducir a defibrinación con dosis más altas. Estos resultados demuestran la adaptación de los venenos ofídicos a las regiones geográficas que habitan estos animales12.
Por otro lado el veneno de B. jararacussu mostró ser α-fibrinogenolítico, al perder el fibrinógeno parte de su estructura proteica se torna incoagulable a la trombina y ha de contribuir con la coagulopatía, al sumarse el efecto pro-coagulante de las enzimas tipo trombina con la pérdida estructural antes mencionada, potenciación que se demuestra en este trabajo en los animales inoculados con el veneno y a través del método SDS-PAGE. Asimismo, otros componentes de venenos de serpientes de Bothrops alternatus, son las hemorraginas (metaloproteinasas) que hidrolisan las cadenas α y β del fibrinógeno sin afectar la cadena δ (Gay et al., 2005)11.
La acción del veneno sobre la fibrina, resultó ser sensiblemente menor que la actividad fibrinolítica inducida por la mayoría de venenos de serpientes centroamericanas (Tabla 1). No obstante, la existencia de esta actividad posiblemente sea la que evite la permanencia de los coágulos generados por la enzima tipo trombina y explicarían en parte las razones por las cuales en la intoxicación botrópica, no se produce la muerte de la víctima en los primeros minutos (30 min) posteriores a la intoxicación, tiempo en que ocurre el consumo masivo de fibrinógeno2, presumiblemente ambas actividades pro-coagulante y fibrinolítica ocurran casi en simultáneo.
La DL50 de venenos Bothropicos 9, 25 varía conforme la vía de inoculación, el animal experimental, género y especie de la serpiente y con la región geográfica que habitan. B. jararacussu de Argentina es de elevada toxicidad por la letalidad manifestada (DL50 43.52 µg/ratón) respecto al mismo género y especie de serpientes que habitan Brasil (Tabla 2).
Tabla 2: Actividad letal de venenos de serpientes de Brasil y Argentina
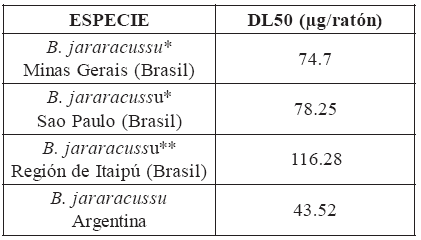
* Sanchez et al., 1992 23 **Perrone et al., 1989 21
En conclusión el veneno de B. jararacussu de Argentina afecta la coagulación de modo complejo, ejerciendo actividad coagulante, defibrinante, fibrinolítica y fibrinogenolítica.
Además es capaz de causar la muerte de la víctima, dada la elevada letalidad manifestada, superior, incluso, a la que presenta la misma especie en otras regiones de Sudamérica. Si bien la composición del veneno es heterogénea, la marcada actividad coagulante y defibrinante exhibida por el veneno de ejemplares de la región nórdica de la Mesopotamia Argentina, pone en evidencia la contribución directa a la letalidad del veneno que tienen los componentes procoagulantes y anticoagulantes, que inducen al agotamiento del fibrinógeno. Este efecto puede conducir a hemorragias severas con la concomitante falla renal y muerte del intoxicado, daños típicos en este tipo de intoxicación botrópica.
AGRADECIMIENTOS
Al Sr. Amado Martinez por la extracción de veneno de ejemplares de B. jararacussu. Este trabajo ha sido financiado por la Secretaría General de Ciencia y Técnica, Universidad Nacional del Nordeste (Proyecto Nº PI 028/ 04) y es parte de la Tesis Doctoral que desarrolla la M.V. Maruñak Silvana, en la Facultad de Ciencias Veterinarias- Universidad Nacional de Buenos Aires-UBA, Argentina.
1. ACOSTA DE PÉREZ, O.C. 1999. Caracterización Bioquímica y Farmacológica del veneno de Bothrops alternatus. Tesis Doctoral, Facultad de Ciencias Veterinarias de Buenos Aires- UBA. [ Links ]
2. ACOSTA DE PÉREZ, O.; KOSCINCZUK, P.; TEIBLER, G.P.; MARUÑAK, S. 1996. Alteraciones de la coagulación sanguínea inducida por veneno de Bothrops alternatus (yarará grande). Respuesta al tratamiento específico. Acta Toxicológica Argentina 4 (2): 28-30. [ Links ]
3. ANDRIAO-ESCARSO, S.H.; SOARES, A.M.; RODRIGUES, V.M.; MANCIN, A.C.; REIS, L.M.; BALLEJO, G.; GIGLIO, J.R. 1999. Isolation and characterization of an arginine ester hydrolase from Bothrops jararacussu venom which induces contractions of the isolated rat uterus. Biochem Mol Biol Int. 47 (4): 699-706. [ Links ]
4. ANDRIAO-ESCARSO, S.H.; SOARES, A.M.; FONTES, M.R.; CORREA, F.M.; ROSA, J.C.; GREENE, L.J.; GIGLIO, J.R. 2002. Structural and functional characterization of an acidic platelet aggregation inhibitor and hypotensive phospholipase A (2) from Bothrops jararacussu snake venom. Biochem Pharmacol. 64 (4): 723-32. [ Links ]
5. BORTOLETO, R.K.; MURAKAMI, M.T.; WATANABE, L.; SOARES, A.M.; Arni, R.K. 2002. Purification, characterization and crystallization of Jararacussin-I, a fibrinogenclotting enzyme isolated from the venom of Bothrops jararacussu. Toxicon 40 (9): 1307-12. [ Links ]
6. CEI, J.N.I. 1993. Reptiles del Noreste, Nordeste y Este de la Argentina p.715 (Museo Regional de Science Naturali Torino, Ed.). Argentina. [ Links ]
7. DENSON, K.W.; RUSSELL, F.E.; ALMAGRO, D.; BISHOP, R.C. 1972. Characterization of the coagulant activity of the some snake venoms. Toxicon 10 (6): 557-562. [ Links ]
8. FRANCISCHETTI, I. M. B.; GOMBAROVITS, M.E.C.; VALENZUELA, J. G.; CARLINI, C. R.; GUIMARÃES, J. A. 2000. Intraespecific variation in the venoms of the South American rattlesnake (Crotalus durissus terrificus). Comp. Biochem. Physiol. Part C 127, 23-36. [ Links ]
9. FURNALETTO, R.S.; ROLIM ROSA, R.; SILES VILLARROEL, M.; ZELANTE, F. 1973. Contribuição ao estudo da determinação da DL50 de venenos botrópicos inoculados por vía venosa em camundongos – Mus musculus-Linnaes, 1758. II-Possibbilidade de determinação da DL50 através da inoculacão previa de doses infreletais do propio veneno. Mem. Inst. Butantan, 37: 109-122. [ Links ]
10. FURTADO, M.F.; MARUYAMA, M.; KAMIGUTI, A.S.; ANTONIO, L.C. 1991. Comparative study of nine Bothrops snake venoms from adult female snakes and their offspring. Toxicon 29 (2): 219-26. [ Links ]
11. GAY, C.C.; LEIVA. L.C.; MARUÑAK, S.; TEIBLER, P.; ACOSTA de PEREZ, O. 2005 Proteolytic, edematogenic and myotoxic activities of a hemorrhagic metalloproteinase isolated from Bothrops alternatus venom. Toxicon 46: 546-554. [ Links ]
12. GENÉ, J.A.; ROY, A.; ROJAS, G.; GUTIÉRREZ, J.M.; CERDAS, L., 1989. Comparative study on coagulant, defibrinating, fibrinolytic and fibrinogenolytic activities of Costa Rican crotaline snake venoms and their neutralization by a polyvalent antivenom. Toxicon 27: 841-848. [ Links ]
13. GUTIERREZ, J.M. AND CHAVES, F. 1980. Efectos proteolítico, hemorrágico y mionecrótico de los venenos de serpientes costarricences de los géneros Bothrops, Crotalus y Lachesis. Toxicon 18: 315-321. [ Links ]
14. HOFMANN, H.; BON, C.1987. Blood coagulation induced by the venom of Bothrops atrox: Identification, purification, and properties of a prothrombina activator. Biochemistry 26: 772-780. [ Links ]
15. KAMIGUTI, A.S.; SANO-MARTINS, I.S., 1995. South American snake venoms affecting haemostasis. Journal of Toxicology, Toxicon Reviews 14: 359-374. [ Links ]
16. LAEMMLI, U.K., 1970 Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680-685. [ Links ]
17. MAZZI, M.V.; MARCUSSI, S.; CARLOS, G.B.; STÁBELI, R.G.; FRANCO, J.J.; CINTRA, A.C.O.; FRANCA, S.C.; SOARES, A.M.; SAMPAIO, S.V. 2004. A New hemorrhagic metalloprotease from Bothrops jararacussu snake venom: isolation and biochemical characterization. Toxicon 44: 215-223. [ Links ]
18. MILANI JUNIOR, R.; JORGE, M.T.; DE CAMPOS, F.P.; MARTINS, F.P.; BOUSSO, A.; CARDOSO, J.L.; RIBEIRO, L.A.; FAN, H.W.; FRANCA, F.O.; SANO-MARTINS, I.S.; CARDOSO, D.; IDE FERNANDEZ, C.; FERNANDES, J.C.; ALDRED, V.L.; SANDOVAL, M.P.; PUORTO, G.; THEAKSTON, R.D.; WARRELL, D.A. 1997. Snake bites by the jararacucu (Bothrops jararacussu): clinicopathological studies of 29 proven cases in Sao Paulo State, Brazil. QJM. 90 (5): 323-34. [ Links ]
19. OLIVERA, J.C.R.; MONTES DE OCA, H.; DUARTE, M.M.; DINIZ, C.R.; FORTES-DIAS, C.L. 2002. Toxicity of South American snake venoms measured by an in vitro cell culture assay. Toxicon 40: 321-325. [ Links ]
20. OUYANG, C.; TENG, C.M; HUANG, T.F. 1992. Characterization of snake venom components acting on blood coagulation and platelet function. Toxicon 30, 945-966.uvidosas. Mem. Inst. Butantan, 51: (1): 25-32. [ Links ]
21. PERRONE, M.A.L.; SILES VILLARROEL, M.; FURTADO, M. de F.D. 1989. Estudo comparativo entre os venenos de serpentes do gênero Bothrops, procedentes do Estado de São Paulo e do Estado do Paraná com algumas espécies morfológicamente duvidosas. Mem. Inst. Butantan, 51(1): 25-32. [ Links ]
22. ROSENFELD, G. 1971. Symptomatology, pathology and treatment of snake bites in South America, p.345. In: W. Bücherl & E. Buckley (Academic Press,New York). Venomous Animals and their venoms. Vol. II Venomous Vertebrates. [ Links ]
23. SANCHEZ, E. F.; FREITAS, T. V.; FERREIRA ALVES, D. L.; VELARDE ,D. T.; DINIZ, M. R. ; CORDEIRO, M. N.; AGOSTINI-COTTA G. and. DINIZ C. R. 1992. Biological activities of venoms from South American snakes. Toxicon 30 (1): 95103. [ Links ]
24. SEEGERS, W.H.; OUYANG, C. 1979. Snake venoms and blood coagulation. Handbook of Experimental Pharmacology 52: 684-750. [ Links ]
25. SILES VILLARROEL, M. 1977. Contribuição ao estudo de venenos e antivenenos botrópicos. São Paulo, (Tese de Livre-Docência- Instituto de Ciências Biomédicas, USP). [ Links ]
26. SMOLTA, M.; MARANGONI, S.; OLIVEIRA, B.; NOVELLO, J.C. 1998. Purification and partial characterization of a thrombin-like enzyme, balterobin, from the venom of Bothops alternatus. Toxicon 36: 1059-1063. [ Links ]
27. SPERMAN-KARBER. 1981. Organización Mundial de la Salud (OMS). Progress in the characterization of venoms and standarization of antivenoms. Who off set publication Nº 58, Genova. [ Links ]
28. THEAKSTON, R.D.G.; REID, H.A. 1983. Development of simple standard assay procedures for the characterization of snake venoms. Bull. WHO 61: 949-956. [ Links ]














