Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet v.11 n.2 Ciudad Autónoma de Buenos Aires jul./dic. 2009
ARTÍCULO DE INVESTIGACIÓN
Inmunolocalización de Tubulina en Túbulos testiculares de Fasciola hepática expuesta a triclabendazole "in vivo"
Solana H. 1,2; Scarcella S.1, 3 ; Gentile M. L.1; Martínez A.1,4; Alzola R.1
1 Lab. Biol. Cel. y Mol. - Dpto. Cs. Biológicas - FCV - UNCPBA - Campus Universitario - Tandil - Argentina.
2 Profesional Principal CIC BA. Email: hsolana@vet.unicen.edu.ar.
3 Becaria ANPCyT.
4 Becario CIC BA.
Recibido: 19/11/09
Aceptado: 16/02/10
Resumen
La fasciolosis es una zoonosis producida por el trematodo Fasciola hepatica afectando a herbívoros rumiantes y el hombre. Ante una fasciolosis generalmente se utiliza triclabendazole, un benzimidazol metilcarbamato halogenado. El mecanismo de acción de los benzimidazoles antihelmínticos se basa en su unión a la β tubulina del helminto con la consecuente despolimerización de sus microtúbulos provocándole la pérdida de función, el desprendimiento y la muerte del parásito. En el caso de triclabendazole (TCBZ) dicho mecanismo aún no ha sido resuelto completamente. En el presente trabajo se evaluó el efecto "in vivo" de triclabendazole sobre la distribución de tubulina en los túbulos testiculares de Fasciola spp obtenidas a partir de bovinos expuestos a dicha droga. Se inmunolocalizó α tubulina tirosinada y β tubulina. Los resultados obtenidos confirman que triclabendazole (TCBZ) altera la distribución de los micro túbulos y reafirman que éste, es al menos uno de sus principales mecanismos de acción utilizando como molécula blanco la β tubulina del trematodo Si bien esta es una posibilidad no debería descartarse la existencia de otro u otros mecanismos de acción alternativo.
Palabras clave: Fasciola hepática; Triclabendazole; Tubulina.
Immunolocalization of Tubulin in testis of fasciola hepatica exposed to triclabendazole "in vivo"
Summary
Fascioliosis, an important zoonotic disease produced by the trematode Fasciola hepatica, causes significant economic losses in ruminant species over the entire world (worldwide). Its control is largely based on the use of the triclabendazole, a benzimidazole flukicidal compound. The mechanism of action of benzimidazole anthelmintic compounds is based on its union to β tubulin with the consequent depolymerization of its microtubules causing the loss of function and the loosening and the death of the parasite. In the specific case of triclabendazole this mechanism not yet has been resolved completely. In the present work was evaluated the effect "in vivo" of triclabendazole on the distribution of α tyrosinated tubulin and β tubulin in the testis tubules of F. hepatica obtained from bovines exposed to this drug. The obtained results confirm that triclabendazole (TCBZ) alters the distribution of the microtubules and reaffirm that at least it is one of its main mechanisms of action.
Keywords: Fasciola hepatica; Triclabendazole; Tubulin.
Introducción
Las infecciones causadas por helmintos constituyen un importante problema médico sanitario tanto en humanos como en animales domésticos. En el ganado, las parasitosis en general, ocasionan serias pérdidas económicas particularmente en áreas donde se practica el pastoreo extensivo. Es sabido que el parasitismo en todo el mundo es una de las principales causas de pérdidas económicas en producción animal. Si bien se han desarrollado diferentes estrategias para contrarrestar el efecto nocivo de los parásitos helmintos (medidas de manejo, control biológico, selección de animales resistentes, etc. el control químico continúa siendo una herramienta fundamental en la lucha contra las parasitosis21. El fracaso en el control antiparasitario, basado casi exclusivamente en quimioterapia, tiene una importancia económica de enorme trascendencia en países como Argentina, donde las condiciones climáticas y de explotación semiextensiva favorecen una alta incidencia del parasitismo. Para controlar la fasciolosis se disponen de varias estrategias de manejo dirigidas a actuar sobre los diferentes momentos en el ciclo biológico del trematodo. Dicho tratamiento se basa en la administración de diferentes drogas antihelmínticas, siendo las más utilizadas los benzimidazoles (BZDs) antihelmínticos. Dentro de la familia de los BZDs el más recomendado es el TCBZ ya que es el único BZD que actúa sobre los estadíos juveniles y adultos con igual eficacia1. Los BZDs desestabilizan el equilibrio tubulinamicrotúbulo dependiendo de la presencia sostenida de la droga activa en contacto con su receptor intracelular, la α tubulina16. En el caso de TCBZ el mecanismo de acción más estudiado en otros helmintos es la despolimerización de los microtúbulos (Mt) aunque dicho mecanismo en el caso de F. hepatica aún no ha sido resuelto completamente existiendo probablemente algún otro fenómeno que podría explicar el porqué de su acción sobre el trematode siendo ineficaz sobre otros helmintos parásitos4.
En los últimos años se ha avanzado con respecto a la ubicación de los Mt y a la variedad de funciones que realizan dentro de las células de los diferentes helmintos. En adultos de Fasciola hepatica se ha determinado que sus Mt están involucradas en varios procesos dentro del parásito23.
Los Mt están formados por tubulinas que se ensamblan como heterodímero de dos subunidades globulares unidas (α y β tubulina) con un peso molecular de 50-55 Kd cada una2. Hasta el presente, a partir de su estudio en cerebro de mamífero han sido identificadas diferentes isoformas para cada subunidad siendo algunas de ellas producto de diferentes genes, adicionalmente otras isoformas son la consecuencia de modificaciones postraduccionales tales como la detirosinacióntirosinación que ocurre sobre α tubulina20 siendo esta modificación la que más atención ha recibido en los últimos años debido a la particularidad de realizarse con la participación de dos enzimas altamente específicas3. A pesar de que dicha modificación postraduccional ya fue descripta en varias especies alejadas entre sí en la escala zoológica, hasta el presente se desconoce si en F. hepatica se manifiesta dicho isotipo. En F. hepatica, ya ha sido descripta la presencia de los Mt en el sinscicio y en los cuerpos celulares del tegumento y sus conexiones con la superficie del sinscicio10. En consecuencia, debería esperarse que F. hepatica fuera susceptible al efecto antiparasitario de la mayoría de los BZDs antihelmínticos pero salvo TCBZ dichas drogas benzimidazólicas son relativamente inactivas contra esta especie de parásitos5; sugiriendo que la tubulina en F. hepatica puede ser diferente en algunos aspectos a la que se encuentra presente en cestodes y nematodes23. El objetivo del presente trabajo fue analizar a través de técnicas inmunocitoquímicas la presencia y distribución de β tubulina y α tubulina tirosinada en tubos testiculares de F. hepatica evaluando además el efecto "in vivo" que ejerce sobre los Mt la presencia del antihelmíntico TCBZ.
Materiales y métodos
Animales
Cuatro bovinos sanos sin antecedentes de fasciolosis fueron inoculados con 400 metacercarias de F. hepatica. La posterior infección intrahepática fue confirmada por la presencia de huevos en heces y la estimación de daño hepático por medio de la detección de niveles elevados de glutamato deshidrogenasa y gamma glutamil transferasa en suero. Dos de los bovinos inoculados (grupo experimental) fueron tratados a los 90 días post infección con 8 mg/Kg PV de TCBZ (Laboratorios Microsules, Buenos Aires, Argentina) siendo sacrificados a los 105 días post inoculación conjuntamente con los controles. Si bien la dosis indicada por el laboratorio para la administración oral de dicho antihelmíntico es de 12 mg/Kg PV obteniéndose en ese caso más del 90% de eficacia9; 11, hemos determinado que a la dosis de 8 mg/Kg PV aproximadamente el 40% de los trematodos adultos se mantienen vivos y además son infértiles. La colecta de F. hepatica adultas se realizó a partir de la apertura del conducto biliar común y los principales conductos hepáticos. Los trematodos adultos fueron sumergidos en 0,9% de NaCl manteniéndolos a 37 ºC durante 30 minutos, colocados posteriormente en formol tamponado al 10% (v/v) procediéndose después a la realización de la técnica histológica convencional, para su posterior análisis histopatológico e inmunohistoquímico.
Histopatología e Inmunohistoquímica
Para los estudios histopatológicos se realizaron cortes de 5 mm coloreándose con hematoxilina de Mayer y eosina y para el estudio inmunohistoquímico se realizaron cortes similares analizándolos según el método de Peroxidasa-antiperoxidasa (Método PAP)22 utilizando dos anticuerpos monoclonales, uno dirigido contra β tubulina (βtub) y el otro dirigido contra a tubulina tirosinada (αtyr) (Sigma- Aldrich, ciudad, país).
Análisis estadísticos
Los datos obtenidos en el recuento se compararon mediante análisis de varianza (ANOVA). Las comparaciones estadísticas se realizaron mediante el software de Instat 3.00 (Gráfico Pad Software, Inc.).
Resultados
Al realizar el recuento de F. hepatica adultas obtenidas en ambos ensayos, del lote control (n=2), se recuperaron 82 ± 7 especímenes vivos mientras que en el lote tratado con 8 mg/Kg PV de TCBZ (n=2) se obtuvieron 28 ± 9 adultos vivos. Se procesaron ambos lotes para histopatología e inmunohistoquímica. Mientras que en el lote control se observó la histología convencional descripta en este tipo de especies (Figura 1), en el lote experimental los túbulos testiculares presentaron una marcada vacuolización observándose reducción de la espermatogénesis y ausencia de espermatozoides (Figura 2, Gráficos 1 y 2). En el análisis de la distribución de β tubulina por inmunohistoquímica, en el grupo control se observaron túbulos testiculares con una homogénea distribución con presencia de espermatozoides (Figura 3) mientras que en el lote experimental se obtuvo una inmunomarcación difusa, no detectándose la presencia de espermatozoides maduros (Figura 5). Al analizar la presencia de αtyr tubulina en los túbulos testiculares en los gusanos no tratados se observó una particular distribución de la misma con manifiesta expresión en la primera línea espermatogénica (E1) y en los espermatozoides maduros (Figura 4). En los túbulos testiculares de F. hepatica tratadas "in vivo" con 8 mg/Kg PV de TCBZ, átyr tubulina se manifestó sólo en las escasas espermatogonias I y III presentes (E1 y E3) no detectándose espermatozoides maduros.

Figura 1: Túbulos testiculares de F. hepatica control. Se visualizan en la periferia, espermatogonias I y II (E1 y E2) y células basófilas con núcleo grande. Hacia el centro de los túbulos se localizaron espermatogonias III (E3), espermatocitos I y II (con núcleo periférico) y espermatozoides (E). E y H. 40X

Figura 2: Túbulos testiculares de F. hepatica tratadas "in vivo" con 8 mg/Kg PV de TCBZ. Se observa una marcada pérdida de la línea espermatogénica con una manifiesta vacuolización periférica, desorganización y reducción de los tipos celulares. Solo se detectan espermatogonias I, II y III (E1, E2 y E3) en escasa cantidad. E y H. 40X

Gráfico 1: Total de espermatogonias presentes en tubos testiculares de F. hepatica Control y expuesta "in vivo" a 8 mg/ Kg PV de TCBZ (Experimental). Media y desvío estándar. n = 15
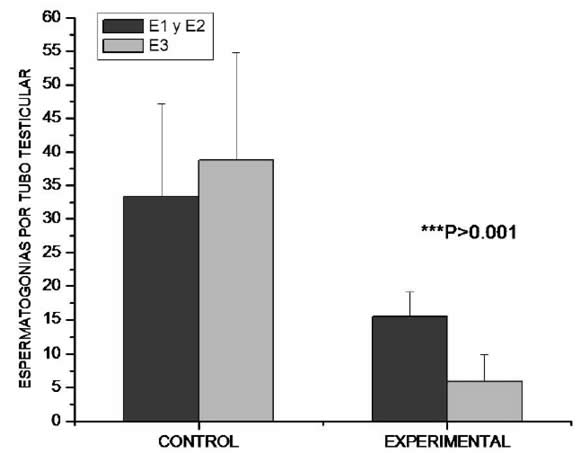
Gráfico 2: Diferentes estadios de espermatogonias (E1, E2 y E3) presentes en tubos testiculares de F. hepatica control y expuesta "in vivo" a 8 mg/Kg PV de TCBZ (Experimental). Media y desvío estándar. n = 15

Figura 3: Inmunolocalización de β tubulina en tubos testiculares de Fasciola hepatica Control. Se observan los tubos testiculares (TT) y espermatozoides (E). 40X

Figura 4: Inmunolocalización de αtyr tubulina en testículo de Fasciola hepatica Control se visualizan en la periferia, espermatogonias I y II (E1 y E2) Hacia el centro de los túbulos se localizaron espermatogonias III (E3) y espermatozoides (E). 40X

Figura 5: Inmunolocalización de β tubulina en tubos testiculares (TT) de F. hepatica tratadas "in vivo" con 8 mg/Kg PV de TCBZ. No se visualizan espermatozoides maduros 40X
Discusión
Los estudios realizados hasta el presente sobre el efecto de TCBZ en F hepatica se realizaron en su mayoría a través de ensayos "in vitro" o a través de modelos "ex vivo" pero es muy poco lo que se conoce sobre el verdadero mecanismo y efecto "in vivo". El presente trabajo analiza los efectos de TCBZ en un modelo "in vivo" respetándose así la totalidad de las interacciones farmacocinéticas y farmacodinámicas que se manifiestan entre el hospedador bovino y el parásito.
A partir del conocimiento que los BZDs expresan su efecto antihelmíntico debido a la despolimerización de los Mt del parásito era de esperar que F. hepatica fuera susceptible al efecto antiparasitario de la mayoría de los BZDs antihelmínticos pero salvo TCBZ dichas drogas son relativamente inactivas contra esta especie de parásitos5; 25 sugiriendo que la tubulina en F. hepatica puede ser diferente en algunos aspectos a la de cestodes y nematodes teniendo probablemente diferencias en su estructura cuaternaria o modificaciones más profundas en su secuencia de amino-ácidos, lo cual podría explicar la baja susceptibilidad del trematodo a la acción de otros BZDs19. El hallazgo de que F. hepatica es susceptible a TCBZ, y que a su vez dicha droga tenga muy poca eficacia contra otros géneros parasitarios7 podría indicar un diferente sitio de unión a la tubulina del trematodo o a otro mecanismo aún no resuelto. Esta idea se apoya en la observación que TCBZ no compite con colchicina por el sitio de unión a tubulina, mientras sí lo hacen los otros BZDs12. En el caso particular de F. hepatica, la tubulina ha sido localizada y parcialmente caracterizada a través de técnicas de inmunofluorescencia indirecta utilizando un anticuerpo monoclonal que permitió su visualización por inmunotransferencia como una única banda de 54 Kd24. Recientemente, realizando estudios comparativos con otros helmintos parásitos y utilizando otros anticuerpos monoclonales se demostró que mientras fue factible la detección de α y β tubulina en mamíferos, cestodes y nematodes, en ninguno de los casos analizados se pudo detectar α o β tubulina correspondientes a F. hepatica19. Esto podría explicarse entre otras causas a probables diferencias en la estructura cuaternaria de la tubulina del trematodo no permitiendo la exposición del epitope correspondiente o directamente a modificaciones más profundas en la secuencia de aminoácidos de la cadena proteica involucrando el sector de reconocimiento de los diferentes anticuerpos monoclonales utilizados19. Los estudios filogenéticos sobre α y β tubulina han demostrado que ambas proteínas están muy relacionadas entre sí y están altamente conservadas en el curso de la evolución. Sin embargo, el número de isoformas para α y β tubulina varía en las diferentes especies, en los diferentes órganos de una misma especie y dentro de un mismo organismo en función del desarrollo del mismo6; 8. Así, el protozoo Trypanosoma cruzi posee un sólo isotipo para ambas tubulinas14 mientras que C. elegans tiene nueve isotipos para α y seis isotipos para β tubulina13. Por su parte recientemente se ha analizado F. hepatica describiéndose al menos 5 α tubulinas entre las cuales se encuentran los isotipos 1 y 4 que terminan en su carboxilo terminal con Glu-Tyr siendo potenciales sustratos para el ciclo de detirosinación/tirosinación18. Hasta el presente es poco lo que se conoce sobre esta particular modificación postraduccional aunque la forma detirosinada de tubulina se la asocia a los Mt estables participantes de estructuras tales como el axonema17. A pesar de que dicha modificación postraduccional ha sido descripta en varias especies alejadas entre sí en la escala zoológica, hasta el presente se desconocía si en F. hepatica existía esta particular forma de manifestación de α tubulina. Nuestros resultados confirman no sólo la presencia sino además la expresión de dicha modificación postraduccional en al menos los túbulos testiculares del trematodo.
Al igual que todos los BZD, en el caso de TCBZ el mecanismo de acción más estudiado es la despolimerización de los Mt aunque dicho mecanismo en el caso de los trematodos aún no ha sido resuelto en su totalidad existiendo probablemente algún otro fenómeno que podría explicar el porqué de su acción sobre F. hepatica. A través de diferentes ensayos de eficacia realizados para evaluar la actividad fasciolicida de TCBZ en bovino, se ha determinado que la dosis indicada para la administración oral de dicho antihelmíntico es de 12 mg/Kg PV obteniéndose en ese caso más del 90% de eficacia9; 11. A la dosis de 8 mg/Kg PV aproximadamente el 40% de los trematodos adultos se mantienen vivos aunque hasta hoy se desconocía la verdadera viabilidad de estos parásitos y las implicancias que esto podría tener sobre el mantenimiento del ciclo biológico y la consecuente reinfección posterior. Al realizar el recuento de F. hepatica adultas obtenidas en ambos ensayos; del lote control se recuperaron 82 ± 7 especímenes vivos mientras que en el lote tratado con 8 mg/Kg PV de TCBZ se obtuvieron 28 ± 9 adultos vivos confirmando el efecto antiparasitario. La espermatogénesis resulta de elección como modelo de evaluación del efecto anti - tubulina de la TCBZ dado el activo rol que cumplen estas moléculas durante la división de las células espermáticas. En el estudio histopatológico, la observación de los túbulos testiculares de F. hepatica adulta en el caso de los trematodos controles mostró un empaquetamiento de células en varios estadíos de la espermatogénesis de manera similar a la descripta por Hanna y cols15. En la periferia de los túbulos existen numerosas espermatogonias de citoplasma basofílico con una alta relación núcleo/citoplasma. Las espermatogonias terciarias (el más abundante tipo celular) se las localiza en el centro de los túbulos rodeadas de espermatozoides y pequeñas células con citoplasma eosinofílico y denso núcleo periférico representando a los espermatocitos primarios y secundarios los cuales fueron sometidos a dos divisiones meióticas. Mientras que en el lote control se observó la histología convencional descripta en este tipo de especies15 (Figura 1), en el lote experimental los túbulos testiculares de los trematodos expuestos al TCBZ a la dosis de 8 mg/kg PV presentaron una marcada vacuolización observándose una manifiesta reducción de la espermatogénesis (Gráficos 1 y 2) con ausencia de espermatozoides (Figura 2). En el análisis de la inmunolocalización de â tubulina, en el grupo control se observó una homogénea distribución perinuclear en todas las células participantes de los túbulos testiculares con una manifiesta presencia en las colas de los espermatozoides (Figura 3) mientras que en el lote experimental solo se obtuvo una inmunomarcación difusa distribuida a lo largo de todo el citoplasma no detectándose la presencia de espermatozoides maduros (Figura 5). Al analizar la presencia de αtyr tubulina en los túbulos testiculares de F. hepatica control se observó una particular distribución de la misma con manifiesta expresión en la primera línea espermatogénica (E1) y en los espermatozoides maduros (Figura 4). La inmunolocalización de αtyr tubulina en los túbulos testiculares de F. hepatica tratadas "in vivo" con 8 mg/Kg PV de TCBZ, se manifestó difusamente en las escasas espermatogonias I y III (E1 y E3) presentes, no detectándose espermatozoides maduros (Figura 6). Estos resultados no solo confirman la presencia de αtyr tubulina en los túbulos testiculares de F. hepatica sino que además demuestran que a pesar de que la molécula blanco para el TCBZ es la β tubulina, debido a que su mecanismo de acción conlleva la despolimerización de los Mt (integrados fundamentalmente por α y β tubulina) indirectamente también se ve alterada la distribución de á tubulina tirosinada.

Figura 6: Inmunolocalización de αtyr tubulina en tubos testiculares (TT) de F. hepatica tratadas "in vivo" con 8 mg/Kg PV de TCBZ. Se visualizan escasas espermatogonias I y III (E1 y E3). No se visualizan espermatozoides maduros. 40X
Otra información importante que se desliza a partir de los resultados obtenidos en el presente trabajo se refiere al hecho que, al analizarse el efecto de una dosis (8 mg/Kg PV) ligeramente inferior a la indicada como dosis efectiva (12 mg/Kg PV) algunos ejemplares adultos se mantienen viables pero son infértiles comprometiendo el ciclo biológico del trematodo. Esto tiene implicancias directas sobre la patogenia de la enfermedad ya que ante esta ligera carga parasitaria, el hospedador bovino puede sobrellevar la parasitosis casi sin manifestación de síntomas pudiendo seguir desarrollando su inmunidad para probables futuras reinfecciones. Este análisis requiere posteriores ensayos los cuales ya se han iniciado en nuestro laboratorio.
Conclusiones
El presente trabajo aporta al entendimiento del mecanismo de acción de TCBZ sobre F. hepatica demostrando claramente que los Mt son el blanco intracelular alterándosele el estado de ensamblaje y tirosinación en los túbulos testiculares. Los hallazgos histopatológicos observados se corroboran con los estudios inmunohistoquímicos, confirmando la efectividad de TCBZ siendo la despolimerización de los Mt uno de sus principales mecanismos de acción teniendo implicancias directas en el entendimiento de las diferentes susceptibilidades de los helmintos y de la actividad farmacológica de este tipo de drogas, aportando a la comprensión de los mecanismos de acción de los diferentes BZDs.
1. Alvarez L., Solana H., Mottier M., et al. Altered drug influx/efflux and enhanced metabolic activity in triclabendazole-resistant liver flukes. Parasitology. 2005;131:501-510. [ Links ]
2. Avila J. Microtubule dynamics. FASEB J. 1990;4:3284-3290. [ Links ]
3. Beltramo D., Arce C., Barra H. Tyrosination-detyrosination of tubulin and microtubules during the development of chick erythrocytes. Mol. Cell. Biochem. 1989;89:47-56. [ Links ]
4. Brennan G., Fairweather I., Trudgett A. et al. Understanding triclabendazole resistance (Review) Exp. Mol. Pathol. 2007;82 (2):104-109. [ Links ]
5. Campbell W. Benzimidazoles: Veterinary uses. Parasitol. Today 1990;6:130-133. [ Links ]
6. Cleveland D. The multitubulin hypothesis revisited: what have we learned. J Cell Biol. 1987;104:381-383. [ Links ]
7. Coles G. Anthelmintic activity of triclabendazole. J. Helminthol. 1986;60:210-212. [ Links ]
8. Dustin P. Microtubules, 1984. 2nd edn. Springer-Verlag. Berlin, pp. 375-383. [ Links ]
9. EMEA Committee for Veterinary Medicinal Products. Triclabendazole. Summary report 1997. (3), EMEA/MRL/196/97-FINAL. [ Links ]
10. Faiweather I., & Boray J. The Veterinary Journal, 1999;158:81- 112. [ Links ]
11. FAO Triclabendazole. Residues of some veterinary drugs in animals and food (Monographs prepared by the fortieth meeting of the Joint FAO/WHO Expert Committee on Food Additives). FAO Food and Nutrition Paper 1993;41/5: 63-86. [ Links ]
12. Fetterer R. The effect of albendazole and triclabendazole on colchicine binding in the liver fluke Fasciola hepatica. J. Vet. Pharmacol. Therap. 1986; 9:49-54. [ Links ]
13. Gogonea C., Gogonea V., Ali Y., Merz Jr K., Siddiqui S. Computational prediction of the three-dimensional structures for the Caenorhabditis elegans tubulin family. J. Mol. Graph. Model. 1999;7:90-100. [ Links ]
14. Gull K. The cytoskeleton of trypanosomatid parasites. Ann Rev Microbiol. 1999;53:629-55. [ Links ]
15. Hanna R., Edgar H., Moffett D., et al. Fasciola hepatica: Histology of the testis in egg-producing adults of several laboratorymaintained isolates of flukes grown to maturity in cattle and sheep and in flukes from naturally infected hosts. Vet. Parasitol. 2008;157:222-234. [ Links ]
16. Lanusse C., Nare B., Prichard R. Comparative sulphoxidation of albendazole by sheep and cattle liver microsomes. Xenobiotica. 1993; 23(3): 285-95. [ Links ]
17. McKean P., Vaughan S, Gull K. The extended tubulin superfamily. J. Cell. Sci. 2001;114:2723-33. [ Links ]
18. Ryana L., Hoey E., Trudgett A., Fairweather I., et al. Fasciola hepatica expresses multiple á and â tubulin isotypes. Molecular & Biochemical Parasitology. 2008; 159:73-78. [ Links ]
19. Scarcella S., Ceriani C., Rodríguez J., Solana H. Caracterización de la proteína microtubular de diferentes helmintos parásitos. Sus implicancias en el modo de acción de los benzimidazoles antihelmínticos. RedVet. 2007; 6:1695-7504. [ Links ]
20. Schulze E., Asai D., Bulinski J., Kirschner M. Posttranslational modification and microtubule stability. J. Cell Biol. 1987;105:2167-2177. [ Links ]
21. Solana H., Scarcella S., Virkel G., Ceriani C., Rodríguez J., Lanusse C. Albendazole enantiomeric metabolism and binding to cytosolic proteins in the liver fluke Fasciola hepatica. Vet. Res.Commun. 2009;33:163-173. [ Links ]
22. Stemberger L., Hardy A., Cuculis J., et al. The unlabeled antibody enzyme method for immune histochemistry. Preparation and properties of soluble antigen-antibody complexes (horseradish peroxidase- antihorseradish peroxidase) and its use in identification of spirochetes. J. Histochem. Cytochem. 1970;18:315-333. [ Links ]
23. Stitt, A., Fairweather, I., Trudgett, A., Johnston, C. Fasciola hepatica: localization and partial characterization of tubulin. Parasitol. Res. 1992;78(2):103-107. [ Links ]
24. Tang L. & Prichard R. Comparison of the properties of tubulin from Nippostrongylus brasiliensis with mammalian brain tubulin. Mol. Biochem. Parasitol. 1988;29:133-140. [ Links ]
25. Van den Bossche H., Rochette F, Hörig C. Mebendazole and related anthelmintics Adv. Pharmacol. Chemother. 1982;19:67-128. [ Links ]














