Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.12 no.2 Ciudad Autónoma de Buenos Aires jul./dic. 2010
ARTÍCULO DE INVESTIGACIÓN
Análisis intraindividuo de la frecuencia de núcleos espermáticos con distintas morfologías en eyaculados porcinos
González, L.O.*1; Campi, S.H.1; Ferrari, M.R.1; Fischman, M.L.1; Cisale, H.O.1
1Cátedra de Física Biológica. Facultad de Ciencias Veterinarias. UBA. Instituto de Investigación y Tecnología en Reproducción Animal (INITRA). Chorroarín 280 (C1427CWO). CABA. República Argentina. *Vet. Liliana O González. e-mail: lgonzalez@fvet.uba.ar
Recibido: 01/11/2010
Aceptado: 27/02/2011
Resumen
La determinación de la morfología del núcleo espermático ha cobrado relevancia dentro de la evaluación de la calidad seminal porque puede reflejar cambios cuantitativos y cualitativos del material nuclear. El objetivo del presente trabajo fue analizar la variabilidad de los porcentajes de núcleos espermáticos morfológicamente normales en eyaculados de un mismo animal.
Se estudió la morfología nuclear en extendidos de semen fresco coloreados con la tinción de Feulgen. Se analizaron muestras provenientes de 23 eyaculados obtenidos de cinco machos híbridos comerciales en edad reproductiva, sanos, y sometidos a una misma rutina de extracción, realizada entre los meses de marzo y diciembre. Las muestras cumplían con los patrones estandarizados en el laboratorio en cuanto a concentración, movilidad y viabilidad.
Se observaron morfologías nucleares normales y anormales (globosos, vacuolados, alargados, grandes, piriformes, pequeños y con condensación defectuosa). La prueba de Chi-cuadrado indicó que la relación entre el número de núcleos espermáticos normales y anormales no presentó diferencias significativas entre los eyaculados de un mismo animal revelando que la frecuencia de núcleos con morfología normal tiene un valor muy estable en cada individuo. Se determinó así mismo que el porcentaje de núcleos morfológicamente anormales era bajo en los 23 eyaculados analizados (< 4%).
Palabras clave: Cerdos; Morfología del núcleo espermático; Feulgen; Eyaculados.
Intraindividual analysis of different morphology frequency of sperm nuclei in porcine ejaculates
Summary
The nuclear morphology is a very important parameter for semen evaluation. Quantitative and qualitative changes of the nuclear material can generate abnormal nuclear morphologies, some of which are associated with fertility problems. The aim of this study was to analyze the variability of the percentages of morphologically normal sperm nuclei present in different ejaculates of a same animal.
Smears of fresh porcine semen were stained with the Feulgen Stain and the nuclear morphology was studied in 23 ejaculates coming from five boars. These animals, which were from a commercial hybrid, healthy, and in reproductive age, were subjected to the same extraction routine, between March and December. The concentration, motility and viability of the samples used in this work were in agreement with the standard patterns of our laboratory.
There were observed normal and abnormal nuclear morphologies (round, vacuolated, tapered, large, pyriform, small and with abnormal condensation). The number of normal and abnormal sperm nuclei did not differ significantly between the ejaculates of a same animal. So, the percentage of nuclei with normal morphology determined in each ejaculate was a very stable value in the different animals. In addition, the percentage of morphologically abnormal nuclei was low in the 23 ejaculates tested (<4%).
Key words: Board; Sperm nuclear morphology; Feulgen; Ejaculates.
Introducción
La evaluación de semen porcino a través de los parámetros convencionales (concentración, movilidad, viabilidad), si bien cubre una amplia gama de características relacionadas con la fertilidad, podría ser complementada y enriquecida con la determinación de la morfología de los núcleos espermáticos maduros.
La aplicación de técnicas de coloración, como la tinción de Feulgen, permite observar la morfología nuclear en distintas especies y detectar anormalidades que estarían asociadas a problemas de fertilidad3,21. Con esta técnica se determinaron cambios en la distribución de la cromatina11, en el contenido de ADN (diploidías y tetraploidías)12,26 y también se pudo evidenciar la presencia de vacuolas3.
La morfología de los núcleos espermáticos es consecuencia de la expresión de numerosos factores que participan en el proceso de espermatogénesis. Dentro de ellos son especialmente importantes los que actúan a nivel de la cromatina, complejo formado por ADN y proteínas básicas caracterizadas en su mayoría como protaminas5.
En distintas especies se observó que la fertilidad de los espermatozoides está relacionada con la calidad de la estructura de la cromatina y la integridad del ADN1,7,8,25,30. Por otra parte, tanto los cambios cuantitativos como los cualitativos del material nuclear pueden originar morfologías anormales6,11,17,21. En cerdos se encontró una relación inversa entre el número de anomalías de la morfología espermática y la fertilidad15,27.
La producción de semen porcino y la calidad espermática son sensibles a la influencia de factores tales como estacionalidad, frecuencia en la recolección del semen, manejo de los eyaculados, alimentación, edad y raza de los animales24. Ciertos parámetros espermáticos como concentración, integridad de membranas y movilidad son sensibles a factores internos y externos y presentan variaciones entre eyaculados de un mismo animal14. En cambio, el núcleo de los mamíferos tiene una estabilidad alta como consecuencia de la organización particular de su cromatina1,5,20.
El objetivo del presente trabajo fue analizar la variabilidad de los porcentajes de núcleos espermáticos morfológicamente normales en eyaculados de un mismo animal.
Materiales y métodos
Se trabajó con cinco machos híbridos comerciales en edad reproductiva, sanos y estabulados en la FCV-UBA, según las condiciones establecidas por el Comité Institucional de Cuidado y Uso de Animales de Laboratorio (CICUAL). Los animales fueron sometidos a una misma rutina de extracción de semen, realizada entre los meses de marzo y diciembre, a fin de evitar temperaturas elevadas y altos porcentajes de humedad que interfieren con la libido y la calidad seminal del macho porcino. Las muestras se obtuvieron mediante la técnica de mano enguantada13 empleándose aquellas que cumplían con los patrones estandarizados en el Laboratorio de Calidad Seminal y Criopreservación de Gametas (FCV - UBA) para esta especie, en cuanto a concentración, movilidad y viabilidad14.
Se analizaron 23 eyaculados, siendo entre 8 y 2 el número de muestras obtenidas de cada animal.
La evaluación de la morfología nuclear se realizó empleando la tinción de Feulgen, que es una técnica que permite colorear el ADN en forma específica y estequiométrica. La técnica se aplicó de acuerdo con la descripción hecha por Ferrari y col10. Los extendidos de semen fresco secados al aire se fijaron en etanol-acético (3:1, v/v) durante 30 min y luego se lavaron 3 veces durante 10 minutos cada vez con agua destilada. Luego se hidrolizaron durante 40 min en HCl 5N a 22°C, se lavaron 3 veces durante 10 minutos cada vez con agua destilada y se colorearon con el reactivo de Schiff a pH 2.2 durante 60 min, en oscuridad y a 5°C. El material coloreado se lavó 3 veces con agua sulfurosa (180 ml de agua destilada, 10 ml de bisulfito de sodio al 10% p/v: y 10 ml HCl 1N) durante 10 minutos cada vez, en oscuridad y a 5°C. Los exámenes fueron realizados en un microscopio de campo claro, por un mismo observador experimentado sobre 300 núcleos en cada extendido y bajo un aumento de 1000x. La clasificación de las morfologías nucleares se hizo de acuerdo a los parámetros descriptos por Boquet y col4.
Los resultados obtenidos fueron procesados mediante estadística descriptiva. La comparación del número de morfologías nucleares normales y anormales en los distintos eyaculados de cada individuo se hizo mediante la prueba de Chicuadrado.
Resultados
En los extendidos de los eyaculados porcinos coloreados con la tinción de Feulgen se observaron morfologías nucleares normales y anormales (globosa, vacuolada, alargada, grande, piriforme, pequeña y con condensación defectuosa). Se consideraron núcleos espermáticos con morfología normal a aquellos que integraban la población más numerosa y tenían características similares en los individuos estudiados.
En el Gráfico 1 se representan los porcentajes de núcleos espermáticos morfológicamente normales en cada uno de los eyaculados de los cinco animales (A, B, C, D, E), y en la Tabla 1 los porcentajes medios ± desvío estándar y los porcentajes mínimos y máximos de espermatozoides con morfología nuclear normal y anormal.
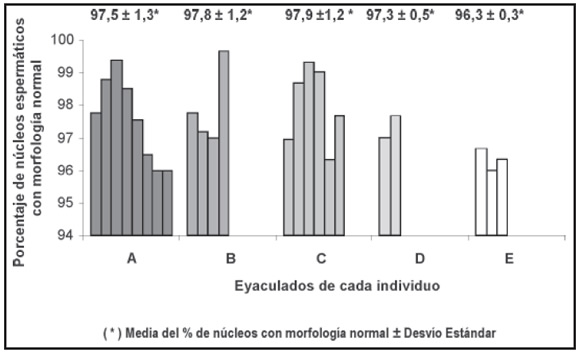
Gráfico 1. Porcentaje de núcleos espermáticos con morfología normal en cada eyaculado de los cinco porcinos estudiados
(A, B, C, D, E).
Tabla 1. Porcentajes medios, mínimos y máximos de espermatozoides con morfología nuclear normal y anormal en los cinco individuos estudiados (A, B, C, D y E).
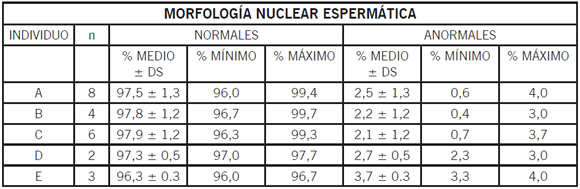
n = número de eyaculados estudiados en cada individuo. DS: Desvío Estándar.
La Tabla 2 muestra, para cada individuo, el porcentaje medio ± desvío estándar y el porcentaje máximo de cada anormalidad. Los rangos de variación del porcentaje de las distintas morfologías en el conjunto de los 23 eyaculados fueron los siguientes: normales (96,0-99,7) y anormales (0,4-4,0). Los rangos de variación observados para las distintas anormalidades fueron: pequeños (0,0-1,6), vacuolados (0,0- 2,0), alargados (0,0-1,0), grandes (0,0-0,7), globosos (0,0-1,7), piriformes (0,0-2,7) y los que presentaron mala condensación (0,0-0,7).
Tabla 2. Porcentajes máximos de espermatozoides con morfología nuclear anormal en los cinco individuos estudiados (A, B, C, D y E).

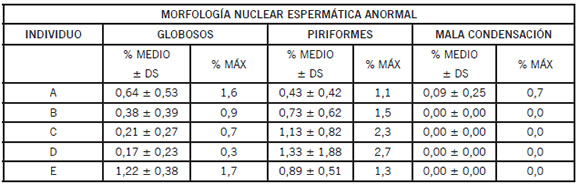
DS: Desvío Estándar
La relación entre el número de núcleos espermáticos normales y anormales, de acuerdo con la prueba de Chi-cuadrado, no difiere significativamente entre los eyaculados de un mismo animal a un nivel de significación del 5% en los individuos B, C, D, E y a un nivel del 4 % en A.
Discusión
Tanto el estrés fisiológico como ciertos agentes ambientales pueden modificar la cromatina y/o el ADN espermáticos durante la gametogénesis9,16,18. No obstante, el núcleo espermático maduro cuenta con una estructura muy compacta, casi cristalina y prácticamente inerte desde el punto de vista bioquímico que le confiere protección19,29. Los resultados obtenidos en el presente trabajo muestran que el porcentaje de núcleos con morfología normal es muy estable tanto en eyaculados de un mismo animal, como en los eyaculados provenientes de distintos animales. La estabilidad en los porcentajes de morfología nuclear normal se diferencia de otros parámetros espermáticos que presentan mayor variabilidad entre eyaculados14,24.
El porcentaje de núcleos morfológicamente anormales fue menor al 4% en los 23 eyaculados. Este valor es bajo en comparación con los que se determinaron en otras especies17,28 Las morfologías nucleares anormales que se observaron en este trabajo coincidieron con las descriptas para porcinos4, pero no todas estaban presentes en cada eyaculado. Algunas morfologías anormales como piriforme, pequeña y vacuolada se han correlacionado con disminución en la fertilidad. No obstante en pequeños números, están presentes en eyaculados fértiles de distintas especies3,23.
La prueba de Chi-cuadrado indicó que la relación entre el número de núcleos morfológicamente normales y anormales no difiere significativamente entre los distintos eyaculados de cada animal. Este resultado sugiere que el estudio de la morfología del núcleo espermático, aunque se realice en un número muy reducido de muestras, podría brindar información valiosa acerca de características nucleares del animal.
La tinción de Feulgen, resultó muy adecuada para evaluar la morfología del núcleo espermático porcino. Esta técnica fue utilizada por diversos autores para colorear el núcleo espermático en distintas especies debido a su especificidad por el ADN y su capacidad para revelar anormalidades en la distribución y forma de condensación de la cromatina3,6,11,22.
En el futuro será importante hacer el seguimiento de muestras de semen porcino provenientes de individuos que hayan sufrido distintas patologías y/o estén sometidos a cambios ambientales, a fin de establecer relaciones entre la morfología del núcleo espermático y dichos factores.
Agradecimientos: Este trabajo se realizó con el aporte de la Universidad de Buenos Aires, subsidios UBACyT V028 y V008.
1.Agarwal, A., Said T. Role of sperm chromatin abnormalities and DNA damage in male infertility. Hum Reprod. Update 2003; 9(4):331-45. [ Links ]
2.Ballechey, BE., Evenson, DP., Saache, RG. The sperm chromatin structure assay. Relationship with alternate test of semen quality and heterospermic performance of bulls. J Androl. 1988; 9(2):109-15. [ Links ]
3. Barth, AD., Oko, RJ. Abnormal morphology of bovine spermatozoa. First Edition. Iowa State University Press, Iowa, USA, 1989. [ Links ]
4. Boquet, M., González, L., Giuliano, S., Cisale H., Ferrari, M. Abnormal sperm nuclei in boar ejaculates. VII Jornadas Multidisciplinarias de la Sociedad Argentina de Biología 2005. Biocell 2006, 30(1):241. [ Links ]
5. Boquet, MG., Ferrari, M.R., Spirito, S.E. Cambios en la cromatina durante la espermatogénesis en mamíferos. Med. Vet. 2009; 90(1-2):9-16. [ Links ]
6. Dobrinski, I., Hughes, HP., Barth AD. Flow cytometric and microscopic evaluation and effect on fertility of abnormal chromatin condensation in bovine sperm nuclei. J Reprod Fertil. 1994; 101(3):531-8. [ Links ]
7. Evenson, DP. Clinical aspects of sperm DNA fragmentation detection and male infertility. Theriogenology 2006; 65(5):979-91. [ Links ]
8. Evenson, DP., Thompson, L., Jost, L. Flow cytometric evaluation of boar semen by the sperm chromatin structure assay as related to cryopreservation and fertility. Theriogenology 1994; 41(3):637-51. [ Links ]
9. Evenson, DP., Jost, LK., Balhorn, R. Characteristics of human sperm chromatin structure following an episode of influenza and high fever: a case study. J Androl. 2000; 21(5):739-46. [ Links ]
10. Ferrari, MR., Spirito, SE., Giuliano, SM. Feulgen reaction: its microespectrophotometric analysis in bovine spermatozoa. Com Biol.1996; 14(1):19-32. [ Links ]
11. Ferrari, MR., Spirito, SE., Giuliano, SM., Fernandez, HA. Chromatin cytophotometric analysis of abnormal bovine spermatozoa. Andrologia 1998; 30(2):85-9. [ Links ]
12. Ferrari, M., Spirito, S., Giuliano, S, Campi, S., Fernández, H. Estudio comparativo de la distribución de la cromatina en espermatozoides con contenido de ADN normal y duplicado. Terceras Jornadas de la Facultad de Cs Veterinarias - U.B.A. Científicas y de actualización profesional, Facultad de Cs.Veterinarias, UBA. InVet. 2005; 7(1):199-201. [ Links ]
13. Fischman, ML., Suhevic, J., Rivolta, MA., Cisale, HO. Collection of wild boar semen by electroejaculation. Vet Rec. 2003;153:365-6. [ Links ]
14. Fischman, ML., González, L., Boquet, M., et al. Comparación entre diferentes técnicas de evaluación de semen porcino. Terceras Jornadas de la Facultad de Cs Veterinarias - U.B.A. Científicas y de actualización profesional, Facultad de Cs. Veterinarias, UBA, 2005. InVet. 2005; 7(1):202-3. [ Links ]
15. Gadea, J. Sperm factors related to in vitro and in vivo porcine fertility. Theriogenology. 2005; 63(2):431-44. [ Links ]
16. Giuliano, S., Agüero, A., Spirito, S., et al. Heat stress effect on sperm morphology in Lama glama. Taller de Biología de la Reproducción Animal y del Desarrollo Embrionario. Fac. Cs. Vet UBA Buenos Aires. Biocell. 2000; 24(3):265. [ Links ]
17. Huser, T., Orme CA., Hollars, CW., Corzett, MH., Balhorn, R. Raman spectroscopy of DNA packaging in individual human sperm cells distinguishes normal from abnormal cells. J Biophotonics. 2009; 2(5):322-32. [ Links ]
18. Karabinus, DS., Vogler, CJ., Saacke, RG., Evenson, DP. Chromatin structural changes in sperm after scrotal insulation of Holstein bulls. J Androl. 1997; 18:549-55. [ Links ]
19. Kierszenbaum, AL. Transition nuclear proteins during spermiogenesis: unrepaired DNA breaks not allowed. Mol Reprod Dev. 2001; 58(4):357-58. [ Links ]
20. Manicardi, GC., Tombacco, A., Bizzaro, D., Bianchi, U., Bianchi, PG., Sakkas D. DNA strand breaks in ejaculated human spermatozoa: comparison of susceptibility to the nick translation and terminal transferase assays. J Histochem. 1998; 30(1):33-9. [ Links ]
21. Ostermeier, GC., Sargeant, GA., Yandell, BS., Everson, DP., Parrish, JJ. Relationship of bull fertility to sperm nuclear shape. J Androl. 2001; 72 (4):595-603. [ Links ]
22. Ramos, L., Hendriks, JCM., Peelen, P., Braat, DDM., Wetzels, AMM. Use of computerized karyometric image analysis for evaluation of human spermatozoa. J Androl. 2002; 23(6):882-8. [ Links ]
23. Rousso, D., Kourtis, A., Mavromatidis, G., Gkoutzioulis, F., Makedos G., Panidis, D. Pyriform head: a frequent but littlestudied morphological abnormality of sperm. Arch Androl. 2002; 48(4):267-72. [ Links ]
24. Sánchez-Prieto, J., González, J., Illera, MJ., Lorenzo, PL., Orensanz, LM. [ 3H] Heparin Binding in Boar Spermatozoa: Characterization and correlation with routine semen quality parameters Biol Reprod. 1996; 55(4):860-7. [ Links ]
25. Spano, M., Bonde, JP., Hjollund, HI., Kolstad, HA., Cordelli, E., Leter, G. Sperm chromatin damage impairs human fertility. The Danish First Pregnancy Planner Study Team. Fertil Steril. 2000; 73: (1):43-50. [ Links ]
26. Spirito, S., Campi, S., Boquet, M., Fernández, H., Ferrari, M. Equine spermatozoa nuclei with different ploidy levels: relationship between the nuclear DNA content and the nuclear area. Andrologia 2010; 41 (En prensa). [ Links ]
27. Tardif, S., Laforest, JP., Cormier, N., Bailey, JL. The importance of porcine sperm parameters on fertility in vivo. Theriogenology. 1999; 52 (3):447-59. [ Links ]
28. Vieytes, AL., Cisale, HO., Ferrari, MR. Relationship between the nuclear morphology of the sperm of 10 bulls and their fertility. Vet Rec. 2008; 163(21):625-9. [ Links ]
29. Ward, WS., Coffey, DS. DNA packaging and organization in mammalian spermatozoa: comparison with somatic cells. Biol Reprod. 1991; 44(4):569-74. [ Links ]
30. Waterhouse, KE, Haugan, T., Kommisrud, E et al.. Sperm DNA damage is related to field fertility of semen from young Norwegian Red bulls. Reprod Fertil Dev. 2006; 18(7):781-8. [ Links ]














