Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.13 no.2 Ciudad Autónoma de Buenos Aires jul./dic. 2011
COMUNICACIÓN CORTA
Evaluación de los cambios ocasionados en espermatozoides bovinos por variaciones en el manejo de las dosis durante su manipulación en inseminación artificial
Bernardi, S.F.1; Allende, R.2; Mazzeo, R.2; Monti, J.2; Marini, P.R3.
1Cátedra de Histología I y Embriología Básica. Facultad de Ciencias Veterinarias. Universidad Nacional de Rosario. Ruta 33 y Bv. Ov. Lagos. (2170) Casilda.
2Cooperativa de Inseminación Artificial de Venado Tuerto, Santa Fe.
3Cátedra de Bovinos Lecheros. Facultad de Ciencias Veterinarias. Universidad Nacional de Rosario.
Correspondencia e-mail: Sandra Bernardi sbernard@unr.edu.ar
Recibido: 16/06/2011
Aceptado: 20/12/2011
Resumen
Considerando el disímil manejo al que las dosis son sometidas durante el descongelado y antes de la inseminación, el objetivo del presente trabajo fue determinar el efecto que estos cambios producen sobre distintas características morfológicas y funcionales de los espermatozoides afectando la calidad del semen a inseminar. Se utilizaron muestras de un toro Holando Argentino, procesadas y congeladas en pajuelas de 0,5 cc utilizando un diluyente semidefinido. El análisis de la motilidad se realizó mediante el uso de Sperm Vision, la funcionalidad de la membrana plasmática mediante una prueba HOST y la integridad del acrosoma bajo microscopio de contraste de fases. Los cambios de protocolo que llevaron a una calidad no aceptable para inseminar (según normas ISO 9002) se refirieron a cambios bruscos de temperatura de descongelado y del tiempo de inmersión, así como demoras en efectivizar la inseminación una vez descongelada la dosis y en retirar la pajuela del termo de nitrógeno. Esta misma situación se evidenció al analizar la funcionalidad de la membrana plasmática. La integridad del acrosoma fue mayor al descongelar utilizando temperaturas altas (55, 75 y 95°C).
Palabras clave: Motilidad; Membrana plasmática; Acrosoma; Morfología; Semen bovino.
Summary
Evaluation of changes ocassioned by changes in bovine sperm in the management of dose during handling artificial insemination
Summary
The aim of this work was to determine the effect of the changes that doses undergo during thawing and before insemination due to a dissimilar handling of them. Focus was placed on the effects on various morphological and functional characteristics of spermatozoa which affect the quality of the semen to be inseminated. Samples from an Holando Argentine bull were employed, processed and frozen in 0.5cc straws using a semidefined diluent. Sperm motility was performed with Sperm Vision, plasmatic membrane functionality was tested with a HOST test and acrosome integrity under phase contrast microscope. Protocol changes that led to an unacceptable quality for insemination -according to ISO 9002- were related to abrupt thawing temperature changes and immersion time as well as to delays in insemination once a dose was thawed and in removing the Straw from the nitrogen flask. This same situation was observed when analysing the functionality of the plasmatic membrane. Acrosome integrity was higher when thawed at high temperatures (55, 75 and 95°C).
Key words: Motility; Plasma membrane; Acrosome; Morphology; Bovine semen.
Introducción
La inseminación artificial (IA) es la biotecnología reproductiva más antigua y más difundida en la especie bovina, es así que el conocimiento de la fertilidad o la capacidad fecundante de cada toro se convierte en uno de los principales objetivos en la producción de semen bovino. Resulta entonces, indispensable que el semen utilizado mantenga su capacidad de fertilización después del proceso de congelado-descongelado.
La capacidad de los espermatozoides de fecundar el oocito y posteriormente de garantizar el desarrollo embrionario guarda relación con parámetros diversos como motilidad, metabolismo celular, integridad del acrosoma, integridad y funcionalidad de la membrana plasmática, integridad del ADN6, 12, 16.
La evaluación de la motilidad, característica de fundamental importancia en el momento de la penetración del óvulo, junto a la velocidad y al tipo de trayectoria de los espermatozoides se realiza de rutina al averiguar la calidad del semen. Los avances en electrónica y computación de los últimos años permitieron que su evaluación pueda realizarse hoy de un modo más objetivo y sistemático mediante la utilización de un analizador seminal computarizado (CASA: Computer Assisted Semen Analysis), si se lo compara con las técnicas realizadas a microscopio óptico4. Este sistema también permite realizar sobre las mismas muestras, una evaluación de la morfología espermática calculando no sólo el porcentaje de células anormales totales sino también discriminadas por tipo de defecto presente. La valoración de la integridad funcional de la membrana plasmática puede ser fácilmente determinada usando el test de endósmosis o hiposmótico (HOST: Hypoosmotic Swelling Test). Este último se basa en la semipermeabilidad de la membrana al estar intacta y bioquímicamente activa, la cual absorbe agua cuando es expuesta a una solución hiposmótica generando en los espermatozoides cambios morfológicos fácilmente detectables3, 18, 20. Para que el espermatozoide penetre la zona pelúcida del ovocito es necesario que ocurra la liberación de las enzimas hidrolíticas contenidas en el acrosoma. Diversas técnicas permiten realizar la valoración de esta estructura, a tal fin la observación bajo microscopio de contraste de fase es habitualmente utilizada en laboratorios como práctica de rutina dando cuenta del porcentaje de espermatozoides que mantienen su capacidad fecundante.
El presente trabajo tuvo como objetivo evaluar los cambios morfológicos y funcionales que sufren los espermatozoides modificando consecuentemente la calidad del semen a inseminar.
Materiales y métodos
Se utilizaron 162 muestras de semen de un toro Holando Argentino, de 1000 kg de peso, de fertilidad conocida y cuyos eyaculados fueran obtenidos por medio de vagina artificial. Luego de realizar la evaluación del semen en fresco (macroscópica y microscópicamente), las muestras clasificadas como aptas para congelar fueron procesadas y envasadas automáticamente en pajuelas de 0,5 cc utilizando un diluyente semidefinido: Andromed, Minitub Alemania y a una concentración espermática mínima de 30 millones de espermatozoides por dosis. Las dosis fueron congeladas y almacenadas en tanques de nitrógeno líquido a -196°C. El toro es propiedad de la Cooperativa de Inseminación Artificial de Venado Tuerto (CIAVT) y los procedimientos y análisis mencionados fueron realizados en dicho establecimiento con personal técnico del lugar.
En la Tabla 1 se indican los 54 protocolos de descongelado que fueron probados y cada uno de ellos fue repetido tres veces (3 pajuelas/ protocolo). Los mismos reflejan modificaciones del protocolo tradicional ocurridas a campo, por ejemplo, variaciones en la temperatura de descongelado, el tiempo en que la pajuela está en inmersión en dicho baño o cuando una vez descongelada la dosis, debe esperarse un tiempo antes de efectivizar la inseminación. Cada dosis descongelada se depositó en un eppendorf y se fraccionó en tres alícuotas: una se destinó al análisis de la motilidad, otra para HOST, y una tercera para integridad del acrosoma.
Tabla 1. Listado de protocolos de descongelado analizados

Motilidad, progresión y vigor de los espermatozoides
Se utilizó un sistema computarizado: Sperm Vision (Minitüb, Alemania), con cámara Leja de 2 µl y analizando 10 campos microscópicos. Este procedimiento se repitió tres veces por cada protocolo probado.
Los parámetros C.A.S.A. (Computer Assisted Semen Analysis) medidos fueron:
- Porcentaje de espermatozoides mótiles (MOT): porcentaje de células que tienen movimiento.
- Porcentaje de espermatozoides progresivos (PRO): porcentaje de células que siendo mótiles, describen un desplazamiento hacia delante.
- Concentración de espermatozoides progresivos por dosis ([]prog/dosis): expresada en millones.
- Velocidad curvolineal (VCL): velocidad calculada sobre el camino real del espermatozoide entre dos puntos de su trayectoria, expresada en micrones por segundo. Describe la motilidad real de los espermatozoides (Figura 1).
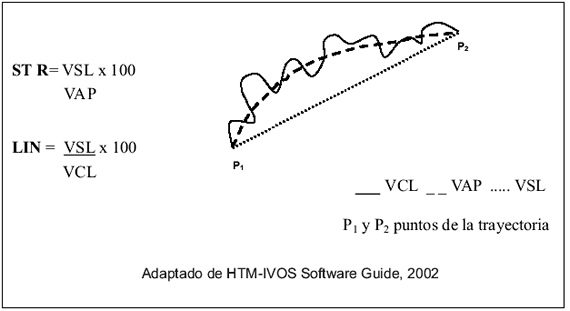
Figura1. Razones entre las velocidades de los espermatozoides
- Velocidad lineal (VSL): velocidad del espermatozoide sobre una línea recta entre dos puntos medida en micrones por segundo (Figura 1).
- Velocidad promedio en su trayectoria (VAP): velocidad promedio del espermatozoide sobre el camino real del espermatozoide expresada en micrones por segundo (Figura 1).
- Linealidad (LIN= (VSL/VCL)*100): desviación de la velocidad del camino real a la velocidad en línea recta expresada en porcentaje.
- Rectilineidad (STR= (VSL/VAP)*100): desviación de la velocidad promedio a la velocidad en línea recta expresada en porcentaje.
-Amplitud lateral de la cabeza (ALH): distancia promedio del desplazamiento de la cabeza desde la posición media del camino, expresada en micrones.
- Frecuencia de batido (BCF): frecuencia de corte de los movimientos laterales de la cabeza del espermatozoide, expresada en Hertz (Hz).
- Distancia en el camino promedio (DAP): distancia promedio expresada en micrones por segundos.
- Distancia en línea curva (DCL): distancia recorrida calculada sobre el camino real del espermatozoide y expresada en micrones por segundo.
- Distancia en línea recta (DSL): distancia recorrida calculada sobre la línea recta que une el punto inicial con el final de la trayectoria, expresada en micrones por segundo.
Los parámetros VCL, ALH y BCF se consideraron medidas que reflejan el vigor de los espermatozoides, y los parámetros VSL, STR y LIN la progresividad, según la categorización realizada por Cancel et al. (2000).
Funcionalidad de la membrana plasmática o integridad celular
Se incubó el semen durante 60 minutos en una solución hipoosmótica de fructosa y citrato de sodio a 100 mOsm/L en un baño María termoestable a 37°C. Para el análisis se realizaron tres lecturas por muestra descongelada observando 200 espermatozoides cada vez, y utilizando un microscopio óptico a 1000 aumentos. Los espermatozoides con cola enrollada totalmente, parcialmente, o simplemente acodada se consideraron vivos (reaccionados) y el resultado final se expresó porcentualmente (HOST). En cada muestra seminal debió observarse un mínimo de 40% de reaccionados para considerarla adecuada.
Integridad del acrosoma
Para la evaluación se colocó una gota de semen sobre un portaobjetos y al lado una gota similar de glutaraldehído al 0,2% diluido con buffer fosfato salino. Se realizaron tres lecturas por cada pajuela descongelada utilizando un microscopio de contraste de fase (1000X) y contando en cada extendido 100 espermatozoides. Para ello la muestra de semen se fijó con glutaraldehído al 2%. El defecto pudo ser la falta total del capuchón acrosómico o su pérdida en distintas proporciones. El resultado final se expresó en porcentaje e indica la proporción de acrosomas dañados (AD), no más del 50% de los espermatozoides debieron presentar acrosomas dañados para que la dosis sea considerada de calidad.
Análisis realizados
Se estimaron los promedios y errores estándar de las variables MOT, PRO, []prog/ dosis, VCL, VSL, VAP, LIN, STR, ALH, BCF, DAP, DCL, DSL, HOST, AD, ANORM. Se probó si existían diferencias significativas entre los protocolos mediante la aplicación de análisis de la variancia a un criterio de clasificación y pruebas de comparaciones múltiples HSD de Turkey-Kramer. Se calcularon coeficientes de Pearson a los efectos de establecer relaciones entre las variables estudiadas. Todos los análisis estadísticos fueron realizados utilizando el programa JMP en su versión 5.0 para Windows (JMP®, 2003).
Resultados
Motilidad, progresión y vigor de los espermatozoides (Parámetros CASA)
Los promedios y errores estándar para cada una de las variables analizadas en función de los cambios de temperatura propuestos se muestran en la Tabla 2. Las diferencias significativas (p<0,05) surgieron sobre los parámetros MOT, PRO, []prog/dosis, VCL, VAP, VSL, DCL, DAP, DSL al comparar las temperaturas de 21°C, 75°C y 95°C con respecto a 35°C, 37°C y 40°C.
Tabla 2. Comparación de distintas temperaturas del baño para descongelado de la dosis

Considerando como protocolo base a 37°C/1' y modificando únicamente el tiempo transcurrido desde el momento de retirar la pajuela del termo de nitrógeno hasta depositarla en el baño de descongelación, las diferencias significativas (p<0,05) se observaron al extender este tiempo por más de 1'. Una demora en esta etapa del proceso de descongelación llevó a un deterioro de los siguientes parámetros: MOT, PRO, []prog/dosis, DCL, DSL, VCL, VAP y BCF (Tabla 3).
Tabla 3. Comparación de distintos tiempos desde retirar la pajuela del termo de nitrógeno hasta depositarla en el baño de descongelado

En cambio, al mantener este tiempo en 4'' y la temperatura en 37°C y variando el tiempo de inmersión de las pajuelas se observó que las diferencias significativas (p<0,05) surgieron sobre MOT, PRO y DCL. Estos parámetros sufrieron una disminución cuando el tiempo utilizado fue menor a 45'' o mayor a 1' (Tabla 4).
Tabla 4. Comparación de tiempos de inmersión de la pajuela en el baño de descongelación a 37°C
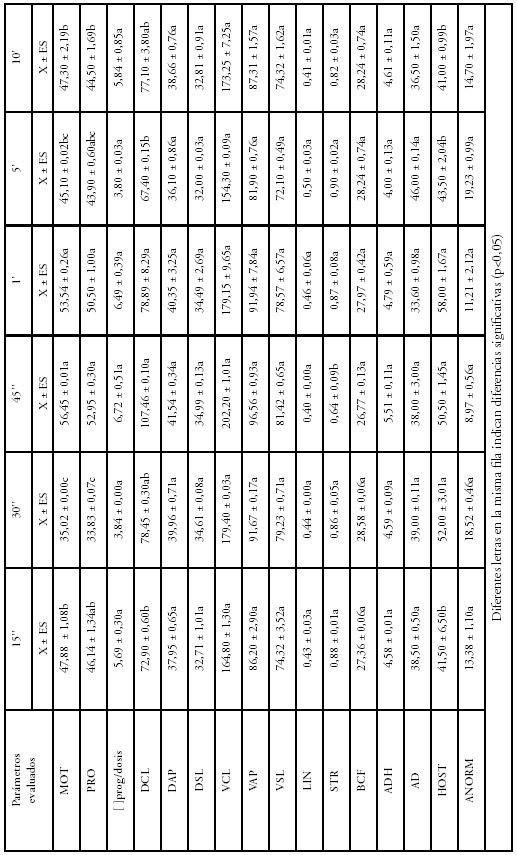
Si luego de realizar el descongelado de una dosis utilizando un protocolo de 4'' 37°C/1', ésta queda expuesta por el término de 20' a temperatura ambiente media de 22°C y 9°C la calidad seminal se deteriora significativamente (p< 0,05). Los cambios se observaron en relación a MOT, PRO, []prog/dosis y BCF (Tabla 5).
Tabla 5. Comparación de distintos tratamientos de la pajuela luego de ser descongelada.

El protocolo que resultó en una calidad de semen significativamente menor fue 75°C/9'' mientras que la mejor calidad resultó al usar indistintamente los protocolos de, 35°C o 37°C/30''-1' y 40°C/30''. Las diferencias de calidad se encontraron en los siguientes parámetros: MOT, VAP, VSL, VCL, DCL, DCP y DLC.
Teniendo en cuenta los parámetros establecidos por las normas ISO 9002 (un mínimo de 30% de espermatozoides progresivos y 6 millones de progresivos por dosis) para garantizar la calidad del semen bovino descongelado, se diferenciaron dos grupos de protocolos. Los que permitieron obtener una calidad final del semen aceptable para inseminar (grupo CA) y aquellos que no lo permitieron (grupo CNA o de calidad no aceptable para inseminar) (Tabla 6). Las modificaciones que llevan a no superar el examen de calidad se refirieron, fundamentalmente, a los cambios bruscos de temperatura para descongelar, demorar la inseminación una vez que la dosis fue descongelada, y extender el tiempo transcurrido al retirar la pajuela del termo de nitrógeno o al modificar en extremo el tiempo de inmersión para descongelar.
Tabla 6. Listado de protocolos de descongelado analizados

Dentro del grupo CA los parámetros MOT, PRO y []prog/dosis mostraron una significativa correlación (p<0,01) con HOST (r=0,32; r=0,32; r=0,06 respectivamente) con las tres medidas de velocidad (VCL, VAP, VSL), y a su vez estos tres parámetros estuvieron significativamente correlacionados con HOST. Lo dicho no se mantuvo al analizar las muestras de semen pertenecientes al grupo CNA. Una correlación negativa altamente significativa (p<0,001) se encontró entre LIN y REC con ALH, para ambos grupos.
Funcionalidad de la membrana plasmática o integridad celular
El porcentaje de espermatozoides reaccionados disminuyó significativamente (p>0,05) cuando el tiempo utilizado para pasar la dosis del termo de nitrógeno al baño de descongelado fue de 1' o de 5' (Tabla 2). Esta misma situación se evidenció cuando la temperatura de descongelado fue de 21, 55, 75 y 95°C (Tabla 3) y cuando al mantener esta temperatura en 37°C, el tiempo de exposición fue de 15'', 5' o 10' (Tabla 4). Las variaciones señaladas de estos dos parámetros fueron también significativas al demorar la inseminación provocando exposición de las dosis a temperatura ambiente (22°C y 9°C) por el término de 20' (Tabla 5).
Integridad del acrosoma
Dentro de las temperaturas probadas para descongelar las dosis, se observó que el porcentaje de espermatozoides con acrosoma dañado fue similar al utilizar temperaturas de 35°C, 37°C y 40°C. Cuando las temperaturas estuvieron por encima de estas (55°C, 75°C y 95°C), el porcentaje de acrosomas dañados se redujo de manera significativa (p<0,05) (Tabla 2).
No se observaron diferencias significativas frente a las modificaciones del tiempo implementado en retirar la pajuela del termo de nitrógeno, así como al variar el tiempo de inmersión en el baño para descongelar (Tablas 3 y 4).
Si después de descongelar la pajuela, la misma es expuesta a temperatura ambiente (22°C y 9°C) por un tiempo de 20', el porcentaje de acrosomas dañados se incrementó significativamente (p<0,05) (Tabla 5).
Discusión
Durante el proceso de descongelado de una pajuela, los espermatozoides se encuentran una vez más, luego del proceso de criopreservación, sometidos a una acción perjudicial, hecho que repercute sobre la capacidad fecundante del semen que será utilizado en inseminación artificial8, 14.
El empleo de semen congelado supone un análisis del semen fresco a fin de evaluar las características del eyaculado que determinan si el mismo se ajusta a ser congelado. Posteriormente, previo a que la partida de semen sea definitivamente almacenada, se realiza otra evaluación para conocer si una dosis al ser descongelada resulta con una calidad"aceptable" para su comercialización según las características mínimas establecidas por normas ISO. En el presente trabajo, bien se utilizó un único toro y esto puede ser discutido puesto que numerosos son los investigadores que demostraron la variabilidad entre animales y también entre eyaculados de un mismo animal, nosotros decidimos tomar como punto de partida, justamente el expuesto anteriormente, una dosis que comercializa un centro de inseminación con calidad de aceptable según los parámetros requeridos. Y desde aquí, se simularon variaciones de cada paso del protocolo de descongelado y después de esto se demora en ejecutar la inseminación, a fin de conocer puntualmente que características de los espermatozoides se ven más afectadas en cada caso, y si estos desmanejos ocurrieran a campo, tener así más elementos para poder tomar la decisión si se insemina o no con dicha dosis.
El control de la temperatura y el tiempo de exposición del baño de descongelado resultaron de vital importancia para mantener las características estructurales y funcionales intactas en la mayor cantidad posible de espermatozoides. Las temperaturas extremas (21°C por 5 minutos, 75°C por 9 segundos y 95°C por 7 segundos), tuvieron un efecto detrimental significativo sobre los espermatozoides mótiles progresivos, la velocidad, la distancia recorrida a lo largo de la trayectoria de desplazamiento y sobre el porcentaje de espermios con una membrana funcionalmente activa. Sí, las temperaturas más elevadas permitieron reducir significativamente el porcentaje de espermatozoides con acrosomas dañados (Tabla 2), característica comprometida directamente con el proceso de penetración al oocito. Esto último también fue comprobado por otros autores, los que observaron que por cada 20°C de aumento en la temperatura de descongelación (35, 55, 75 y 95°C) la retención acrosomal se incrementaba entre el 4,4 y 6,6% 19; 23. Las altas temperaturas, en general, se relacionan favorablemente con la calidad del semen obtenido al descongelar, más aun cuando las temperaturas son extremadamente elevadas como 115 y 135°C. Sin embargo, controlar tales temperaturas a campo y además teniendo en cuenta que los tiempos de inmersión son muy breves, es prácticamente inviable. Esta situación hace que el beneficio de las temperaturas elevadas (mayor retención de acrosomas) se diluya, motivo por el cual no resulta aconsejable adoptar a campo este tipo de protocolos 10.
Los protocolos con temperaturas intermedias entre las mínimas y máximas probadas (35°C, 37°C y 40°C) resultaron en una calidad superadora cuando se complementaron con tiempos no menores a 30 segundos y no mayores a un minuto.
Se consideró a 37°C como temperatura estándar por dos razones, una porque fue la temperatura intermedia dentro del grupo que permitió obtener una calidad seminal comercialmente aceptable, y otra, porque coincide con la temperatura corporal del tracto reproductivo de la hembra donde la dosis será depositada. Situación que permite evitar cambios bruscos de temperatura que deterioren la calidad del semen a inseminar. Además, los resultados demostraron que el tiempo que la pajuela debe estar sumergida deberá ser entre 45 segundos y un minuto, por debajo o encima de estos tiempos los espermatozoides mótiles y progresivos disminuyeron significativamente (Tabla 4). Decuadro-Hansen (2010) y Pace et al. (1981) compararon la fertilidad, medida como tasa de no retorno a los 60-90 días, obtenida al utilizar semen descongelado a 37°C con distintos tiempos de inmersión en el baño. En ambos casos los mejores resultados se obtuvieron al extender el tiempo en que la pajuela se sumerge en el agua caliente entre 30 y 60 segundos.
Si en cambio, el tiempo que lleva retirar la pajuela del nitrógeno se extiende por un plazo superior a un minuto, además de las variables antes mencionadas se deteriora también la funcionalidad de la membrana plasmática, la velocidad (VAP y VCL), la distancia, la frecuencia de cabeceo y amplitud del desplazamiento de la cabeza (Tabla 3). En este sentido, Garcia Guerra et al. (2008) al evaluar mediante el sistema CASA el efecto de la exposición de semen congelado al ambiente por distintos tiempos, encontraron diferencias significativas en exposiciones mayor a 30 segundos (también descongelando a 37°C por un minuto) y los parámetros que disminuyeron fueron el porcentaje de espermatozoides mótiles y progresivos, no encontrando diferencias para de velocidad, distancia y cabeceo. También, Dejarnette et al. (2000) demostraron que los cambios deletéreos que pueden sufrir los espermatozoides en el proceso previo al descongelado, son seriamente negativos y superan en sus efectos dañinos a los perjuicios ocasionados por los cambios del protocolo de descongelado.
Una vez que la dosis fue descongelada, esta deberá ser inseminada inmediatamente cuidando que no sufra cambios bruscos de temperatura. Ocasionalmente, puede darse la situación de tener la pajuela descongelada, lista para aplicar pero causas diversas pueden demorar dicha acción, por ejemplo por unos 20 minutos, exponiendo la pajuela a temperatura ambiente (22°C y 9°C como promedios para la primavera y el otoño) (Tabla 5). Frente a esta situación nuestros resultados demuestran que tales desmanejos generan cambios detrimentales en la calidad de los espermatozoides afectando parámetros que hacen referencia a la funcionalidad de la membrana celular y del acrosoma, motilidad, progresión y frecuencia de batido de los espermatozoides.
Investigaciones anteriores corroboraron que cualquier variación de la temperatura post-descongelación resulta dañino para los espermatozoides, independientemente de la temperatura a la que se descongeló (5°C o 35°C), de la velocidad de calentamiento y de si estos cambios se producen inmediatamente o luego de unos minutos de la descongelación. Además, comprobaron que la fertilidad (tasa de no retorno) fue significativamente mayor cuando las dosis descongeladas fueron inseminadas sin demoras evitando el efecto ambiente sobre ellas1, 9; 21; 22.
Finalmente la relación encontrada entre las variables estudiadas en este trabajo fue similar a lo comentado por Kathiravan et al. (2008), así la correlación positiva entre los parámetros de velocidad y la motilidad progresiva indican que los espermatozoides con una ruta de avance en línea recta pueden cubrir una mayor distancia en menor tiempo; la correlación positiva entre HOST y motilidad progresiva demuestra que los espermatozoides que cuentan con una membrana plasmática intacta y bioquímicamente activa lograrán una motilidad progresiva mayor. Sin embargo la relación entre los parámetros de velocidad y HOST pone al descubierto que el avance o progresión en la trayectoria también depende de la funcionalidad de las mitocondrias alimentando energéticamente al flagelo.
Otros autores también han demostrado que las características evaluadas sobre los espermatozoides guardan relación con la tasa de fertilización o con parámetros de fertilidad. Kathiravan et al. (2008) al analizar la relación entre los diferentes parámetros CASA y la fertilización in vitro, observaron que la motilidad progresiva contribuyó en un 62,6% a la variación del porcentaje de fertilización obtenido. Si además de estas variables se considera la velocidad (VAP y VSL) y HOST puede explicarse el 66,1% de la variación encontrada en el porcentaje de fertilización. Suleyman et al. (2008) demostraron que los defectos de acrosoma y otros defectos morfológicos fueron significativamente menores en un grupo de toros de alta fertilidad comparados con los de baja fertilidad. Contrario a estos resultados, Andersson et al. (1988) no observaron correlación entre daño acrosomal y fertilidad. Por otra parte, Correa et al. (1997) comunicaron una baja integridad de dicha estructura en toros de alta tasa de fecundidad en comparación con los de baja fertilidad.
Se recomienda no exponer la pajuela a temperatura ambiente, más allá del tiempo estrictamente necesario para retirarla del termo y depositarla en el baño de descongelado, utilizar temperaturas de descongelación que vayan entre los 35 y 40°C por 30 a 60 segundos, debiendo inseminar inmediatamente o conservar la dosis descongelada sin que sufra cambios bruscos de temperatura.
1. Almquist, JO. Effect of cold shock after thawing on acrosomal maintenance and motility of bovine spermatozoa frozen in plastic straws. J. Dairy Sci. 1976; 59:1825-29. [ Links ]
2. Andersson, M.; Vierula, M.; Alanko, M. Acrosomal morphology and fertility in AI-bulls. 11th International Congress on Animal Reproduction and Artificial Insemination 1988. Dublin. Vol. III, pp. 222-24. [ Links ]
3. Anzar, M., Rasul, Z., Ahmed, T.A., and Ahmad, N. Response of buffalo spermatozoa to low temperatures during cryopreservation. Reproduction, Fertility and Development. 2010; 22 (5):871-880. [ Links ]
4. Brogliatti, GM. Impacto de la calidad seminal en los programas de IATF. http://www.abspecplan.com.br/upload/library/Impacto_seminal.pdf. 2005. [ Links ]
5. Cancel, AM.; Lobdell, D.; Mendola, P.; Perreault, D. Objective evaluation wing assisted reproductive tesperm analysis. Human Reprod. 2000; 15 (6):1322-28. [ Links ]
6. Cormier, N.; Sirard, M.; Bailey, J. Premature capacitation of bovine spermatozoa is initiated by cryopreservation. J. Androl. 1997; 18:461-68. [ Links ]
7. Correa, JR.; Pace, MM.; Zavos, PM. Relationships among frozen-thawed sperm characteristics assessed via the routine semen analysis, sperm functional tests and fertility of bulls in an artificial insemination program. Theriogenology. 1997; 48:721-31. [ Links ]
8. Crespilho, A.M.; Papa, FO.; Junior, AM.; Dell'Aqua Junior, JA. Evaluation of frozen bovine semen: how do semen collection and processing centers evaluate the quality of commercialized simples? Vet e Zootec. 2009; 16(2):335-42. [ Links ]
9. De Abreu, RM.; Berndtson, WE.; Smith, RL. y Pickett, BW. Effect of post thaw warnming on viability of bovine spermatozoa thawed at different rates on French straws. J. Dairy Sci. 1979; 62:1449-54. [ Links ]
10. Decuadro-Hansen, G. Manejo del semen en un programa de IATF: aspectos críticos para preservar la fertilidad. Conferencia. Quintas Jornadas TAURUS de Reproducción Bovina 2010. Campus Nuestra Señora del Pilar, Universidad del Salvador. Buenos Aires, Argentina. [ Links ]
11. Dejarnette, J.M.; Barnes, D. A.; Marsahall, C.E. Effects of pre and post- thaws thermal insults on viability characteristics of cryopreserved bovine semen. Theriogenology. 2000; 1;53 (6): 1225-38. [ Links ]
12. Foote, R. Fertility estimation: a review of past experience and future prospects. Anim. Reprod. Sci. 2003; 75:119-139. [ Links ]
13. Garcia Guerra, A.; Etcheverry, M.P.; Larraburu, G.; Brogliatti, G.M. Efecto de la exposición de semen congelado al ambiente por distintos tiempos evaluado mediante el sistema CASA. InVet. 2008; 10 (1):169. [ Links ]
14. Graham, J. K.; Mocé, E. Fertility evaluation of frozen/ thawed semen. Theriogenology. 2005; 64:492-504. [ Links ]
15. Kathiravan, P.; Kalatharan, J.; John Edwin, M.; Veerapandian, C. Computer automated motion analysis of crossbred bull spermatozoa and its relationship with in vitro fertility in zona-free hamster oocytes. Anim. Reprod. Sci. 2008; 104:9-17. [ Links ]
16. Muiño, R.; Fernández, M.; Areán, H.; Viana, J.L.; López, M.; Fernández, A.; Peña, A.I. Nuevas Tecnologías aplicadas al procesado y evaluación del semen bovino en centros de inseminación artificial. ITEA. 2005; 101 (3): 175-91. [ Links ]
17. Pace, M.M.; Sullivan, J. J.; Elliott, F.I.; Graham, E. F. and Coylter, G. H. Effects of thawing temperature, number spermatozoa and spermatozoa quality on fertility of bovine spermatozoa packaged in 0.5 ml French straws. J Anim Sci. 1981; 53: 693-701. [ Links ]
18. Quintero-Moreno, A.; Rubio-Guillén, J.; González Villalobos, D.; Palomares, R.; Madrid-Bury, N. Efecto de la criopreservación sobre la integridad estructural y funcional de la membrana plasmática de espermatozoides de toros. XI Jornadas Nacionales de la Facultad Experimental de Ciencias 2007. Maracaibo, Venezuela. [ Links ]
19. Rodríquez, DL.; Berndtson, WE.; Ennew, BD. y Pickett, BW. Effect of rates of freezing, thawing and level of glicerol on the survival of bovine spermatozoa in straws. J. Anim. Sci. 1975; 41:129-33. [ Links ]
20. Rubio-Guillén, J.; Quintero-Moreno, A.; González Villalobos, D. Efecto de la criopreservación sobre la integridad de la membrana plasmática y acrosomal de espermatozoides de toro. Revista Científica, FCV-LUZ. 2009; 19(4):382-89. [ Links ]
21. Senger, PL.; Becker, WC. y Hillers, JK. Effect of rates of freezing, thawing and level of glicerol on the survival of bovine spermatozoa in straws. J. Anim. Sci. 1976; 41:129-33. [ Links ]
22. Senger, PL. Handling frozen bovine semen-factors wick influence viability and fertility. Theriogenology. 1980; 13:51-62. [ Links ]
23. Suleyman Bacinoglu; Muzaffer Tas; ü müt Cirit; Özen Banu Özdas; Kemal Aka. The potential fertility estimation capacity of the hypoosmotic swelling test, the thermal stress test and a modified cervical mucus penetration test in the bovine. Anim. Reprod. Sci. 2008; 104:38-46. [ Links ]














