Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
InVet
versão On-line ISSN 1668-3498
InVet vol.13 no.2 Ciudad Autónoma de Buenos Aires jul./dez. 2011
COMUNICACIÓN CORTA
Clonado de cepas de Tritrichomonas foetus obtenidas de infecciones naturales en bovinos
Doumecq, M.L.1, 2; Soto, P.2; Echevarría, H.2; Monteavaro, C.2
1Becaria CONICET.
2Laboratorio de Microbiología Clínica y Experimental. Centro de Investigación Veterinaria de Tandil (CIVETAN) CONICET. Facultad de Ciencias Veterinarias. UNCPB
Correspondencia e-mail: Laura Doumecq ldoumecq@vet.unicen.edu.ar
Recibido: 13/06/2011
Aceptado: 16/03/2011
Resumen
El objetivo del presente trabajo es describir una técnica sencilla para clonar cepas de Tritrichomonas foetus en un medio sólido. A partir de diferentes cepas obtenidas de infecciones naturales de bovinos se ensayaron dos técnicas: Homogeneizado en tubo y Homogeneizado en placa. Para cada una de ellas se evaluaron diferentes concentraciones de agar en el medio de cultivo y el tiempo de incubación más apropiado. Los resultados obtenidos demostraron que la técnica más adecuada fue la técnica de Homogeneizado en placa, con una concentración de agar 0,45 g % p/v y un tiempo de incubación de 5 días en anaerobiosis. Esta técnica resulta un procedimiento útil y sencillo para la obtención de clones de T. foetus ya que permite el crecimiento de protozoarios en colonias aisladas sobre un medio sólido. Además la técnica puede ser utilizada para evaluar la producción de colonias hemolíticas por la presencia de glóbulos rojos en el medio de cultivo.
Palabras clave: Tritrichomonas foetus; Clonado; Cepas de campo; Medios de cultivo.
Cloned strains of Tritrichomonas foetus obtained from natural infections in cattle
Summary
The aim of this work is to describe a simple technique to cloned strain of Tritrichomonas foetus in a solid medium. From different strains from natural infections in cattle two techniques: Homogenized in tube and Homogenized in plate were tested. The must appropriate agar concentrations in the culture medium and incubation time were evaluated for each techniques. The results showed that the most appropriate technique was Homogenized in plate with an agar concentration of 0.45 g% w /v and an incubation time of 5 days. This technique is a useful and easy to obtain clones of T. foetus, allows the growth of protozoa in isolated colonies on solid media. Furthermore the technique can be used to evaluate the production of hemolytic colonies for the presence of bovine red blood cells in the culture medium.
Key words: Tritrichomonas foetus; Cloned; Field strains isolates; Culture medium.
Introducción
La Tricomonosis bovina es una enfermedad de transmisión sexual que causa fallas reproductivas cuyo agente etiológico es un protozoario flagelado denominado Tritrichomonas foetus (T. foetus)10.
El método de rutina válido para el diagnóstico de la Tricomonosis es el aislamiento e identificación del agente causal a partir de muestras clínicas prepuciales, mucus vaginal o fluido abomasal de feto abortado. La eficiencia del diagnóstico dependerá de una suma de factores como la técnica de muestreo, la calidad de la muestra, condiciones de transporte y características del medio de cultivo para el aislamiento del protozoario10.
T. foetus posee un metabolismo respiratorio anaerobio aerotolerante y sobrevive en el tracto reproductor en un pH aproximadamente neutro. Las tensiones elevadas de oxígeno como un pH ácido ó alcalino actúan como un factor limitante en su crecimiento. Un medio de cultivo adecuado debe proporcionar los requerimientos mínimos que necesita T. foetus para su desarrollo in vitro. Para ello debe contar con una fuente proteica, hidratos de carbono, sustancias reductoras de la tensión de oxígeno y una fuente lipoproteica14. Es importante contar con una adecuada mezcla de antimicrobianos para inhibir el desarrollo de los agentes contaminantes y permitir que el protozoario crezca sin competencia por los nutrientes del medio de cultivo3.
El primer aislamiento de T. foetus fue realizado en 1933 por Witte16, usando una solución de caldo peptonado con 5 a 10% de sangre desfibrinada; desde entonces ha sido cultivado y evaluado en diferentes medios de cultivo. Entre los más empleados se pueden citar al medio Plastridge modificado por Fitzgerald7 que contiene una pequeña cantidad de agar al igual que el medio de Diamond5 también denominado TYM (Trypticasa- extracto de levadura- maltosa) y el medio Sutherland15 basado en un caldo de infusión de hígado.
La casuística diagnóstica en la Argentina sugiere que la situación epidemiológica es diferente en cada región ganadera encontrándose tasas de infección en establecimientos que oscilan entre el 11 al 30 %11,12. Otro aspecto relevante desde el punto de vista epidemiológico es la variación de la persistencia de la infección en el tracto reproductor de la hembra2. Estas observaciones han motivado a los autores a continuar con los estudios sobre la caracterización patogénica y molecular de cepas de T. foetus presentes en nuestro país. Para ello es imprescindible conformar un cepario representativo de las diferentes regiones ganaderas y a partir de los aislamientos primarios, obtener cepas clonadas que representen sus características genéticas y fenotípicas en pureza.
En tal sentido no se mencionan referencias de metodologías sencillas que describan un procedimiento de clonado de cepas de T. foetus. La mayoría de las técnicas descriptas fueron realizadas con T. vaginalis y se las asocia a la capacidad de estos protozoarios de producir hemólisis en agar sangre4. Algunos autores, como Asami y col.1 y Filadoro y Orsi6 describieron aislamiento de colonias de T. vaginalis por diferentes métodos sin embargo, fue Ivey8 en 1961 el primero en describir una técnica favorable para obtener colonias aisladas de T. vaginalis en medios sólidos. Luego Krieger y col9 en 1983 describieron una técnica para analizar la producción hemolítica de cepas de T. vaginalis. La única publicación que describe el clonado de diferentes especies de Trichomonas y entre ellas T. foetus, es de Samuels usando un método laborioso con una doble capa de agar13.
El objetivo del presente trabajo es describir una técnica sencilla para clonar cepas de T. foetus aisladas de infecciones naturales para su posterior estudio. Con este propósito, se ensayaron dos técnicas diferentes y se evaluaron dos variables, la concentración de agar en el medio de cultivo y el tiempo de incubación más apropiado para la visualización de colonias definidas.
Materiales y métodos
Cepas de T. foetus
Para la puesta a punto de la metodología de clonado se utilizaron 3 cepas de T. foetus aisladas de material prepucial de toros infectados naturalmente. Las cepas fueron subcultivadas en caldo TYM5 por 24 a 48 h a 37 ºC. Luego los protozoarios fueron centrifugados a 1000xg y resuspendidos con buffer fosfato salino estéril (BFS; pH 7,2 0,01M) ajustando la concentración a 3 x 103 T. foetus/ml mediante el conteo en cámara de Neubauer
Medio de cultivo
Se utilizó como base el medio de Diamond5 (TYM), con las siguientes concentraciones de agar: 0,45; 0,5; 0,55 y 0,6 g % p/v, las cuales fueron preparadas en cuatro erlenmeyer. Cada concentración se hizo por duplicado para ser utilizadas en ambas técnicas. Los erlenmeyer fueron mantenidos en un baño de agua termostatizado a 50ºC para evitar su solidificación hasta el momento de su empleo.
Eritrocitos bovinos
A partir de sangre bovina con 20 % de anticoagulante (ACD: ácido cítrico, citrato de Na, dextrosa Merck®), se procedió a separar los eritrocitos mediante centrifugado a 1000xg durante 10 minutos y se resuspendió en BFS pH 7,2 estéril.
Técnica de Homogeneizado en tubo
A cada uno de los cuatro erlenmeyer con los medios de cultivo se le agregó 10 % de suero equino inactivado a 56 ºC durante 30 minutos y los antibióticos (penicilina G 1000 UI/ml Fluka®, estreptomicina 1 g/L Sigma- Aldrich® y nistatina 436 UI/ml Parafarm®). Luego de homogeneizar por agitación, el medio de cultivo se fraccionó en tubos de hemólisis tapa a rosca con 5 ml cada uno. Se rotularon los tubos según la concentración de agar. A cada uno de los tubos, se le agregó 0,1 ml de la suspensión de protozarios a las concentraciones indicadas y 0,1 ml de eritrocitos bovinos al 2% v/v. Posteriormente fueron homogeneizados y vertidos en placas de Petri de 6 cm de diámetro.
Técnica de Homogeneizado en placa
El medio de cultivo utilizado en este ensayo fue preparado de acuerdo con la descripción anterior. En cada placa de Petri de 6 cm de diámetro, se agregó 0,1 ml de la suspensión de protozoarios a las concentraciones indicadas y luego se adicionó 5 ml del medio de cultivo. Los protozoarios y el medio de cultivo se homogeneizaron suavemente mediante movimientos circulares.
En ambas técnicas la incubación se realizó en jarras de anaerobiosis utilizando sobres generadores de dióxido de carbono e hidrógeno (Anaerogen TM AN 35 OXOID®) a 37 ºC evaluando el crecimiento a los 4, 5 y 6 días.
Observación de colonias
Para la caracterización de colonias y determinación de la presencia de protozoarios se tuvieron en cuenta los siguientes parámetros:
a) observación macroscópica de colonias de T. foetus teniendo en cuenta: morfología, diámetro, presencia o ausencia de halo de hemólisis.
b) observación microscópica de la colonia (4 X y 10 X).
Resultados
Técnica de Homogeneizado en tubo
Durante la observación macroscópica de las placas al 4º, 5º y 6º días de incubación y con sus diferentes concentraciones de agar, no se observó la formación de colonias aisladas. No obstante la observación microscópica de alícuotas de medio permitió detectar la presencia de T. foetus con morfología y movimientos típicos.
Técnica de Homogeneizado en placa
Con esta metodología se pudo observar macroscópicamente, a partir del 4º día, la formación de colonias pequeñas con halo de hemólisis en las placas con 0,45 g % p/v de agar. En las observaciones posteriores, al 5º y 6º día, las colonias formadas fueron aumentando su tamaño como también la zona de hemólisis (Figura 1).
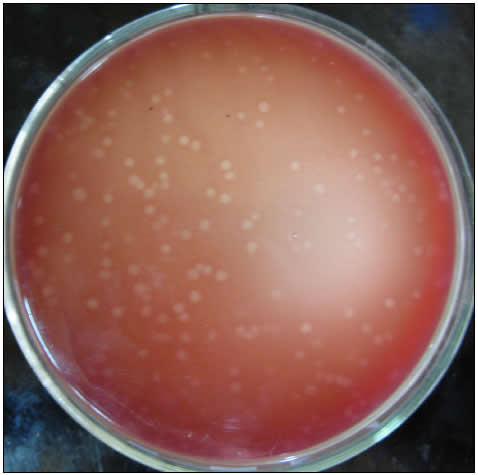
Figura 1. Observación macroscópica del reverso de una placa con una concentración de 0,45 % p/v de agar y 5 días de incubación. Se observa la formación de colonias hemolíticas de T. foetus.
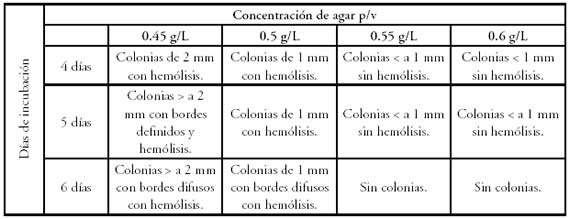
En los medios preparados con 0,5; 0,55 y 0,6 g % p/v de agar, se observó la formación de colonias pequeñas o puntiformes con halo muy estrecho que fue ampliándose hacia el 6º día (Tabla 1).
Tabla 1. Caracterización macroscópica de las colonias con la técnica de Homogeneizado en placa teniendo en cuenta el tamaño y presencia o ausencia de hemólisis.
Microscópicamente, a partir de las colonias visibles y definidas en las placas, se observaron, T. foetus con buena morfología y motilidad (Figura 2). No obstante, en las placas con 6 días de incubación, en las colonias formadas se observaron T. foetus con morfología atípicas y escasa motilidad.

Figura 2. Observación microscópica (4X) del centro de la colonia de T. foetus en la placa de petri.
No se observaron colonias bacterianas o fúngicas en ninguna de las dos técnicas ensayadas.
En las placas donde hubo formación de colonias el número obtenido fue satisfactorio con un promedio de 50 colonias, teniendo en cuenta que el número de protozoarios sembrados fue de 60 por placa aproximadamente.
Discusión
La técnica de clonado de trichomonas reportada por Samuels13 a partir de dos concentraciones de agar, describe la formación de colonias de Trichomonas spp. entre ambas capas. Este autor menciona haber clonado cepas de T. foetus, no obstante en su reporte no hay una descripción técnica de las colonias ni el tiempo de formación.
En el diseño experimental del presente trabajo se evaluaron las variables: concentración de agar y el tiempo de incubación. Ivey8 menciona en su trabajo que una concentración de agar menor a 0,35 % p/v impiden la solidificación del medio y mayor a 0,6 % p/v no permiten la formación en colonias. Teniendo en cuenta estos antecedentes con T. vaginalis, se realizaron ensayos con una concentración de agar entre 0,45 a 0,6 % p/v. En este contexto se consideró un punto crítico el control de la temperatura entre 45 y 50 ºC durante la homogeneización del protozoario con el medio de cultivo para asegurar la viabilidad de las T. foetus.
Los resultados del presente trabajo demuestran que la técnica de homogeneizado en placa fue la técnica más adecuada, permitiéndonos con una concentración de agar de 0,45 % p/v y un tiempo de incubación de 5 días, observar colonias aisladas con bordes bien delimitados, redondas de 1 a 2 mm de diámetro y con una leve depresión en la superficie del agar. Por otro lado, con la Técnica de Homogeneizado en tubo no hubo formación de colonias aisladas pero se observaron protozoarios vivos entre el agar y el fondo de la placa. La incapacidad para crecer formando colonias aisladas podría atribuirse al shock térmico que sufren los protozoarios cuando son homogeneizados en el tubo con el medio a 50ºC, este contacto es aproximadamente de 15 a 30 segundos hasta la solidificación del medio y descenso de la temperatura. La ventaja de la prueba de Homogeneizado en placa es que al colocar el inóculo sobre el fondo de la placa pasan aproximadamente sólo 5 segundos hasta su solidificación sobre una bandeja refrigerada. En la metodología, el tiempo que transcurre entre el contacto protozoario- medio a 50 ºC, es importante para la futura formación de colonias.
Conclusión
La técnica Homogeneizado en placa resulta un procedimiento útil y sencillo para la obtención de clones de T. foetus ya que permite el crecimiento de protozoarios en colonias aisladas sobre un medio sólido. Además la técnica puede ser utilizada para evaluar la producción de colonias hemolíticas por la presencia de glóbulos rojos en el medio de cultivo.
1. Asami, K.; Yukio, N.; Veno, T. Cultivation of Tritrichomonas vaginalis on solid medium. Exp Parasitol. 1955; 4:34-39 [ Links ]
2. BonDurant, R.H. Pathogenesis, diagnosis, and management of trichomoniasis in cattle. Vet Clin North Am Food Anim Pract. 1997; 13:345-361. [ Links ]
3. Campero, C.M. Medios de cultivo para Tritrichomonas foetus: consideraciones generales. Rev Med Vet. 1992; 85:318-322 [ Links ]
4. De Carli, G.; Brasseur, P.; Tasca, T.; Da Silva, A.; Castilhos, D.S.; Wendorff, A. Hemolityc aspects of strains and clones of Tritrichomonas vaginalis. Parasitol día. 1998; 22:59-64. [ Links ]
5. Diamond, L. The establishment of various Trichomonas of animals and man in axenic cultures. J Parasitol. 1957; 43:488-490. [ Links ]
6. Filadoro, F.; Orsi, N. Cultivation of Tritrichomonas vaginalis on a solid medium and its aplication to the assay of trichomycin potency. Antibiot Chemother. 1958; 8:561-563. [ Links ]
7. Fitzgerald, P.R.; Hammond, D.M.; Shupe, J.L. The role of culture in immediate and delayed examinations of preputial samples for Trichomonas foetus. Rev Vet Med. 1954; 49: 409-413. [ Links ]
8. Ivey, M. Growth charasteristics of Tritrichomonas vaginalis in solid medium. J Parasitol. 1961; 47:539- 544. [ Links ]
9. Krieger, J.N.; Poisson, M.A.; Rein, M.F. Beta-hemolytic Activity of Trichomonas Vaginalis Correlates with Virulence. Infect Immun. 1983; 41:1291-1295 [ Links ]
10. Manual de la OIE sobre animales terrestres 2008. Capítulo 2.4.17. Tricomonosis. En: http://www. oie.int/fileadmin/Home/esp/Health_standards/ tahm/2.04.17.%20Tricomonosis.pdf consultado el 6 de Marzo de 2011. [ Links ]
11. Mardones, F.O; Perez, A.M; Martínez, A; Carpenter, T.E. Risk factors associated with Tritrichomonas foetus infection in beef herds in the Province of Buenos Aires, Argentina. Vet Parasitol. 2008; 153:231-237. [ Links ]
12. Ministerio de Asuntos Agrarios de la Provincia de Buenos Aires. Programa impulso ganadero. Plan Toros. Informe 2006. En: http:// www.maa.gba.gov.ar/impulsoganadero/archivos/PlanToros2006.pdf. consultado el 7 de febrero de 2011. [ Links ]
13. Samuels, R. Agar techniques for colonizing and cloning trichomonads. J Protozool. 1962; 9:103-107. [ Links ]
14. Skirrow S.Z.; BonDurant R.H. Bovine trichomoniasis. Vet Bull. 1988; 58:591-603. [ Links ]
15. Sutherland, A.K.; Simmons, G.C.; Bell, A.T. An outbreak of bovine tricomoniasis. Part 2: diagnosis. Aust Vet J. 1953; 29:67-69. [ Links ]
16. Witte, J. Bakterienfreie ziichtung von Trichomonaden aus dem Uterus des Eindes in einfaehen Nahrboden. Zentralbl Bakteriol Orig.1933; 128:188-195. [ Links ]














