Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
InVet
versión On-line ISSN 1668-3498
InVet vol.14 no.1 Ciudad Autónoma de Buenos Aires jun. 2012
COMUNICACIÓN CORTA
Supervivencia y capacidad infectiva de larvas criopreservadas de nematodes trichostrongylideos
Guzmán, M.1, 2; Fiel, C.A.1; Steffan, P.E.1; Riva, E.1, 2; Bernat, G.1, 3
1Área de Parasitología. Departamento de Sanidad Animal y Medicina Preventiva. Facultad de Ciencias Veterinarias. Universidad Nacional del Centro de la Provincia de Buenos Aires. Campus Universitario Paraje Arroyo seco s/n Tandil (7000) Buenos Aires. Argentina.
2Becaria de Posgrado Tipo II Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET).
3Personal de Apoyo Técnico Comisión de Investigaciones Científicas (CIC).
Correspondencia e-mail: Maricel Guzman mguzman@vet.unicen.edu.ar
Recibido: 14/07/2011
Aceptado: 29/06/2012
Resumen
La criopreservación de larvas infectantes (L3) ha permitido mantener nematodes gastrointestinales en laboratorio por prolongados periodos. El objetivo de este trabajo fue determinar la tasa de supervivencia y la capacidad infectiva post-descongelado de L3 de nematodes gastrointestinales. Para ello se utilizaron L3 denominadas Ayacucho y Balcarce, que fueron desenvainadas y posteriormente congeladas en nitrógeno líquido. Transcurrido un período de 3 y 7 meses, las larvas fueron descongeladas calculándose la tasa de supervivencia (%) considerando la movilidad como vital. La capacidad infectiva se determinó mediante la excreción de huevos en materia fecal de ovinos infectados con L3 criopreservadas. La supervivencia post-descongelado fue 31-70% a los 3 meses y 68-72% a los 7 meses. Los animales comenzaron a eliminar huevos a los 21 días post-inoculación, independientemente del tiempo de congelado y del origen de las larvas. Se destaca la contribución significativa a la investigación en parasitología veterinaria de la técnica de criopreservación.
Palabras claves: Criopreservación; Haemonchus; Ovinos; Descongelado; Infección.
Survival and infective capability of cryopreserved infective larvae of trichostongyles
Summary
Cryopreservation of gastrointestinal nematode infective larvae (L3) has been used to preserver gastrointestinal nematodes in laboratory for a long time. The aim of this study was to establish the survival and infective capability of infective larvae after cryopreservation. A total of 2 isolates named as Ayacucho and Balcarce were used and L3 were exsheathed and thereafter, frozen in liquid nitrogen. Rate of survival (%) was estimated taking into account larval motility after thawing as discriminate factor for live/dead at 3 and 7 months from freezing. Six lambs were infected orally with L3 previously cryopreserved. The nematode infection was monitored through egg excretion in faeces. The rate of survival was 31-70% at 3 months and 68-72% at 7 months of freezing. Nematode eggs in faeces samples were detected at 3 weeks after infection being recorded no differences among isolates and/or freezing period of time. Advantages of the cryopreservation in nematodes research are emphasizing.
Key words: Criopreservation; Haemonchus; Sheep; Thawing; Infection.
Introduccón
El mantenimiento de aislamientos de nematodes trichostrongylideos requiere de una infraestructura importante para el alojamiento y muestreo de los animales utilizados para repicar las infecciones parasitarias con determinada frecuencia. Además, exige el apoyo de actividades de logística y de laboratorio para la producción de larvas infectivas (L3) a partir de la materia fecal recolectada de los animales donantes, que servirán para infectar nuevos individuos y garantizar el mantenimiento de las cepas aisladas a partir de infecciones naturales. Este procedimiento demanda un costo económico y operativo importante que limita seriamente a la mayoría de los grupos de investigación con el riesgo de que en el proceso se pierdan determinados géneros, debido a la acción negativa de temperaturas de refrigeración en su conservación, a un bajo potencial biótico y a diferentes condiciones de eclosión.
La criopreservación de L3 constituye una alternativa para mantener en el laboratorio los aislamientos originados de infecciones naturales12, a la vez que minimiza el número de pasajes en animales, mantiene las características originales de cada población parasitaria10, permitiendo la conservación de los aislamientos por largos períodos de tiempo4, 10. En este sentido cepas de Haemonchus contortus resistentes y susceptibles a benzimidazoles han sido criopreservadas exitosamente en Sudáfrica9, 12.
El objetivo de este trabajo fue determinar la supervivencia y capacidad infectiva post-descongelado de L3 de nematodes gastrointestinales criopreservadas en nitrógeno líquido y su capacidad para infectar animales con fines de investigación
Materiales y Métodos
Obtención de las muestras
Las muestras de materia fecal fueron tomadas de manera individual del recto de animales recolectores en cada uno de los aislamientos, Ayacucho y Balcarce. Las heces fueron cultivadas bajo condiciones de laboratorio para la obtención de larvas infectantes3 y posteriormente recuperadas mediante la técnica de Baermann a fin de efectuar la identificación de los géneros parasitarios5. La prevalencia de los géneros previamente a la criopreservación fue para Ayacucho (1 y 2) de 97% Haemonchus spp., 2% Trichostrongylus spp. y 1% Nematodirus spp., mientras que para Balcarce 78% Haemonchus spp., 19% Trichostrongylus spp. y 3% Teladorsagia spp.
Procesado del material a congelar
Las larvas infectivas fueron desenvainadas con solución de hipoclorito sodio al 0,16% hasta alcanzar aproximadamente un 90% de desenvainado. Posteriormente fueron lavadas con solución fisiológica al 0,9% sobre papel de filtro (Double Rings Filter Paper Nº 102) en embudo conectado a bomba de vacío12, y recolectadas en un equipo de Baermann colocando el papel de filtro con las larvas hacia abajo. Una vez concentradas las larvas en el fondo del tubo, fueron transferidas a criotubos de 2 ml y de inmediato sumergidas directamente en nitrógeno líquido a -196º C en concentraciones que oscilaron entre 30.000 y 32.250 L3 por criotubo (Tabla 1).
Tabla 1. Supervivencia de larvas infectivas (L3) criopreservadas durante 3-7 meses en nitrógeno líquido y su capacidad para infectar ovinos.

Proceso de descongelado
Se descongelaron 2 criotubos correspondientes a cada aislamiento Ayacucho 1 y Balcarce a los 3 meses de efectuado el congelado, y Ayacucho 2 a los 7 meses posteriores al congelado. Durante el proceso, cada criotubo fue sumergido en agua a 55º C durante aproximadamente 2 minutos y posteriormente en agua a temperatura ambiente 25ºC durante 30-40 segundos1. Para el cálculo de supervivencia post-descongelado se contaron las L3 móviles sobre un total de 100 larvas10 sin tomar en cuenta ni las que estallaron ni las que no desenvainaron.
Infección artificial
Luego del descongelado y con el objetivo de determinar la capacidad infectiva de las larvas, se infectaron artificialmente 6 borregos machos libres de parásitos, de 5-6 meses de edad. A cuatro animales se les suministró L3 criopreservadas durante 3 meses y a dos animales L3 criopreservadas durante 7 meses. Todos los animales fueron infectados por vía oral9 con un inóculo de 18.500 larvas móviles en promedio (Tabla 1).
Obtención y procesado de muestras de materia fecal
Para determinar los géneros que se conservaron post-descongelado, se tomaron muestras de materia fecal de todos los animales a los 21 días post-infección para el recuento de huevos (hpg) mediante la técnica de McMaster modificada6. Cuando el hpg resultó positivo, la materia fecal fue cultivada en condiciones de laboratorio según la técnica de Henriksen & Korsholm3. La identificación de los géneros parasitarios en coprocultivos se realizó mediante la clave de identificación de larvas infectantes de nematodes gastrointestinales de ovinos y bovinos5.
Resultados
Tasa de supervivencia de larvas infectivas post- descongelado
La tasa promedio de supervivencia de L3 fue de 58,8%. La supervivencia post-descongelado varió entre 31- 70% y entre 68-72% en aquellas larvas congeladas en nitrógeno líquido por 3 y 7 meses, respectivamente. Las larvas provenientes de Ayacucho mantuvieron porcentajes de supervivencia cercanos al 70% a los 3 meses (Ayacucho 1) y a los 7 meses (Ayacucho 2) posteriores al congelado (Tabla 1).
Capacidad infectiva de larvas 3 postdescongelado
La excreción de huevos en materia fecal comenzó a hacerse evidente en el hpg a los 21 días post-infección en todos los ovinos, independientemente del tiempo de conservación de cada uno de los aislamientos. El recuento de huevos en materia fecal fue superior a 1.000 hpg a excepción de Ayacucho 1 que presentó conteos máximos de 500 hpg (Gráfico 1). Los coprocultivos post-infección revelaron una importante participación del género Haemonchus (Tabla 1).
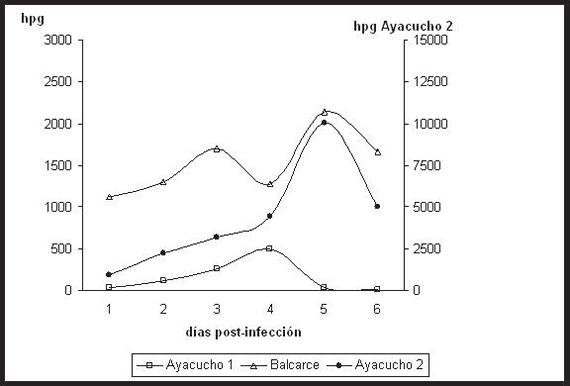
Gráfico 1. Evolución del conteo de huevos por gramo (hpg) en materia fecal de ovinos infectados artificialmente con larvas criopreservadas durante 3 y 7 meses.
Discusión
Los porcentajes de supervivencia postdescongelado fueron variables, sin embargo se observan valores similares entre Ayacucho 1 y Ayacucho 2, mientras que para Balcarce los porcentajes se mantuvieron par debajo del 50%, pero en todos los casos alcanzaron valores por debajo de los citados en la bibliografía1, 10, 11, 12 donde larvas criopreservadas por más de 1 año presentaron más del 90% de movilidad postdescongelado. Tal diferencia podría atribuirse al elevado número de larvas congeladas por criotubo, coincidiendo con datos presentados por Hubert & Kerboeuf (1997) quienes obtuvieron los mejores resultados de supervivencia cuando el número de L3 oscilaba entre 3000-5000 por criotubo. Aun así, las infecciones experimentales prosperaron manifestándose con hpg altos en la mayoría de los casos, y con inóculos de más de 10.000 L3 descongeladas, superando el número de L3 inoculadas en trabajos anteriores con la misma especie4, 11. En la primera infección experimental, la cepa Ayacucho 1 presentó un 70% de larvas móviles post-descongelado y bajos conteos de huevos, quizá debido a que las larvas eran más longevas al momento del congelado si se compara con los trabajos de Van Wyk et al (1977) y Hubert & Kerboeuf (1997), quienes utilizaron larvas infectivas frescas de no más de 2 semanas conservadas a 4ºC. Sin embargo, cuando larvas del mismo origen (Ayacucho 2) se inocularon después de 7 meses de permanencia en nitrógeno líquido, el hpg resultó considerablemente más alto aunque los porcentajes de supervivencia fueron similares a los obtenidos con 3 meses de criopreservación. Tal variabilidad podría atribuirse a diferencias en la susceptibilidad individual de los animales experimentales, y también debe considerarse la posibilidad de que un número de larvas pudieran hacer hipobiosis al aproximarse a una época poco favorable para el desarrollo de Haemonchus spp.7. No obstante, este comportamiento no fue observado en otros aislamientos, con similar composición de géneros parasitarios, cuando los animales se inocularon a principios de otoño (Guzmán et al., datos no publicados).
Trabajos realizados con L3 almacenadas por diferentes periodos en nitrógeno líquido han relacionado la supervivencia (medida a través del porcentaje de larvas móviles post-descongelado) con el tiempo de almacenamiento12. Según Van Wyk et al (1977) las larvas 3 de H. contortus con 17 días de congeladas presentaban un 52,9% de supervivencia pero llegaban a más del 90% de movilidad después de 2 años de criopreservación. Por tal motivo, es esperable que los porcentajes de supervivencia de las cepas de H. contortus obtenidos en este trabajo sean mayores en la medida que permanezcan criopreservadas por varios años9, 10.
Respecto a los géneros presentes en coprocultivo es preciso destacar que la composición porcentual original no se modificó considerablemente manteniéndose altos los porcentajes de Haemonchus spp. Sin embargo, aquellos géneros que participan en una menor proporción como Trichostongylus y Nematodirus cuyo potencial biótico es considerablemente menor, 100-200 huevos/hembra/día para Trichostongylus y 50-100 huevos/hembra/día para Nematodirus, pueden no observarse en los cultivos post-infección, y ser subestimados cuando co-existen géneros con una oviposición marcadamente superior como Haemonchus spp. con 5.000 a 10.000 huevos/hembra/día8. Si bien, los géneros recuperados de coprocultivos indican qué parásitos están presentes en el estudio, no necesariamente son indicativos de las cargas parasitarias que albergan los animales. Una situación similar ha sido descripta en estudios epidemiológicos realizados en bovinos del norte argentino, donde Haemonchus resultó el género predominante en aquellos basados en coprocultivos, en tanto que en los basados en el análisis de las cargas parasitarias de los animales quedó en el 3er lugar en importancia, después de los géneros Cooperia y Ostertagia2, ambos con potencial biótico marcadamente menor.
Sería importante complementar la presente información con trabajos que permitan determinar la carga parasitaria real en el huésped y permitan calcular la viabilidad (implantación) de las L3 criopreservadas, incluyendo además trabajos con bovinos.
Conclusiones
La técnica de criopreservación permitió mejorar la conservación de diferentes aislamientos de nematodes gastrointestinales en el laboratorio sin poner en riesgo la capacidad infectiva de las L3. Al mismo tiempo, permitió la reproducción rápida y exitosa de inóculos en ovinos facilitando la obtención de larvas frescas.
La utilidad de ésta técnica para los grupos de investigación en parasitología veterinaria se enmarca en una cuestión práctica y económica ya que podrían conservarse un gran número de L3 de diversos géneros parasitarios (incluso la conservación del material genético de cepas con diferentes características de resistencia/ susceptibilidad a antihelmínticos) en un espacio reducido y por largos periodos de tiempo, sin la necesidad de repicarlos periódicamente in vivo.
Agradecimientos
Al FONCyT por el apoyo financiero a través del PI CT 02023/2006. Por el aporte de cepas a: Lab. de Parasitología INTA Balcarce, Est. "La Araucaria" (Ayacucho), Est. "La Correntina" (Corrientes), Centro de Diagnóstico e Investigaciones Veterinarias (CEDIVE) (Chascomús) y Secretariado Uruguayo de la Lana (SUL) (Uruguay). Al equipo de l Depar tamento de Parasitología. Dirección de Laboratorios Veterinarios (DILAVE ) "Miguel C Rubino". Uruguay, por sus valiosos aportes para la puesta a punto de la técnica.
1. Campbell, W.C.; Slayton Blair, L.; Egerton, J.R. Unimpaired infectivity of the nematode Haemonchus contortus after freezing for 44 weeks in the presence of liquid nitrogen. J. Parasitol. 1973; 59:425-427. [ Links ]
2. Fiel, C.A.; Daffner A.; Álvarez, J. Epidemiología de los nematodes gastrointestinales en la región subtropical. En Nari, A. y Fiel, C. (eds). En: Enfermedades parasitarias de importancia económica en bovinos. Editorial Hemisferio Sur. Montevideo, Uruguay, 1994:115-129. [ Links ]
3. Henriksen, Sv.Aa.; Korsholm, H. A method for culture and recovery of gastrointestinal strongyle larvae. Nord. Vet. Med. 1983; 35:429-430. [ Links ]
4. Hubert, H.; Keboeuf, D. A high efficiency technique for the long-term preservation of infective nematode larvae. Can. J. Vet. Res. 1997; 61:77-79. [ Links ]
5. Niec, R. Cultivo e Identificación de Larvas Infectantes de Nematodes Gastrointestinales del Bovino y Ovino. Instituto Nacional de Tecnología Agropecuaria. En: http://cnia.inta.gov.ar/helminto/Niec/historicos0.htm, consultado el 22 de abril 2008. [ Links ]
6. Roberts, F.; O'Sullivan, P. Methods for egg counts and larval culture for strongyles infesting gastrointestinal tract of cattle. Aust .J. Agric. Res. 1949; 1:99-102. [ Links ]
7. Romero, J.R.; Boero, C.A. Epidemiología de la gastroenteritis verminosa de los ovinos en las regiones templadas y cálidas de la Argentina. Analecta Veterinaria 2001; 1:21-37. [ Links ]
8. Solusby, E.J.L. Familia Trichostrongylidae. En: Parasitología y enfermedades parasitarias en los animales domésticos. 7ma Edición. Editorial Interamericana. Mexico DF, Mexico, 1987. [ Links ]
9. Van Wyk, J.A.; Gerber, H.M. Oral infectivity of cryopreserved Haemonchus contortus infective larvae that recovered relatively slowly when thawed after more than 15 years in liquid nitrogen. Onderstepoort J. Vet. Res. 2000; 67:149-152. [ Links ]
10. Van Wyk, J.A.; Gerber, H.M.; de Villiers, F.J. Parenterally administered gastrointestinal nematode infective larvae viable after more than 15 years in liquid nitrogen. Vet. Parasitol. 2000; 88:239-247. [ Links ]
11. Van Wyk, J.A.; Gerber, H.M. Bezimidazole-resistant Haemonchus contortus- the effect of cryopreservation on the resistance of successive generations. Onderstepoort J. Vet. Res. 1980; 47:143-146. [ Links ]
12. Van Wyk, J.A.; Gerber, H.M.; Van Aardt, W.P. Cryopreservation of the infective larvae of the common nematodes of ruminants. Onderstepoort J. Vet. Res. 1977; 44:173-193. [ Links ]














